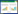中国科学院微生物研究所、中国微生物学会主办
文章信息
- 凌思英, 张柏杨, 滕勇, 魏巍, 喻武, 孙建明, 唐博, 陈以宽
- Ling Siying, Zhang Baiyang, Teng Yong, Wei Wei, Yu Wu, Sun Jianming, Tang Bo, Chen Yikuan
- 人大隐静脉干细胞原代培养方法的改良
- An improved method for stem cell derivation from human great saphenous vein
- 生物工程学报, 2018, 34(6): 973-982
- Chinese Journal of Biotechnology, 2018, 34(6): 973-982
- 10.13345/j.cjb.170459
-
文章历史
- Received: November 21, 2017
- Accepted: January 22, 2018
干细胞作为组织器官再生修复的种子细胞,是近年来研究的热点与难点。从组织器官中获取的成体干细胞(Somatic stem cells)不仅可用于细胞生物学的体外研究还可参与组织再生[1]。研究发现,间充质干细胞可促进胃大部切除术后创面的愈合[2];小鼠下肢缺血肌肉组织中注射内皮祖细胞可促进血管新生[3];静脉血栓中注射干细胞可促进血栓溶解[4]。骨髓干细胞动员剂可以促进大鼠深静脉血栓的机化、溶解和吸收[5]。国内外多项研究表明血管外膜存在CD34、CD117、CD133、CXCR4等阳性干细胞[6],其参与血管疾病的发生发展机制研究受到广泛重视[7-8]。人大隐静脉与胚胎组织、骨髓相比相对容易获取[9],若能将提取的干细胞用于自体移植,不但可以避免排斥反应减少并发症,而且这将为疾病的临床治疗提供新的思路和前景。
目前血管壁细胞的提取方法主要有组织块贴壁法和酶消化法[3, 10-11],组织块贴壁法操作简单,但培养时间较长,而酶消化法在消化完成后可以获取较多数量的细胞,但需要严格掌握胶原酶浓度及消化时间,技术要求更高。用这两种方法得到的血管壁细胞形态及活性等方面是否有差异仍需进一步研究。因此,本研究旨在相同的条件下,针对大隐静脉血管壁干细胞提取方法进行研究,以期待高效获得优质的原代培养干细胞,为其后续相关研究提供支持,为临床探寻静脉疾病的治疗方法提供新的思路。
1 材料与方法 1.1 材料试验中的大隐静脉来源于重庆医科大学附属第二医院血管外科,为血管搭桥手术术后剩余的正常大隐静脉,符合伦理学会要求,患者知情同意。
1.2 试剂DMEM/F12培养基(Lonza公司);胎牛血清(FBS,Gibco公司);Ⅱ型胶原酶(Sigma公司);台盼蓝染液(碧云天公司);碱性成纤维生长因子(bFGF)、表皮生长因子(EGF)、ITS、白细胞抑制因子(LIF)购于R & D公司;兔单克隆CD34、CD31、VEGF2、SMA抗体,小鼠单克隆CD117抗体,购于Abcam公司;羊抗兔-FITC 488羊抗鼠-DyLight 549荧光二抗购于Abbkine公司;基质胶购于Corning公司。
1.3 原代血管壁细胞的分离培养方法 1.3.1 大隐静脉的获取及处理取血管搭桥手术后剩余的大隐静脉,用含有双抗的PBS冲洗5−6次,去除血管外脂肪组织并洗净残留血液。将血管均分为两段,置于培养皿中并加入培养基充分浸润血管,用无菌眼科剪分别将两段血管剪碎成0.2 cm3。
1.3.2 组织贴壁法将其中一份按照组织块贴壁法均匀接种于25 cm2培养瓶中,放入5% CO2、37 ℃恒温孵育箱。1.5 h后取出培养瓶,加入2 mL完全培养基(含10% FBS、链霉素+青霉素100 U/mL、10 ng/mL bFGF、10 ng/mL EGF、0.2% ITS、0.1% LIF),缓慢放回孵箱,以防组织块漂浮,7 d后于倒置显微镜下观察并换液。
1.3.3 酶消化法将另一份组织块置于50 mL无菌离心管中,加入20 mL 0.1% Ⅱ型胶原酶,于37 ℃水浴锅中消化6−7 h,其中每半小时摇动5 min,使组织块与胶原酶充分混合。待组织块基本消化后,加入等体积的完全培养基终止消化,并用细胞筛过滤,收集滤液,离心后制成细胞悬液,孵育箱中培养。72 h后于倒置显微镜下观察并换液。
1.4 观察项目及检测指标 1.4.1 Ⅱ型胶原酶最适消化浓度和时间分别采用0.05%、0.10%、0.15%的Ⅱ型胶原酶各消化4−5、6−7、8−9 h,计数每个实验浓度和时间点获得的细胞数,进行统计分析。
1.4.2 细胞形态学观察倒置显微镜下观察两种方法提取的血管壁细胞生长情况,如细胞形态、生长状况、是否贴壁、细胞数量等。
1.4.3 细胞存活率用台盼蓝染色液对不同提取方法获得的P3代细胞进行染色,将细胞悬液与0.4%台盼蓝溶液按9:1 (体积比)混匀,室温放置3−5 min,于倒置显微镜下观察并计算细胞活率,死细胞着浅蓝色并膨大,无光泽,活细胞不着色并保持正常形态,有光泽。细胞活率(%) =活细胞数/细胞总数×100。
1.4.4 流式细胞术分选血管壁干细胞收集细胞悬液,使细胞浓度为1×107个/mL,加入10% BSA,常温下封闭20 min后重悬细胞,加入CD34-FITC和CD117-APC抗体,于4 ℃避光孵育45 min后加入培养基再次重悬细胞,行流式细胞术分选血管壁干细胞。采用flow-Jo软件分析。
1.4.5 细胞免疫荧光染色在无菌盖玻片上滴加细胞悬液,待细胞完全贴壁后弃去培养基,4%多聚甲醛室温固定10 min后用10%山羊血清37 ℃封闭30 min,加入CD34和CD117一抗,4 ℃过夜。次日,于37 ℃避光孵育二抗,1 h后加入DAPI染核,抗荧光淬灭剂封片。于倒置荧光显微镜观察并采集图像,计数双阳性干细胞比例并分析。
1.4.6 细胞阳性率鉴定收集细胞悬液,使细胞浓度为1×105个/mL,加入CD31-FITC/VEGF2-FITC/SMA-FITC,于4 ℃避光孵育30 min后加入培养基再次重悬细胞,行流式细胞术分选血管壁干细胞,采用flow-Jo软件分析。
1.4.7 管腔形成实验96孔板提前预冷,冰上操作,每孔加入50 μL基质胶,避免产生气泡,于37 ℃孵育箱中放置45 min。收集细胞悬液,使细胞浓度为2×105个/mL,每孔加入100 μL细胞悬液,37 ℃孵育箱孵育,分别于3 h和6 h采图。
1.4.8 统计学分析采用SPSS 12.0对实验数据进行统计学分析,计量资料以均数±标准差(x±s)表示,以P < 0.05为差异有统计学显著性。
2 结果与分析 2.1 Ⅱ型胶原酶最适消化浓度和时间分别采用0.05%、0.10%、0.15%的Ⅱ型胶原酶各消化4−5、6−7、8−9 h,将收获的细胞数量进行两因素方差分析,结果显示采用0.10%的Ⅱ型胶原酶消化6−7 h为最适消化浓度和时间,差异有统计学意义(图 1)。
|
| 图 1 Ⅱ型胶原酶消化浓度和时间分析 Figure 1 Number of vascular cells obtained at different concentrations of collagenase Ⅱ and different digestion times. The results showed that the yield was highest when digested with 0.10% collagenase Ⅱ for 6−7 hours. **P < 0.01. |
| |
在倒置显微镜下观察,组织块贴壁法7 d后有少量细胞爬出,形态多呈梭形、三角形,未形成集落样生长。14 d时,细胞数量增多,出现纤维样细胞,胞体小,呈细丝状。P1代细胞有部分聚集现象,但数量少,细胞体积较小,形态良好。当传至P3代时出现纤维化老化等现象(图 2A–D)。采用酶消化法获得的血管壁细胞48 h后贴壁,伸出伪足,细胞形态多为梭形、三角形、不规则形,呈集落样分布。7 d后细胞完全展开,集落增大变多,细胞排列紧密,形态佳。P1代细胞集落被吹散,但仍可见到细胞聚集现象,单个细胞形态良好。P3代时细胞仍可见聚集生长现象,纤维化细胞明显少于组织块法(图 2E–H)。

|
| 图 2 倒置显微镜下血管壁细胞形态 Figure 2 Morphology of GSV cells under inverted microscope. Panels A–D show cells obtained by tissue attachment method at day 7, at day 14, at passage 1 (P1) and at passage 3 (P3). Panels E–H show cells isolated by enzymatic digestion at 48 h, at day 7, at P1 and at P3. Scale bars=100 μm. |
| |
台盼蓝染色结果显示,组织块法细胞存活率为(91.7±1.2)%,酶消化法为(97.2±0.65)%,对两个结果进行独立样本t检验,P=0.005,差异有统计学意义(图 3)。

|
| 图 3 组织块法和酶消化法对细胞存活率的比较 Figure 3 Comparison of survival rates of cells derived from tissue attachment and enzymatic digestion. **P < 0.01. |
| |
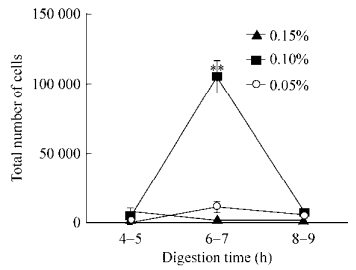
流式分选结果表明两种血管壁细胞提取法均可获得CD34、CD117双阳性干细胞,其中组织块获得干细胞的阳性率为(0.16±0.05)%,酶消化法为(0.44±0.07)% (图 4A,B)。对两组分选结果进行独立样本t检验,差异有统计学意义(P=0.005,图 4C),说明采用酶消化法可获得更多CD34+CD117+双阳性干细胞,且实验周期短。
|
| 图 4 组织块法(A)和酶消化法(B)得到的P3代细胞进行流式分选(将分选结果进行独立样本t检验) Figure 4 Flow sorting of P3 cell derived from tissue attachment (A) and enzymatic digestion (B), respectively. Storing results of the two groups were assessed with independent t-test, **P < 0.01 (C). |
| |
流式分选后获得双阳性干细胞,培养1周后进行CD34 (绿光)、CD117 (红光)免疫荧光染色(图 5A),随机选取5个视野计算阳性率,其中组织块获得干细胞的阳性率为(89.41±2.06)%,酶消化法为(94.03±1.83)%,结果进行独立样本t检验,P=0.04,差异有统计学意义(图 5B)。

|
| 图 5 流式分选7 d后CD34、CD117染色(A)并将两组阳性率进行比较(B) Figure 5 Double positive cells cultured for 7 days after flow sorting were subjected to immunofluorescent staining for CD34 (FITC 488; green) and CD117 (DyLight 549; red). (A) Scale bars=100 μm. (B) Graph was shown as x ± s compared with control, *P < 0.05. |
| |
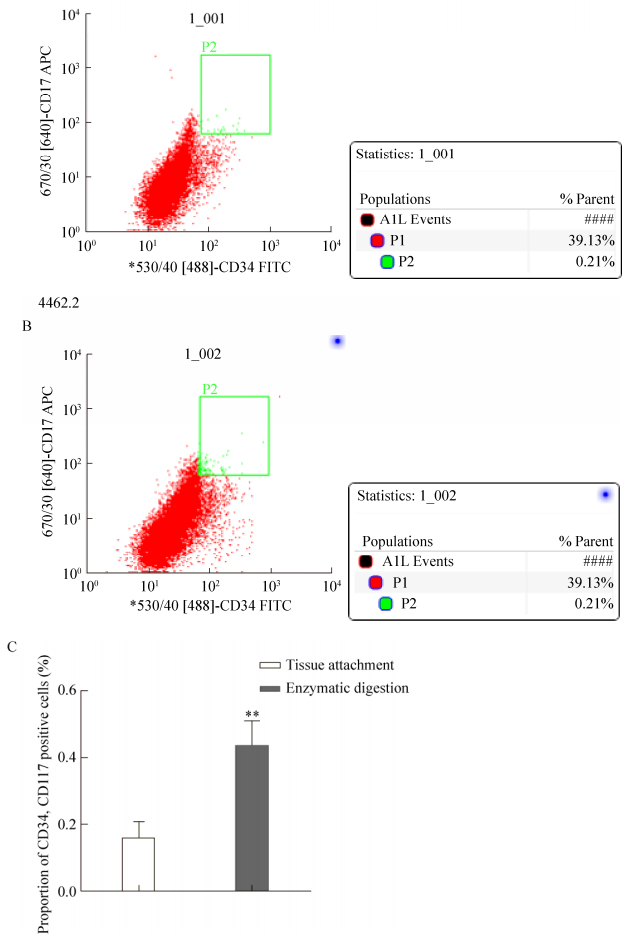
流式细胞仪检测分选出的干细胞中CD31、VEGF2、SMA含量分别为(0.12±0.01)%、(0.19±0.02)%、(0.45±0.01)%,结果进行独立样本t检验,P > 0.05。与阴性对照组差异无统计学意义(图 6),排除成熟内皮细胞和平滑肌细胞存在的可能性。
|
| 图 6 流式分选的干细胞进行CD31、VEGF2、SMA阳性率鉴定(A),并与阴性对照进行统计分析(B) Figure 6 Identification of positive rates of CD31, VEGF2 and SMA by Stem cells sorting by flow cytometry (A). (B) Graph shown as x±s compared with control, P > 0.05. |
| |
37 ℃孵育箱孵育3 h后有部分干细胞汇合,但未形成完整管腔,(图 7A),6 h后管腔完全形成,(图 7B),说明大隐静脉分选出的干细胞具有向内皮细胞分化形成管腔的潜能。
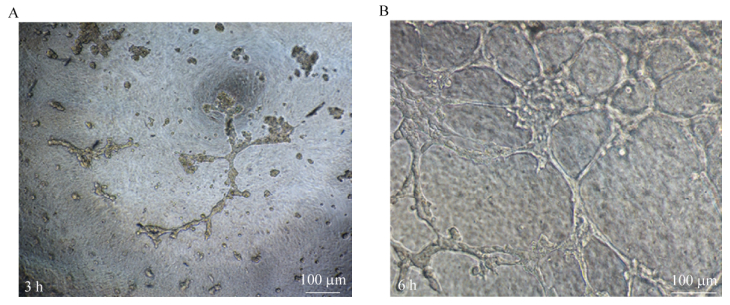
|
| 图 7 细胞接种后分别于3 h (A)、6 h (B)观察管腔形成情况 Figure 7 Tube formation was observed under inverse microscope after seeded into 96-well plates for 3 hours (A) and 6 hours (B). Scale bars=100 μm. |
| |
人类及动物的血管壁中主要存在4种具有分化和增殖能力的干细胞,即间充质干细胞、周细胞、内皮祖细胞、平滑肌祖细胞[12-13]。迄今为止对于这些血管壁祖细胞尚未明确定论,单纯用Sca-1、CD34高表达不足以描述,因为这些祖细胞间细胞表面标记物存在重叠范围,这反过来又使得定义特定的子集很难[14]。科研团队在该领域经过不断探索发现了许多具有意义的研究结果。但总的来说,对于血管壁干细胞的研究目前还处于早期阶段。Havelka等[15]和Majesky等[16]认为内皮祖细胞最初来源于骨髓和外周血,然而真正的血管壁干细胞是来源于血管壁之中。成体干细胞主要参与组织的再生修复,而骨髓间充质干细胞来源于发育早期的中胚层,具有多项分化潜能、造血支持以及促进干细胞植入、免疫调控和自我复制等特点[17]。干细胞的获取及多向分化潜能是目前医学研究的热点,如何获得一种来源稳定的多能干细胞成为再生医学的主要研究方向[18]。研究表明,成体干细胞(SSC)与骨髓间充质干细胞在免疫表型、生长动力学、特异性转录调控、端粒酶活性等方面差异无统计学意义[19]。Campagnolo等[6]研究发现,人大隐静脉血管外膜中存在一种可高度增殖并表达间充质干细胞标记物Sox2的CD34+CD31-成体干细胞,其具有克隆和多项分化潜能,在体外可诱导分化为多种细胞,如成骨细胞、脂肪细胞、软骨细胞、内皮细胞、肝细胞、肌细胞和神经元细胞。干细胞的多项分化潜能使其在再生医学、体外疾病模拟、药物筛选等方面具有广阔的应用前景。干细胞技术近年来取得了很大进展,特别是多能干细胞的出现,使干细胞领域发生了巨大的变化[20]。
本研究选用人大隐静脉作为血管壁干细胞来源,将血管搭桥手术后剩余的正常大隐静脉用于实验研究,可获得丰富的血管壁干细胞,并且自体移植干细胞治疗缺血性疾病与异体移植相比更加安全、有效。另一方面靶向阻断病理性血管干细胞可抑制血管生成与肿瘤生长[21]。组织块贴壁法获取血管壁干细胞虽然可行,但在研究应用中发现一些不足,如干细胞收获率不理想,培养时间过长,直接影响细胞的生长状态,不但延缓了实验进度,而且浪费了科研经费。近年来,酶消化法获取血管壁干细胞的方法增多,但消化酶的作用时间和消化强度尚无明确定论[3, 6, 11],故本研究通过对胶原酶浓度和消化时间进行反复摸索,分别用0.05%、0.10%、0.15%的Ⅱ型胶原酶消化4−5、6−7、8−9 h,发现消化酶浓度过高或消化时间过长会导致大量细胞破裂,丧失贴壁能力,而消化酶浓度过低或消化时间过短又影响细胞获取率。通过不断的技术改进,最终确定0.1%的Ⅱ型胶原酶消化6−7 h可最大数量获取血管壁细胞,细胞活性好。与组织块法相比,酶消化法提取的血管壁细胞48 h后已有部分细胞贴壁,实验周期短,获得的细胞数量多呈明显的集落样生长。但在细胞存活率方面经统计分析后发现酶消化法优势并不十分明显,可能因统计次数较少和组内差异较小等原因引起,在后续试验中应增加实验次数以及加入其他方面的比较,如流式细胞仪测量法、CCK-8法、MTT法、LDH释放法等[22]。
综上所述,对于人大隐静脉干细胞培养采用酶消化法效果相对较好。分选出的干细胞进行管腔形成实验证实其具有向内皮分化的潜能[23]。本研究团队进一步证实,将人大隐静脉分选出的CD34、CD117双阳性干细胞移植到裸鼠结扎的下腔静脉外膜,在某些细胞因子的诱导下这些干细胞可以迁徙进入血栓,促进血栓的溶解[24]。血管的形成是生命发展的基础,失调可能导致疾病甚至死亡,这将成为一个潜在的治疗靶点。干细胞的获取和扩大培养还可用于组织再生,甚至与组织来源无关的胚层起源研究,但存在一些关键问题,如这些细胞在体外具有多向分化潜能,而目前尚未证实其在体内是否具有相似性。细胞系绝大部分还未能满足临床要求而限制了其临床应用[25]。总之,血管壁祖细胞在血管愈合和血管生成中发挥重要作用。精确不同祖细胞群的定义和特征及其在生理和病理条件下功能效应研究将会推动具有临床潜力的细胞疗法的发展,用于治疗动脉粥样硬化和其他心血管疾病。
| [1] | Aguilar-Gallardo C, Simon C. Cells, stem cells, and cancer stem cells. Semin Reproduct Med, 2013, 31(1): 5–13. DOI: 10.1055/s-00000072 |
| [2] | Askarov MB, Onischenko NA. Multipotent mesenchymal stromal cells of autologous bone marrow stimulate neoangiogenesis, restore microcirculation, and promote healing of indolent ulcers of the stomach. Bull Experim Biol Med, 2008, 146(4): 512–516. DOI: 10.1007/s10517-009-0324-6 |
| [3] | Invernici G, Emanueli C, Madeddu P, et al. Human fetal aorta contains vascular progenitor cells capable of inducing vasculogenesis, angiogenesis, and myogenesis in vitro and in a murine model of peripheral ischemia. Am J Pathol, 2007, 170(6): 1879–1892. DOI: 10.2353/ajpath.2007.060646 |
| [4] | Li XQ, Meng QY, Wu HR. Effects of bone marrow- derived endothelial progenitor cell transplantation on vein microenvironment in a rat model of chronic thrombosis. Chin Med J, 2007, 120(24): 2245–2249. |
| [5] | Chen YK, Jiang XM, Gong JP. Recombinant human granulocyte colony-stimulating factor enhanced the resolution of venous thrombi. J Vascul Surg, 2008, 47(5): 1058–1065. DOI: 10.1016/j.jvs.2007.12.042 |
| [6] | Campagnolo P, Cesselli D, Al Haj Zen A, et al. Human adult vena saphena contains perivascular progenitor cells endowed with clonogenic and proangiogenic potential. Circulation, 2010, 121(15): 1735–1745. DOI: 10.1161/CIRCULATIONAHA.109.899252 |
| [7] | Chen YK, Wong MM, Campagnolo P, et al. Adventitial stem cells in vein grafts display multilineage potential that contributes to neointimal formation. Arterioscl, Thromb, Vascul Biol, 2013, 33(8): 1844–1851. DOI: 10.1161/ATVBAHA.113.300902 |
| [8] | Wong MM, Chen YK, Margariti A, et al. Macrophages control vascular stem/progenitor cell plasticity through tumor necrosis factor-alpha-mediated nuclear factor- kappa B activation. Arterioscl, Thrombo, Vascul Biol, 2014, 34(3): 635–643. DOI: 10.1161/ATVBAHA.113.302568 |
| [9] | Kirchhoffer DG, Dierickx K. Human dignity and human tissue: a meaningful ethical relationship?. J Med Eth, 2011, 37(9): 552–556. DOI: 10.1136/jme.2010.041509 |
| [10] | Hu YH, Zhang ZY, Torsney E, et al. Abundant progenitor cells in the adventitia contribute to atherosclerosis of vein grafts in ApoE-deficient mice. J Clin Investigat, 2004, 113(9): 1258–1265. DOI: 10.1172/JCI19628 |
| [11] | Zengin E, Chalajour F, Gehling UM, et al. Vascular wall resident progenitor cells: a source for postnatal vasculogenesis. Development, 2006, 133(8): 1543–1551. DOI: 10.1242/dev.02315 |
| [12] | Lu WS, Li XR. Vascular stem/progenitor cells: functions and signaling pathways. Cellul Mol Life Sci, 2018, 75(5): 859–869. DOI: 10.1007/s00018-017-2662-2 |
| [13] | Psaltis PJ, Simari RD. Vascular wall progenitor cells in health and disease. Circulat Res, 2015, 116(8): 1392–1412. DOI: 10.1161/CIRCRESAHA.116.305368 |
| [14] | Bobryshev YV, Orekhov AN, Chistiakov DA. Vascular stem/progenitor cells: current status of the problem. Cell Tissue Res, 2015, 362(1): 1–7. DOI: 10.1007/s00441-015-2231-7 |
| [15] | Havelka GE, Kibbe MR. The vascular adventitia: its role in the arterial injury response. Vasc Endovascr Surg, 2011, 45(5): 381–390. DOI: 10.1177/1538574411407698 |
| [16] | Majesky MW, Dong XR, Hoglund V, et al. The adventitia: a dynamic interface containing resident progenitor cells. Arterioscler Thromb Vasc Biol, 2011, 31(7): 1530–1539. DOI: 10.1161/ATVBAHA.110.221549 |
| [17] | Fadini GP, Madeddu P, Waltenberger J, et al. Vascular stem and progenitor cells in diabetic complications. Exp Diabetes Res, 2012, 2012: 580343. |
| [18] | Tabar V, Studer L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nat Rev Genet, 2014, 15(2): 82–92. DOI: 10.1038/nrg3563 |
| [19] | Beltrami AP, Cesselli D, Bergamin N, et al. Multipotent cells can be generated in vitro from several adult human organs (heart, liver, and bone marrow). Blood, 2007, 110(9): 3438–3446. DOI: 10.1182/blood-2006-11-055566 |
| [20] |
Wang LB, Zhu H, Hao J, et al. Progress in stem cells and regenerative medicine.
Chin J Biotech, 2015, 31(6): 871–879.
(in Chinese). 王立宾, 祝贺, 郝捷, 等. 干细胞与再生医学研究进展. 生物工程学报, 2015, 31(6): 871-879. |
| [21] | Watt SM, Athanassopoulos A, Harris AL, et al. Human endothelial stem/progenitor cells, angiogenic factors and vascular repair. JR Soc Interface, 2010, 7(S6): S731–S751. |
| [22] |
Li L, Yang YH, Wang S, et al. Comparison of cellular activity detection methods.
J Biol, 2011, 28(1): 87–90, 93.
(in Chinese). 李磊, 杨雨晗, 王双, 等. 细胞活性检测方法之比较. 生物学杂志, 2011, 28(1): 87-90, 93. |
| [23] |
Shi MX, Li WJ, Li BZ, et al. Comparison of cellular activity detection methods.
Chin J Biotech, 2009, 25(5): 754–760.
(in Chinese). 史明霞, 李维佳, 李炳宗, 等. 人羊膜来源成体干细胞的多向分化潜能. 生物工程学报, 2009, 25(5): 754-760. |
| [24] |
Ma Z, Chen YK. Establishment of inferior vena cava thrombosis model in nude mice.
Med J Chin People's Lib Army, 2016, 41(11): 883–886.
(in Chinese). 马振, 陈以宽. 裸鼠下腔静脉血栓模型的构建. 解放军医学杂志, 2016, 41(11): 883-886. DOI:10.11855/j.issn.0577-7402.2016.11.01 |
| [25] | Jonlin EC. Differing standards for the NIH stem cell registry and FDA approval render most federally funded h ESC lines unsuitable for clinical use. Cell Stem Cell, 2014, 14(2): 139–140. DOI: 10.1016/j.stem.2013.12.014 |
 2018, Vol. 34
2018, Vol. 34