中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李乔乔, 张丽君, 黄志立, 王飞, 吴振强, 王妍
- Li Qiaoqiao, Zhang Lijun, Huang Zhili, Wang Fei, Wu Zhenqiang, Wang Yan
- 重组人干扰素β1a对人骨髓间充质干细胞成软骨细胞定向分化的影响
- Effects of recombinant human interferon β1a on the chondrogenic differentiation of human bone marrow mesenchymal stem cell
- 生物工程学报, 2018, 34(6): 964-972
- Chinese Journal of Biotechnology, 2018, 34(6): 964-972
- 10.13345/j.cjb.170443
-
文章历史
- Received: November 13, 2017
- Accepted: February 5, 2018
2 深圳职业技术学院 应用化学与生物技术学院,广东 深圳 518055
2 Shenzhen Institute of Applied Chemistry and Biotechnology, Shenzhen Polytechnic, Shenzhen 518055, Guangdong, China
关节软骨是高度分化的组织,它的组织结构决定了软骨细胞代谢缓慢,受损伤后难以自行修复,如果关节软骨损伤未得到及时修复,则会造成骨性关节炎。关节软骨损伤及缺损一直是骨科治疗的难题[1-2]。目前,组织工程软骨已在临床应用方面进行了初步尝试,为临床软骨缺损的修复提供了新的思路与途径,种子细胞、生物材料以及细胞因子是组织工程软骨的重要因素。骨髓间充质干细胞(Human bone marrow mesenchymal stem cells,hMSCs)具有自我增殖能力和多向分化潜能,在特定条件下可分化为软骨细胞,且移植后能够与软骨下板更好地融合,是软骨组织工程的理想细胞,已有的研究表明细胞因子是定向诱导hMSCs分化成软骨细胞的关键因素,如转化生长因子β (TGF-β)、骨形态发生蛋白(BMP)、地塞米松(DEX)等[3-5]。然而细胞因子的作用是一个复杂的过程,其诱导效应与细胞因子的来源、浓度、剂量等多种因素有关,需要不断探索新的细胞因子以及各种因子相互作用关系,因此细胞因子对hMSCs诱导分化方向影响及作用机制一直以来都是干细胞研究中的一个热点。
干扰素β (IFN-β)是成纤维细胞和某些上皮细胞产生的一类糖蛋白,具有抗病毒、抗细胞分裂及免疫调节等多种生物学活性。重组人干扰素β (rhIFN-β)是通过基因工程改造得到的,对性疣、多发性硬化症、丙型肝炎及相关肝癌、其他病毒性疾病以及多种肿瘤具有明显的疗效,虽有研究表明其他亚型干扰素如干扰素γ对细胞增殖和分化有一定的作用,但重组人干扰素β体外对hMSCs向软骨细胞分化作用的研究尚少[6-8]。本次实验通过观察重组人干扰素β1a对hMSCs向软骨细胞分化的影响,探讨重组人干扰素β1a体外是否能够促进hMSCs向软骨细胞分化,为软骨损伤治疗提供实验参考。
1 材料与方法 1.1 材料与仪器hMSCs细胞株(赛业(广州)生物科技有限公司),成人骨髓间质干细胞的基础培养基(赛业(广州)生物科技有限公司),成软骨分化培养基(赛业(广州)生物科技有限公司),胰酶(美国Gibco公司),Trizol (美国Invitrogen公司),SYBR荧光定量试剂盒(美国Invitrogen公司),转录试剂盒(Promega生物技术有限公司),内参GAPDH (上海康成生物),兔抗人CollagenⅡ抗体(英国Abcam公司),兔抗人Sox9抗体(英国Abcam公司),羊抗兔IgG-HRP二抗(美国Southern biotech公司),重组人干扰素β1a (以色列ProSpec-Tany公司),Alcain blue染色试剂盒(上海杰美基因医药科技有限公司),GAG总含量检测试剂盒(上海杰美基因医药科技有限公司)。
Hera Cell 240型细胞培养箱(美国热电公司),Olympus CKX41型倒置相差显微成像系统(日本奥林巴斯公司),净安泰BHC-1000IIA2型生物安全柜(江苏苏净集团有限公司),Eppendorf 5810 R型台式离心机(德国Eppendorf公司),Spectramax M5e型多功能酶标仪(美国Molecular Devices公司),Real-time PCR仪(美国ABI公司),核酸蛋白测定仪(德国Eppendorf公司)。
1.2 方法 1.2.1 hMSCs细胞培养方法hMSCs细胞培养于含10%胎牛血清、1% 5 mmol/L谷氨酰胺、100 U/mL青/链霉素的成人骨髓间质干细胞基础培养基中,37 ℃下于5% (体积分数) CO2培养箱中孵育至细胞铺满瓶底时,用0.25% (质量分数)的胰蛋白酶消化传代,于每3天换液,每7天传代,至第6代用于实验。
1.2.2 hMSCs成软骨细胞分化方法取第6代hMSCs胰酶消化计数,2 000 r/min离心5 min,用软骨分化培养基按照5.0×105 cells/mL的密度进行重悬。室温下2 000 r/min离心5 min,吸去上清,分别加入1 mL成人骨髓间质干细胞的完全培养基、成软骨分化培养基Ⅰ (含10 ng/mL TGF-β3)、成软骨分化培养基Ⅱ (含100 ng/mL IFN-β1a)、成软骨分化培养基Ⅲ (含10 ng/mL TGF-β3和50 ng/mL IFN-β1a)、成软骨分化培养基Ⅳ (含10 ng/mL TGF-β3和100 ng/mL IFN-β1a)、成软骨分化培养基Ⅴ (含10 ng/mL TGF-β3和200 ng/mL IFN-β1a)和成软骨分化培养基Ⅵ (含10 ng/mL TGF-β3和400 ng/mL IFN-β1a),室温下2 000 r/min离心5 min,拧松离心管盖以便气体交换,将其放置于37 ℃、5% CO2的培养箱中培养。24 h后轻弹离心管底部使软骨球脱离管底悬浮在液体中。自接种开始计算,每隔3 d换液,换液后轻弹离心管底部使软骨球脱离管底悬浮在液体中。
1.2.3 GAG总含量测定收集诱导21 d的细胞,按试剂盒说明测定GAG含量,方法如下:加入300 μL萃取液,充分混匀,56 ℃孵育16 h,90 ℃孵育10 min。13 000 r/min离心10 min,移取上清,置于冰上备用;取25 μL上清加入400 μL染色液,室温下孵育30 min,避免光照,期间每隔5 min涡旋振荡15 s,13 000 r/min离心10 min,抽去上清,加入400 μL解离液,室温下孵育5 min,避免光照。取200 μL样品,在酶标仪上以656 nm波长测定OD值,每组3个复孔。
1.2.4 Alcain blue染色取诱导21 d的软骨球经石蜡包埋切片,脱蜡和脱水,阿利新蓝染液染色30 min,自来水冲洗2 min,蒸馏水冲洗1次,显微镜下观察阿利新蓝染色效果。
1.2.5 荧光定量PCR检测成软骨分化相关基因表达取诱导分化后细胞,Trizol法提取细胞总RNA,按照Promega逆转录试剂盒说明书将RNA逆转录为cDNA,用SYBR Green qPCR SuperMix进行荧光定量PCR扩增,检测Collangen Ⅱ和Sox9的mRNA表达,引物序列见表 1。每个样本设3个复孔,在Real-time PCR仪上进行反应。反应条件:50 ℃ 2 min;95 ℃ 2 min;95 ℃ 15 s;60 ℃ 32 s,共40个循环。以18S rRNA为内参基因,采用2-ΔΔCt法计算基因表达的相对水平。
| Primer name | Primer sequence (5′–3′) |
| CollagenⅡ-forward | CAGATGACCTTCCTACGCCT |
| CollagenⅡ-reverse | TCTTCTGTGACCGGTACTCG |
| Sox9-forwardF | CCACCCGGATTACAAGTACC |
| Sox9-reverse | GCCTTGAAGATGGCGTTGG |
| 18S rRNA-forward | CCTGGATACCGCAGCTAGGA |
| 18S rRNA-reverse | GCGGCGCAATACGAATGCCCC |
取诱导分化后细胞,按RIPA裂解液提取细胞总蛋白,BCA法检测蛋白浓度。加入5×蛋白质上样缓冲液煮沸10 min使其变性。SDS-PAGE凝胶电泳,然后用湿转法将凝胶中的蛋白转至PVDF膜上,TBST漂洗1次5 min;将PVDF膜置于含5%脱脂奶粉溶液中室温摇床封闭1 h,TBST洗膜1次10 min;分别加入含Collagen Ⅱ (1:1 000)、Sox9 (1:1 000)、内参GAPDH (1:10 000)一抗工作液4 ℃过夜,TBST漂洗4次,每次10 min;用含标记辣根过氧化物酶的二抗(1:20 000) 37 ℃孵育1 h,TBST洗膜4次,每次10 min。将杂交膜置于一透明塑料板上,注意不要让膜干燥。用移液器将化学荧光发光底物均匀地加到膜的表面,并使反应持续5 min。用试剂盒提供的滤纸吸去膜表面多余的底物溶液,放至暗盒显影。
1.2.7 统计学分析采用SPSSl9.0统计软件对实验数据进行统计学分析,数据以“平均值±平均标准误差(x ± s)”的形式表示,采用t检验,若P < 0.05则认为差异有统计学意义。
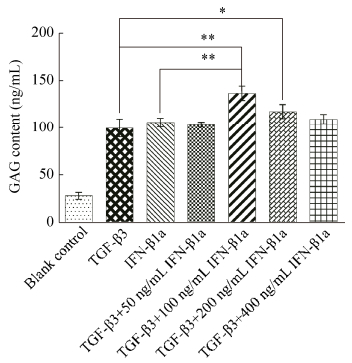
2 结果与分析 2.1 GAG总含量检测结果糖胺多糖(GAG)总含量是代表hMSCs成软骨分化水平的重要生化指标。通过检测细胞的GAG总含量,结果见图 1,发现单独添加10 ng/mL TGF-β3组和单独添加100 ng/mL IFN-β1a组无显著差异(P > 0.05)。而TGF-β3和IFN-β1a联合诱导组均高于单独添加组,其中联合添加10 ng/mL TGF-β3和100 ng/mL IFN-β1a组显著高于其他组GAG含量(P < 0.05)。结果表明在常规TGF-β3诱导分化过程添加100 ng/mL IFN-β1a能够提高GAG含量,促进hMSCs成软骨分化程度。
|
| 图 1 诱导过程添加不同IFN-β1a浓度对细胞GAG含量的影响 Figure 1 Effect of different IFN-β1a concentration on GAG content during chondrogenic differentiation of hMSCs. *P < 0.05; **P < 0.01. |
| |
成软骨立体诱导1 d时可见到离心管底有嵴状突起形成,在诱导3 d可见突起形成小球状。轻轻振荡离心管可见小球在培养液中漂浮,并不散开,随后小球缓慢增大。21 d后取出小球,小球柔软略有弹性及一定的粘性。测量软骨球直径见图 2,可见常规TGF-β3诱导分化过程添加100 ng/mL IFN-β1a形成的软骨球明显大于其他组单一成分组。

|
| 图 2 软骨球形态学观察 Figure 2 Morphological observation of cartilage ball. (A) Blank control group. (B) TGF-β3 group. (C) IFN-β1a group. (D) TGF-β3+100 ng/mL IFN-β1a group. |
| |
聚集蛋白聚糖是软骨细胞表面标志物,该物质经阿利新蓝染色会呈现蓝色。hMSCs诱导21 d成软骨球后,切片、染色,结果见图 3。TGF-β3和IFN-β1a单独添加组之间无明显的差异。而常规TGF-β3诱导分化过程添加100 ng/mL IFN-β1a蓝色所占比例明显提高。组织染色结果也表明添加IFN-β1a能促进hMSCs成软骨分化。

|
| 图 3 阿利新蓝染色结果 Figure 3 Alcian blue staining results. (A) Blank control group. (B) TGF-β3 group. (C) IFN-β1a group. (D) TGF-β3+ 100 ng/mL IFN-β1a group. |
| |
添加不同诱导分化培养基诱导4、7、11、14、21 d后,qRT-PCR检测Sox9和Collagen Ⅱ基因mRNA表达水平。对于Sox9,在诱导分化不同时间点,与对照组相比,其他各组表达量均显著高于对照组,且IFN-β1a组和TGF-β3+100 ng/mL IFN-β1a组均显著高于TGF-β3组,但当诱导至21 d时,只有TGF-β3+100 ng/mL IFN-β1a组显著高于TGF-β3组(P < 0.01) (图 4A)。结果同时表明,随着诱导分化时间延长,各诱导组中Sox9 mRNA的表达量均有升高,其中TGF-β3组和TGF-β3+100 ng/mL IFN-β1a组增加显著,而IFN-β1a组在第7天有明显升高,而后随着诱导时间延长,其表达量上升趋势不明显。对于Collagen Ⅱ,其mRNA的表达规律与Sox9相似,但在第7天之后,IFN-β组和TGF-β3组之间表达无极显著差异,而TGF-β3+100 ng/mL IFN-β1a组相对表达量在不同诱导时间点均显著高于其他组(图 4B)。

|
| 图 4 Sox9 (A)和Collagen Ⅱ (B)的qRT-PCR检测结果 Figure 4 qRT-PCR result of gene Sox9 (A) and Collagen Ⅱ (B). |
| |
添加不同诱导分化培养基诱导4、7、11、14、21 d后,收取各组细胞,Western blotting检测SOX9和COL Ⅱ蛋白表达水平。检测结果及灰度(IOD)分析结果表明(图 5),在不同诱导分化时间点,TGF-β3+100 ng/mL IFN-β1a组的SOX9和COL Ⅱ蛋白均显著高于其他组(P < 0.01),且随着分化时间延长,上述两种蛋白表达呈上升趋势。而IFN-β1a组和TGF-β3相比较,第21天IFN-β1a组表达的SOX9和COL Ⅱ蛋白显著高于TGF-β3组,但只有在第11天IFN-β1a组表达的SOX9蛋白显著高于TGF-β3组,其他时间点均无显著差异。而且随着分化时间延长,IFN-β1a组和TGF-β3中SOX9和COL Ⅱ蛋白表达总体也呈上升趋势。

|
| 图 5 SOX9和COL Ⅱ的Western blotting检测结果 Figure 5 Western blotting result of SOX9 and COL Ⅱ in hMSCs. (A) The immune fluorescent protein electrophoresis figure at five time points. lane Ⅰ: blank control group; lane Ⅱ: TGF-β3 group; lane Ⅲ: IFN-β1a group; lane Ⅳ: TGF-β3+100 ng/mL IFN-β1a group. (B) IOD analysis of SOX9. (C) IOD analysis of COL Ⅱ. |
| |
由于创伤、感染、痛风和退行性病变等各种原因导致的关节长期疼痛和功能障碍,所致关节软骨缺损在临床十分常见,软骨组织因缺乏血管和神经营养而自我修复能力不足,软骨的缺损经常会导致以软骨退变、软骨下骨硬化、骨赘形成及关节内炎症为病变特点的骨性关节炎(Osteoarthritis,OA)的发生[9-10]。体外构建组织工程化软骨是治疗软骨缺损的重要途径之一,其中骨髓间充质干细胞因其具有增殖传代能力强、细胞均一性好、能够多向分化、不存在伦理问题和排斥反应等特点[11-12],已经成为体外构建组织化工程软骨的细胞来源之一[13-14]。但体外诱导hMSCs向软骨细胞的定向分化需要在一定的诱导条件。细胞因子是诱导分化的关键因素,其中细胞因子TGF-β超家族主要包括TGF-β1、TGF-β2和TGF-β3[15],广泛参与包括细胞增殖、分化、黏附、血管形成、骨骼形成和胚胎发育在内的重要生命活动[16-17]。其中TGF-β3对细胞分化、增殖和细胞外基质沉积有重要作用,在组织损伤修复中具有拮抗纤维化的作用,是最经典的成软骨诱导因子,可以促进未分化或分化早期的软骨细胞增殖[18],使间质细胞向软骨细胞分化,还可增加Ⅱ型胶原及蛋白多糖的合成[19-20]。因此TGF-β3、地塞米松、维生素C的联合应用是体外诱导hMSCs向软骨细胞分化诱导的最经典方案。但细胞因子来源、浓度和因子之间的相互作用都对细胞增殖分化有影响,因此需要探索更多细胞因子。
干扰素β (IFNβ)是成纤维细胞和某些上皮细胞产生的一类糖蛋白,具有抗病毒、抗细胞分裂及免疫调节等多种生物学活性。目前已发现的哺乳动物干扰素有10多个家族,其中人干扰素有7个家族,包括Ⅰ型干扰素α、β、ε、τ、ω、κ,Ⅱ型干扰素γ[21],另外,还发现了干扰素样蛋白(Interferon-like proteins),也称为Ⅲ型干扰素。重组人干扰素β (rhIFN-β)是通过基因工程改造的一种糖蛋白,具有抗病毒、抗肿瘤和免疫调节作用,根据表达IFN-β体系的不同,可将其分为CHO细胞表达的rhIFN-β1a和在E. coli中表达的rhIFN-β1b。国外上市的rhIFN-β1a与rhIFN-β1b比较,rhIFN-β1a活性高、疗效好,副反应更少。虽然干扰素一直用于临床抗病毒治疗,但近年的研究也表明干扰素对细胞增殖分化有影响。Irudayam等[6]研究结果显示IFN-α激活STAT-JAK通路促进多功能干细胞分化。Diao等[22]研究结果显示Ⅰ型IFN在体外增加平滑肌细胞数。Matatall等[23]发现Ⅰ型和Ⅱ型干扰素可促进造血干细胞细胞分裂,干扰素γ信号有助于造血干细胞髓样分化。Hirsch等[24]研究结果表明在体外低浓度IFN-β能够降低小鼠神经祖细胞(NPCs)的凋亡,对中枢神经系统的细胞进行直接保护作用,从而治疗多发性硬化症。而对于研究干扰素β体外对hMSCs诱导分化研究尚少。
糖胺多糖(GAG)总含量是代表hMSCs成软骨分化水平的重要生化指标。为了确定在常规TGF-β3诱导分化培养基中添加不同浓度IFN-β1a成软骨细胞分化的影响,本研究中首先比较了添加50、100、200、400 ng/mL的IFN-β1a后各组细胞的GAG含量的变化,结果表明在含有10 ng/mL TGF-β3的诱导分化培养基础上添加100 ng/mL IFN-β1a组显著高于其他组GAG含量(P < 0.05),说明IFN-β1a与TGF-β3联合使用能够促进hMSCs成软骨分化(图 1)。诱导骨髓间充质干细胞成软骨分化有平面培养和成球培养,离心管成球培养使细胞间的黏附增殖有利于细胞间信号传导,为维护细胞的代谢活动提供了适宜的微环境,聚集成球培养的GAG、Collagen Ⅱ和Sox9表达量高于平面培养[25],hMSCs在成球培养条件下可获得更强的向软骨分化的能力[26-27],因此本次实验采用了成球培养。采用不同组诱导培养基对hMSCs进行成球成软骨诱导培养21 d,测量结果表明,与对照组相比,TGF-β3常规培养基组、100 ng/mL IFN-β1a组、TGF-β3+100 ng/mL IFN-β1a组软骨球尺寸均大于对照组,且TGF-β3+100 ng/mL IFN-β1a组软骨球尺寸最大(图 2)。进一步采用阿利新蓝染色软骨球中聚集蛋白聚糖(Aggreecan),结果也表明TGF-β3+100 ng/mL IFN-β1a组的染色之后,蓝色所占比例增多,说明添加IFN-β1a之后能促进hMSCs成软骨分化程度(图 3)。
除检测添加IFN-β1a对上述成软骨细胞组织化学指标的影响之外,本研究在mRNA水平和蛋白水平研究了成软骨细胞标志蛋白的影响。其中Sox9是一种高迁移率族蛋白转录因子,是间质祖细胞成软骨分化早期阶段的标志[28],Sox9不但能结合并激活非软骨组织细胞的软骨基因增强子序列,使之呈软骨细胞表型[29],其还能与Wnt/β-catenin和TGF-β/Smad信号转导通路相互作用调控软骨细胞分化[30-31]。而Collagen Ⅱ是软骨细胞的主要结构成分,维持细胞的基本骨架,也是软骨细胞的标志性蛋白,临床研究中多用于衡量软骨细胞的数量和成熟状态[32],因此上述两者是成软骨细胞的重要标志物。本研究中的结果表明,在相同的诱导时间下,TGF-β3+100 ng/mL IFN-β1a组中Sox9和Collagen Ⅱ在mRNA水平和蛋白表达水平均显著高于TGF-β3组和IFN-β1a组,且随着诱导时间的延长呈上升趋势。而TGF-β3组和IFN-β1a组中上述两种标志因子在相同诱导时间下,并非都有显著性差异。且随着诱导分化时间延长总体也呈上升趋势,但IFN-β1a组在第7、11天后达到一个峰值,分析可能IFN-β1a在开始阶段会强烈地刺激hMSCs的成软骨分化,随着时间的推移这种刺激作用会减弱。上述研究结果表明,在常规的TGF-β3诱导分化培养基中添加重组人IFN-β1a能促进hMSCs成软骨细胞定向分化,且能上调Sox9转录因子。但是,其具体的作用机制需要进一步的研究探索,以期为今后重组人IFNβ在细胞分化方面的应用奠定基础。
| [1] | Correa D, Lietman SA. Articular cartilage repair: Current needs, methods and research directions. Semin Cell Dev Biol, 2017, 62: 67–77. DOI: 10.1016/j.semcdb.2016.07.013 |
| [2] | Wyles CC, Houdek MT, Behfar A, et al. Mesenchymal stem cell therapy for osteoarthritis: current perspectives. Stem Cells Cloning, 2015, 8: 117–124. |
| [3] | Tsai TL, Manner PA, Li WJ. Regulation of mesenchymal stem cell chondrogenesis by glucose through protein kinase C/transforming growth factor signaling. Osteoarthritis Cartilage, 2013, 21(2): 368–376. DOI: 10.1016/j.joca.2012.11.001 |
| [4] | Park JS, Shim MS, Shim SH, et al. Chondrogenic potential of stem cells derived from amniotic fluid, adipose tissue, or bone marrow encapsulated in fibrin gels containing TGF-b3. Biomaterials, 2011, 32(32): 8139–8149. DOI: 10.1016/j.biomaterials.2011.07.043 |
| [5] | Rodrigues M, Griffith LG, Wells A. Growth factor regulation of proliferationand survival of multipotential stromal cells. Stem Cell Res Ther, 2010, 1(4): 32–41. DOI: 10.1186/scrt32 |
| [6] | Irudayam JI, Contreras D, Spurka L, et al. Characterization of type Ⅰ interferon pathway during hepatic differentiation of human pluripotent stem cells and hepatitis C virus infection. Stem Cell Res, 2015, 15(2): 354–364. DOI: 10.1016/j.scr.2015.08.003 |
| [7] | Zheng LS, Hitoshi S, Kaneko N, et al. Mechanisms for Interferon-a-induced depression and neural stem cell dysfunction. Stem Cell Reports, 2014, 3(1): 73–84. DOI: 10.1016/j.stemcr.2014.05.015 |
| [8] | Suzuki H, Mochizuki A, Yoshimura K, et al. Bropirimine inhibits osteoclast differentiation through production of interferon-β. Biochem Biophys Res Commun, 2015, 467(1): 146–151. DOI: 10.1016/j.bbrc.2015.09.092 |
| [9] | Martel-Pelletier J, Barr AJ, Cicuttini FM, et al. Osteoarthritis. https://www.nature.com/articles/nrdp201672. |
| [10] | Loeser RF, Goldring SR, Scanzello CR, et al. Osteoarthritis: a disease of the joint as an organ. Arthritis Rheum, 2012, 64(6): 1697–1707. DOI: 10.1002/art.v64.6 |
| [11] | Shen H, Wang Y, Zhang Z, et al. Mesenchymal stem cells for cardiac regenerative therapy: optimization of cell differentiation strategy. Stem Cells Int, 2015, 2015: 524756–524766. |
| [12] | Kuroda Y, Kitada M, Wakao S, et al. Unique multipotent cells in adult human mesenchymal cell populations. Proc Natl Acad Sci USA, 2010, 107(19): 8639–8643. DOI: 10.1073/pnas.0911647107 |
| [13] | Sensebe L, Krampera M, Schrezenmeier H, et al. Mesenchymal stem cells for clinical application. Vox Sang, 2010, 98(2): 93–107. DOI: 10.1111/vox.2010.98.issue-2 |
| [14] | Kanda A, Sotomaru Y, Nobukiyo A, et al. Characterization of common marmoset (Callithrix jacchus) bone marrow-derived mesenchymal stem cells. Folia Histochem Cytobiol, 2013, 51(4): 292–299. |
| [15] | Hall BE, Wankhade UD, Konkel JE, et al. Transforminggrowth factor-β3 (TGF-β3) knock-in ameliorates inflammation due to TGF-β1 deficiency while promoting glucose tolerance. J Biol Chem, 2013, 288(44): 32074–32092. DOI: 10.1074/jbc.M113.480764 |
| [16] | Appel H, Kuhne M, Spiekermann S, et al. Immunohistologic analysis of zygapophyseal joints in patients with ankylosing spondylitis. Arthritis Rheum, 2006, 54(9): 2845–2851. DOI: 10.1002/(ISSN)1529-0131 |
| [17] | Horbelt D, Denkis A, Knaus P. A portrait of transforming growth factor beta superfamily signalling: Background matters. Int J Biochem Cell Biol, 2012, 44(3): 469–474. DOI: 10.1016/j.biocel.2011.12.013 |
| [18] | Jayasuriya CT, Zhou FH, Pei M, et al. Matrilin-3 chondrodysplasia mutations cause attenuated chondrogenesis, prematurehy pertrophy and aberrant response to TGF-β in chondroprogenitor cells. Int J Mol Sci, 2014, 15(8): 14555–14573. DOI: 10.3390/ijms150814555 |
| [19] | Jin XB, Sun YS, Zhang K, et al. Tissue engineered carti-lage from h TGF beta2 transduced human adipose derived stem cells seeded in PLGA / alginate compound in vitro and in vivo. J Biomed Mater Res A, 2008, 86(4): 1077–1087. |
| [20] | Murata D, Miyakoshi D, Hatazoe T, et al. Multipotency of equine mesenchymal stem cells derived from synovial fluid. Vet J, 2014, 202(1): 53–61. DOI: 10.1016/j.tvjl.2014.07.029 |
| [21] |
Zhao GR. Research progress of recombinant human interferon.
Chin J Biol, 2010, 23(12): 1384–1388.
(in Chinese). 赵广荣. 重组人干扰素的研究进展. 中国生物制品学杂志, 2010, 23(12): 1384-1388. |
| [22] | Diao Y, Mohandas R, Lee P, et al. Effects of long-term Type Ⅰ interferon on the arterial wall and smooth muscle progenitor cells differentiation. Arterioscler Thromb Vasc Biol, 2016, 36(2): 266–273. DOI: 10.1161/ATVBAHA.115.306767 |
| [23] | Matatall KA, Shen CC, Challen GA, et al. Type Ⅱ interferon promotes differentiation of myeloid-biased Hematopoietic Stem Cells. Stem Cells, 2014, 32(11): 3023–3030. DOI: 10.1002/stem.1799 |
| [24] | Hirsch M, Knight J, Tobita M, et al. The effect of interferon-beta on mouse neural progenitor cell survival and differentiation. Biochem Biophys Res Commun, 2009, 388(2): 181–186. DOI: 10.1016/j.bbrc.2009.07.073 |
| [25] |
Liu J, Xu C, Yu L, et al. Induced differentiation of human umbilical cord mesenchymal stem cells into chondrocytes in two kinds of culture systems.
Chin J Tissue Engin Res, 2012, 16(41): 7625–7630.
(in Chinese). 柳菁, 许超, 宇丽, 等. 两种培养体系条件下人脐带间充质干细胞向软骨细胞的分化. 中国组织工程研究, 2012, 16(41): 7625-7630. |
| [26] | Furukawa KS, Imura K, Tateishi T, et al. Scaffold-free cartilage by rotational culture for tissue engineering. J Biotechnol, 2008, 133(1): 134–145. DOI: 10.1016/j.jbiotec.2007.07.957 |
| [27] | Wang Y, Kim UJ, Blasioli DJ, et al. In vitro cartilage tissue engineering with 3D porous aqueous-derived silk scaffolds and mesenchymal stem cells. Biomaterials, 2005, 26(34): 7082–7094. DOI: 10.1016/j.biomaterials.2005.05.022 |
| [28] | Venkatesan JK, Ekici M, Madry H, et al. SOX9 gene transfer via safe, stable, replication-defective recombinant adeno-asso-ciated virus vectors as a novel, powerful tool to enhance thechondrogenic potential of human mesenchymal stem cells. Stem Cell Res Ther, 2012, 3(3): 22–37. DOI: 10.1186/scrt113 |
| [29] | Furumatsu T, Shukunami C, Amemiya-Kudo M, et al. Scleraxis and E47 cooperatively regulate the Sox9-dependent transcription. Int J Biochem Cell Biol, 2010, 42(1): 148–156. DOI: 10.1016/j.biocel.2009.10.003 |
| [30] | Topol L, Chen W, Song H, et al. Sox9 inhibits Wnt signaling by promoting beta-catenin phosphorylation in the nucleus. J Biol Chem, 2009, 284(5): 3323–3333. DOI: 10.1074/jbc.M808048200 |
| [31] | Lorda-Diez CI, Montero JA, Martinez-Cue C, et al. Transforming growth factors beta coordinate cartilage and tendon differentiation in the developing limb mesenchyme. J Biol Chem, 2009, 284(43): 29988–29996. DOI: 10.1074/jbc.M109.014811 |
| [32] | Whitaker AT, Berthet E, Cantu A, et al. Smad4 regulates growth plate matrix production and chondrocyte polarity. Biol Open, 2017, 6(3): 358–364. DOI: 10.1242/bio.021436 |
 2018, Vol. 34
2018, Vol. 34