中国科学院微生物研究所、中国微生物学会主办
文章信息
- 黄莉敏, 张大准, 王艳, 张巧, 梁伟, 张永顶, 熊祖应
- Huang Limin, Zhang Dazhun, Wang Yan, Zhang Qiao, Liang Wei, Zhang Yongding, Xiong Zuying
- 自制抗人磷脂酶A2受体抗体ELISA试剂盒的临床应用评价
- Clinical application of homemade ELISA kit for anti-human phospholipase A2 receptor antibody
- 生物工程学报, 2018, 34(5): 743-751
- Chinese Journal of Biotechnology, 2018, 34(5): 743-751
- 10.13345/j.cjb.170460
-
文章历史
- Received: November 21, 2017
- Accepted: January 26, 2018
2 深圳市伯劳特生物制品有限公司,广东 深圳 518054
2 Shenzhen Blot Biotech Co. Ltd, Shenzhen 518054, Guangdong, China
膜性肾病(Membranous nephropathy,MN)是一个病理学概念,根据病因可分为原发性膜性肾病(Primary membranous nephropathy,pMN)和继发于全身其他病因的继发性膜性肾病(Secondary membranous nephropathy,sMN)。两者临床表现相似,仅从临床表现不能进行鉴别,但两者治疗方案差异巨大,如何鉴别pMN和sMN一直困扰着国内外肾脏病专家[1-2]。2009年,Beck等[3]在pMN患者血清中检测出抗M型磷脂酶A2受体(Phospholipase A2 receptor,PLA2R)抗体,抗体阳性率可达约70%;而健康人、sMN病人及其他肾病患者血清抗体均阴性,提示抗PLA2R抗体可能是pMN特异性标志物。而国内外相关研究也相继证实抗PLA2R抗体在膜性肾病中的作用[4]。
目前市场上仅有欧蒙公司能生产该ELISA试剂盒,本研究通过自主研发,自制了PLA2R抗体定量检测ELISA试剂盒,并对试剂盒性能进行了评价。
1 材料与方法 1.1 研究对象 1.1.1 pMN组北京大学深圳医院肾内科2010年5月至2016年2月住院患者,经肾穿刺活检病理组织检查,通过光镜、免疫荧光、电镜确诊为MN;并通过临床资料,结合实验室检查,排除肿瘤、药物、感染及其他自身免疫病等引起的继发性膜性肾病。于肾穿刺当日清晨留取患者血清标本,符合标准的276例pMN患者入组。
1.1.2 非pMN组随机选取同期诊断为其他肾脏病及健康体检者,共122例入组。包括继发性膜性肾病(sMN) 12例,肾功能不全9例,糖尿病患者8例,系统性红斑狼疮6例,健康体检者87名(年龄在20– 70岁之间)。
1.2 方法 1.2.1 样本收集所有入组患者于清晨空腹状态下采集静脉血,于3 000 r/min、4 ℃离心10 min。分离血清,并分装于–80 ℃冰箱待用。
1.2.2 抗原及校准品制备抗原为HEK293细胞表达的重组PLA2R全长蛋白(由美国SHENZHEN BLOT BIOTECH- WISCONSIN,LLC公司提供,HEK293细胞表达)。校准品通过德国欧蒙公司(E150522BD)检测膜性肾病患者血清,选取抗体滴度大于1 500 RU/mL的阳性血清,将阳性血清混合后以阴性血清进行不同比例稀释作候选校准品原料血清,再通过注册试剂盒重复检测候选校准品血清3次,选择与注册试剂盒校准品OD值无差异(P > 0.05)的校准品候选血清。入选校准品血清以校准品稀释液稀释101倍即得自制试剂盒校准品(市售试剂盒校准品滴度2、20、100、500、1 500 RU/mL)。
1.2.3 自制ELISA试剂盒用0.05 mol/L CB缓冲液稀释重组PLA2R抗原至1 μg/mL,加入酶标板,每孔100 μL,于4 ℃包被过夜。TBS缓冲液洗涤3次,每次5 min。每孔加入1%的BSA,150 μL/孔,室温(18–26 ℃)封闭30 min。将酶标板拍干,置于室温(18–26 ℃)、湿度 < 15%条件下干燥2–4 h,封装并保存于4 ℃备用。
1.2.4 自制ELISA试剂盒检测血清抗体滴度待检样本用Tris+1% BSA稀释液按1:101稀释(Sigma公司),取包被好的酶标板条,室温平衡之后,加入稀释好的样本和校准品以及对照品,每孔100 μL,室温温育30 min;然后洗涤3次(TECAN洗板机),加入1:6 000稀释好的HRP标记兔抗人IgG (Sigma公司),每孔100 μL,室温温育30 min;洗涤3次,加入底物TMB,每孔100 μL,室温避光反应30 min;加入0.5 mol/L的H2SO4,每孔100 μL终止反应。用酶标仪(TECAN NanoQuant)测定450 nm和620–650 nm任一波长处的吸光度值,以450 nm波长处的吸光度值减去620–650 nm波长处的吸光度值记为各孔的OD值。然后以校准品的浓度值2、20、100、500、1 500 RU/mL作为x轴,各校准品对应的OD值作y轴,进行曲线回归拟合,根据拟合的标准曲线方程计算出各待测样本的浓度。
1.2.5 注册试剂盒测血清抗体滴度该检测试剂盒购自德国欧蒙公司(E150522BD),实验操作按试剂盒内说明书进行。并根据说明书将血清抗体滴度 < 14 RU/mL记为阴性,将抗体滴度 > 20 RU/mL记为阳性。若抗体滴度介于14– 20 RU/mL则为疑似阳性,疑似阳性患者选取同期血清进行多次检测,> 20 RU/mL记为阳性。
1.3 统计学分析统计学分析均用SPSS 19.0,以α=0.05为检验水准,P < 0.05说明差异有统计学意义。
1.3.1 准确度用试剂盒内阳性对照直接进行检测,重复测量3次后,其平均值记作x,根据公式:测量偏差=(x–理论值)/理论值×100%,结果相对偏差在±15%区间内。
1.3.2 检测限用样本稀释液作为样本进行检测,重复测定20次,得出20次测量结果的吸光度值(A值),计算其平均值(x)和标准差(s),得出x+2s所对应A值,根据试剂盒所用校准品校准曲线方程,将x+2s所对应A值代入上述方程中,求出对应浓度值,即为检测限,其结果不高于2 RU/mL。其中自制试剂盒记为A1,市售试剂盒记为A2。
1.3.3 测量系统线性范围将接近线性范围上限的校准品用样本稀释液倍比稀释为5种浓度,其中低值样本需接近线性范围下限。按试剂盒说明书进行操作,将每一浓度样本重复检测2次,计算其浓度平均值,将结果平均值和稀释比例用最小二乘法进行直线拟合,并计算线性相关系数R2,结果线性范围2–500 RU/mL,线性相关系数R2值不低于0.99。
1.3.4 重复性用2个浓度水平样本各重复检测10次,计算10次测量浓度结果平均值x和标准差s,根据如下公式(1)得出变异系数CV,结果变异系数(CV)不高于15%。其中自制试剂盒记为CV1,市售试剂盒记为CV2。
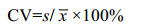
|
(1) |
式中,CV:变异系数;s:10次测量结果标准差;x:10次测量结果平均值。
1.3.5 批间差用3个批号试剂盒分别检测同一份样本,各重复10次,计算30次测量浓度值平均值x和标准差s,根据公式(2)得出变异系数CV,结果变异系数(CV)不高于15%。其中自制试剂盒记为CV1,市售试剂盒记为CV2。

|
(2) |
试剂盒在37 ℃恒温箱放置6 d后,2–8 ℃贮存365 d后,取试剂盒检测准确度、检测限、线性范围、重复性,应符合以上1.3.1–1.3.5要求。
2 结果 2.1 自制试剂盒性能评价结果自制试剂盒测量偏差如表 1所示,市售试剂盒测量偏差如表 2所示,测量偏差均在±15%区间内。两组测量偏差比较,P > 0.05,不认为两组试剂盒的测量偏差存在统计学差异。
| Kit lot number | OD value | Concentration (RU/mL) | Average concentration (RU/mL) | x-theory of value (RU/mL) | Measured deviation (%) |
| 150727 | 0.689 | 94.581 27 | 93.730 53 | –6.269 47 | –6.27 |
| 0.691 | 95.012 03 | ||||
| 0.675 | 91.598 30 | ||||
| 150803 | 0.767 | 93.710 85 | 94.172 09 | –5.827 91 | –5.83 |
| 0.751 | 90.371 09 | ||||
| 0.789 | 98.434 34 | ||||
| 150914 | 0.767 | 92.083 58 | 98.220 85 | –1.779 15 | –1.78 |
| 0.802 | 99.802 97 | ||||
| 0.815 | 102.776 00 | ||||
| The theory of concentration represents the ideal positive control value, the positive control theoretical value of these boxes is 100 RU/mL. | |||||
| Kit lot number | OD value | Concentration (RU/mL) | Average concentration (RU/mL) | x-theory of value (RU/mL) | Measured deviation (%) |
| E160821AD | 0.732 0 | 104.586 056 | 101.258 085 | 1.258 085 | 1.26 |
| 0.699 0 | 96.972 321 | ||||
| 0.721 9 | 102.215 878 | ||||
| E161010BH | 0.938 0 | 93.715 206 | 95.118 724 | –4.881 276 | –4.88 |
| 0.949 8 | 95.567 399 | ||||
| 0.953 0 | 96.073 567 | ||||
| E160204AH | 0.906 9 | 98.136 572 | 97.441 879 | –2.558 121 | –2.56 |
| 0.902 0 | 97.263 117 | ||||
| 0.900 1 | 96.925 948 |
检测限评估结果见表 3及表 4,试剂盒检测限均不高于2 RU/mL。
| Kit lot number | x | s | x+2s | Detection limit (RU/mL) |
| 150727 | 0.015 70 | 0.000 923 | 0.017 550 | 0.605 034 |
| 150803 | 0.016 00 | 0.001 835 | 0.019 670 | 0.702 500 |
| 150914 | 0.016 45 | 0.001 504 | 0.019 458 | 0.598 708 |
| Kit lot number | x | s | x+2s | Detection limit (RU/mL) |
| E160821AD | 0.024 945 | 0.003 639 | 0.032 223 | 0.122 107 |
| E161010BH | 0.070 300 | 0.007 143 | 0.084 586 | 0 |
| E160204AH | 0.017 716 | 0.002 389 | 0.022 494 | 0 |
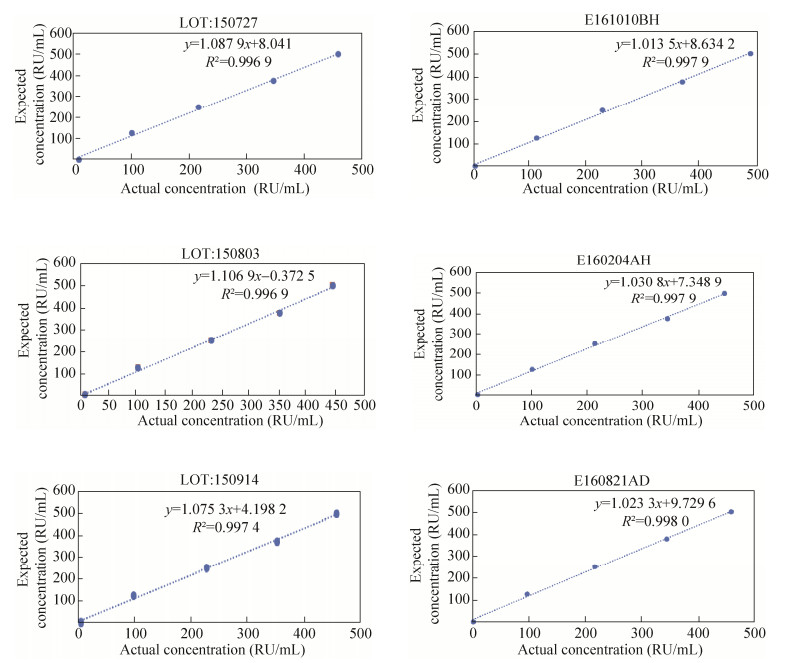
自制试剂盒与市售试剂盒线性范围2–500 RU/mL,线性相关系数R2值均不低于0.99,如图 1所示。
|
| 图 1 试剂盒线性评估 Figure 1 Liner assessment for ELISA kit. The figture of "LOT:150727, LOT:150803, LOT:150914" represent liner assessment for homomade ELISA kits, while the "E160821AD, E161010BH, E160204AH" are liner assessment for commercial ELISA kits. |
| |
对两种试剂盒进行重复性检测,自制试剂盒在100 RU/mL时的批内变异系数为CV1a=5.98%,在500 RU/mL时的批内变异系数为CV1b=4.27%。市售试剂盒在100 RU/mL时的批内变异系数为CV2a=3.85%,在500 RU/mL时的批内变异系数为CV2b=1.31%。
检测自制试剂盒批间差,得出变异系数CV1=7.95%,市售试剂盒批间差CV2=4.39%。两种试剂盒3个批间差均在15%以内。
试剂盒分别在37 ℃恒温箱放置6 d后,4 ℃贮存365 d后,取试剂盒检测准确度、检测限、线性范围、重复性。结果见表 5,试剂盒在37 ℃恒温箱放置6 d,2–8 ℃放置365 d后,试剂盒检测准确度、检测限、线性范围、重复性均符合要求。
| Storage conditions | Precision (%) | Detectability | Coefficient of correlation | Repeatability |
| 37 ℃, 6 d | 4.67 | 0.64 | R2=0.995 | CV1=6.21% CV2=5.43% |
| 4 ℃, 90 d | 2.77 | 0.70 | R2=0.998 | CV1=5.38% CV2=10.58% |
| 4 ℃, 180 d | 8.15 | 0.31 | R2=0.991 | CV1=8.67% CV2=9.63% |
| 4 ℃, 270 d | 4.04 | 0.86 | R2=0.997 | CV1=6.71% CV2=8.89% |
| 4 ℃, 365 d | 2.38 | 0.10 | R2=0.989 | CV1=5.65% CV2=7.47% |
用EUROIMMUN Anti-PLA2R ELISA试剂盒和自制试剂盒同时测定276份pMN患者血清和122份非pMN组血清,检测结果如表 6所示。欧蒙试剂盒检测pMN患者血清敏感度为51.81%,特性度为100%;自制试剂盒检测敏感度为50.36%,特异度为100%。自制试剂盒与市售商品化试剂盒比较,阳性符合率97.2%,阴性符合率为100%,总体符合率有98.9%,两种试剂盒的差异不显著(P=0.583,P > 0.05)。
| Commercial kit | Homemade kit | |||
| Positive | Negative | Positive | Negative | |
| pMN | 143 | 133 | 139 | 136 |
| Non-pMN | 0 | 122 | 0 | 122 |
| Non-pMN represents the group of other renal diseases and a general population. | ||||
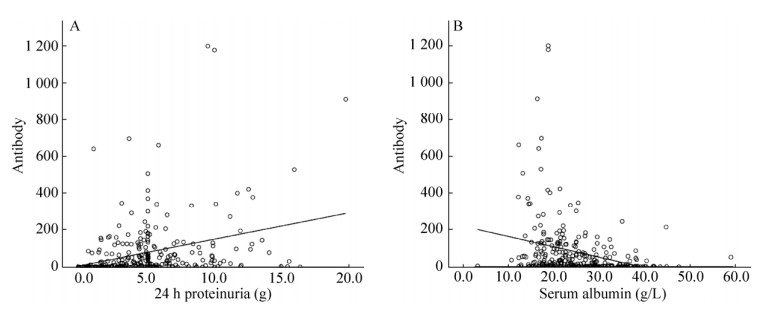
2010–2016年在我科住院并行肾穿刺活检病理和临床诊断,共纳入符合标准的pMN患者276例,以自制试剂盒测量抗体滴度,其中抗PLA2R抗体阳性患者139例,阴性患者137例,pMN患者血清抗PLA2R抗体阳性率为50.36%。通过统计学分析发现阴性组与阳性组患者血清肌酐无统计学差异,但阳性组患者年龄、尿蛋白定量高于阴性组患者,阳性组患者血白蛋白低于阴性组(P < 0.05) (表 7)。进一步分析抗PLA2R抗体滴度分别与尿蛋白、血白蛋白的相关性,通过线性回归,得到如图 2A、2B所示散点图,发现抗PLA2R抗体滴度与尿蛋白呈正相关,与血白蛋白呈负相关。
|
| 图 2 血清抗PLA2R抗体与24 h蛋白尿(A)和血清白蛋白(B)的关系 Figure 2 Relationship between serum anti-PLA2R antibody and 24 h proteinuria (A), serum albumin (B). |
| |
| Clinical parameter | Anti-PLA2R antibody | P value | |
| Positive | Negative | ||
| Case (n) | 139 | 137 | |
| Gender (Male/Female) | 84/55 | 74/63 | |
| Age (year) | 44.33±15.44 | 38.45±12.86 | <0.05 |
| Systolic BP (mmHg) | 131.69±18.94 | 123.24±19.12 | <0.05 |
| Diastolic BP (mmHg) | 79.49±12.82 | 76.93±11.66 | 0.084 |
| 24 h proteinuria (g) | 6.13±3.38 | 4.21±3.05 | <0.05 |
| Serum albumin (g/L) | 22.46±6.46 | 27.31±8.58 | <0.05 |
| Serum creatinine (μmol/L) | 76.13±26.91 | 77.11±45.46 | 0.827 |
有效鉴别pMN与sMN对于疾病治疗具有重要指导意义[5-6]。临床上,当病理诊断是MN时,如果能排除各种继发性病因,则可作出pMN诊断。导致MN的继发因素常常复杂多变,如某些肿瘤继发MN,有时甚至在MN发生后数月至数年后才表现出来,这给临床排除继发病因带来较多困难;再如膜性肾病合并乙型肝炎病毒感染与乙型肝炎病毒引起sMN鉴别,很难通过病理或其他实验室检查得以鉴别[7-9]。鉴别pMN和sMN的特异性抗PLA2R抗体的出现无疑为临床医生带来新希望。研究发现,超过70% pMN患者血清PLA2R抗体阳性,而sMN患者则该抗体很少阳性;且血清抗PLA2R抗体滴度变化先于尿蛋白变化,与病情呈平行关系,可指导临床调整治疗方案[10-14]。
本课题组研究发现在特发性膜性肾病患者中,血清抗体水平与蛋白尿水平呈正相关,与血清白蛋白水平呈负相关,血清抗PLA2R抗体的检测有利于辅助病情的诊断与疾病严重情况的预测。本课题组自制PLA2R抗体试剂盒可定量检测患者血清抗PLA2R抗体,进而鉴别pMN和sMN,该试剂盒具有准确、快捷的特性,为确诊pMN提供证据。同时可监测病人血清PLA2R抗体滴度水平,评估患者病情活动性,从而调整治疗方案。
评估该试剂盒基本性能发现,自制试剂盒诊断检测pMN敏感性50.36%,特异性100%,在4 ℃保存12个月,批间和批内稳定性良好,能够满足临床需要。比较本试剂盒与目前市面上唯一注册产品EUROIMMUN Anti-PLA2R ELISA试剂盒符合率差异无统计学意义。但由于市售试剂盒购买受条件限制,未进行两个试剂盒的稳定性比较,需进一步完善。
由于抗PLA2R抗体IgG无国际约定参考测量程序和校准品,因此我们用适当校准等级传递方案,将校准品溯源至EUROIMMUN Medizinische Labordiagnostika AG的Anti-PLA2R ELISA(IgG)检测方法。虽然检测临床样本时有4份血清样本出现差异,但整体符合率高度一致,部分差异原因可能系两种试剂盒所选抗原片段部分不同所致。
综上所述,依据自制试剂盒检测病人抗PLA2R抗体滴度水平,不仅可区别pMN和sMN,还可预测患者病变活动性,为提高pMN诊断准确率,提高治愈率创造条件[15-16]。本试剂盒符合行业内相关标准,与注册试剂盒比对结果高度一致,差异无显著意义,能满足临床应用需要。同时,自制试剂盒操作简便、质量稳定,填补了国内空白,为MN患者提供了一种有效、可靠的检测方法。本研究也将进行更大样本量的验证,寻求第三方验证,以及临床前瞻性研究,以进一步完善自制试剂盒的性能。
| [1] |
Song DX, Wang WT, Lin L, et al. Clinical significance of autoantibodies against phospholipase A2 receptor in adult patients with idiopathic membranous nephropathy.
Chin J Pract Internal Med, 2015, 35(5): 414–418.
(in Chinese). 宋东旭, 王武涛, 林鹭, 等. 成人特发性膜性肾病血清抗M型磷脂酶A2受体抗体临床意义研究. 中国实用内科杂志, 2015, 35(5): 414-418. |
| [2] |
Xie LJ, Liao YH. The molecular pathogenesis of idiopathic membranous nephropathy.
Chin J Kidney Dis Invest (Electronic Ed), 2015, 4(6): 33–39.
(in Chinese). 谢丽君, 廖蕴华. 特发性膜性肾病的分子发病机制. 中华肾病研究电子杂志, 2015, 4(6): 33-39. |
| [3] | Beck LH Jr, Bonegio RGB, Lambeau G, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med, 2009, 361(1): 11–21. DOI: 10.1056/NEJMoa0810457 |
| [4] |
Wang Y, Wang Q, Zheng AP, et al. Diagnostic value of anti-phospholipase A2 receptor antibody in atypical membranous nephropathy.
Chin J Pract Int Med, 2016, 36(11): 975–978.
(in Chinese). 王艳, 王琪, 郑爱萍, 等. 抗M型磷脂酶A2受体抗体诊断成人不典型膜性肾病价值研究. 中国实用内科杂志, 2016, 36(11): 975-978. |
| [5] | VanBeek C, Haas M. Anti-PLA2R-associated membranous nephropathy: a review with emphasis on diagnostic testing methods. Clin Nephrol, 2015, 84(1): 1–9. |
| [6] | Xu X, Wang GB, Chen N, et al. Long-Term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol, 2016, 27(12): 3739–3746. DOI: 10.1681/ASN.2016010093 |
| [7] | Ronco P, Debiec H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet, 2015, 385(9981): 1983–1992. DOI: 10.1016/S0140-6736(15)60731-0 |
| [8] | Segarra-Medrano A, Jatem-Escalante E, Quiles-Pérez MT, et al. Prevalence, diagnostic value and clinical characteristics associated with the presence of circulating levels and renal deposits of antibodies against the M-type phospholipase A2 receptor in idiopathic membranous nephropathy. Nefrologia, 2014, 34(3): 353–359. |
| [9] | Timmermans SAMEG, Damoiseaux JGMC, Heerings-Rewinkel PTJ, et al. Evaluation of anti-PLA2R1 as measured by a novel ELISA in patients with idiopathic membranous nephropathy: a cohort study. Am J Clin Pathol, 2014, 142(1): 29–34. DOI: 10.1309/AJCP8QMOY5GLRSFP |
| [10] | Beck LH Jr, Salant DJ. Membranous nephropathy: from models to man. J Clin Invest, 2014, 124(6): 2307–2314. DOI: 10.1172/JCI72270 |
| [11] | Francis JM, Beck LH Jr, Salant DJ. Membranous nephropathy: a journey from bench to bedside. Am J Kidney Dis, 2016, 68(1): 138–147. DOI: 10.1053/j.ajkd.2016.01.030 |
| [12] | Hill PA, McRae JL, Dwyer KM. PLA2R and membranous nephropathy: A 3 years prospective Australian study. Nephrology (Carlton), 2016, 21(5): 397–403. DOI: 10.1111/nep.2016.21.issue-5 |
| [13] | Hoxha E, Harendza S, Pinnschmidt HO, et al. Spontaneous remission of proteinuria is a frequent event in phospholipase A2 receptor antibody-negative patients with membranous nephropathy. Nephrol Dial Transplant, 2015, 30(11): 1862–1869. DOI: 10.1093/ndt/gfv228 |
| [14] | Kanigicherla D, Gummadova J, McKenzie EA, et al. Anti-PLA2R antibodies measured by ELISA predict long-term outcome in a prevalent population of patients with idiopathic membranous nephropathy. Kidney Int, 2013, 83(5): 940–948. DOI: 10.1038/ki.2012.486 |
| [15] | Liu YP, Li C, Ma CQ, et al. Serum anti-PLA2R antibody as a diagnostic biomarker of idiopathic membranous nephropathy: the optimal cut-off value for Chinese patients. Clin Chim Acta, 2017, 476: 9–14. |
| [16] | Beck LH Jr. PLA2R and THSD7A: Disparate paths to the same disease?. J Am Soc Nephrol, 2017, 28(9): 2579–2589. DOI: 10.1681/ASN.2017020178 |
 2018, Vol. 34
2018, Vol. 34