中国科学院微生物研究所、中国微生物学会主办
文章信息
- 倪娜, 吴建强, 李梨, 高友鹤
- Ni Na, Wu Jianqiang, Li Li, Gao Youhe
- 大鼠、豚鼠和金黄地鼠的尿液蛋白质组比较
- Comparison of urinary proteomes among rats, guinea pigs and golden hamsters
- 生物工程学报, 2018, 34(4): 578-585
- Chinese Journal of Biotechnology, 2018, 34(4): 578-585
- 10.13345/j.cjb.170398
-
文章历史
- Received: October 15, 2017
- Accepted: November 23, 2017
2 北京师范大学 生物化学与分子生物学系 北京基因工程与生物技术重点实验室,北京 100875;
1 中国医学科学院基础医学研究所/北京协和医学院基础学院 病理生理学系,北京 100005
2 Gene Engineering and Biotechnology Beijing Key Laboratory, Department of Biochemistry and Molecular Biology, Beijing Normal University, Beijing 100875, China;
1 Department of Pathophysiology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences/Peking Union Medical College, Beijing 100005, China
寻找生物标志物最主要的就是寻找与生理以及病理生理过程相关的可监测的变化[1]。尿液由于不受稳态机制的调节,可以反映体内代谢的变化,收集方便,因此,尿液是寻找疾病标志物的良好生物学来源[2]。
然而人类临床尿液样本受到多种生理性或病理性的影响,例如年龄、性别、饮食状况、运动以及药物等[3]。而动物模型是寻找疾病因果关系最有效的方法,原因如下:1)使用动物模型可以减少遗传和环境因素对尿液蛋白质组学的影响;2)有助于识别每个阶段的生物标志物,包括早期诊断;3)因为临床患者的治疗是不可避免的,所以动物模型可以避免药物对蛋白质组的影响。因此,运用动物模型进行尿液蛋白标志物的研究,更经济节约,更单一可控,有利于早期观察疾病和监测疾病进展过程中的相关病理生理变化[4]。
在科研活动中,常用大鼠来建立疾病动物模型并进行蛋白质组研究,例如大鼠肾病模型[5-6]、大鼠冠状动脉疾病模型[7-9]、大鼠膀胱癌模型[10-11]等。但是大鼠并非所有疾病的优势模型动物,不同的疾病应该选择其相应的优势模型动物,因此,研究其他动物的优势模型和蛋白质组更为必要。地鼠(Hamster)又名仓鼠,属哺乳纲、啮齿目、仓鼠科。常用于实验动物的地鼠主要有金黄地鼠Mesocricetus auratus和中国地鼠Cricetulus gzriseus。金黄地鼠现有近交系38种,突变系17种,远交群38种。地鼠在生物医学中主要应用于肿瘤学研究、生殖生理和计划生育研究、血管生理学和微循环研究、营养学研究和传染病研究。地鼠是狂犬病毒、乙型脑炎病毒的研究及其疫苗生产的主要生物材料[12]。豚鼠Cavia porcellos又名天竺鼠,属哺乳纲、啮齿目、豚鼠科。豚鼠广泛地用于免疫学、营养学、生理学、毒理学和传染病学研究。
本研究通过分析蛋白质组比较大鼠、金黄地鼠和豚鼠的尿液蛋白质的差异,旨在为医学实验提供基础数据,为优势动物模型的选择提供依据。
1 材料与方法 1.1 材料二硫苏糖醇(DTT)、碘乙酰胺(IAA)、碳酸氢铵、尿素、硫脲、Tris等均购自Sigma公司。胰蛋白酶购自Promega公司。Oasis小柱购自Waters公司。
1.2 实验动物SPF级的雄性Sprague-Dawley大鼠(170–200 g)、SPF级的雄性金黄地鼠(80–100 g)、SPF级的雄性Hartley豚鼠(200–250 g)由北京维通利华实验动物技术有限公司提供,动物许可证SCXK (京) 2012–0001)。动物实验遵循北京师范大学生命科学院伦理委员会的审查和批准。所有动物均饲养于标准条件下,室内温度为(22±1) ℃,湿度为65%–70%。
1.3 尿蛋白样品制备和LC-MS/MS分析使用动物代谢笼装置收集大鼠、金黄地鼠和豚鼠的尿液,于–80 ℃冰箱保存以备分析使用。提取尿液样品蛋白过程:将未经任何处理的大鼠、金黄地鼠和豚鼠冻存尿液(大鼠取4 mL,金黄地鼠取4 mL,豚鼠由于尿液太稀,取全部尿液),分别2 000 × g、4 ℃离心30 min,取上清,置于新的EP管中,12 000 × g、4 ℃离心30 min取上清,目的是去除大的细胞碎片;然后用3倍体积的预冷乙醇于–20 ℃过夜沉淀蛋白;沉淀完成后,12 000 × g、4 ℃离心30 min,弃上清,取沉淀,加入适量的蛋白裂解液(8 mol/L尿素、2 mol/L硫脲、25 mmol/L二硫苏糖醇和50 mmol/L Tris)重新溶解尿蛋白[13];最后用Bradford方法测定蛋白浓度。
大鼠、金黄地鼠和豚鼠各5只通过膜上酶切方法进行质谱分析。过程如下:用新配置好的UA溶液(8 mol/L尿素加入0.1 mol/L Tris-HCl,pH 8.5) 200 μL清洗10 kDa滤膜(Pall,Port Washington,NY,USA)两次,18 ℃、14 000 × g离心5 min,弃去滤过液;再将200 μg蛋白样品加载到滤膜上,用UA和50 mmol/L NH4HCO3分别洗涤蛋白样品两次;再向滤膜上加入20 mmol/L DTT于37 ℃水浴1 h;然后再加入50 mmol/L IAA室温避光作用45 min;加入胰蛋白酶(1:50) 37 ℃孵育过夜[14];次日,离心收集肽段;最后将肽段通过HLB柱(Waters, Milford,MA)脱盐,最后通过真空泵(Thermo Fisher Scientific,Bremen,Germany)抽干。
将酶切后的肽段用0.1%的甲酸酸化后,使用ABSCIEX Triple-TOF5600质谱仪(Framing-ham, MA, US)进行质谱分析并且获得数据。
1.4 蛋白质的鉴定和非标记定量质谱数据均使用Mascot软件进行处理(version 2.5, Matrix Science, London, UK),并且在Swiss-Prot中进行搜索匹配。搜索条件如下:胰酶酶切,允许最大漏切位点两个,固定修饰为半胱氨酸的脲基甲基化,可变修饰为蛋白质N-末端乙酰化和甲硫氨酸氧化。
蛋白结果使用Scaffold软件(Version 4.4.6,Proteome Software Inc.,Portland,Oregon,USA)进行筛选并定量分析。检索条件如下:肽段鉴定可信度≥90.0%,FDR≤1%,蛋白鉴定可信度≥95.0%,且包含两个以上的特异肽段[15]。用谱图数进行差异蛋白的筛选[16]。
1.5 尿蛋白质谱数据分析先将大鼠、金黄地鼠和豚鼠尿液中鉴定到的所有蛋白质转化成人的同源蛋白,再通过PANTHER数据库(http://www.pantherdb.org/)和Peptide Atlas数据库(http://www.proteinatlas.org/)分析。分别从分子功能、生物过程、细胞成分和通路等方面对大鼠、金黄地鼠和豚鼠尿液蛋白进行比较。
1.6 统计学分析用SPSS22.0软件进行统计学分析。三种鼠的尿液蛋白质结果转换成人的同源蛋白后,用单因素方差分析方法比较3种鼠的谱图数,然后再通过多重比较方法进行两两比较。所有实验均重复3次,所有结果均以“x±s”表示,组间差异P < 0.05表示具有统计学意义。
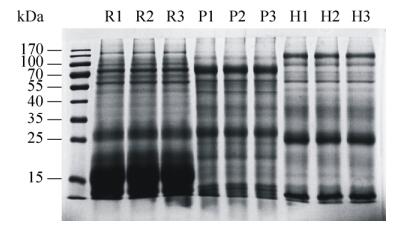
2 结果与分析 2.1 尿蛋白的SDS-PAGE分析通过SDS-PAGE技术分析比较大鼠、金黄地鼠和豚鼠尿蛋白。差异如下:大鼠与其他两种鼠相比,条带差异较大,而金黄地鼠和豚鼠条带较为相似;大鼠尿蛋白主要集中在35–15 kDa表达,而豚鼠和金黄地鼠在35–25 kDa之间表达较弱(图 1)。
|
| 图 1 SDS-PAGE分析三种鼠尿液蛋白样品 Figure 1 SDS-PAGE analysis of urinary protein samples. R1–3: samples from rats; P1–3: samples from guniea pigs; H1–3: samples from golden hamsters. |
| |
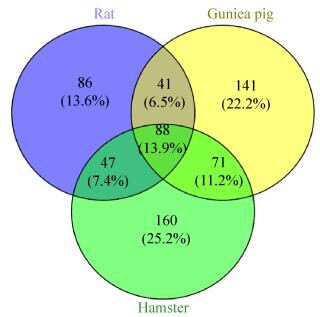
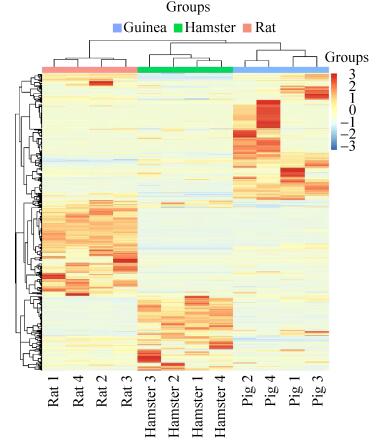
将大鼠、金黄地鼠和豚鼠尿液蛋白质谱鉴定的结果通过Mascot搜库,再通过Uniprot分别与人的同源蛋白进行比对并转换成人的同源蛋白进行比较(附表1)。三种鼠与人同源蛋白比对结果显示,豚鼠尿液所含人的同源蛋白有340个,大鼠尿液所含人同源蛋白266个,金黄地鼠尿液所含人同源蛋白366个。如图 2所示,有88个可信蛋白是3种鼠都有的,而有86个蛋白是大鼠独有的,141个蛋白是豚鼠独有的,160个蛋白是金黄地鼠独有的。如图 3所示,豚鼠和金黄地鼠尿蛋白的相似性更大。
|
| 图 2 大鼠、豚鼠和金黄地鼠尿蛋白比较Venn图 Figure 2 Rat, guinea pig and golden hamster urine protein comparison Venn diagram. The blue part represents 86 proteins that are unique to rats, the yellow part represents 141 proteins that are unique to guinea pigs, and the green part represents 160 proteins that are unique to golden hamsters. |
| |
|
| 图 3 三种鼠尿蛋白质谱结果对比热图 Figure 3 The heat map of three kinds of animal urine protein. From left to right are: rats, golden hamster and guinea pigs. The expression of protein in golden hamster and guinea pig is close. |
| |
大鼠、金黄地鼠和豚鼠尿液中鉴定到的所有蛋白质通过PANTHER数据库分析,分别从分子功能、生物过程、细胞成分和通路等方面对大鼠、金黄地鼠和豚鼠尿液蛋白进行比较(图 4)。分析显示,3种鼠的尿蛋白参与的生物过程和通路不同,具有不同的分子功能,而且细胞成分也不同。例如,豚鼠和金黄地鼠比大鼠参与钙信号通路、整合素信号通路以及Wnt信号通路的尿蛋白更多。
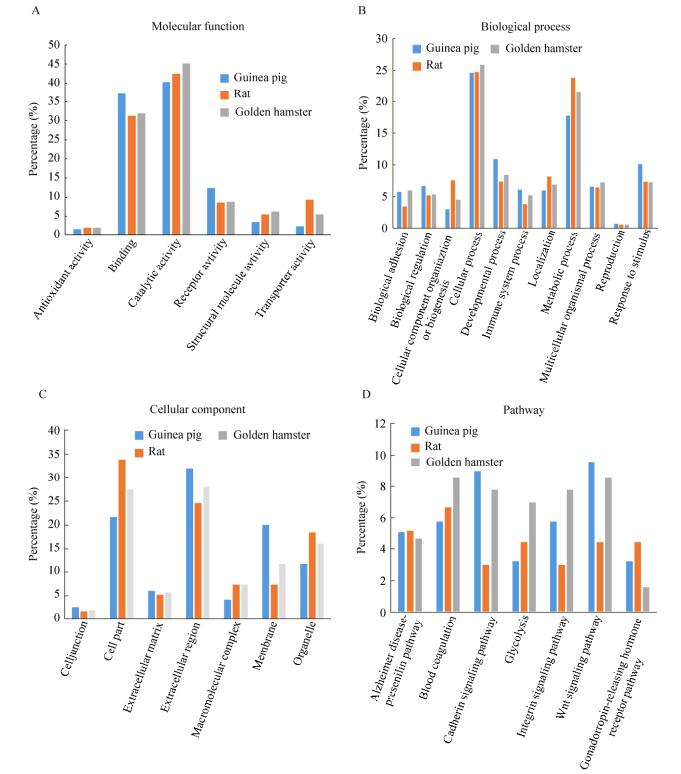
|
| 图 4 Gene ontology分析 Figure 4 Gene ontology analysis. There were significant differences in the expression of three animal proteins. (A) Molecular function. (B) Biological process. (C) Cellular component. (D) Pathway. |
| |
将大鼠,豚鼠和金黄地鼠尿蛋白质与Human Protein Atlas数据库进行比对,结果显示在泌尿系统、消化系统、神经系统、呼吸系统、免疫系统以及内分泌系统中,3种鼠的蛋白表达情况均不同,而且金黄地鼠尿蛋白在各个脏器的表达量都远远高于其他两种鼠,大部分情况下大鼠尿蛋白表达量最低(图 5)。

|
| 图 5 大鼠、豚鼠和金黄地鼠与Human Protein Atlas数据库对比结果 Figure 5 The Human Protein Atlas result between rats, guinea pigs and golden hamsters. In different organs, the three animal urine protein expression was significantly different. Among them, the highest expression of golden hamsters, followed by guinea pigs, and finally rats. |
| |
尿液是寻找疾病生物标志物良好的生物学来源[17]。尿液作为机体的一种排泄物,不受机体稳态调节,能够反映机体生理和病理的不同状态[18],而且能够更加及时、敏感地反映机体与疾病发生发展相关的早期变化。然而对于临床研究样品而言,尿液存在显著个体差异,同时也受药物、运动、饮食和生活习惯等的影响[19-21],而且临床样本复杂,难以选取同一个病理阶段进行尿液蛋白质组学分析,因此试验结果重复性不好。而用动物建立疾病模型是一个简单实用并且重复性好的筛选尿液生物标志物的方法。动物模型遗传背景简单、可控性强、实验重复性好,容易建立疾病与尿液蛋白质组之间变化体系。通过这种方法,不仅可以寻找疾病早期诊断的标志物,而且可以寻找疾病不同阶段的变化标志物。
现阶段,大鼠是常用的模型动物,而用豚鼠和金黄地鼠进行研究的报道少之甚少。截止到2017年8月1日,通过关键词(“rat” and “proteomics”)在PubMed上检索到3 873篇文章。而通过关键词(“golden hamster” and “proteomics”)和(“cavia cobaya” and “proteomics”)在PubMed上分别检索到35篇和46篇文章。
本研究通过蛋白质组学方法比较大鼠、金黄地鼠和豚鼠的尿液蛋白质,目的是为医学实验奠定数据基础,为优势动物模型的选择提供线索。本研究中检测到大鼠和豚鼠、金黄地鼠的尿液蛋白质差异很大,从SDS-PAGE中能看出,3种鼠高丰度蛋白不同,丰度抑制不同,所以对蛋白组鉴定的影响也不同,相对来说豚鼠和金黄地鼠的蛋白表达情况更为相似。因此,仅仅用大鼠来建立疾病动物模型是不适合研究所有疾病的尿液蛋白质组学。
与此同时,我们分别将大鼠、金黄地鼠和豚鼠的尿液蛋白结果转换成人的同源蛋白进行比对(附表1,可在网络版中下载),可见3种鼠中大鼠与人的同源蛋白数量最少,有很多同源蛋白只在金黄地鼠和豚鼠中发现,其中141个蛋白是豚鼠独有的,160个蛋白是金黄地鼠独有的,而这些同源蛋白参与人体各个系统各个器官的活动中。
我们将3种鼠转换后的同源蛋白与Human Protein Atlas数据库和PANTHER数据库比对,在各个系统各个器官中,大鼠、豚鼠和金黄地鼠尿蛋白表达情况都不同,并且它们参与的生物过程也都不同,其中大鼠的表达量最少,这表明在建立人类疾病模型选择模型动物的时候,金黄地鼠和豚鼠相对来说更占优势。例如在我们的数据中可以看出,在肝脏、胰腺中,金黄地鼠尿蛋白表达量高,而且目前在医学领域,肝内胆管癌和胰腺癌死亡率高,早期诊断困难,预后差,因此寻找这两种疾病的尿液蛋白标志物尤为重要,通过查询相关文献,已有报道说明金黄地鼠是肝内胆管癌和胰腺癌的优势模型动物[22-23]。在皮肤和肺中,豚鼠尿蛋白表达量虽然没有金黄地鼠高,但是金黄地鼠尿量偏少且浓,在收取尿液样本上,豚鼠更为合适,而且皮肤过敏、皮肤癣以及慢性阻塞性肺疾病在临床的早期诊断与鉴别诊断都困难,且治疗效果不佳,所以我们可以通过寻找尿液蛋白标志物进行鉴别诊断,监测疾病进展和疾病疗效,现已有报道验证豚鼠是研究慢性阻塞性肺疾病、皮肤过敏、皮肤癣菌等疾病的优势模型[24-26]。通过以上的研究,可以指导疾病动物模型的选择。例如在肝脏、胰腺疾病模型的选择中,我们可以优先考虑金黄地鼠,在皮肤等疾病模型中,我们可以优先考虑豚鼠,再结合疾病和动物的自身特点以及之前的报道,正确选择出优势模型。综上所述,用豚鼠、金黄地鼠和大鼠选择其相应的疾病模型,提高了尿液蛋白标志物筛选的效率和准确率,在寻找人类疾病早期诊断的尿液蛋白标志物方面更有前景。
| [1] | Gao YH. Urine-an untapped goldmine for biomarker discovery?. Sci China Life Sci, 2013, 56(12): 1145–1146. DOI: 10.1007/s11427-013-4574-1 |
| [2] | Gao YH. Urine is a better biomarker source than blood especially for kidney diseases. Adv Exp Med Biol, 2015, 845: 3–12. DOI: 10.1007/978-94-017-9523-4 |
| [3] | Wu JQ, Gao YH. Physiological conditions can be reflected in human urine proteome and metabolome. Expert Rev Proteomics, 2015, 12(6): 623–636. DOI: 10.1586/14789450.2015.1094380 |
| [4] | Zhao MD, Li ML, Li XD, et al. Dynamic changes of urinary proteins in a focal segmental glomerulosclerosis rat model. Proteome Sci, 2014, 12: 42. DOI: 10.1186/1477-5956-12-42 |
| [5] | Carter JL, Parker CT, Stevens PE, et al. Biological variation of plasma and urinary markers of acute kidney injury in patients with chronic kidney disease. Clin Chem, 2016, 62(6): 876–883. DOI: 10.1373/clinchem.2015.250993 |
| [6] | Rosner MH. Urinary biomarkers for the detection of renal injury. Adv Clin Chem, 2009, 49: 73–97. DOI: 10.1016/S0065-2423(09)49004-8 |
| [7] | Paapstel K, Zilmer M, Eha J, et al. Early biomarkers of renal damage in relation to arterial stiffness and inflammation in male coronary artery disease patients. Kidney Blood Press Res, 2016, 41(4): 488–497. DOI: 10.1159/000443450 |
| [8] | Zimmerli LU, Schiffer E, Zürbig P, et al. Urinary proteomic biomarkers in coronary artery disease. Mol Cell Proteomics, 2008, 7: 290–298. DOI: 10.1074/mcp.M700394-MCP200 |
| [9] | Mullen W, Gonzalez J, Siwy J, et al. A pilot study on the effect of short-term consumption of a polyphenol rich drink on biomarkers of coronary artery disease defined by urinary proteomics. J Agric Food Chem, 2011, 59: 12850–12857. DOI: 10.1021/jf203369r |
| [10] | Zhu X, Qiao Y, Liu WH, et al. CXCL5 is a potential diagnostic and prognostic marker for bladder cancer patients. Tumour Biol, 2016, 37(4): 4569–4577. DOI: 10.1007/s13277-015-4275-4 |
| [11] | Vrooman OP, Witjes JA. Urinary markers in bladder cancer. Eur Urol, 2008, 53: 909–916. DOI: 10.1016/j.eururo.2007.12.006 |
| [12] |
Cui XX, Shang SC, Zhang XF, et al. Analysis and determination of blood biochemical parameters in mesocricetusauratus and albino mutant.
Chin J Compar Med, 2014, 24(1): 31–34, 30.
(in Chinese). 崔晓霞, 尚世臣, 张小飞, 等. 白化地鼠和金黄地鼠的血清生化指标的测定. 中国比较医学杂志, 2014, 24(1): 31-34, 30. |
| [13] | Sun W, Li FX, Wu SZ, et al. Human urine proteome analysis by three separation approaches. Proteomics, 2005, 5(18): 4994–5001. DOI: 10.1002/(ISSN)1615-9861 |
| [14] | Wiśniewski JR, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis. Nat Methods, 2009, 6: 359–362. DOI: 10.1038/nmeth.1322 |
| [15] | Nesvizhskii AI, Keller A, Kolker E, et al. A statistical model for identifying proteins by tandem mass spectrometry. Anal Chem, 2003, 75(17): 4646–4658. DOI: 10.1021/ac0341261 |
| [16] | Schmidt C, Grønborg M, Deckert J, et al. Mass spectrometry-based relative quantification of proteins in precatalytic and catalytically active spliceosomes by metabolic labeling (SILAC), chemical labeling (iTRAQ), and label-free spectral count. RNA, 2014, 20(3): 406–420. DOI: 10.1261/rna.041244.113 |
| [17] | Shao C, Li ML, Li XD, et al. A tool for biomarker discovery in the urinary proteome: a manually curated human and animal urine protein biomarker database. Mol Cell Proteomics, 2011, 10(11): M111. 010975. DOI: 10.1074/mcp.M111.010975 |
| [18] | Li ML, Zhao MD, Gao YH. Changes of proteins induced by anticoagulants can be more sensitively detected in urine than in plasma. Sci China Life Sci, 2014, 57(7): 649–656. DOI: 10.1007/s11427-014-4661-y |
| [19] | Li YH, Fu CL, Zhou XF, et al. Urine interleukin-18 and cystatin-C as biomarkers of acute kidney injury in critically ill neonates. Pediatr Nephrol, 2012, 27: 851–860. DOI: 10.1007/s00467-011-2072-x |
| [20] | Doi K, Katagiri D, Negishi K, et al. Mild elevation of urinary biomarkers in prerenal acute kidney injury. Kidney Int, 2012, 82(10): 1114–1120. DOI: 10.1038/ki.2012.266 |
| [21] | Jin J, Ku YH, Kim Y, et al. Differential proteome profiling using iTRAQ in microalbuminuric and normoalbuminuric type 2 diabetic patients. Exp Diabetes Res, 2012, 2012: 168602. |
| [22] | Kawaura A, Tanida N, Akiyama J, et al. Inhibitory effect of 1α-hydroxyvitamin D3 on N-nitrosobis (2-oxopropyl) amine-induced cholangiocarcinogenesis in Syrian hamsters. Acta Med Okayama, 2011, 65(3): 193–197. |
| [23] | Takahashi M, Hori M, Mutoh M, et al. Experimental animal models of pancreatic carcinogenesis for prevention studies and their relevance to human disease. Cancers (Basel), 2011, 3(1): 582–602. DOI: 10.3390/cancers3010582 |
| [24] | Basketter D. Skin sensitisation, adverse outcome pathways and alternatives. Altern Lab Anim, 2016, 44(5): 431–436. |
| [25] | Cambier L, Heinen MP, Mignon B. Relevant animal models in dermatophyte research. Mycopathologia, 2017, 182(1/2): 229–240. |
| [26] | Ramírez-Ramírez E, Torres-Ramírez A, Alquicira-Mireles J, et al. Characteristic plethysmographic findings in a guinea pig model of COPD. Exp Lung Res, 2017, 43(2): 57–65. DOI: 10.1080/01902148.2017.1294632 |
 2018, Vol. 34
2018, Vol. 34