中国科学院微生物研究所、中国微生物学会主办
文章信息
- 刘传志, 李伟, 刘桂莹, 杨羽, 宫平, 侯玥
- Liu Chuanzhi, Li Wei, Liu Guiying, Yang Yu, Gong Ping, Hou Yue
- 降钙素原荧光免疫层析方法的建立
- Detection of procalcitonin based on fluorescence immune chromatography
- 生物工程学报, 2018, 34(3): 440-448
- Chinese Journal of Biotechnology, 2018, 34(3): 440-448
- 10.13345/j.cjb.170305
-
文章历史
- Received: August 2, 2017
- Accepted: November 7, 2017
目前临床上PCT的检测方法主要有两种:半定量法和定量法[1-5]。半定量法主要是胶体金法,但其只能依靠肉眼观察颜色深浅来估计PCT含量的大概范围,人的主观性较强,影响后期用药。定量法主要是免疫发光法,临床应用较多,但其对检测人员的专业化水平要求较高,应用限制也较大。
荧光定量免疫层析是免疫荧光技术和传统免疫层析技术相结合,具有操作简便、检测快速、便携性强的优点,检测结果更为精确和灵敏[6-9]。荧光标记物采用一种新型标记方法——量子点(Quantum dots,ODs),它是一种半导体荧光纳米材料,具有激发谱线范围宽、发射谱线窄、发光效率高、发光颜色可调、光稳定性好等优良特征,十分适合作为荧光标记物[10-13]。2009年宋健等[14]首次应用量子点标记抗体对心肌肌钙蛋白进行特异性定量检测,检测限达0.4 μg/L,比其他方法的最低检出度降低了10倍。2014年,Taranova等[15]研究了一种基于多色量子点同步时检测牛奶中多种抗生素的方法,氧氟沙星、氯霉素、链霉素的检测限分别达0.3、0.12、0.2 ng/mL,且仅在10 min中内就能完成检测。此种方法不仅快速、成本低,而且具有高特异性和灵敏性。建立一种操作简单、快速、灵敏度高的PCT检测方法,定量检测PCT的含量为开发相关产品及试剂盒提供实验基础,对临床治疗和检测具有重大实际价值[16-20]。本文利用实验室已纯化好的降钙素原抗原,经弗氏佐剂混合免疫Balb/c小鼠制备PCT多克免疫腹水、取小鼠脾细胞与骨髓瘤细胞融合制备单克隆抗体;将制备得到的抗体与CdSe/ZnS量子点偶联,研究一种基于量子点标记的荧光免疫层析方法,制备出试纸条,设立对照C线,并对检测的T线进行了分析检测范围、误差、稳定性等。对制备的试纸条行了初步应用,与现有市售产品进行了检验比对,检测效果较好,可用于替代进口产品。
1 材料 1.1 实验仪器设备荧光检测仪TBS-380购于上海捷宁生物科技有限公司;YHQ-LS-50A型立式压力蒸汽灭菌器;SW-CJ-2FD型超净工作台;BioTeK Synergy型多功能微孔板检测仪;Galaxy170s型CO2培养箱;三维划膜喷金仪购于上海金标实业有限公司;Deaou-308C荧光检测仪购于迪奥生物生物科技有限公司。
1.2 材料与药品新西兰大耳兔、Balb/c小鼠购于吉林大学实验动物中心;SP2/0骨髓瘤细胞实验室存种;血清样本来自长春461医院。
PCT抗原为本实验制备保存;聚乙二醇、HAT培养液、HT培养液、青霉素、链霉素购于美国SIGMA公司;培养细胞用小牛血清购于杭州四季青公司;蛋白亲和层析柱购于Amersham;量子点CdSe/ZnS购于深圳海王英特龙生物有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)购于深圳海王英特龙生物有限公司;试纸条材料购于上海杰一公司;降钙素原ELISA检测试剂盒购于德国IBL公司。
2 方法 2.1 PCT抗体的制备取实验室已经制备纯化好的PCT抗原,免疫新西兰大白兔,经4次兔子皮下多点注射免疫接种,每只兔子注射蛋白20 μg。免疫完成5 d后进行耳缘静脉采血测定效价,达到标准后2周进行颈动脉采血,离心分离血清,采用间接ELISA方法测定效价,考马斯亮蓝法测定浓度,分装后于-20 ℃冰箱保存。
选取3只6周龄的Balb/c鼠,用实验室已制备好的PCT抗原进行免疫,经4次小鼠皮下多点注射免疫接种。第4次免疫7 d后,断尾取血,用ELISA方法测定血清中抗体效价。选取免疫效价高小鼠的脾细胞与骨髓瘤细胞sp2/0进行融合,培养10-20 d,用间接ELISA方法筛选产生的杂交瘤细胞,有限稀释法进行3次克隆化,将最后克隆出的细胞株注入小鼠腹腔得到腹水。
收集细胞破碎离心,回收蛋白,抗体纯化采用辛酸-硫酸铵法得到初步纯化的抗体,然后再经亲和层析柱得到最终纯化的抗体。纯化抗体用考马斯亮蓝法测定其浓度,ELISA法测其效价,并用SDS-PAGE进行检测。同时采取无关蛋白BSA、CRP和常见交叉物CT、CGRP为对照对其特异性进行鉴定。
2.2 PCT抗体与量子点偶联及试纸条的制备活化量子点CdSe,通过透射电镜进行分析。用MES缓冲液进行初洗3次,然后用EDC和NHS避光活化,加入PCT抗体偶联过夜,次日离心收集沉淀,用缓冲液重悬,经琼脂糖凝胶电泳检测,然后即可使用。
在硝酸纤维素膜上用划线机划好由PCT-自备鼠源抗体形成的检测线,将制备好的量子点标记的PCT单抗均匀地加在释放垫上,并用冻干机冷冻干燥2 h,完成后,将样品垫、释放垫、硝酸纤维膜和吸水纸依次叠加组装,用机器切割成宽为0.4 cm、长为7 cm大小的试纸条。
2.3 PCT质控线控制和特异性质控线C的制备:羊抗鼠二抗质控线于硝酸纤维素膜上,胶体金与抗体的连接同PCT-自备鼠源抗体的方法相同。
取血清中常见干扰物质胆红素(2.0 g/L)、三酰甘油(30.0 g/L)和PCT常见干扰物CGRP (10 μg/L)来进行试纸条的特异性检测。每种物质重复进行3次检测。
2.4 PCT试纸条的性能测试将试纸条依次排开,取80 μL待测样品加到样品垫上,每个待测样品重复检验6次,10 min后,用荧光检测仪测定其荧光值,取其平均值。
2.4.1 检测范围对PCT蛋白浓度进行梯度稀释,分别为750、350、150、80、50、30、15、7.5、3.5、0.15、0.075 μg/L,每个浓度作6个试纸条,用荧光检测仪测定,剔除跳值,取其平均值制作出标准曲线。
2.4.2 灵敏度将PCT抗原从1.5 μg/L的浓度用PB液开始稀释1.5、0.15、0.075、0.015、0.007 5、0.001 5 μg/L,确定该方法的最低检出量,即为灵敏度。
2.4.3 回收率定量检测方法的回收实验作为评估准确度的一种方法,可用于对定量检测方法准确测定加入纯分析物的能力进行评估,结果的表示指标是回收率。采用基础样本PCT抗原浓度为5 μg/L,分别向其中加入不同浓度的PCT抗原,检测其回收浓度,并计算出回收率。
2.4.4 精密度分别选取不同浓度共6个血清样本进行批内精密度测定,一个批次的试纸条1 d内检测完成,为荧光免疫层析法检测PCT批内实验结果。取10 d每天做一个批次的试纸条,每天检测6个浓度的PCT抗原样本并重复检测2次取平均值,10 d的批间实验结果。计算其平均值、标准差和变异系数。
2.4.5 稳定性根据4 ℃蛋白保存变性标准,放置37 ℃、3 d相当于置于4 ℃半年,放置37 ℃、3 d相当于置于4 ℃一年。将制备好的试纸条分3次检测,第1次是制备好后37℃第2天检测,第2次是置于37 ℃培养箱第3天检测,第3次是置于37 ℃培养箱第6天再进行检测,每次检测6个浓度,分别编号A-F每个浓度检测3次,取平均值后,比较3次的实验结果。
2.5 PCT试纸条的临床样品测试利用进口降钙素原ELISA检测试剂盒与本文所建立的荧光免疫试纸条方法,分别检测从长春461医院带回的血清样本,共15例,其中3例为正常人血清即无细菌感染,12例为不同程度细菌感染的血清,初步分析测量的准确性。将样品血清标记好,分别标记为1-15号,逐个滴加到试纸条上,每个试纸条加80 μL,每个样品加3个试纸条。用荧光检测仪分别检测出各个试纸条的荧光值,并计算平均值,将其代入建立出的标准曲线方程,求出血清样品中PCT的含量。
3 结果与分析 3.1 PCT抗体效价测定通过间接ELISA方法,PCT抗原以2 μg/mL进行包被,测得PCT多克隆抗体效价可达5×105。用考马斯亮蓝法测蛋白含量6 mg/mL。经过多次检测筛选出阳性单克隆的细胞株分别命名为2F5、5C9,制备腹水测效价结果如表 1所示,表明得到的PCT单抗效价达107。
| Positive cell strains | Antibody titer | Ascites titer |
| 2F5 | (6±1.5)×104 | (4±1.25)×107 |
| 5C9 | (8±0.42)×104 | (5±0.37)×107 |
经纯化后浓缩的单抗,考马斯亮蓝法测蛋白含量为4 mg/mL,纯化后抗体的效价能达到1×105,SDS-PAGE分析结果见图 1。

|
| 图 1 SDS-PAGE检测PCT抗体 Figure 1 Detection of PCT antibody by SDS-PAGE. M: marker; 2: unpurified antibody; 3: purified antibody. |
| |
将EDC和NHS浓度分别稀释至原来的1/2、1/4、1/8、1/16、1/32进行活化,抗体和量子点的偶联时间为过夜,分别8 h、10 h、12 h、14 h、16 h。提示活化剂浓度为原来的1/32时,偶联时间在10 h时形成较为均匀的溶液,鉴定结果见图 2,其中泳道2-6是在偶联10 h且EDC和NHS浓度分别稀释至原来的1/2、1/4、1/8、1/16、1/32时CdSe/ZnS-PCT的凝胶电泳图,提示量子点同蛋白的偶联分布均匀,得到弥散的条带,其中泳道1是量子点CdSe/ZnS。
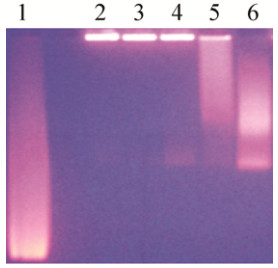
|
| 图 2 琼脂糖凝胶电泳检测PCT与量子点偶联 Figure 2 Detection of PCT coupling with quantum dots by AGE. |
| |
干扰物质胆红素、三酰甘油和CGRP加入试纸条中,均没有产生条带,证明该试纸条特异性良好。实验图 3试纸条特异性良好,左上:PCT抗原,左下:胆红素,右上:三酰甘油,右下:CGRP。

|
| 图 3 PCT荧光免疫试纸条特异性测定 Figure 3 Detection of the specificity of PCT fluorescent immumoassay strip. |
| |
利用制备的PCT单抗,与各个浓度的抗原重复进行检测后,所加的PCT抗原浓度为横坐标,所测得的荧光值为纵坐标,建立标准曲线,如图 4所示,方程为y=30.322x+250.73,R2值为0.990 6。而在浓度达到0.15 μg/L时,荧光值趋近与0,PCT抗原浓度150 μg/L时,荧光值5 700,已不再该线性范围内,不再满足线性方程。此方法的线性检测范围是0.15-120 μg/L。
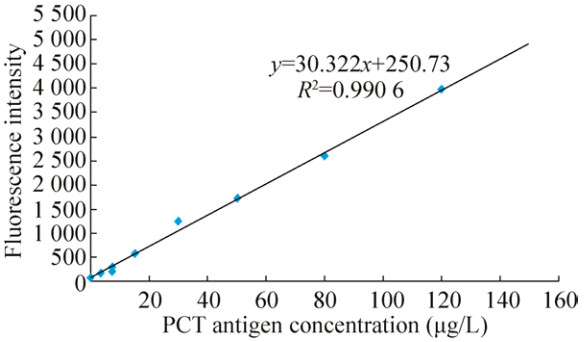
|
| 图 4 荧光免疫层析法所测得的PCT标准曲线 Figure 4 PCT standard curve by fluorescence immune chromatography. |
| |
将PCT抗原从0.75 μg/L的浓度用PB液开始稀释,做2倍浓度的稀释,由于Deaou-308C荧光检测仪的限制,直至仪器检测不出荧光值为止,这时PCT抗原浓度0.007 μg/L (表 2)。
| PCT Ag levels (μg/L) | 0.75 | 0.37 | 0.19 | 0.09 | 0.045 | 0.027 | 0.013 | 0.007 |
| RFU | 204±142 | 168±104 | 107±86 | 75±43 | 60±53 | 25±23 | 5±24 | - |
采用基础样本PCT抗原浓度为5 μg/L,分别向其中加入10种不同样品浓度的PCT抗原,检测其回收浓度,并计算出回收率,结果如表 3所示,该方法的回收率达91%-113%。
| Measured (μg/L) | Addition (μg/L) | Recycled (μg/L) | Recovery (%) | |
| Ori-samples | 5.00 | |||
| Samples 1 | 7.27 | 2.00 | 2.27±1.2 | 113±3.1 |
| Samples 2 | 9.65 | 5.00 | 4.65±2.1 | 93±2.4 |
| Samples 3 | 13.69 | 8.00 | 8.69±2.3 | 109±3.7 |
| Samples 4 | 14.20 | 10.0 | 9.20±4.1 | 92±1.4 |
| Samples 5 | 26.93 | 20.0 | 21.93±5.2 | 109±2.6 |
| Samples 6 | 35.18 | 30.0 | 30.18±4.5 | 101±3.1 |
| Samples 7 | 44.85 | 40.0 | 38.64±4.6 | 96±2.3 |
| Samples 8 | 56.76 | 50.0 | 51.76±5.1 | 103±4.2 |
| Samples 9 | 82.31 | 80.0 | 77.31±6.2 | 91±3.7 |
| Samples 10 | 99.82 | 100.0 | 94.82±8.2 | 94±2.6 |
通过1个批次的荧光测定和10个批次的取样测定荧光值并计算相关x±s、AD、CV值等,检测结果见表 4,批内、批间的变异系数均在8.0%以下,P < 0.05制备的试纸条精密度良好。
| Samples | Intra-AVG (%) | Intra-AD (%) | Intra-CV (%) | Inter-AVG (%) | Inter-AD (%) | Inter-CV (%) |
| A (7.5 μg/L) | 166.22±24.7 | 8.39±1.4 | 5.0±0.4 | 160.46±17.6 | 9.00±2.1 | 5.6±0.2 |
| B (15 μg/L) | 585.96±51.5 | 18.78±1.7 | 3.2±0.3 | 602.74±64.8 | 49.70±3.8 | 8.0±0.1 |
| C (30 μg/L) | 1 254.1±64.3 | 38.43±2.7 | 3.1±0.5 | 1 278.76±175.1 | 81.50±6.7 | 6.4±0.4 |
| D (75 μg/L) | 1 932.1±121.4 | 55.71±5.4 | 3.0±0.4 | 1 966.20±241.5 | 88.46±8.1 | 4.5±0.2 |
| E (80 μg/L) | 2 734.1±201.4 | 76.01±6.8 | 2.9±0.2 | 2 595.46±321.4 | 94.00±7.4 | 3.6±0.3 |
| F (90 μg/L) | 3 113.6±362.4 | 72.28±4.6 | 2.3±0.2 | 3 159.91±435.3 | 128.73±6.1 | 4.1±0.2 |
在第2天、第3天、第6天进行不同浓度样品检测,结果相差相近,表明PCT荧光免疫层析试纸条在37 ℃下,6 d内可保持稳定,3次的荧光值相对均一,变化不大,试纸条4℃可保持大约一年的生物稳定性。检测结果如表 5所示。
| Samples | The 2nd day | The 3rd day | The 6th day |
| A (7.5 μg/L) | 297.84±15.13 | 271.21±14.51 | 267.43±43.17 |
| B (15 μg/L) | 583.04±23.48 | 497.92±24.52 | 253.67±34.46 |
| C (30 μg/L) | 1 265.32±14.67 | 1 210.20±43.62 | 1 187.64±42.18 |
| D (75 μg/L) | 1 941.54±32.51 | 1 879.36±33.74 | 1 801.32±22.52 |
| E (80 μg/L) | 2 789.46±22.11 | 2 703.98±51.37 | 2 615.45±61.24 |
| F (90 μg/L) | 3 139.50±17.56 | 3 098.41±56.18 | 3 007.35±87.53 |
将样品血清标记好,分别标记为1-15号,逐个滴加到试纸条上,每个试纸条加80 μL,静置5 min,每个样品加3个试纸条。用荧光检测仪分别检测出各个试纸条的荧光值,并计算平均值,将其代入建立出的标准曲线方程,计算出血清样品中PCT的含量,计算结果见表 6。
| FU 1 (μg/L) | FU 2 (μg/L) | FU 3 (μg/L) | AVG (μg/L) | PCT (μg/L) | |
| Sal 1 | 1 276.32 | 1 389.41 | 1 219.86 | 1 295.19 | 34.45 |
| Sal 2 | 485.74 | 536.19 | 573.42 | 531.78 | 9.27 |
| Sal 3 | 783.48 | 761.09 | 675.91 | 740.16 | 16.14 |
| Sal 4 | 326.74 | 389.59 | 412.07 | 376.13 | 4.13 |
| Sal 5 | 992.42 | 917.83 | 1 091.12 | 1 000.46 | 24.73 |
| Sal 6 | 1 568.56 | 1 498.79 | 1 501.43 | 1 522.93 | 41.96 |
| Sal 7 | 1 192.49 | 1 101.32 | 1 269.70 | 1 187.84 | 30.91 |
| Sal 8 | 279.37 | 201.58 | 295.32 | 258.76 | 0.26 |
| Sal 9 | 823.98 | 899.24 | 776.38 | 833.20 | 19.21 |
| Sal 10 | 672.45 | 592.47 | 623.19 | 629.37 | 12.49 |
| Sal 11 | 1 743.61 | 1 692.57 | 1 791.34 | 1 742.51 | 49.20 |
| Sal 12 | 1 329.37 | 1 396.52 | 1 404.80 | 1 376.89 | 37.14 |
| Sal 13 | 0.12 | 0.02 | 0.03 | 0.01 | 0.00 |
| Sal 14 | 0.02 | 0.01 | 0.03 | 0.05 | 0.00 |
| Sal 15 | 0.05 | 0.05 | 0.12 | 0.04 | 0.00 |
| CON | 0.02 | 0.07 | 0.05 | 0.10 | 0.00 |
根据购买的某公司ELISA试剂盒提供的PCT标准品绘制检测标准曲线,并根据各个浓度及其吸光度值建立标准曲线,为之后样品浓度检测做铺垫,标准曲线方程为y=0.009 1x+0.321 71,其中R2=0.995 85。表 7是样品PCT浓度计算结果。
| No. | UV (μg/L) | PCT (μg/L) |
| Sal 1 | 0.645±0.003 | 35.60±0.31 |
| Sal 2 | 0.402±0.002 | 8.90±0.07 |
| Sal 3 | 0.475±0.003 | 16.84±0.08 |
| Sal 4 | 0.363±0.002 | 4.67±0.05 |
| Sal 5 | 0.549±0.002 | 25.02±0.23 |
| Sal 6 | 0.699±0.001 | 41.52±0.34 |
| Sal 7 | 0.606±0.001 | 31.28±0.26 |
| Sal 8 | 0.323±0.002 | 0.23±0.02 |
| Sal 9 | 0.504±0.001 | 20.05±0.18 |
| Sal 10 | 0.442±0.002 | 13.24±0.06 |
| Sal 11 | 0.764±0.003 | 48.57±0.47 |
| Sal 12 | 0.654±0.002 | 36.51±0.34 |
| Sal 13 | 0.065±0.001 | 0(N.V) |
| Sal 14 | 0.066±0.001 | 0(N.V) |
| Sal 15 | 0.072±0.002 | 0(N.V) |
| CON | 0.049±0.001 |
从表 6、7中可以看出,检测的15个血清样本结果与市售的进口试剂盒检测值相近,具有一定的相关性,有一定的临床意义。而且建立的方法比市场上的ELISA试剂盒的检测方法更为方便、快捷,操作人员不需要任何专业技能,表明建立的PCT荧光免疫层析方法的初步应用比较成功。但考虑到检测的临床样品相对数量较少,与市售产品比较还需要更多的血清样本,所以该方法临床应用还有待进一步实验验证。
4 讨论PCT作为一种具有更高的特异性和灵敏度的临床诊断生物标志物并且可以指导抗生素的临床应用,研究其定量检测方法将具有广阔的应用前景[21-24]。通过制备出高特异性及高效价的抗体,并成功标记量子点,建立得到PCT的荧光免疫层析方法。检测范围0.15-120 μg/L,灵敏度0.007 μg/L,回收率91%-113%,批内批间变异系数小于0.1,与血清中其他蛋白没有交叉反应,特异性高,4 ℃放置一年稳定性良好,并与市售的进口降钙素原ELISA试剂盒进行对比,检测结果表明两种方法的检测结果无明显差异,并且具有更宽的检测范围、更低的灵敏度及较高的便捷性。同时本方法所用的主要试剂均为国产和自制所得,生产成本低,未来在市场上的售价也将是低于其他诊断试剂,且荧光检测仪器便携,可在患者身旁20 min内即可完成检测,临床推广应用将具有广阔的空间。但本试纸条的开发在于市售的产品比较中相对样本较少,只有15个,在统计学中还欠缺比较意义,还需要更多的临床样本进行对照。本荧光检测试纸条的开发旨在为PCT临床上检测提供更加简便、快捷的检测方法,对PCT的早期诊断及临床检验有应用价值。
| [1] |
Zeng H, Zhang ZX, He QY. Comparative study on two methods for the analysis of procalcitonin.
Med Inf, 2013, 26(8): 242–243.
(in Chinese). 曾华, 张智贤, 何秋莹. 降钙素原两种检测方法的比较. 医学信息, 2013, 26(8): 242-243. |
| [2] | Ren HT, Li Y, Han CM, et al. Serum procalcitonin as a diagnostic biomarker for sepsis in burned patients: a meta-analysis. Burns, 2015, 41(3): 502–509. DOI: 10.1016/j.burns.2014.08.019 |
| [3] |
Ren ZQ, Wu YS, Liu TC. The research progress of new immune chromatography technology.
Guangdong Med J, 2013, 34(2): 312–314.
(in Chinese). 任志奇, 吴英松, 刘天才. 新型免疫层析技术的研究进展. 广东医学, 2013, 34(2): 312-314. |
| [4] | Volkov Y. Quantum dots in nanomedicine: recent trends, advances and unresolved issues. Biochem Biophys Res Commun, 2015, 468(3): 419–427. DOI: 10.1016/j.bbrc.2015.07.039 |
| [5] |
Zhang GH, Lai WH, Xiong YH, et al. Application of quantum dot labeling to development of immunochromatographic test strip for rapid detection of ractopamine.
Food Sci, 2009, 30(12): 254–257.
(in Chinese). 张国华, 赖卫华, 熊勇华, 等. 量子点标记免疫层析试纸条快速检测莱克多巴胺的研究. 食品科学, 2009, 30(12): 254-257. DOI:10.3321/j.issn:1002-6630.2009.12.058 |
| [6] |
Zhang PF, Song J, Chen J, et al. Study on conjugation of quantum dot with anti-hepatitis b surface antigen antibody.
Chin J Anal Chem, 2013, 41(6): 846–850.
(in Chinese). 张鹏飞, 宋杰, 陈佳, 等. 量子点与抗乙肝表面抗原(HBsAg)抗体的偶联研究. 分析化学, 2013, 41(6): 846-850. |
| [7] | Akshath US, Shubha LR, Bhatt P, et al. Quantum dots as optical labels for ultrasensitive detection of polyphenols. Biosens Bioelectron, 2014, 57: 317–323. DOI: 10.1016/j.bios.2014.01.038 |
| [8] |
Hu HJ, Fu T, Zhang MZ, et al. Development of CdTe/ZnSe core/shell quantum dots-based lateral-flow immunoassay for rapid detection of clenbuterol.
Chin J Anal Chem, 2010, 38(12): 1727–1731.
(in Chinese). 胡华军, 付涛, 张明洲, 等. CdTe/ZnSe核壳量子点免疫层析试纸条检测克伦特罗的研究. 分析化学, 2010, 38(12): 1727-1731. |
| [9] | Choi S, Choi EY, Kim DJ, et al. A rapid, simple measurement of human albumin in whole blood using a fluorescence immunoassay (I). Clin Chim Acta, 2004, 339(1/2): 147–156. |
| [10] |
Yang B, Kang M. Calcitonin original application in diagnosis and treatment of bacterial infectious diseases.
Mod Prev Med, 2009, 36(3): 596–597.
(in Chinese). 杨滨, 康梅. 降钙素原在细菌感染性疾病诊断及治疗中的应用. 现代预防医学, 2009, 36(3): 596-597. |
| [11] |
Guo LN, He HQ. Development of an immunochromatographic test strip for the detection of anti-CCP antibody based on quantum dots.
Chin J Biochem Mol Biol, 2013, 29(4): 389–395.
(in Chinese). 郭利宁, 何红秋. 一种基于量子点检测抗CCP抗体的免疫荧光层析法. 中国生物化学与分子生物学报, 2013, 29(4): 389-395. |
| [12] | Goryacheva IY, Speranskaya ES, Goftman VV. Synthesis and bioanalytical applications of nanostructures multiloaded with quantum dots. TrAC Trends Anal Chem, 2015, 66: 53–62. DOI: 10.1016/j.trac.2014.11.008 |
| [13] | Yang QH, Gong XQ, Song T. Quantum dot-based immunochromatography test strip for rapid, quantitative and sensitive detection of alpha fetoprotein. Biosens Bioelectron, 2011, 30(1): 145–150. DOI: 10.1016/j.bios.2011.09.002 |
| [14] |
Song J, Fan J, Song DQ, et al. Sandwich immunosensing method for measuring cardiac troponinⅠwith quantum dots-coupled antibody against troponinⅠ.
Chem J Chin Univ, 2009, 30(10): 1940–1944.
(in Chinese). 宋健, 范佳, 宋大千, 等. 量子点偶联抗体型夹心免疫传感法检测心肌肌钙蛋白Ⅰ. 高等学校化学学报, 2009, 30(10): 1940-1944. DOI:10.3321/j.issn:0251-0790.2009.10.006 |
| [15] | Taranova NA, Berlina AN, Zherdev AV. 'Traffic light' immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk. Biosens Bioelectron, 2015, 63: 255–261. DOI: 10.1016/j.bios.2014.07.049 |
| [16] |
Zhang T, Zhou H, Wang YJ, et al. Calcitonin original diagnosis significance in emergency anti-infection.
Chin J Emerg Med, 2010, 19(5): 556–558.
(in Chinese). 张涛, 周虹, 王用金, 等. 降钙素原在急诊抗感染中的诊断意义. 中华急诊医学杂志, 2010, 19(5): 556-558. |
| [17] |
Wang LX, Han GQ. Clinical value of procalcitonin for the early diagnosis of bacterial sepsis.
Zhejiang Clin Med J, 2009, 11(11): 1150–1152.
(in Chinese). 王林霞, 韩国强. 降钙素原对细菌性脓毒症早期诊断的临床意义. 浙江临床医学, 2009, 11(11): 1150-1152. DOI:10.3969/j.issn.1008-7664.2009.11.012 |
| [18] |
Kong WQ, Zhuang R, Wei DZ, et al. Procalcitonin and C-reactive protein in diagnosis of early bacterial infection in severe multiple injury patients.
Chongqing Med, 2009, 38(16): 2018–2019.
(in Chinese). 孔万权, 庄荣, 魏大臻, 等. 降钙素原与血清C-反应蛋白联合测定对严重多发伤患者早期细菌感染的诊断价值. 重庆医学, 2009, 38(16): 2018-2019. DOI:10.3969/j.issn.1671-8348.2009.16.011 |
| [19] | Monneret G, Pachot A, Laroche B, et al. Procalcitonin and calcitonin gene-related peptide decrease LPS-induced TNF production by human circulating blood cells. Cytokine, 2000, 12(6): 762–764. DOI: 10.1006/cyto.1999.0607 |
| [20] | Wang HY, Wang H, Chen SP, et al. Development of a fluorescent immnunochromatographic assay for the procalcitonin detection of clinical patients in China. Clin Chim Acta, 2015, 444: 37–42. DOI: 10.1016/j.cca.2015.01.024 |
| [21] |
Liu YL, Zhao XH, Zhang KW. Calcitonin original with allergic C-reactive protein in acute aggravating period of chronic obstructive pulmonary disease clinical significance.
Chin J Coal Ind Med, 2012, 15(9): 1384–1385.
(in Chinese). 刘玉玲, 赵小慧, 张克武. 降钙素原与超敏C-反应蛋白在慢性阻塞性肺疾病急性加重期中的临床意义. 中国煤炭工业医学杂志, 2012, 15(9): 1384-1385. |
| [22] | Baylan O, Balkan A, Inal A, et al. The predictive value of serum procalcitonin levels in adult patients with active pulmonary tuberculosis. Jpn J Infect Dis, 2006, 59(3): 164–167. |
| [23] | Charles PE, Dalle F, Aho S, et al. Serum procalcitonin measurement contribution to the early diagnosis of candidemia in critically ill patients. Intensive Care Med, 2006, 32(10): 1577–1583. DOI: 10.1007/s00134-006-0306-3 |
| [24] | Gilbert DN. Use of plasma procalcitonin levels as an adjunct to clinical microbiology. J Clin Microbiol, 2010, 48(7): 2325–2329. DOI: 10.1128/JCM.00655-10 |
 2018, Vol. 34
2018, Vol. 34




