中国科学院微生物研究所、中国微生物学会主办
文章信息
- 邓发军, 潘宇, 常飞, 房伟, 方泽民, 肖亚中
- Deng Fajun, Pan Yu, Chang Fei, Fang Wei, Fang Zemin, Xiao Yazhong
- β-葡萄糖苷酶与透明颤菌血红蛋白在大肠杆菌中的共表达
- Co-expression of β-glucosidase and Vitreoscilla hemoglobin in Escherichia coli
- 生物工程学报, 2018, 34(3): 379-388
- Chinese Journal of Biotechnology, 2018, 34(3): 379-388
- 10.13345/j.cjb.170198
-
文章历史
- Received: May 14, 2017
- Accepted: June 12, 2017
β-葡萄糖苷酶(E.C. 3.2.1.21)能催化水解或转移β-1, 4-糖苷键,是糖苷水解酶类的重要成员[1-2]。早期研究表明,β-葡萄糖苷酶广泛存在于生物体内,其在纤维素降解、生物燃料炼制中有广泛的应用潜力[3-5]。随着研究的深入,β-葡萄糖苷酶在食品加工及活性苷元制备等方面也逐步展现出巨大的应用潜力[6-8]。由于原核生物来源的β-葡萄糖苷酶具有较好的催化能力和较高的产量,近年来关于其表达及性质研究的报道越来越多[9-12]。与原始产酶菌株相比,利用大肠杆菌Escherichia coli作为宿主细胞诱导表达原核生物来源重组β-葡萄糖苷酶,具有发酵周期更短、酶蛋白产量更高等优势,因此其在β-葡萄糖苷酶生产中有广泛的应用[13-15]。然而,在大肠杆菌高密度发酵生产过程中,菌体生物量和异源蛋白表达量往往受到溶解氧不足的限制而难以达到较高的水平[16]。因此,改进大肠杆菌异源表达方法、提高大肠杆菌对低溶氧环境的适应能力,对于提高β-葡萄糖苷酶的产量、加快推进其工业化生产应用具有重要意义。
透明颤菌Vitreoscilla最早发现于湖泊等淡水沉积物中,是一种革兰氏阴性细菌,属于贝日阿托氏菌属(Beggiatoa sp.)。为了适应其生存的厌氧环境,透明颤菌能够合成一种类似于动物血红蛋白的多肽,被称为透明颤菌血红蛋白(Vitreoscilla Hemoglobin,VHb)。研究发现VHb在不同的胞内环境下可以呈现出不同的状态(氧化态、氧合态和还原态)并且可以互相转化并具有氧结合性[17]。Wang等将VHb和耶罗维亚酵母脂肪酶在毕赤酵母中共表达,在10 L发酵罐微氧环境中脂肪酶的产量增加了约84%[18]。Pablos等在大肠杆菌菌株W3110中表达VHb后,微氧环境中菌体生物量提高了约33%,同时菌体比生长速率提高了约30%[19]。
本实验室前期构建获得β-葡萄糖苷酶突变体蛋白Bgl1A (A24S/F297Y),其具有葡萄糖和乙醇双耐受的特性,在大豆异黄酮苷元制备中表现出优秀的应用潜力[20]。然而在使用大肠杆菌高密度发酵制备Bgl1A (A24S/F297Y)时,溶解氧不足阻碍了酶蛋白产量的进一步提高。为了缓解大肠杆菌菌体在高密度发酵中的溶解氧不足的限制,本研究将VHb和Bgl1A (A24S/F297Y)在大肠杆菌中进行共表达,并在摇瓶水平和3 L发酵罐水平考察了VHb的表达对菌体生物量和酶活变化的影响情况。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株和培养基突变体蛋白Bgl1A (A24S/F297Y)表达菌株E. coli BL21 (DE3)/pET22b-bgl为本实验室构建。质粒pET-22b为本实验室保存。透明颤菌血红蛋白基因序列(vgb)根据大肠杆菌密码子偏好性进行密码子优化,并由生工生物工程(上海)股份有限公司合成。表达菌株BL21 (DE3)购自北京全式金生物技术有限公司。
摇瓶培养基采用LB培养基和TB培养基。LB培养基(1 L):酵母提取物5 g,胰蛋白胨10 g,氯化钠10 g。TB培养基(1 L):酵母提取物24 g,胰蛋白胨12 g,甘油4 mL,使用时加入终浓度为17 mmol/L的KH2PO4和72 mmol/L K2HPO4缓冲液。发酵罐初始培养基为改良TB培养基(增加甘油至终浓度15 g/L)。发酵罐补料培养基(1 L):酵母提取物45 g,胰蛋白胨45 g,甘油500 mL。
1.1.2 主要试剂和仪器限制性核酸内切酶、T4 DNA连接酶、Taq DNA聚合酶均购自TaKaRa公司;isopropy-β-D-thiogalactoside (IPTG)购自生工生物工程(上海)股份有限公司;p-nitrophenyl-β-D-glucopyranoside (pNPG)购自Sigma公司;质粒抽提试剂盒、DNA凝胶回收试剂盒购自Axygen公司;其他试剂均为国产或进口分析纯试剂。大肠杆菌的高密度发酵使用Eppendorf BioFlo 115的3 L发酵罐。
1.2 方法 1.2.1 表达质粒的构建以T7启动子表达VHb的质粒pET22b-T7-vgb构建:以pUC57-vgb为模板,使用引物vgb-F和vgb-R克隆出vgb片段,使用内切酶NdeⅠ和XhoⅠ分别对vgb片段和pET22b质粒进行双酶切,并对酶切后的片段进行回收。使用T4 DNA连接酶将回收后的vgb片段和pET22b片段进行连接,并转化至表达菌株BL21 (DE3)。
以双顺反子形式共表达VHb和β-葡萄糖苷酶Bgl1A (A24S/F297Y)的质粒pET22b-bgl-Bic-vgb构建:以pET22b-bgl和pUC57-vgb为模板,使用引物bgl-F、bgl-Bic-R和引物vgb-Bic-F、vgb-Bic-R分别克隆出bgl和vgb片段,以获得的bgl和vgb片段为模板,使用重叠延伸PCR进一步获得bgl-Bic-vgb片段。使用内切酶NdeⅠ和XhoⅠ分别对bgl-Bic-vgb片段和pET22b质粒进行双酶切,并对酶切后的片段进行回收。使用T4 DNA连接酶将回收后的bgl-Bic-vgb片段和pET22b片段进行连接,并转化进入表达菌株BL21 (DE3)。双顺反子形式中,bgl和vgb的间隔序列为GAAGGAGATAT ATAATG,其中GAAGGAG为核糖体结合位点RBS,bgl终止密码子TAA与vgb起始密码子ATG重叠,保证VHb的表达。
| Primer name | Primer sequence (5′–3′) |
| vgb-F | GATATACATATGATGCTGGACCAACAGACTATCA |
| vgb-R | GTGGTGCTCGAGTTATTCAACGGCCTGCGC |
| bgl-F | GATATACATATGATGACTAAAATATCTTTACCAACTTGTT |
| bgl-Bic-R | TGATAGTCTGTTGGTCCAGCATTATATATCTCCTTCTCTATTTGAGATTAATGCTTTATAG |
| vgb-Bic-F | ATGCTGGACCAACAGACTATCA |
| vgb-Bic-R | GTGGTGCTCGAGTTATTCAACGGCCTGCGC |
| T7-Pro-F | ATCGCTACGTGACTGGGTCAGATCTCGATCCCGCGAA |
| T7-Ter-R | CAGCCATGACCCAGTCCAAAAAACCCCTCAAGACCC |
以T7启动子形式共表达VHb和β-葡萄糖苷酶Bgl1A (A24S/F297Y)的共表达质粒pET22b-bgl-T7-vgb构建:以按上述方法构建获得的pET22b-vgb为模板,使用引物T7-Pro-F和T7-Ter-R克隆获得T7-vgb片段。使用内切酶Tth111Ⅰ分别对T7-vgb片段和pET22b-bgl质粒进行双酶切,并对酶切后的片段进行回收。使用T4 DNA连接酶将回收后的T7-vgb片段和pET22b-bgl片段进行连接,并转化进入表达菌株BL21 (DE3)。
1.2.2 发酵培养方法挑取活化的表达菌株单克隆接种于含有100 μg/mL氨苄青霉素的LB培养基中,37 ℃、220 r/min振荡过夜培养。将培养获得的种子液以1%接种量(V/V)接种于发酵培养基中,同时添加氨苄青霉素至终浓度100 μg/mL,放置于37 ℃摇床中振荡培养。当发酵液菌体生物量OD600值达到0.6时,添加终浓度0.2 mmol/L的IPTG进行诱导表达,并将诱导温度设置为28 ℃,在不同诱导时间进行取样,并对样品的生物量和发酵酶活进行测定。在摇瓶水平(250 mL三角瓶)中模拟低溶氧环境进行诱导表达时设置装液量为200 mL,摇床转速为120 r/min;高溶氧诱导表达条件为装液量50 mL,摇床转速为220 r/min。
在3 L发酵罐中进行高密度发酵时,将过夜培养的种子液以1%接种量(V/V)接种于50 mL含有100 μg/mL氨苄青霉素的LB液体培养基中继续扩大培养,当OD600达到1.5–2.5时,按5%接种量接种于3 L发酵罐中。发酵罐中的初始培养基为1 L的改良TB培养基。用25% (V/V)氨水控制发酵过程中的发酵液pH在6.8–7.2之间,适当调节通气量和搅拌速度来控制溶氧。采用三阶段控制:第一阶段为接种后至菌体生物量达到OD600=25时,调节搅拌转速和通气量控制溶氧在10%以上;当菌体生物量达到OD600=25时,进入第二阶段,将空气流速控制在3.5 L/min、搅拌转速控制在500 r/min并维持6 h;第三阶段提高转速至1 000 r/min,并在通气中加入0.5 L/min的氧气直至发酵结束。发酵过程中温度控制在28 ℃,当发酵液溶氧(DO)上升幅度超过30%时,开始进行补料,补料速率设置为6 mL/(L·h)。当菌体生物量达到OD600=25时,添加IPTG至终浓度0.2 mmol/L进行诱导,在不同诱导时间进行取样并对样品的生物量和发酵酶活进行测定。
1.2.3 分析方法将不同诱导条件下取得的样品在4 000 r/min离心20 min获得菌体,用适当体积50 mmol/L的柠檬酸-磷酸氢二钠缓冲液(pH 6.5)重悬菌体。随后使用超声破碎的方法对细胞壁进行破碎,超声条件设置为:超声4 s,静置6 s,超声时间设置为15 min。将超声破碎后的破碎液在12 000 r/min离心10 min,分别收集上清和沉淀,并对样品采用SDS-PAGE进行分析。
β-葡萄糖苷酶活力测定:pNPG溶液(100 mmol/L)和缓冲液各取25 μL和450 μL并混匀。预热3 min后,向反应液中加入适当稀释的酶液25 μL开始反应。反应时间设置为10 min,终止反应方法为加入500 μL的碳酸钠溶液(母液浓度为1 mol/L)。在405 nm处测量终止反应后的反应液的OD值。依据pNP标准曲线公式计算pNP的浓度和酶的活性及相对活性。酶活单位(U)定义:即在酶最适作用条件下,每分钟催化水解pNPG生成1 μmol pNP所需要的酶量为1 U。
2 结果与分析 2.1 单独表达VHb对大肠杆菌的影响在高溶氧条件下,LB培养基中加入IPTG对VHb诱导表达8 h后,菌体生物量即可达到OD600值为4.44±0.19,无VHb表达的对照组OD600值仅为2.24±0.12 (图 1A)。在低溶氧条件下诱导VHb表达24 h后,重组菌生物量比对照组提高了70.21% (图 1B)。

|
| 图 1 LB培养基中生物量随诱导时间的变化情况(A为高溶氧条件,B为低溶氧条件) Figure 1 Changes of biomass in the LB medium with time under aerobic (A) and microaerobic (B) conditions. |
| |
高溶氧条件下,在营养更为丰富的TB培养基诱导VHb表达8 h后的菌体生物量达到4.41±0.22,对照组为2.9±0.15;随诱导时间的延长,含VHb的菌体OD600值达到13.8±0.96,无VHb的对照组为11.4±0.79 (图 2A)。在低溶氧环境中TB培养基中诱导表达24 h后的菌体生物量OD600值为2.99±0.32,比对照组的生物量提高了45.82 % (图 2B)。初步实验结果表明,在大肠杆菌BL21 (DE3)中诱导表达VHb能够提高菌体的生物量。
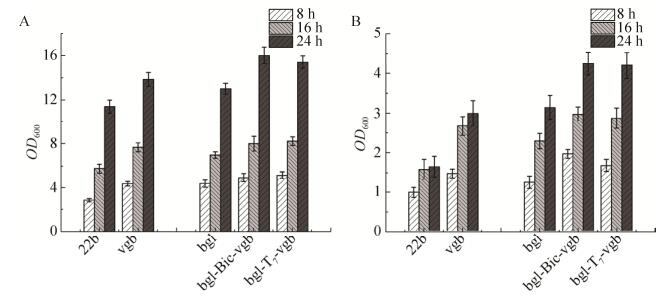
|
| 图 2 TB培养基中生物量随诱导时间的变化情况(A为高溶氧条件,B为低溶氧条件) Figure 2 Changes of biomass in the TB medium with time under aerobic (A) and microaerobic (B) conditions. |
| |
为了获得不同的诱导表达强度,分别使用双顺反子形式和T7启动子形式对VHb和β-葡萄糖苷酶在大肠杆菌中进行共表达,考察不同共表达形式对菌体生物量和β-葡萄糖苷酶酶活的影响。高溶氧条件下,在LB培养基中以两种形式诱导表达VHb均能够在诱导前期促进菌体生物量增加。
2.2.1 摇瓶水平中双顺反子形式共表达β-葡萄糖苷酶和VHb双顺反子情况下,在诱导8 h时生物量较对照组均能增加33.33%左右;随诱导时间延长到24 h,实验组和对照组的生物量趋于一致(图 1A)。在TB培养基中,高溶氧条件下VHb的表达能够持续促进生物量增加,以双顺反子形式表达VHb菌株的生物量在诱导24 h后达到OD600值为16.25±0.98,比无VHb表达的对照组提高25.09% (图 2A)。
低溶氧条件下,在两种培养基中诱导表达VHb后菌体的生物量均得到明显提高。LB培养基中采用双顺反子共表达方法在诱导8 h后的生物量达到OD600值为1.89±0.34,持续诱导至24 h后的生物量增加到OD600值2.29±0.36,比对照组提高了21.12% (图 1B)。在TB培养基中使用双顺反子对VHb诱导表达24 h后,菌体生物量达到4.24±0.29,比对照组提高了35.03% (图 2B)。
以双顺反子形式共表达VHb能够提高β-葡萄糖苷酶的发酵总酶活。图 3中的实验结果显示,在LB培养基中以双顺反子形式共表达VHb,高溶氧条件诱导8 h后β-葡萄糖苷酶的发酵酶活达到(10.35±0.45) U/mL,比对照组提高19.79%;低溶氧条件诱导24 h后酶活达到(5.68±0.45) U/mL,比对照组提高15.92%。在TB培养基中以双顺反子形式共表达VHb后,高溶氧条件下β-葡萄糖苷酶的发酵酶活达到(36.4±2.2) U/mL,比对照组提高20.93%;在低溶氧条件下发酵总酶活为(9.78±0.55) U/mL,比对照组提高25.38%。

|
| 图 3 LB培养基和TB培养基中β-葡萄糖苷酶酶活的变化情况(A为LB培养基,B为TB培养基) Figure 3 Changes of β-glucosidase activity in LB medium (A) and TB medium (B) with time. |
| |
LB培养基中采用T7启动子共表达方法,在诱导8 h后的生物量达到OD600值为1.86±0.33,持续诱导至24 h后的生物量增加到OD600值为2.31±0.43,比对照组提高了22.22% (图 1B)。在TB培养基中使用T7启动子对VHb诱导表达24 h后,菌体生物量OD600值为4.19±0.33,比对照组提高了31.85% (图 2B)。
以T7启动子表达VHb时β-葡萄糖苷酶的总酶活均低于对照组,在高溶氧条件LB和TB培养基中仅为(5.47±0.35) U/mL和(21.14±1.31) U/mL;在低溶氧条件下的总酶活仅为(2.91±0.29) U/mL和(6.47±0.48) U/mL。SDS-PAGE结果显示,以T7启动子表达VHb时,有部分VHb以包涵体的形式存在(图 4)。
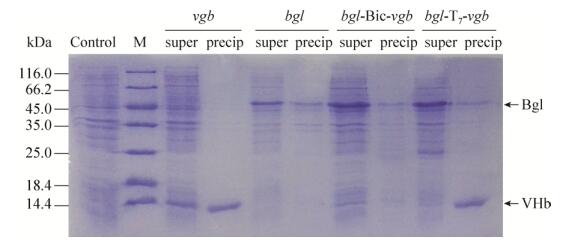
|
| 图 4 SDS-PAGE分析三角瓶中低溶氧条件下β-葡萄糖苷酶和VHb的表达情况(TB培养基) Figure 4 SDS-PAGE assay for the expression of β-glucosidase and VHb in TB medium under microaerobic condition in triangular flask. M stands for molecular marker, super and precip denote the supernatant and precipitate components of broken cells. |
| |
为了考察大肠杆菌高密度发酵中共表达VHb对菌体生物量和β-葡萄糖苷酶产量的影响,本实验通过对搅拌桨转速和通气量进行调节,将高密度发酵过程分为三阶段。在第一阶段中,由于维持了较高的溶氧水平,发酵菌体能够快速进入对数生长期,重组工程菌在发酵6 h后菌体密度均能够达到OD600值为25左右,此时加入IPTG对目标蛋白进行诱导。诱导表达2 h后,调节搅拌转速至500 r/min和降低通气量至3.5 L/min使发酵溶氧水平降至5%以下。在第二阶段中使用双顺反子形式和T7启动子形式共表达VHb的工程菌生物量均超过对照组。经过6 h的低溶氧发酵后,增大搅拌转速至1 000 r/min并在通气中增加氧气0.5 L/min进行第三阶段发酵。共表达VHb的工程菌对氧气的利用能力均高于对照组。大肠杆菌生物量在第三阶段增长迅速,其中以双顺反子形式共表达VHb的工程菌生物量在发酵20 h时达到最大生物量(OD600值为67.14±2.98),以T7启动子共表达VHb的工程菌BL21(DE3)/pET22b-bgl-T7-vgb生物量达到最大(OD600值为73.28±3.21),无VHb表达的对照菌株生物量仅为OD600值48.83±3.24 (图 5A)。以双顺反子形式共表达VHb能够显著提高β-葡萄糖苷酶的发酵酶活,诱导14 h后达到最大发酵酶活(141.23±6.84) U/mL。而以T7启动子表达VHb的工程菌β-葡萄糖苷酶发酵酶活为(110.12±5.26) U/mL,无VHb表达的对照菌发酵酶活为(104.45±6.98) U/mL (图 5B)。

|
| 图 5 3 L发酵罐中生物量和酶活变化情况 Figure 5 Changes of biomass and β-glucosidase activity in 3 L fermentor with time. |
| |
β-葡萄糖苷酶在生物能源、食品工业、保健品行业、农业、医药等领域有着广泛的应用,但是在利用大肠杆菌高密度发酵生产β-葡萄糖苷酶时,溶解氧不足往往阻碍了酶蛋白产量的进一步提高。在供氧不足的情况下,大肠杆菌糖酵解代谢和三羧酸循环代谢不均衡引发的乙酰辅酶A积累,进而积累的乙酰辅酶A在酰基转移酶和乙酸激酶等作用下生成乙酸等其他副产物[16, 21-22]。本研究通过在大肠杆菌中共表达透明颤菌血红蛋白VHb并对共表达方法进行优化对比,提高了大肠杆菌对溶氧的利用和对低溶氧环境的耐受能力。Pablos等对VHb影响大肠杆菌代谢进行研究发现,VHb能加快三羧酸循环进程,提高菌体对乙酰辅酶A的消耗速度,进而在一方面能够促进菌体生物量的增加,另一方面可以抑制乙酸等代谢副产物的生成[16, 23]。本研究在摇瓶水平中的实验结果显示,VHb与目标蛋白的共表达能够在高溶氧环境中最大提高23.17%的生物量,在低溶氧环境中最大能够提高35.03%的生物量。与我们的结果类似,Liu等在大肠杆菌中共表达VHb和eGFP,在摇瓶中的低溶氧条件下提高了eGFP蛋白的表达量[24]。值得注意的是,在高溶氧条件下,IPTG对VHb诱导表达后的菌体生物量比无VHb表达的对照组高。此结果暗示VHb在摇瓶中模拟高溶氧环境时,也能够提高大肠杆菌菌体对溶解氧的利用效率,并在一定程度上缓解了异源蛋白表达所带来的代谢压力。Li等将空肠弯曲杆菌Campylobacter jejuni中的血红蛋白CBh在大肠杆菌BL21 (DE3)中进行异源表达,在500 mL三角瓶中装液量100 mL,200 r/min条件下,诱导表达CBh的菌株生物量(OD600值)在平台期较对照组有22.2%的提高[25]。Kim等使用BL21 (DE3)作为表达宿主,将VHb与目标蛋白进行共表达,最终在发酵罐中获得了提高1.9倍的目标蛋白产量[26]。
本研究中对发酵罐获得的发酵样品进行SDS-PAGE检测结果显示,使用T7启动子表达VHb虽然比双顺反子形式能够获得更多的蛋白表达量,但有部分VHb形成了不可溶的包涵体,不能够发挥其相应的氧传递功能(图 4,图 7)。过量表达的VHb虽然能够帮助大肠杆菌对溶氧的利用(图 5C),但也在一定程度上消耗了大肠杆菌的资源,进而导致β-葡萄糖苷酶的表达受到限制。以双顺反子形式进行异源蛋白的共表达,所获得的VHb表达量较T7启动子获得的表达量低,但均为可溶的活性形式存在于细胞中,这不仅有利于获得较高的菌体生物量,β-葡萄糖苷酶的表达量也得到提高。以上结果表明,在大肠杆菌中以双顺反子形式共表达VHb和β-葡萄糖苷酶能够提高低溶氧环境中的生物量水平和酶蛋白的表达水平,是有开发应用前景的一种蛋白表达方法。

|
| 图 6 3 L发酵罐中溶氧变化情况 Figure 6 Changes of solube oxygen in 3 L fermentor with time. |
| |

|
| 图 7 SDS-PAGE分析3 L发酵罐中β-葡萄糖苷酶和VHb的表达情况 Figure 7 SDS-PAGE assay for the expression of β-glucosidase and VHb in 3 L fermentor. M stands for molecular marker, super and precip denote the supernatant and precipitate components of broken cells. |
| |
| [1] | Leah R, Kigel J, Svendsen I, et al. Biochemical and molecular characterization of a barley seed β-glucosidase. J Biol Chem, 1995, 270: 15789–15797. DOI: 10.1074/jbc.270.26.15789 |
| [2] | Chamoli S, Kumar P, Navani NK, et al. Secretory expression, characterization and docking study of glucose-tolerant β-glucosidase from B. subtilis. Int J Biol Macromol, 2016, 85: 425–433. DOI: 10.1016/j.ijbiomac.2016.01.001 |
| [3] | Youn SY, Park MS, Ji GE. Identification of the β-glucosidase gene from Bifidobacterium animalis subsp. lactis and its expression in B. bifidum BGN4. J Microbiol Biotechnol, 2012, 22(12): 1714–1723. DOI: 10.4014/jmb |
| [4] | Yao GS, Wu RM, Kan QB, et al. Production of a high-efficiency cellulase complex via β-glucosidase engineering in Penicillium oxalicum. Biotechnol Biofuels, 2016, 9: 78. DOI: 10.1186/s13068-016-0491-4 |
| [5] | Cripwell R, Favaro L, Rose SH, et al. Utilisation of wheat bran as a substrate for bioethanol production using recombinant cellulases and amylolytic yeast. Appl Energ, 2015, 160: 610–617. DOI: 10.1016/j.apenergy.2015.09.062 |
| [6] | Gueguen Y, Chemardin P, Janbon G, et al. A very efficient β-glucosidase catalyst for the hydrolysis of flavor precursors of wines and fruit juices. J Agr Food Chem, 1996, 44(8): 2336–2340. DOI: 10.1021/jf950360j |
| [7] | Yan FY, Xia W, Zhang XX, et al. Characterization of β-glucosidase from Aspergillus terreus and its application in the hydrolysis of soybean isoflavones. J Zhejiang Univ Sci B, 2016, 17(6): 455–464. DOI: 10.1631/jzus.B1500317 |
| [8] | Kaya M, Ito J, Kotaka A, et al. Isoflavone aglycones production from isoflavone glycosides by display of β-glucosidase from Aspergillus oryzae on yeast cell surface. Appl Microbiol Biotechnol, 2008, 79(1): 51–60. DOI: 10.1007/s00253-008-1393-6 |
| [9] | Gu MZ, Wang JC, Liu WB, et al. Expression and displaying of β-glucosidase from Streptomyces coelicolor A3 in Escherichia coli. Appl Biochem Biotechnol, 2013, 170(7): 1713–1723. DOI: 10.1007/s12010-013-0301-4 |
| [10] | Mai ZM, Su HF, Zhang S. Characterization of a metagenome-derived β-glucosidase and its application in conversion of polydatin to resveratrol. Catalysts, 2016, 6(3): 35. DOI: 10.3390/catal6030035 |
| [11] | Cui CH, Kim JK, Kim SC, et al. Characterization of a ginsenoside-transforming β-glucosidase from Paenibacillus mucilaginosus and its application for enhanced production of minor ginsenoside F-2. PLoS ONE, 2014, 9(1): e85727. DOI: 10.1371/journal.pone.0085727 |
| [12] | Maki ML, Armstrong L, Leung KT, et al. Increased expression of β-glucosidase A in Clostridium thermocellum 27405 significantly increases cellulase activity. Bioengineered, 2013, 4(1): 15–20. DOI: 10.4161/bioe.21951 |
| [13] | Naz S, Ikram N, Rajoka MI, et al. Enhanced production and characterization of a β-glucosidase from Bacillus halodurans expressed in Escherichia coli. Biochemistry, 2010, 75(4): 513–518. |
| [14] | Ohmiya K, Takano M, Shimizu S. Cloning of a β-glucosidase gene from Ruminococcus albus and its expression in Escherichia coli. Ann N Y Acad Sci, 1991, 646: 41–52. DOI: 10.1111/nyas.1991.646.issue-1 |
| [15] | Shin KC, Lee HJ, Oh DK. Substrate specificity of β-glucosidase from Gordonia terrae for ginsenosides and its application in the production of ginsenosides Rg3, Rg2, and Rh1 from ginseng root extract. J Biosci Bioeng, 2015, 119(5): 497–504. DOI: 10.1016/j.jbiosc.2014.10.004 |
| [16] | Pablos TE, Sigala JC, Le Borgne S, et al. Aerobic expression of Vitreoscilla hemoglobin efficiently reduces overflow metabolism in Escherichia coli. Biotechnol J, 2014, 9(6): 791–799. DOI: 10.1002/biot.201300388 |
| [17] | Tyree B, Webster DA. Electron-accepting properties of cytochrome o purified from Vitreoscilla. J Biol Chem, 1978, 253(21): 7635–7637. |
| [18] | Wang XF, Sun YC, Shen XG, et al. Intracellular expression of Vitreoscilla hemoglobin improves production of Yarrowia lipolytica lipase LIP2 in a recombinant Pichia pastoris. Enzyme Microb Technol, 2012, 50(1): 22–28. DOI: 10.1016/j.enzmictec.2011.09.003 |
| [19] | Pablos TE, Mora EM, Le Borgne S, et al. Vitreoscilla hemoglobin expression in engineered Escherichia coli: improved performance in high cell-density batch cultivations. Biotechnol J, 2011, 6(8): 993–1002. DOI: 10.1002/biot.v6.8 |
| [20] | Fang W, Yang Y, Zhang XX, et al. Improve ethanol tolerance of β-glucosidase Bgl1A by semi-rational engineering for the hydrolysis of soybean isoflavone glycosides. J Biotechnol, 2016, 227: 64–71. DOI: 10.1016/j.jbiotec.2016.04.022 |
| [21] | Stark BC, Dikshit KL, Pagilla KR. Recent advances in understanding the structure, function, and biotechnological usefulness of the hemoglobin from the bacterium Vitreoscilla. Biotechnol Lett, 2011, 33(9): 1705–1714. DOI: 10.1007/s10529-011-0621-9 |
| [22] | Khosla C, Curtis JE, DeModena J, et al. Expression of intracellular hemoglobin improves protein synthesis in oxygen-limited Escherichia coli. Biotechnology, 1990, 8(9): 849–853. |
| [23] | Khleifat KM, Abboud MM, Al-Mustafa AH, et al. Effects of carbon source and Vitreoscilla hemoglobin (VHb) on the production of β-galactosidase in Enterobacter aerogenes. Curr Microbiol, 2006, 53(4): 277–281. DOI: 10.1007/s00284-005-0466-3 |
| [24] | Liu T, Chen JY, Zheng Z, et al. Construction of highly efficient E. coli expression systems containing low oxygen induced promoter and partition region. Appl Microbiol Biotechnol, 2005, 68(3): 346–354. DOI: 10.1007/s00253-005-1913-6 |
| [25] | Xu L, Xiong W, Yang JK, et al. Recombinant Escherichia coli Strains with inducible Campylobacter jejuni single domain hemoglobin CHb expression exhibited improved cell growth in bioreactor culture. PLoS ONE, 2015, 10(3): e0116503. DOI: 10.1371/journal.pone.0116503 |
| [26] | Kim D, Hwang DS, Kang DG, et al. Enhancement of mussel adhesive protein production in Escherichia coli by co-expression of bacterial hemoglobin. Biotechnol Prog, 2008, 24(3): 663–666. DOI: 10.1021/bp0703477 |
 2018, Vol. 34
2018, Vol. 34




