中国科学院微生物研究所、中国微生物学会主办
文章信息
- 魏莹, 张哲文, 陆亚敏, 程艳菊
- Wei Ying, Zhang Zhewen, Lu Yamin, Cheng Yanju
- 长效重组蛋白药物发展动态
- Advances of long-acting recombinant protein therapeutics
- 生物工程学报, 2018, 34(3): 360-368
- Chinese Journal of Biotechnology, 2018, 34(3): 360-368
- 10.13345/j.cjb.170241
-
文章历史
- Received: June 13, 2017
- Accepted: September 12, 2017
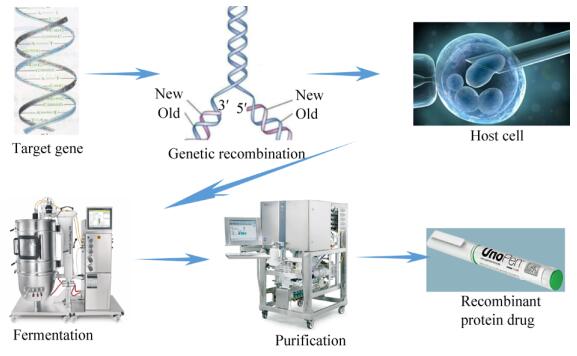
重组蛋白药物是指对某种疾病有预防和治疗作用的重组蛋白质。将编码蛋白质序列的基因合成出来,经过一系列操作转入宿主细胞中,通过宿主细胞培养获得重组蛋白药物(图 1)。宿主细胞包括细菌、酵母菌、动物细胞和植物细胞。
|
| 图 1 重组蛋白药物生产流程 Figure 1 Production process of recombinant protein drugs. |
| |
生物技术药物是新药研究发展的热点。近年来,制药业的增长速度放慢,但以基因工程产品、抗体工程产品和细胞工程产品为代表的生物制药产业却在快速发展[1]。
生物医药作为21世纪的国家战略性新兴产业和支柱产业,国家从多方面给予了高度的重视。从2006年以来,国家先后出台了一系列的规划和政策,鼓励生物医药产业的创新和发展,《中华人民共和国国民经济和社会发展第十三个五年规划纲要》[2]中提出坚持战略和前沿导向,促进生物医药及高性能医疗器械等产业发展壮大。
自1998年开始,生物制药产业全球销售额连续保持15%−33%的增长速度,成为发展最快的高技术产业之一。从地理分布来看,6家重组蛋白药物研发巨头公司(Amgen、Biogen IDEC、Johnson & Johnson、Eli Lily、Novo Nordisk、Roche)全部来自欧美[3],占全球市场约80%的比例。而所有欧美公司的销售额占全球生物技术公司销售额的97%。
从1982年第一个现代生物技术药物重组胰岛素优泌林(Humulin)在美国批准上市,重组蛋白药物已走过30多年的历史,20世纪90年代以重组干扰素、重组生长激素、重组人红细胞生成素等短效的重组蛋白药物为主,1996年长效化的胰岛素类似物上市,开启了重组蛋白药物长效化时代,随后聚乙二醇化重组干扰素α、长效红细胞生成素、聚乙二醇化重组粒细胞集落刺激因子、长效凝血因子等长效重组蛋白药物相继上市。
重组蛋白药物的发展趋势有以下两个特点。
第一,哺乳动物细胞作为表达体系的比例增加。原因在于,原核表达系统(如大肠杆菌E. coli),适合分子量较小、不需要翻译后修饰的非糖基化蛋白(如胰岛素、生长激素、干扰素和白细胞介素等);而哺乳动物细胞表达系统可进行复杂的翻译后修饰(如蛋白质折叠、糖基化和二硫键的形成),表达的蛋白质与天然蛋白质更为接近,且能通过控制翻译后修饰实现预期功效。
第二,长效化重组蛋白的进展较大。利用化学修饰、基因工程技术等对蛋白质药物进行改造或修饰,解决大分子蛋白质药物血液中半衰期短、给药途径单一、免疫原性和毒副反应等问题,增强药物活性、提高药效等,是近年来生物技术药物发展的趋势。长效蛋白质生物制剂技术的研究一直是大分子蛋白质药物的研究热点,国际上许多大公司纷纷开展蛋白质药物长效制剂的开发研究,抢占核心技术的制高点。
国内外长效重组蛋白药物的种类和数量众多,疗效良好。近年来上市的长效重组蛋白药物详见表 1。以PEG (Polyethyleneglycol,聚乙二醇)化蛋白质药物为例,1990年,美国食品药品监督管理局(FDA)批准了治疗重度免疫缺陷综合征的Adagen (Pegadamase);2006年,批准了培加帕酶Oncaspar (即PEG化天冬氨酸酶,可用于治疗急性淋巴母细胞白血病)[4];2011年,石药集团百克生物的津优力(聚乙二醇化重组人粒细胞刺激因子)获批上市,成为国内第一个PEG化长效重组蛋白药物;2014年1月,长春高新的PEG化重组生长激素获批,是全球第一个长效的重组生长激素。截止2016年8月份,国外聚乙二醇化重组蛋白药物已有10种以上上市,例如Adagen、Oncaspar、Pegasys、PegIntron、Neulasta、Somavert、Macugen、Mircera、Cimzia、Krystexxa、Sylatron、Omontys等[5]。
| Brand name | Active ingredient | Host cell | t1-2 extension method | Indication | Half-life | Approval year |
| Oncaspar | Pegaspargase | E. coli | PEGylation | Acute lymphoblastic leukemia | 5.8 d | 1994 |
| Peglntron | Peginterferon-a2b | E. coli | PEGylation | Chronic hepatitis C infection | 27-53 h | 2000 |
| Pegasys | Peginterferon-a2a | E. coli | PEGylation | Chronic hepatitis C infection | 60-80h | 2002 |
| Neulasta | Pegfilgrastim | E. coli | PEGylation | Febrile neutropenia | 15-80 h | 2002 |
| Somavert | Pegyisomant | E. coli | PEGylation | Acromegalia | 74-172 h | 2003 |
| Krystexxa | Pegloticase | S. cerevisiae | PEGylation | Chronic gout | 6.8-16.8 d | 2010 |
| Lonquex | Lipegfilgrastim | E. coli | PEGylation | Neutropenia | 32-62h | 2013 |
| Levemir | Insulin detemir | S. cerevisiae | Lipidation | Type Ⅰ diabetes mellitus | 14 h | 2004 |
| Victoza | Liraglutide | S. cerevisiae | Lipidation | Type Ⅱ diabetes mellitus | 13 h | 2009 |
| Tresiba | Insulin degludec | S. cerevisiae | Lipidation | Type Ⅰ diabetes mellitus | 17-25 h | 2013 |
| Zaltrap | Ziv-aflibercept | CHO | Fc fusion | Colorectal cancer | 6d | 2012 |
| Trulicity | Dulaglutide | CHO | Fc fusion | Type Ⅱ diabetes mellitus | 4.7 d | 2014 |
| Eylea | Aflibercept | CHO | Fc fusion | Neovascular age-related macular degeneration | 1.7-7.4 d | 2011 |
| Orencia | Abatacept | CHO | Fc fusion | Antirheumatoid arthritis | 13.1 d | 2005 |
| Nplate | Romiplostim | E. coli | Fc fusion | Thrombocytopenia | 3.5 d | 2008 |
| 郎沐 | Conbercept | CHO | Fc fusion | Neovascular age-related macular degeneration | 7d | 2013 |
| Arcalyst | Rilonacept | CHO | Fc fusion | Familial Cold Auto-inflammatory Syndrome | 8.6 d | 2008 |
| Enbrel | Etanercept | CHO | Fc fusion | Rheumatoid arthritis | 4.3 d | 1998 |
| Benepali | Etanercept | CHO | Fc fusion | Rheumatoid arthritis | 2.9 d | 2016 |
| Erelzi | Etanercept-szzs | CHO | Fc fusion | Rheumatoid arthritis | (102±30) h | 2016 |
| Nulojix | Belatacept | CHO | Fc fusion | Patients receiving a kidney transplant | 8-10 d | 2011 |
| Amevive | Alefacept | CHO | Fc fusion | Severe chronic plaque psoriasis | 270 h | 2011 |
| Eloctate | rFⅧFc | HEK293 | Fc fusion | Hemophilia A | 19 h | 2014 |
| Alprolix | rFIXFc | HEK293 | Fc fusion | Hemophilia B | 82 h | 2014 |
| Albiglutide | Eperzan/T anzeum | S. cerevisiae | HSA fusion | Type Ⅱ diabetes mellitus | 6-8 d | 2014 |
| Idelvion | rFIX/Human albumin | CHO | HSA fusion | Hemophilia B | 92 h | 2016 |
当药物进入系统时,由各种酶引起的代谢,尤其是多种形式的蛋白水解酶的作用,可导致药物降解为小分子肽或者氨基酸[6]。这类酶广泛存在于胃、肠道[7],其分布具有细胞组织的特异性。
非蛋白酶因素的影响来源于蛋白质物理或化学上的变化。物理变化包括聚合、沉淀;化学变化包括氨基酸残基的修饰,主要有氧化作用、还原作用、脱酰胺反应、水解反应、β消除、二硫化物交换等几种反应,并且蛋白质在构建中的稳定性和免疫原性以及导致蛋白质化学结构错误变化的环境条件也被认为是影响蛋白质代谢稳定性的主要因素。
较大的多肽常通过受体介导的方式来清除,有不少例子显示,受体介导的清除可能是一种主要的清除机制。
不同的给药途径对于药物的体内分布、代谢过程、生物利用度和药理作用也具有显著的影响[7]。
2.2 重组蛋白药物长效化技术 2.2.1 化学修饰化学修饰是延长蛋白质药物半衰期的一个有效途径。它是一种用化学的方法将蛋白质药物与大分子亲水修饰剂进行共价偶联的方法。共价连接到大分子上能减小免疫原性,改善可溶性和生物学利用度,以及增加抗蛋白水解作用,同时也能够延长半衰期[9]。
1) 聚乙二醇(polyethyleneglycol,PEG)修饰
PEG是由环氧乙烷聚合而成的大分子聚合物,PEG类修饰剂具有无毒性、溶解性良好、免疫原性低且高低不同分子量产品种类多、可选择余地大等优点,是FDA批准的极少数能作为体内注射用的合成聚合物之一。
经PEG共价修饰后,蛋白质药物的多方面性能得到提高,主要体现在以下几个方面:1)蛋白质经PEG修饰后,表观分子半径增大,表现为肾清除速率下降,且PEG在蛋白质表面起到屏蔽和位阻效应,使得修饰后的蛋白质酶解速率明显降低,稳定性提高,从而延长体内半衰期。例如,PEG修饰的干扰素(IFNα)与未修饰的IFNα相比,半衰期延长10−20倍;超氧化物歧化酶PEG修饰前半衰期为5 min,PEG修饰后半衰期延长至4.2 h;2) PEG在蛋白质表面的屏蔽和位阻效应还能掩盖蛋白质表面的抗原位点,降低了蛋白质的免疫原性;3) PEG为两亲性分子,还能改善蛋白质溶解性等理化性质[10]。
PEG修饰技术经历了从随机修饰到定点修饰的发展,从多个线性PEG修饰发展到单一分支型PEG修饰,从利用小分子量(5 kDa) PEG进行修饰发展到利用大分子量(40 kDa)进行修饰。传统的PEG随机修饰技术,修饰剂可以与蛋白药物表面的多个位点的基团发生反应,修饰后产物是不同位点修饰异构体的混合物,产物组分复杂,产品质量难以控制,批间一致性也难以控制。而近几年来,出于对工艺控制、质量控制以及药物本身有效性、安全性的考虑,各种定点修饰技术受到各药物研发机构的亲睐,成为热门方向。如Nulasta (Amgen)和PEG化IFNb (Biogen Idec)是利用末端氨基与赖氨酸(Lys)氨基解离常数的细微差异,在N末端定点修饰,添加了一个20 kDa的直链PEG;Bayer公司的PEG化重组人凝血因子Ⅷ,通过蛋白质工程引入半胱氨酸,利用巯基进行定点修饰;诺和诺德公司(Novo Nordisk)则着重发展糖基化PEG修饰技术,即利用酶促反应,将PEG分子偶联到蛋白质分子糖末端的唾液酸上(重组凝血因子Ⅶ、Ⅷ、Ⅸ);而Ambrx公司则是通过非天然氨基酸引入特异性的活性基团进行修饰[11]。2006年,申请美国专利的PEG化粒细胞集落刺激因子(PEG-G-CSF)[11]和PEG化白细胞介素-10 (PEG-IL-10)便是N端氨基定点修饰的产物。
2) 多聚唾液酸修饰
多聚唾液酸(Polysialition,PSA)是一类线性、均一的多聚α-2, 8连接唾液酸的独特碳水化合物,它主要通过典型的N-连接糖苷键附着在脊椎动物神经系统神经黏附分子上[4]。多聚唾液酸是一种比PEG更具潜力的蛋白药物修饰材料,它是天然的多聚物,除了具有更好的生物相容性、可降解性和高度亲水性,还具有抗人体免疫系统识别的功能。PSA在抗免疫识别能力和生物可降解性上具有明显优势,降解产物是无毒性的多聚乙酰神经氨糖酸(Colominic acid,CA)。目前已有多聚唾液酸化修饰的天冬酰胺酶、胰岛素和干扰素等多种蛋白类药物处于临床试验阶段。
采用平均分子量27 kDa的氧化态CA修饰血浆丁酰胆碱酯酶(rhBChE,plasma butyrylcholine-sterase)的产物rhBChE-CAO27皮下注射给小鼠,停留时间比未修饰的rhBChE增长了6.3倍(从3.7 h增加至23.3 h),清除半衰期增加了5.6倍(从3 h增加至16.6 h)[13]。
3) 脂肪酸修饰
脂肪酸链与蛋白质发生酰基化修饰反应,通过在蛋白质表面暴露羧基残基可增加蛋白质与血清白蛋白的亲和力,从而增加它在血液中的循环时间,最终也可以延长蛋白质药物的半衰期。酰基化对于分子量较小的蛋白质和多肽更有效,因为它相对更大地增加了蛋白质的疏水性。酰基化的原理成功地运用到了蛋白质的构建上,如年销售额已经超过20亿美元的利拉鲁肽(胰高血糖素样肽-1,GLP-1)和去氨加压素(DDAVP, Desmopressin)。
地特胰岛素是由Novo Nordisk公司研发,于2004年在欧洲上市,批准治疗2型糖尿病。地特胰岛素是在人胰岛素的基础上,将B30的苏氨酸去除,在B29位的赖氨酸增加一个十四碳脂肪酸链组成。其长效机制主要是,一是胰岛素分子以六聚体形式存在,而14碳脂肪酸侧链可增强胰岛素六聚体的稳定性,从而延缓吸收与扩散的速度;二是地特胰岛素进入外周血液循环后,因其脂肪酸结构,98%与白蛋白可逆性结合,结合后再逐步解离才发挥作用,进一步延长地特胰岛素的作用时间。
德谷胰岛素(Insulin degludec)由Novo Nordisk公司研发,分别于2012年10月在日本上市,2013年在欧盟上市,2015年在美国上市,批准治疗1、2型糖尿病。它是在人胰岛素的基础上,将B30的苏氨酸去除,通过一个L-γ-谷氨酸连接子,将1个十六碳脂肪二酸连接在B29位赖氨酸上形成的。其长效机制主要是:皮下注射后,随着制剂中苯酚的迅速弥散,德谷胰岛素通过脂肪二酸侧链自我聚集形成多六聚体,并于注射部位形成储存库,稳定、持久地发挥其降糖作用;此后,锌离子逐渐分散,多六聚体缓慢解离释放出单体通过毛细血管进入血液循环,添加的脂肪二酸侧链与血浆白蛋白发生可逆性结合,以发挥长效降糖作用[14]。皮下注射后,血药浓度会轻微升高,10−12 h后达到最高血药浓度,半衰期(t1/2)达到17−25 h[15]。
2.2.2 构建突变体将蛋白分子一个位点或多个位点进行突变,以期改善蛋白稳定性,提高亲和力或活性,降低免疫原性等,是蛋白药物设计的一个重点方向。
来得时(Lantus)是由大肠杆菌K12株表达的重组人胰岛素的突变体,在人胰岛素A链第21个位点将天冬氨酸(Asp)突变成甘氨酸(Gly);在B链C端最后第30个位点加两个精氨酸(Arg),使胰岛素等电点pI由原来的pH 4.0变为pH 6.7。这种突变结构在酸性条件下为澄清液体,一旦注射进人体可以形成缓释的微沉淀物,可持续释放,形成平稳的药物浓度曲线,趋近于正常生理胰岛素的基础分泌曲线,体内药物浓度恒定长达24 h[16]。
2.2.3 蛋白融合应用蛋白融合能够构建具有双功能的目的蛋白,这种融合蛋白是将2个或多个基因的编码区首尾直接或通过接头序列(Linker)[17]连接,由同一调控序列控制构成的基因表达产物。在分子水平,这个技术具有设计简单、灵活的特性。按主要结构域的化学本质将融合蛋白药物分为细胞因子类、抗体类、酶类、受体类和激素类[18]。其中,半衰期较长、分子量较大的人免疫球蛋白(Immunoglobulin,IgG)的Fc (Fragment crystallizable,可结晶片段)片段融合、人血清白蛋白(Human serum albumin,HSA)融合及其他血清蛋白如转铁蛋白(Transferrin)融合可以达到延长半衰期的目的,而前两者应用较为广泛。
1) Fc融合蛋白
Fc融合蛋白是指利用基因工程等技术将某种具有生物学活性的功能蛋白分子与Fc片段融合而产生的新型蛋白质,功能蛋白可以是能结合内源性受体(或配体)的可溶性配体(或受体)分子或其他需要延长半衰期的活性物质(如细胞因子)[19]。Fc融合蛋白大大增加活性蛋白或多肽的分子量,降低肾小球的滤过率,而FcRn (Neonatal Fc receptor,新生儿Fc受体)介导的再循环机制可以避免蛋白降解,有效延长半衰期[20]。另外,采用人源的Fc片段可以降低融合蛋白的免疫原性[21],防止人体自身免疫系统对药物的消除作用,也对融合蛋白半衰期的延长有所帮助。通过基因工程手段对Fc段的氨基酸序列进行突变,还可以获得半衰期更长的突变型融合蛋白[22]。此外,根据需要还可以发挥Fc段结合FcγR产生的抗体依赖细胞介导的细胞毒性(Antibody-dependent cellmediated cytotoxicity,ADCC)或结合补体C1q来介导补体依赖的细胞毒性(Complement-dependent cytotoxicity,CDC)等生物学活性,进一步增强融合蛋白的效应器功能[19-23],当然对于自身免疫疾病和炎症性疾病等不需要效应器功能的药物,需突变改造FcγR或使用IgG4的Fc。
Fc融合蛋白的发展分为两个阶段:第一阶段,对于小分子肽通过表达二聚体融合蛋白实现延长药物的半衰期(例如礼来糖尿病药物Trulicity);第二阶段,对于分子量大于30 kDa的大分子蛋白使用二聚体Fc和单体蛋白策略。百健艾迪的Fc融合凝血因子Ⅷ蛋白产品Eloctate、Fc融合凝血因子Ⅸ产品Nonacog beta pegol,利用的均是第二种表达策略,采用Syntonix公司专有的Syn-Fusion技术平台生产。研究人员发现只有一个生物活性分子、但有两个免疫球蛋白恒定区部分的单体-二聚体杂合体比同源二聚体更能有效地发挥功能和被转运。这是因为,包含两个或多个生物活性分子、以二聚体和更高等级的多聚体形式存在的嵌合蛋白存在两个或多个相互邻近的生物活性分子,在空间上会被阻碍与其靶分子或细胞相互作用。
截至2016年,欧美及中国共批准了14个Fc融合蛋白,包括中国批准的郎沐以及EMA批准的两款Enbrel的生物类似物,分别为三星Bioepis的Benepali和Sandoz公司的Erelzi。Biogen的Amevive已于2011年撤市。2015年,13个融合蛋白的销售额超过161亿美元,适应症涵盖自身免疫病、眼科、贫血和糖尿病等,显示出Fc融合蛋白强大的应用市场,而且未来具有良好的应用前景。从表达系统看,除Nplate为大肠杆菌表达、Tanzeum为酿酒酵母Saccharomyces cerevisiae外,其余均为以中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO)或人胚肾细胞(HEK293)为主的哺乳动物细胞表达,可以预见这一趋势将继续得到保持。
2) 人血清白蛋白融合蛋白
人血清白蛋白在血清中大量存在,且无毒性和免疫原性,这些特性使得白蛋白成为延长小分子蛋白或多肽半衰期的又一良好选择。人血清白蛋白融合蛋白也是通过FcRn介导的再循环机制避免蛋白降解,延长半衰期。由于白蛋白与FcRn结合位点与IgG不同,因此,白蛋白不会影响IgG的回收[24-25],这种方式成为延长活性蛋白或多肽的一个重要手段。通过对白蛋白突变改造甚至可以获得更长的半衰期,如K573P突变,使得白蛋白对FcRn受体亲和力增加12倍,大幅延长半衰期[26]。此外,治疗性蛋白可以连接白蛋白的N端或者C端,甚至两端均连接治疗性蛋白形成双特异性分子[27]。2014年,FDA批准了针对2型糖尿病降糖药阿必鲁肽(Albiglutide)即为GLP-1-HSA融合蛋白,半衰期可达6−8 d,为每周注射一次的长效GLP-1类似物。HSA融合可以显著延长凝血因子的半衰期,如CSL Behring的FVIIa与白蛋白融合,半衰期可延长3−4倍;CSL Behring的FIX与白蛋白融合,半衰期延长4−5倍[28]。有研究结果显示人血清白蛋白融合后会出现一些目标蛋白产率低、易降解等共性的问题,可以通过融合蛋白的优化设计、蛋白酶缺陷宿主的构建、融合基因多拷贝以及与分子伴侣共表达得以解决[29]。近年来上市的长效重组蛋白药物详见表 1[30-32]。
2.2.4 糖基化蛋白质的糖基化(Glycosylation)是真核生物的一种常见翻译后修饰方式,是某些蛋白质发挥生物活性所必需的。蛋白质表面的糖链能够影响蛋白质的药物动力学作用、生物活性、稳定性、对蛋白酶的易感性、水溶性、凝集性、免疫原性等。
用基因工程手段对TNK组织纤维蛋白溶酶原激活剂分子进行糖基化修饰,修饰后的蛋白质具有更长的半衰期,并且在急性心梗治疗中可以采用低剂量单次快速注射[33]。促红细胞生成素(EPO)是一种调节红系祖细胞生长的细胞因子,含有3个N-糖链和1个O-糖链。研究表明,糖基化不影响其体外生物学活性,但可延长体内半衰期。由此,美国Amgen公司的科学家合成了一种新型的促红细胞生成蛋白Aranesp (Novel erythropoiesis stimulatingprotein,NESP),体内半衰期是EPO的3倍,从而达到了减少用药次数的目的[34]。
3 总结长效重组蛋白药物具有极大临床优势,是蛋白药物开发的一大重要方向。诸多长效蛋白药物已成功开发上市,长效蛋白药物的研究开发也日益增长。
进一步推动国产长效重组蛋白药物提升质量并国际化,推动并协助相关企业进入国际市场,进一步提高中国重组生物产品国际声誉及地位意义重大且迫在眉睫。
政府需更加鼓励并支持国内创新,逐步实现中国长效重组蛋白品种由仿制到创新,由低端模仿跟随到高端仿制跟进,最终走向技术和产品引领。
综上所述,进一步提高国产重组蛋白药物质量水平,紧跟国外先进技术和质量标准发展,推进国内相关产品标准升级,并加大创新长效重组蛋白药物的开发,是未来几年国内该领域的发展方向。与国内技术型企业共同努力,成为相关产品标准的制定者和领跑者,逐步实现中国重组蛋白药物产品质量标准与国际最高标准对接指日可待。
| [1] | 安徽省生物医药产业技术创新链研究报告[EB/OL]. [2017-06-05]. https://wenku.baidu.com/view/cb00410c1eb91a37f1115ca7.html. |
| [2] | 中华人民共和国国民经济和社会发展第十三个五年规划纲要[EB/OL]. [2016-03-16]. https://wenku.baidu.com/view/8dd58f33360cba1aa911da8e.html. |
| [3] |
Wu WX, Zhang Y, Wang XN, et al. Market analysis and the R & D trend for recombinant protein therapeutics.
Lett Biotechnol, 2006, 17(6): 929–934.
(in Chinese). 吴卫星, 张毓, 王小宁, 等. 国际重组蛋白药物市场和研发趋势的分析. 生物技术通讯, 2006, 17(6): 929-934. |
| [4] | van Witteloostuijn SB, Pedersen SL, Jensen KJ. Half-life extension of biopharmaceuticals using chemical methods: alternatives to PEGylation. Chem Med Chem, 2016, 11(22): 2474–2495. DOI: 10.1002/cmdc.v11.22 |
| [5] |
Du ZM, Xu HM, Wang YB, et al. Research progress on long-term protein and polypeptide drugs technology.
Pharm Biotechnol, 2017, 24(1): 63–67.
(in Chinese). 杜昭明, 徐寒梅, 王轶博, 等. 长效蛋白多肽类药物技术研究进展. 药物生物技术, 2017, 24(1): 63-67. |
| [6] |
Wang YX, Zhou XW, Dang Y, et al. Progress in the stability of protein and polypeptide drugs.
Lett Biotechnol, 2005, 16(6): 665–667.
(in Chinese). 王宇新, 周晓巍, 党颖, 等. 提高蛋白质和多肽类药物代谢稳定性的研究进展. 生物技术通讯, 2005, 16(6): 665-667. |
| [7] | Garibotto G, Tessari P, Sacco P, et al. Amino acid metabolism, substrate availability and the control of protein dynamics in the human kidney. J Nephrol, 1999, 12(4): 203–211. |
| [8] |
Fu YM, Wang QM, An LG. Progress on the long-lasting protein and peptide drugs.
Chin Bull Life Sci, 2008, 20(2): 258–262.
(in Chinese). 傅一鸣, 王清明, 安利国. 蛋白质和多肽药物长效性研究进展. 生命科学, 2008, 20(2): 258-262. |
| [9] |
Bian L, Shi YF. Current status and progress on the techniques for prolonging half-life of protein pharmaceuticals.
China Biotechnol, 2009, 29(2): 114–118.
(in Chinese). 边蕾, 石屹峰. 蛋白质药物长效化技术的现状和进展. 中国生物工程杂志, 2009, 29(2): 114-118. |
| [10] | Veronese FM, Pasut G. PEGylation, successful approach to drug delivery. Drug Discov Today, 2005, 10(21): 1451–1458. DOI: 10.1016/S1359-6446(05)03575-0 |
| [11] |
Liang CG, Wang JZ. Research progress of long-acting protein therapeutics.
Chin J New Drugs, 2014, 23(20): 2388–2393.
(in Chinese). 梁成罡, 王军志. 长效蛋白生物药研究进展. 中国新药杂志, 2014, 23(20): 2388-2393. |
| [12] | Kinstler OB, Gabriel NE, Farrar CE, et al. N-terminally chemically modified protein compositions and methods: US, 7090835. 2006-08-15. |
| [13] | Ilyushin DG, Smirnov IV, Belogurov AA, et al. Chemical polysialylation of human recombinant butyrylcholinesterase delivers a long-acting bioscavenger for nerve agents in vivo. Proc Natl Acad Sci USA, 2013, 110(4): 1243–1248. DOI: 10.1073/pnas.1211118110 |
| [14] |
Zhao T, Xiao YJ, Cao CL, et al. Three novel long acting human insulin analogs produced.
China Med Herald, 2013, 10(8): 21–23.
(in Chinese). 赵腾, 肖拥军, 曹春来, 等. 3种新型长效胰岛素类似物. 中国医药导报, 2013, 10(8): 21-23. |
| [15] | Rendell M. Insulin degludec: a long-acting modern insulin analogue with a predictable pharmacokinetic/ pharmacodynamic profile. Drugs Today, 2013, 49(6): 387–397. |
| [16] | Scholtz HE, Pretorius SG, Wessels DH, et al. Pharmacokinetic and glucodynamic variability: assessment of insulin glargine, NPH insulin and insulin ultralente in healthy volunteers using a euglycaemic clamp technique. Diabetologia, 2005, 48(10): 1988–1995. DOI: 10.1007/s00125-005-1916-y |
| [17] | Chen XY, Zaro JL, Shen WC, et al. Fusion protein linkers: property, design and functionality. Adv Drug Deliv Rev, 2013, 65(10): 1357–1369. DOI: 10.1016/j.addr.2012.09.039 |
| [18] |
Li L, Xu BJ, Xuan YX. Research progress of fusion protein drugs.
Chin J New Drugs, 2015, 24(3): 266–270.
(in Chinese). 李磊, 许冰洁, 宣尧仙. 融合蛋白药物的研究进展. 中国新药杂志, 2015, 24(3): 266-270. |
| [19] |
Wang YH, Guo W, Wang X, et al. Advances in research on Fc fusion protein in pharmaceutical field.
Prog Pharm Sci, 2014, 38(6): 419–425.
(in Chinese). 王宇恒, 郭薇, 王欣, 等. Fc融合蛋白在药学领域的研究进展. 药学进展, 2014, 38(6): 419-425. |
| [20] |
Zhang Y, Zhao SQ, Yao WB. Application of fusion protein technique in development of long-acting drugs.
Prog Pharm Sci, 2013, 37(9): 454–459.
(in Chinese). 张瑜, 赵述强, 姚文兵. 融合蛋白技术在长效药物开发中的应用. 药学进展, 2013, 37(9): 454-459. |
| [21] | Levin D, Golding B, Strome SE, et al. Fc fusion as a platform technology: potential for modulating immunogenicity. Trends Biotechnol, 2015, 33(1): 27–34. DOI: 10.1016/j.tibtech.2014.11.001 |
| [22] | Robbie GJ, Criste R, Dall'Acqua WF, et al. A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults. Antimicrob Agents Chemother, 2013, 57(12): 6147–6153. DOI: 10.1128/AAC.01285-13 |
| [23] | Czajkowsky DM, Hu J, Shao ZF, et al. Fc-fusion proteins: new developments and future perspectives. EMBO Mol Med, 2012, 4(10): 1015–1028. DOI: 10.1002/emmm.201201379 |
| [24] | Kontermann RE. Half-life extended biotherapeutics. Expert Opin Biol Ther, 2016, 16(7): 903–915. DOI: 10.1517/14712598.2016.1165661 |
| [25] | Sand KMK, Bern M, Nilsen J, et al. Unraveling the Interaction between FcRn and albumin: opportunities for design of albumin-based therapeutics. Front Immunol, 2015, 5: 682. |
| [26] | Andersen JT, Dalhus B, Viuff D, et al. Extending serum half-life of albumin by engineering neonatal Fc receptor (FcRn) binding. J Biol Chem, 2014, 289(19): 13492–13502. DOI: 10.1074/jbc.M114.549832 |
| [27] | Yang F, Wen WH, Qin WJ. Bispecific antibodies as a development platform for new concepts and treatment strategies. Int J Mol Sci, 2016, 18(1): 48. DOI: 10.3390/ijms18010048 |
| [28] | Powell JS. Longer-acting clotting factor concentrates for hemophilia. J Thromb Haemost, 2015, 13(S1): S167–S175. |
| [29] |
Liu WH, Wu M, Shen Q, et al. Research progress in fusion technique of human serum albumin.
Prog Pharm Sci, 2015, 39(3): 199–203.
(in Chinese). 刘文慧, 吴敏, 沈其, 等. 人血清白蛋白融合技术研究进展. 药学进展, 2015, 39(3): 199-203. |
| [30] | Soleimanpour S, Hassannia T, Motiee M, et al. Fcγ1 fragment of IgG1 as a powerful affinity tag in recombinant Fc-fusion proteins: immunological, biochemical and therapeutic properties. Crit Rev Biotechnol, 2017, 37(3): 371–392. DOI: 10.3109/07388551.2016.1163323 |
| [31] | Kimchi-Sarfaty C, Schiller T, Hamasaki-Katagiri N, et al. Building better drugs: developing and regulating engineered therapeutic proteins. Trends Pharmacol Sci, 2013, 34(10): 534–548. DOI: 10.1016/j.tips.2013.08.005 |
| [32] | Lu XM, Sun XD. Profile of conbercept in the treatment of neovascular age-related macular degeneration. Drug Des Devel Ther, 2015, 9: 2311–2320. |
| [33] | Werner RG, Kopp K, Schlueter M. Glycosylation of therapeutic proteins in different production systems. Acta Paediatr, 2007, 96(S455): 17–22. |
| [34] | Egrie JC, Browne JK. Development and characterization of novel erythropoiesis stimulating protein (NESP). Br J Cancer, 2001, 84(S1): 3–10. DOI: 10.1054/bjoc.2001.1746 |
 2018, Vol. 34
2018, Vol. 34




