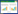中国科学院微生物研究所、中国微生物学会主办
文章信息
- 魏艳秋, 段勇成, 毕玉海, 王萌, 李云龙, 王选, 林玮, 范文辉, 王晶, 刘文军, 杨利敏
- Wei Yanqiu, Duan Yongcheng, Bi Yuhai, Wang Meng, Li Yunlong, Wang Xuan, Lin Wei, Fan Wenhui, Wang Jing, Liu Wenjun, Yang Limin
- 一种超高灵敏的埃博拉病毒胶体碳侧流免疫层析检测方法的建立
- A novel carbon nanoparticle probe-based ultrasensitive lateral flow assay for rapid detection of Ebola virus
- 生物工程学报, 2018, 34(12): 2025-2034
- Chinese Journal of Biotechnology, 2018, 34(12): 2025-2034
- 10.13345/j.cjb.180074
-
文章历史
- Received: March 9, 2018
- Accepted: May 11, 2018
2 广西大学 动物科学技术学院,广西 南宁 530004;
3 中国科学院大学,北京 100049;
4 中国计量科学研究院,北京 100029;
5 国为生物科技泰州有限公司,江苏 泰州 225300
2 College of Animal Science and Technology, Guangxi University, Nanning 530004, Guangxi, China;
3 University of Chinese Academy of Sciences, Beijing 100049, China;
4 National Institute of Metrology, Beijing 100029, China;
5 Goodwe Biotechnology Taizhou Co., Ltd., Taizhou 225300, Jiangsu, China
埃博拉病毒是烈性传染病埃博拉出血热的病原体,为单股负链RNA病毒,属于丝状病毒科埃博拉病毒属。该病毒于1976年首次被发现,1995年在刚果民主共和国暴发后才被人们所认知[1]。EBOV分为5个亚型,分别是苏丹型(Sudan Ebola virus,SEBOV)、扎伊尔型(Zaire Ebola virus, ZEBOV)、塔伊森林型(Ta Forest Ebola virus,TAFV)、莱斯顿型(Reston Ebola virus, REBOV)和本迪布焦型(Bundibugyo Ebola virus, BEBOV)[1]。不同亚型毒力各不相同,除了REBOV,其他4种亚型对人都有致病力,ZEBOV和SEBOV的致死率高达53%–90%[2]。埃博拉病毒感染性极强,传播途径包括体液、接触及气溶胶,可通过野生动物传播给人,并在人与人之间传播蔓延。世界卫生组织已将其列为对人类危害最严重的病毒之一,在生物安全等级上被列为最危险的第4级病毒[3]。
EBOV作为一种极其危险的病原体,快速筛查和确诊对于控制疫情蔓延尤为重要。EBOV感染早期仅出现头痛、发热等症状,后期出现高热,且伴随严重的头疼、疲劳、呕吐、腹泻、腹痛及出血症状。初期症状与非洲其他常见病毒感染如马尔堡病毒、黄热病、登革热、流感等不易区分,仅凭临床症状难以及时准确地发现和诊断。而感染病人确诊期越晚则传播风险越大,疫情越难控制。因此,WHO呼吁加快研究一种快速、灵敏、简便的诊断方法及产品,以便能够第一时间发现感染病例并实施隔离就诊,控制疫情的发展及恶化。
EBOV检测技术包括病毒分离培养、核酸检测以及血清学检测技术。病毒分离培养是诊断埃博拉出血热的金标准,但由于操作复杂,且必须在生物安全4级实验室(BSL-4)中开展,因此无法作为常规诊断技术。荧光PCR技术是目前应用最广泛的EBOV核酸检测技术,具有良好的灵敏度和特异性[4],但作为一种实验室技术,无法实现现场对可疑病人的快速筛查,而且从样本采集、运输到检测平均需要5 d时间,从而增加了疫情扩散的风险[5]。为了实现快速检测EBOV,多个研究机构开发了基于恒温扩增技术的EBOV快速诊断方法[6-8],但受限于核酸抽提及操作步骤繁琐,且需要一台加热设备,因此依然未能广泛推广应用。由于埃博拉出血热病人体内含有高浓度的病毒,因此直接检测病毒抗原也是个不错的选择[9]。胶体金免疫层析技术是目前应用最广泛的快速检测(Point-of-care testing, POCT)技术,已被应用于各个快检领域,该技术不需要任何设备,加入样本后15 min内即可判定检测结果,但是存在灵敏度偏低的缺陷。美国国家卫生研究院(NIH)资助Corgenix公司开发了基于胶体金免疫层析技术的EBOV快检产品(ReEBOV™ Antigen Rapid Test Kit),该产品最终获得WHO和美国FDA紧急授权。但该产品最低检出限只有108 copies/mL,以荧光PCR产品“RealStar Filovirus Screen RT-PCR Kit 1.0” (Altona Diagnostics GmbH)作对照,检出率91.8%,假阳性率15.4%[10]。较高的漏检率意味着感染风险的增加,过高的假阳性率会导致结果的误判及产品可信度的下降。而且该产品需要冷藏保存,限制了其在非洲的推广应用。国内阎锡蕴研究团队建立了基于纳米酶技术的EBOV快检试纸条,灵敏度与ELISA技术相当,解决了胶体金试纸条灵敏度偏低的问题,而且检测时间控制在30 min以内,具有很好的应用前景[11]。
为了建立更高灵敏度且更稳定的EBOV快检技术,本研究选用碳纳米颗粒作为标记探针,与金颗粒相比,碳颗粒具有更高的灵敏度和稳定性,而且更环保[12]。本研究建立的针对埃博拉病毒基质蛋白VP40的胶体碳免疫层析试纸条技术灵敏度较Corgenix公司胶体金产品提高100倍,假阳性率仅为其1/100,与多种非洲常见病原无交叉反应,而且可在室温稳定保存1年以上,非常适合非洲热带环境对于埃博拉病毒的现场筛查。
1 材料与方法 1.1 主要试剂及仪器胶体碳标记试剂盒购自北京纳晶生物科技有限公司;羊抗兔IgG多克隆抗体(H+L)购自北京沫之东生物技术有限公司;硝酸纤维素膜M135购自美国Millipore公司;玻璃纤维Alstrom 8964购自美国Alstrom公司;吸水滤纸购自美国Whatman公司;PVC底板和卡壳购自上海金标生物技术有限公司;Tris、BSA等常规试剂均购自AMRESCO公司;XYZ三维划膜喷金仪HM3030、微电脑自动斩切机ZQ2000、数据裁条机CTD300、压壳机YK725、胶体金免疫分析仪均购自上海金标生物技术有限公司;真空包装机购自上海星贝包装机械有限公司;灭活埃博拉病毒由加拿大国家微生物实验室邱香国教授赠予;流感病毒A/PR/8 (IVA/PR/8)、黄热病毒(YFV-17D)和登革热2型病毒(DEN2)由本实验室保存。
1.2 病毒样颗粒的制备参照已发表文献[13-14],分别将编码埃博拉病毒(GenBank登录号KM034555.1)或马尔堡病毒(GenBank登录号Z12132.1)糖蛋白(GP)和基质蛋白(VP40)的真核表达质粒(pCAGGS/EBOVGP、pCAGGS/EBOVVP40、pCAGGS/MARVGP和pCAGGS/MARVVP40)共转染293T细胞,培养68 h后收集上清,9 500×g离心4 h,弃去大部分上清,将留存底部混匀即为粗制EBOV-VLP和MARV-VLP,用免疫印迹(Western blotting)确认GP和VP40的表达。
1.3 重组蛋白及抗体的制备合成非洲2014年流行毒株VP40基因(GenBank登录号KM034555.1),克隆入原核表达载体pET28a,转化大肠杆菌Rosetta (DE3),诱导表达并通过镍离子金属螯合层析纯化目的蛋白。将纯化的重组VP40免疫兔子3次,采集兔血清并通过Protein G层析柱纯化兔多抗。将纯化的重组VP40免疫BALB/c小鼠,采用杂交瘤技术,筛选单克隆抗体并通过Protein G层析柱纯化单抗。分别采用免疫印迹(Western blotting)和酶联免疫吸附实验(ELISA)鉴定获得的抗体与重组VP40和灭活EBOV的反应特异性。
1.4 胶体碳试纸条的制备 1.4.1 胶体碳标记抗体取出碳标记试剂盒,8 000 r/min离心10 min后收集胶体碳颗粒,涡旋振荡混匀后超声处理3 min,复溶后的胶体碳溶液为深黑色。将纯化的抗EBOV-VP40兔多抗浓度调至1.0 mg/mL。将1×胶体碳溶液500 μL与兔多抗5 μL,室温搅拌30 min,使抗体与胶体碳充分反应。再向标记混合液中加入500 μL等量的复溶液与其充分反应,室温搅拌30 min封闭。将封闭后的混合液6 000 r/min离心15 min,弃上清,加入500 μL等量的复溶液复溶。
1.4.2 胶体碳标记垫将玻璃纤维膜Alstrom 8964置于胶体碳标记垫处理液(0.3% BSA,4%蔗糖,0.2% Tween-20,溶于0.02 mol/L Tris-HCl缓冲液,pH 8.0)中,静置1 min,取出后置37 ℃烘干。用XYZ三维划膜喷金仪将标记兔多抗的胶体碳分别以10 μL/cm、20 μL/cm、30 μL/cm、40 μL/cm的量喷涂到玻璃纤维膜上,37 ℃烘干,组装试纸条,滴加模拟阳性血清样品80 μL,室温反应15 min,采用胶体金免疫分析仪读取T/C线信号强度,确定胶体碳在玻璃纤维素膜上的最适喷涂量。
1.4.3 样品垫将玻璃纤维膜Alstrom 8964置于样品垫处理液(1% PVP-K30,1% Tritonx-100,0.3% BSA,4%蔗糖于0.02 mol/L Tris-HCl缓冲液,pH 8.0)中静置1 min,取出后置37 ℃烘干,密闭保存备用。
1.4.4 检测线及质控线将纯化的单抗4B7F9用Tris-HCl缓冲液(0.02 mol/L,pH 8.0)稀释为2.0 mg/mL、1.0 mg/mL、0.5 mg/mL三个不同浓度。以2 μL/cm的包被量,分别印迹于硝酸纤维素膜,作为检测线。同样按照2 μL/cm的包被量,将1 mg/mL的羊抗兔IgG印迹于硝酸纤维素膜为质控线。烘干,组装试纸条,滴加模拟阳性血清样品80 μL,室温反应15 min,采用胶体金免疫分析仪读取T/C线信号强度,确定单抗的最适印迹量。
1.4.5 试纸条的组装与结果判定标准将最适浓度的单抗4B7F9和羊抗兔IgG分别装入XYZ三维划膜喷金仪的样品泵中,将硝酸纤维素膜展平放于喷点仪平台上,放上压条,检测线与质控线相距0.5 cm,位于膜的中间,距膜的边距分别为1.0 cm,置于37 ℃干燥。依次将样品垫、标记兔多抗的碳垫、印迹有检测线和质控线的硝酸纤维素膜、吸水纸分别固定在粘性的PVC板上,彼此之间叠加2 mm左右,裁剪成4 mm宽的试纸条(图 1),装卡壳,抽真空、密封、干燥保存于铝箔袋中。
|
| 图 1 胶体碳侧流层析试纸条结构示意图 Figure 1 Schematic of colloidal carbon lateral flow test strip. |
| |
特异性:分别将重组VP40蛋白、EBOV-VLP和灭活EBOV加入到阴性血清中,模拟临床阳性血清,将MARV-VLP、IAV/PR/8、YFV-17D和DENV2加入到阴性血清中,模拟其他病原临床血清,利用组装好的试纸条分别检测模拟临床阳性血清和其他病原模拟血清,各取样品80 μL,滴加到加样孔,室温反应15 min,观察试纸条的T、C线颜色变化,确定胶体碳侧流层析试纸条的特异性。为评价检测假阳性率,用试纸条检测1 500份国内采集阴性血清。
灵敏度:将已用荧光PCR标定的纯化灭活EBOV用阴性血清进行10倍梯度稀释,制备不同浓度模拟临床血清样品,具体按照100 μg/mL、10 μg/mL、1 μg/mL、100 ng/mL、10 ng/mL梯度稀释(对应荧光PCR标定值:109 copies/mL、108 copies/mL、107 copies/mL、106 copies/mL、105 copies/mL),分别采用胶体金试纸条(ReEBOV™)和胶体碳试纸条进行平行检测,室温反应15 min,观察两种试纸条的T、C线颜色变化,确定胶体金与胶体碳试纸条的最低检出限。
稳定性:将制备的胶体碳试纸条分别放置25 ℃和37 ℃,每隔1个月随机取3支试纸条评价其最低检出限,共检测12个月。
2 结果与分析 2.1 重组抗原及抗体的制备将转化pET28a-EBOV-VP40的菌种诱导表达,SDS-PAGE分析,诱导后有重组蛋白表达,分子量约为35 kDa,与预期大小一致。诱导表达的目的蛋白包涵体经亲和层析纯化后得到高纯度重组蛋白(图 2A)。重组蛋白免疫制备了兔多抗和鼠单抗,经Protein G亲和层析获得高纯度抗体(图 2B)。将Western blotting鉴定、制备的多抗和单抗能够特异识别重组VP40蛋白和灭活EBOV (图 2C、D)。经ELISA鉴定,制备的单抗能与灭活病毒反应(图 3),经筛选确认4B7F9单抗株作为诊断用抗体。

|
| 图 2 分析鉴定重组EBOV-VP40蛋白及抗体 Figure 2 SDS-PAGE and Western blotting analysis of rEBOV-VP40 and anti-EBOV-VP40 antibody. (A) SDS-PAGE analysis results. 1: un-induced Rosetta-pET28a-EBOV-VP40; 2: post-induced Rosetta-pET28a-EBOV-VP40; 3: purified rVP40 protein. (B) 1: purified rabbit anti-EBOV-VP40 IgG; 2: purified mouse anti-EBOV-VP40 McAb (4B7F9). Western blotting analysis results: rVP40 protein (lane 1) and inactivated EBOV (lane 2) were analyzed by immunoblotting with rabbit anti-EBOV-VP40 IgG (C) and mouse anti-EBOV-VP40 McAb (D). Molecular mass markers are indicated on the left. |
| |
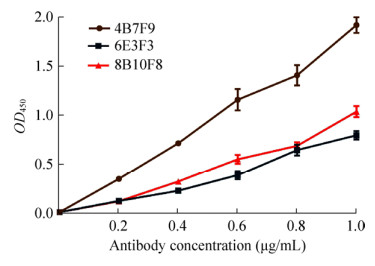
|
| 图 3 ELISA鉴定不同EBOV单抗株与灭活EBOV相互反应 Figure 3 McAbs (4B7F9, 6E3F3 and 8B10F8) were assessed by Inactivated-EBOV-specific ELISA. |
| |
应用XYZ三维划膜喷金仪将标记兔多抗的胶体碳,分别以10、20、30、40 μL/cm的量喷涂到处理好的玻璃纤维膜上并组装试纸条,确定胶体碳在玻璃纤维素膜上的最适喷涂量为30 μL/cm (图 4)。
|
| 图 4 碳标记抗体最适喷涂量 Figure 4 The optimal spraying quantity of carbon-labeled IgG. (A) Image of detection positive sample by strips which were sprayed with different amounts of carbon-labeled IgG. 1: 40 μL/cm; 2: 30 μL/cm; 3: 20 μL/cm; 4: 10 μL/cm. (B) The strips were scanned by lateral flow reader and signal intensity of control and test lines were compared. |
| |
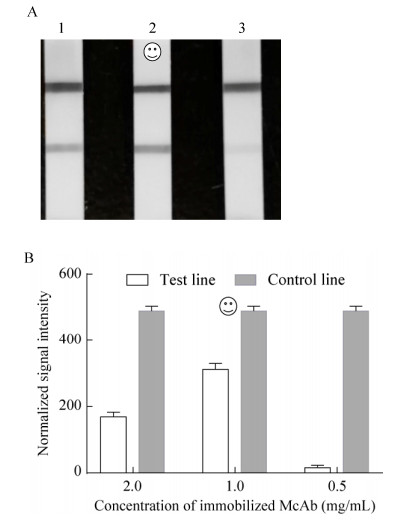
将纯化的单抗4B7F9,按3个不同浓度分别印迹于硝酸纤维素膜,作为检测线;将1 mg/mL的羊抗兔IgG,印迹于硝酸纤维素膜为质控线,组装试纸条。滴加阳性血清样品80 μL,室温反应15 min,确定单抗的最适印迹量为1.0 mg/mL (图 5)。
|
| 图 5 单抗4B7F9的最适印迹量 Figure 5 Concentration of immobilized McAb (4B7F9). (A) Image of detection positive sample by strips which were immobilized with different concentrations of McAb. 1: 2.0 mg/mL; 2: 1.0 mg/mL; 3: 0.5 mg/mL. (B) The strips were scanned by lateral flow reader and signal intensity of control and test lines were compared. |
| |
取80 μL血清样品垂直滴加至组装好的检测卡加样处,室温反应15 min,观察结果。当待检样品中含有灭活埃博拉病毒时,则在试纸条的检测线(T)和质控线(C)处分别出现一条黑色线;当待检样品中不含有抗原时,则只在试纸条的质控线(C)处出现一条黑线(图 6)。

|
| 图 6 EBOV胶体碳侧流层析试纸条检测结果判定 Figure 6 Detection criterion of EBOV colloidal carbon lateral flow test strip. 1: positive result; 2: negative result. T: test line; C: control line. |
| |
特异性:用组装好的试纸条分别检测含重组EBOV-VP40蛋白、EBOV-VLP或EBOV灭活病毒的模拟阳性临床血清和分别含MARV-VLP、IAV/PR/8、YFV-17D和DEN2的对照模拟临床血清样本,取血清样品80 μL,滴加到加样孔,室温反应15 min,滴加模拟阳性临床血清的试纸条反应均为阳性,其余对照样本均为阴性,表明该胶体碳免疫层析试纸条具有良好的特异性,与其他非洲常见病原无交叉反应(图 7)。为了评价试纸条的假阳性率,分别对1 500份国内采集的阴性血清进行了检测,共出现两例弱阳性反应,将该两例血清样本经荧光定量RT-PCR进一步鉴定确认为阴性样本,因此可判断其假阳性率为1.3‰,明显低于ReEBOVTM试纸条15.4%的假阳性率[10]。
|
| 图 7 EBOV胶体碳侧流层析试纸条特异性评价 Figure 7 Specificity of EBOV colloidal carbon lateral flow test strip. 1: EBOV-VP40; 2: inactivated-EBOV; 3: DEN2; 4: YFV-17D; 5: EBOV-VLP; 6: MARV-VLP; 7: IAV/PR/8. |
| |
灵敏度:将已用荧光PCR技术定量的灭活EBOV用阴性血清梯度稀释后,分别用商品化ReEBOVTM胶体金试纸条或胶体碳试纸条进行平行检测,ReEBOV™胶体金试纸条最低检出限为10 μg/mL (108 copies/mL) (图 8A),胶体碳试纸条最低检出限为100 ng/mL (106 copies/mL) (图 8B),胶体碳试纸条灵敏度是ReEBOVTM胶体金试纸条的100倍。

|
| 图 8 EBOV侧流层析试纸条灵敏度评价 Figure 8 Detection limit of EBOV colloidal carbon lateral flow test strip and ReEBOV™ test strip. Simulated clinical specimens spiked with different concentrations of inactivated-EBOV were tested by colloidal carbon or colloidal gold test strip. (A) 1: 10 μg/ mL; 2: 1 μg/ mL; 3: 100 ng/ mL; 4: 10 ng/ mL. (B) 1: 100 μg/ mL; 2: 10 μg/ mL; 3: 1 μg/ mL. * indicates the limit of detection. |
| |
稳定性:分别将胶体碳试纸条放置25 ℃和37 ℃两个温度条件,定期检测其最低检出限,结果显示,25 ℃放置12个月试纸条的最低检出限未发生明显变化,37 ℃第3个月最低检出限出现上升(图 9),提示试纸条可在37 ℃稳定保存2个月,室温稳定保存1年以上,证明该试纸条具有良好的稳定性。
|
| 图 9 EBOV侧流层析试纸条稳定性评价(试纸条分别放置25 ℃和37 ℃并定期检测其最低检出限,虚线以上代表无法检出,即试纸条已失效) Figure 9 Thermal stability analysis of the colloidal carbon test strip. Strips were placed under different temperature conditions (25 ℃, 37 ℃) for 1 year and detection limit were tested per month. The test results above the dashed line mean that it cannot be detected, i.e., the test strip has expired. |
| |
埃博拉出血热是一种可引起人和非人灵长类动物高死亡率的烈性传染病,2014–2016年在西非的大规模暴发疫情引起全世界的关注。目前,该疾病没有特效治疗药物,很多实验室的疫苗或药物还处于临床前研究阶段,不过我国已率先研制了基于腺病毒载体的埃博拉疫苗,有效提升了我国针对埃博拉疫情的防控能力[15-16]。近期的埃博拉疫情导致超过28 000人感染,超过40%的死亡率,尽管疫情告一段落,但是部分幸存者体内依然存在病毒,而我国与非洲经贸往来日渐频繁,因此我国存在输入性风险。及早发现感染病例并进行隔离是控制疫病流行最有效的措施。尽管荧光PCR技术具有良好的灵敏度和特异性,但仅限于在高等级专业实验室进行,在非洲各地建立PCR实验室存在困难,而且从样本采集、运输到实验室检测出结果平均需要5 d时间,容易贻误病情[17],并导致疫情扩散。美国Corgenix公司开发的EBOV胶体金试纸条产品可实现EBOV的现场快速检测,但其灵敏度偏低(检出率91.8%),而且特异性较差(假阳性率15.4%),由于EBOV感染急性期血液中病毒含量为106–109 copies/mL,而ReEBOVTM胶体金试纸条的最低检出限为108 copies/mL[18],从而导致一些血液中病毒含量较低的感染病例被漏检,而且该产品需要冷链运输、保存,对于供电紧张、医疗设施匮乏的非洲地区,其推广应用受到了限制。针对非洲这一特殊环境,建立一种快速、简便、高灵敏和热稳定的EBOV快速诊断技术迫在眉睫。
采用碳纳米颗粒作为标记探针代替金颗粒建立的胶体碳侧流层析试纸条,不需要仪器设备,仅需几分钟即可肉眼判断结果,适合现场快速检测,而且其稳定性明显优于胶体金产品,更适合在非洲这种特殊环境使用。本研究采用抗体夹心法建立的胶体碳免疫层析检测试纸条能够特异地与EBOV重组VP40、VLP和灭活病毒反应,而与马尔堡、流感、黄热、登革热这些热带地区常见病原无交叉反应,表明其具有良好的特异性。为评价其灵敏度,将其与WHO和美国FDA授权的ReEBOV™胶体金试纸条产品平行检测了梯度稀释的灭活EBOV,结果显示其灵敏度是对照胶体金产品的100倍。本研究确认了ReEBOVTM胶体金试纸条的最低检出限是108 copies/mL,该结果与WHO的评价报告结果一致[10],胶体碳试纸条的最低检出限是106 copies/mL。EBOV感染急性期病人血液中病毒含量为106–109 copies/mL,因此胶体碳试纸条有望在EBOV初期发热症状出现后即迅速对疑似感染者进行鉴别诊断并隔离以防止疫情扩散。研究表明,如果能将EBOV感染者的诊断期由目前的5 d缩短为1 d,则其感染他人的几率将由80%降为0[5],也就是说将大幅降低埃博拉病毒的感染性从而控制疫情扩散。另外,考虑到非洲地区环境炎热,医疗技术水平薄弱,产品的热稳定性和易操作性至关重要。本研究的胶体碳试纸条可在37 ℃稳定保存2个月,25 ℃稳定保存1年,非常适合非洲缺乏冷链运输的环境条件,而且操作简便,无需培训,可用于家庭或诊所发现疑似症状后的快速筛查。该试纸条产品有望作为荧光PCR产品的一个补充,弥补PCR产品无法进行现场筛查的缺陷,将埃博拉病毒检测由高等级实验室前移到社区、家庭,人们甚至可以进行发热后的自我筛查,由于检测时间的提前,埃博拉病毒的高传染性将被有效遏制。
为满足非洲地区及进出口岸对于EBOV快速筛查的需求,本研究首次将该胶体碳免疫层析技术用于EBOV的快速检测,研制的胶体碳试纸条灵敏度是已上市并获WHO和美国FDA授权的胶体金试纸条产品的100倍,假阳性率是其1/100,而且无需冷链,室温即可以稳定保存。检测过程不需任何仪器设备,只需15 min即可快速获得检测结果。本试纸条可用于发热病人的筛查,针对阳性结果可通过荧光PCR技术进行进一步的确认。由于国内缺乏EBOV临床血清样本,本研究只采用模拟样本和临床阴性血清对其进行了评价,后续工作仍需采用大量EBOV临床样本对其进行进一步的评价。本研究建立的EBOV胶体碳免疫层析方法为我国EBOV的防控提供了技术支撑。
| [1] | Kuhn JH, Becker S, Ebihara H, et al. Proposal for a revised taxonomy of the family Filoviridae: classification, names of taxa and viruses, and virus abbreviations. Arch Virol, 2010, 155(12): 2083–2103. DOI: 10.1007/s00705-010-0814-x |
| [2] | Towner JS, Sealy TK, Khristova ML, et al. Newly discovered ebola virus associated with hemorrhagic fever outbreak in Uganda. PLoS Pathog, 2008, 4(11): e1000212. DOI: 10.1371/journal.ppat.1000212 |
| [3] | Wool-Lewis RJ, Bates P. Characterization of Ebola virus entry by using pseudotyped viruses: identification of receptor-deficient cell lines. J Virol, 1998, 72(4): 3155–3160. |
| [4] | Cherpillod P, Schibler M, Vieille G, et al. Ebola virus disease diagnosis by real-time RT-PCR: a comparative study of 11 different procedures. J Clin Virol, 2016, 77: 9–14. DOI: 10.1016/j.jcv.2016.01.017 |
| [5] | Dhillon RS, Srikrishna D, Garry RF, et al. Ebola control: rapid diagnostic testing. Lancet Infect Dis, 2015, 15(2): 147–148. |
| [6] | Kurosaki Y, Magassouba N, Oloniniyi OK, et al. Development and evaluation of Reverse Transcription-Loop-Mediated Isothermal Amplification (RT-LAMP) assay coupled with a portable device for rapid diagnosis of ebola virus disease in guinea. PLoS Negl Trop Dis, 2016, 10(2): e0004472. DOI: 10.1371/journal.pntd.0004472 |
| [7] | Kurosaki Y, Takada A, Ebihara H, et al. Rapid and simple detection of Ebola virus by reverse transcription-loop-mediated isothermal amplification. J Virol Methods, 2007, 141(1): 78–83. DOI: 10.1016/j.jviromet.2006.11.031 |
| [8] | Xu CP, Wang HL, Jin HL, et al. Visual detection of Ebola virus using reverse transcription loop-mediated isothermal amplification combined with nucleic acid strip detection. Arch Virol, 2016, 161(5): 1125–1133. DOI: 10.1007/s00705-016-2763-5 |
| [9] | Ksiazek TG, West CP, Rollin PE, et al. ELISA for the detection of antibodies to Ebola viruses. J Infect Dis, 1999, 179(Suppl 1): S192–S198. |
| [10] | WHO. WHO emergency use assessment and listing for Ebola Virus Disease IVDs. Public report. Product: ReEBOVTM Antigen Rapid Test Kit.[2018-03-01].http://www.who.int/diagnostics_laboratory/procurement/150219_reebov_antigen_rapid_test_public_report.pdf?ua=1. |
| [11] | Duan DM, Fan KL, Zhang DX, et al. Nanozyme-strip for rapid local diagnosis of Ebola. Biosens Bioelectron, 2015, 74: 134–141. DOI: 10.1016/j.bios.2015.05.025 |
| [12] | Liu B, Wang LL, Tong B, et al. Development and comparison of immunochromatographic strips with three nanomaterial labels: colloidal gold, nanogold- polyaniline-nanogold microspheres (GPGs) and colloidal carbon for visual detection of salbutamol. Biosens Bioelectron, 2016, 85: 337–342. DOI: 10.1016/j.bios.2016.05.032 |
| [13] | Swenson DL, Warfield KL, Kuehl K, et al. Generation of Marburg virus-like particles by co-expression of glycoprotein and matrix protein. FEMS Immunol Med Microbiol, 2004, 40(1): 27–31. DOI: 10.1016/S0928-8244(03)00273-6 |
| [14] | Warfield KL, Bosio CM, Welcher BC, et al. Ebola virus-like particles protect from lethal Ebola virus infection. Proc Natl Acad Sci USA, 2003, 100(26): 15889–15894. DOI: 10.1073/pnas.2237038100 |
| [15] | Zhu FC, Hou LH, Li JX, et al. Safety and immunogenicity of a novel recombinant adenovirus type-5 vector-based Ebola vaccine in healthy adults in China: preliminary report of a randomised, double-blind, placebo-controlled, phase 1 trial. Lancet, 2015, 385(9984): 2272–2279. DOI: 10.1016/S0140-6736(15)60553-0 |
| [16] | Zhu FC, Wurie AH, Hou LH, et al. Safety and immunogenicity of a recombinant adenovirus type-5 vector-based Ebola vaccine in healthy adults in Sierra Leone: a single-centre, randomised, double-blind, placebo-controlled, phase 2 trial. Lancet, 2017, 389(10069): 621–628. DOI: 10.1016/S0140-6736(16)32617-4 |
| [17] | WHO Ebola Response Team, Aylward B, Barboza P, et al. Ebola virus disease in West Africa--the first 9 months of the epidemic and forward projections. N Engl J Med, 2014, 371(16): 1481–1495. DOI: 10.1056/NEJMoa1411100 |
| [18] | USFDA. ReEBOVTM Antigen Rapid Test (Ebolavirus VP40 antigen detection). Instructions for use.[2018-03-01]. https://www.fda.gov/downloads/MedicalDevices/Safety/EmergencySituations/UCM528060.pdf. |
 2018, Vol. 34
2018, Vol. 34