中国科学院微生物研究所、中国微生物学会主办
文章信息
- 康晓圳, 曹佳莉, 张保惠, 袁权
- Kang Xiaozhen, Cao Jiali, Zhang Baohui, Yuan Quan
- 单域抗体的研究和应用进展
- Single-domain antibody–advances in research and application
- 生物工程学报, 2018, 34(12): 1974-1984
- Chinese Journal of Biotechnology, 2018, 34(12): 1974-1984
- 10.13345/j.cjb.180076
-
文章历史
- Received: March 9, 2018
- Accepted: April 8, 2018
2 厦门大学 公共卫生学院,福建 厦门 361102;
3 国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102
2 School of Public Health, Xiamen University, Xiamen 361102, Fujian, China;
3 National Institute of Diagnostics and Vaccine Development in Infection Diseases, Xiamen University, Xiamen 361102, Fujian, China
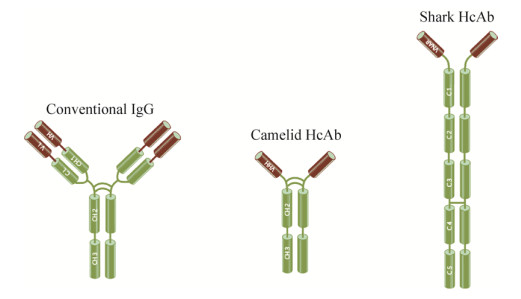
传统抗体分子(IgG)在结构上是由两条相同的重链和两条相同的轻链组成,此种结构在哺乳动物中均是非常保守的。抗体分子的轻链包含了1个VL区和1个CL区(图 1),而重链则拥有1个VH区和3个CH区(CH1、CH2和CH3)。VH区和VL区之间通过二硫键相互连接形成抗体的可变区(Fv),是抗体识别抗原的最小单位,抗体可变区的序列差异决定了抗体能够特异地识别不同的抗原。而CL区和CH区则是相对保守的,被称为抗体的恒定区,其中CH区的CH2和CH3两个区域对于抗体招募免疫细胞发挥ADCC (抗体依赖的细胞介导的细胞毒性作用)和CDC (补体依赖的细胞毒性作用)功能有着重要的作用[1-2]。
|
| 图 1 传统抗体与重链抗体的结构对比示意图 Figure 1 Structures of conventional antibody and heavy-chain antibody. |
| |
1993年布鲁塞尔自由大学的Hamers-Casterman等首先报道了骆驼血液中除了传统的IgG抗体外还存在另一种类型的抗体,与传统的哺乳动物抗体IgG分子结构不同,这种抗体既缺失传统抗体的轻链,也缺少重链恒定区的CH1区域,被称为重链抗体(Heavy chain antibody,HcAb)。重链抗体的可变区仅由抗体重链的可变区组成(图 1),与传统抗体的Fab类似,该可变区可以与抗原特异性结合,因此重链抗体可以发挥和传统抗体一样的功能。在哺乳类动物中,目前只有在胼足亚目的骆驼科动物血液中发现含有功能性的重链抗体,同属于偶蹄目的反刍亚目和猪形亚目动物体内未发现这类抗体[3]。HcAb普遍存在于各种骆驼科动物中,包括单峰驼Camelus dromedarius、亚州双峰驼Camelus bactrianus、南美洲的大羊驼Lama glama、原驼Lama guanicoe、羊驼Vicugna pacos等,尽管其所占比例略有不同,如在南美洲羊驼的血液中重链抗体比例为10%–25%,而在普通的双峰骆驼中则高达50%–80%[4-5]。除了骆驼科动物外,在护士鲨(又称为铰口鲨,Nurse shark,Ginglymostoma cirratum)、大星鲨(Smooth dogfish,Mustelus canis)、白斑角鲨(Spiny dogfish,Squalus acanthias)、鳐鱼(Skate)和
无论是骆驼科动物来源的HcAb还是软骨鱼来源的IgNAR,其特异性结合抗原的均为单一重链的可变区,分别被称为VHH (Variable domain of heavy chain of heavy-chain antibody,VHH)和VNAR (Variable domain of new antigen receptor,VNAR)。采用分子生物学技术直接克隆并重组表达VHH或VNAR,可获得只含有单个结构域的最小单元抗原结合片段,被称为单域抗体(Single-domain antibodies,sdAbs),亦被称为纳米抗体(Nanobody)。单域抗体通常只由110–130个氨基酸组成,分子量仅有12–15 kDa,远远小于传统完整抗体(150–160 kDa)及其Fab片段(约50 kDa),但却能具备与传统抗体相似或更高的特异性抗原亲和力。单域抗体固有的分子量小、理化特征稳定、亲和力高和易于重组表达制备的特点使得其在被发现后备受关注,经过20多年的研究,在免疫研究、诊断检测、医学和生物学成像、治疗性抗体发展等领域的应用均取得了积极进展。文中主要从sdAbs的结构和理化特征、筛选和制备方法、在生物学和医学研究中的应用等方面总结分析了单域抗体的新近研究进展,并展望了其进一步发展和应用的前景以及面临的问题。
1 单域抗体的理化性质相比于传统抗体而言,单域抗体有着独特的理化性质。主要包括以下几点:1)单域抗体的分子量小,因为没有轻链的存在,单域抗体VHH的大小只有15 kDa左右,鲨鱼来源的单域抗体VNAR因为缺少CDR2区(Complementarity- determining region 2,互补决定簇2),只有12 kDa左右,是已知的最小的抗原结合单位。这一特点使得其相对易于携带靶向药物进入细胞内部或穿越血脑屏障发挥作用。2)单域抗体具有更好的溶解度和稳定性。传统抗体VH的FR2区域通常会包含数个相对保守的疏水氨基酸,利于与VL通过疏水相互作用结合,但在VHH中这段区域常是暴露的,因此这几个氨基酸被演化替换成亲水性的氨基酸,例如,在传统抗体的VH中第37位的Val、第44位的Gly、第45位的Leu和第47位的Phe/Trp等疏水氨基酸,在骆驼科动物VHH中被相应替换为Phe/Tyr(aa37)、Glu/Gln (aa45)、Arg/Cys (aa45)、Gly/Arg/Leu/Ser(aa47)等相对亲水性更强的氨基酸[7-8]。这些氨基酸改变使得VHH在蛋白可逆折叠、热稳定性和抗蛋白降解等方面的性质相较于传统抗体更优。一些单域抗体可以耐受2.3–3.3 mol/L的盐酸胍以及60–80 ℃的高温[9]。此外,VHH除形成Ig分子保守的FR1 (Framework region 1,框架区域1)和FR3 (Framework region 3,框架区域3)间的二硫键外,还可能形成连接CDR1 (Complementarity- determining region 1,互补决定簇1)和CDR3 (Complementarity-determining region 3,互补决定簇3)或者连接CDR2和CDR3之间的额外二硫键,从而进一步提高VHH构象结构的稳定性[10-12],这些二硫键甚至可以让单域抗体不被胃蛋白酶和糜蛋白酶降解,因此有些单域抗体可以口服应用[10]。3)单域抗体的CDR3较长,使其与抗原的结合方式更加灵活,此种结构特征使得单域抗体可以结合抗原凹状的隐藏表位,例如病毒的隐藏表位[13]和酶/受体蛋白分子的激活位点等[14-15]。4)与传统的鼠单克隆抗体相比,骆驼单域抗体的免疫原性更小,鼠源抗体与人源抗体的差异较大,导致其免疫原性强,一般需要经过复杂的人源化才能得到进一步的应用,而骆驼抗体的VH和人抗体的VH相似度很高,易于进行人源化改造和临床应用。
2 单域抗体筛选方法 2.1 基于噬菌体表面展示技术的单域抗体筛选噬菌体表面展示技术最早由Smith等在1985年发展出来,该技术的核心是将目的基因通过基因工程方法融合表达在噬菌体外壳蛋白基因中,使其展示在噬菌体表面,进而可通过特异性富集筛选获得携带有靶蛋白/多肽的噬菌体,再进行克隆化和序列测定,并最终获得靶蛋白/多肽的DNA编码序列。这一技术借助噬菌体的高扩增性,将基因型和功能表型(结合活性)结合在一起,是一种非常高效的筛选系统[16]。
由于不存在传统抗体的轻重链匹配问题,单域抗体更适合采用噬菌体展示文库技术进行筛选。噬菌体单域抗体文库一般分为三大类:免疫库、天然库和全合成库。免疫库是指从预先免疫过的动物(如羊驼等)体内通过特异性富集靶抗原特异的B细胞基因,并扩增获得重链抗体VH基因而构建的单域抗体表达文库,通常只需较小库容即可筛选到高亲和力抗体。免疫库的受限因素在于免疫原的特征,不同免疫原在动物中的体液免疫应答强弱和表位差异均可能影响最终获得抗体的质量和多样性,最终筛选到的抗体同质化(如识别的表位相同等)程度较高。天然库是采用未经靶抗原免疫动物的B细胞扩增全部重链抗体VH基因构建的单域抗体文库。从天然库中筛选获得高亲和力单域抗体的成功率基本与库容成正比,理论上只要所构建的抗体库库容和多样性足够大(> 109 CFU/mL),即可从中筛选到针对各种靶抗原的高亲和力单域抗体,甚至是针对哺乳动物中高度保守的抗原(类似自身抗原)的单域抗体。尽管天然库已具有较高多样性,但由于在实际建库操作中,会因抗体基因家族的偏向性以及先天免疫耐受导致的克隆缺失等原因导致克隆多样性的降低。直接采用基因合成方法构建的合成单域抗体库可通过调节抗体分子中抗原结合区域附近的骨架区域来进一步提高库的多样性,也可直接基于人源化的VHH分子骨架进行合成构建。Moutel等新近采用全合成的方法构建了人源化的通用单域抗体库NaLi-H1,库容达到3×109 CFU/mL,并从中成功筛选到若干针对不同靶标的高亲和力单域抗体(亲和力达到10–9 CFU/mL– 10–10 mol/L)[17]。
噬菌体展示技术筛选抗体的流程一般包括以下几点(图 2):1)抗体基因片段的获取。取羊驼或鲨鱼的外周血,采用淋巴细胞分离液分离得到淋巴细胞,提取淋巴细胞的总RNA,通过RT-PCR逆转录成cDNA,采用巢式PCR两步法扩增VHH基因,最后将VHH基因克隆到噬菌体载体上,克隆构建完成后可用二代测序的方法来质控文库质量。2)目的基因的淘选。先将噬菌体文库与不带有目的抗原的封闭液共孵育,进行负选,减少非特异性反应,提高抗体淘选的效率。再将抗原固定到固相载体上(聚苯乙烯板或者磁珠)进行淘选。淘选一般要进行多轮,每轮淘选后可采用Phage-ELISA检测,直到能检测到明显的富集效果。3)抗体的表达纯化。将目的抗体基因序列克隆到表达载体上,可以通过原核表达系统或真核表达系统进行表达。

|
| 图 2 噬菌体抗体库的建立和筛选流程 Figure 2 Process of the establishment and selection of phage display antibody library. |
| |
酵母属于真核的单细胞生物,用于抗体展示技术的酵母一般是酿酒酵母Saccharomyces cerevisiae,这种酵母有大约200 nm厚的细胞壁,出芽的酵母细胞壁表面有凝集素蛋白,可以与相对交配型的酵母上的Aga2p蛋白结合,单域抗体便是以融合蛋白的形式与Aga2p蛋白融合表达并展示于酵母细胞表面[18-20]。
酵母展示抗体库的筛选方法一般采用磁珠辅助的细胞分选(MACS)和流式细胞分选(FACS),MACS的主要作用是为了减少非特异性结合,通常会在MACS筛选过后的基础上进行多轮的FACS筛选[20-21]。
相比于噬菌体展示技术,酵母展示技术既有优势也有不足。一方面酵母属于真核细胞,抗体的翻译后修饰与哺乳动物细胞类似,糖基化后的抗体稳定性高,同时也避免在哺乳动物表达系统中可能存在的未知情况。其次酵母展示技术采用的是流式细胞分选的方法,整个筛选过程的可控性更高[16]。但另一方面酵母抗体库的库容一般比噬菌体抗体库的小,最高到1×109 CFU,但随着技术的优化,已有报道酵母抗体库的库容可以提高到1010 CFU水平[22],而噬菌体抗体库的库容可以高达1011 CFU。同时酵母展示技术在筛选低聚物的抗原时效果可能不理想,因为每一个酵母细胞上会同时展示1×104到1×105个抗体片段[20],因此一个酵母细胞可能同时共价结合多个抗原,这样便会导致筛选到的抗体的亲和力可能不如预期。
2.3 基于细菌展示技术的单域抗体筛选大肠埃希氏菌Escherichia coli除了用于噬菌体文库的构建外,其本身也可以作为抗体展示的载体。E. coli属于革兰氏阴性菌,除了有细菌内膜,在细胞壁外还有一层细菌外膜。抗体片段通常展示在E. coli细菌的内膜,通过抗体的Fc段与膜上的脂蛋白结合,这种展示和表达方式称为锚定周质表达(Anchored periplasmic expression,APEx)。但由于E. coli细菌细胞壁和外膜的存在,因此细菌需要通透处理成原生质球的形式才能与抗原结合[23-24]。利用外膜展示抗体的技术也被报道过,例如Salema等将抗体片段展示在自转运蛋白(EhaA autotransporter)或紧密黏附素(Intimin)上,这两种蛋白来源于E. coli O157:H7 (EHEC)细菌的外膜,且可以在E. coli K-12细菌中表达和展示[25-27]。革兰氏阳性菌中的肉葡萄球菌Staphylococcus carnosus也可以用于抗体展示,该方法是通过肉葡萄球菌的蛋白A上的细胞壁锚定区域(Cell-wall anchoring domain)将抗体片段从细胞膜内转运到膜外并锚定在细胞壁上[28]。细菌展示技术的筛选方法一般采用流式细胞分选(FACS)的方式,同时也会结合磁珠辅助的细胞分选(MACS)。
3 单域抗体的应用 3.1 单域抗体在显微镜学中的应用因为单域抗体体积小,已经有许多研究证实了将单域抗体带上标签后,可以用作纳米级的检测工具。例如,针对GFP和RFP等荧光蛋白的单域抗体在标记上有机染料后可用于超分辨率显微镜成像[29-30]。2012年,Ries等利用该方法对稳定表达tubulin-YFP的Ptk2细胞进行成像,并最终将分辨率提高到(26.9±3.7) nm (细胞微管蛋白的直径为25 nm)[29],而如果用传统的抗体,分辨率只能达到45 nm左右。Chamma等将GFP的单域抗体应用于活细胞成像和双色荧光成像系统。他们利用单域抗体去活体标记轴突蛋白-1β,然后用双色成像系统去观察神经细胞间的跨突触连接[31]。GFP和RFP的单域抗体还可以用于研究亚细胞上的超微结构,例如核孔复合物和胞膜窖,与间接的抗体免疫化学方法不同,利用单域抗体染色可以更好地模拟这些超微结构的真实情况[32-33]。
3.2 单域抗体用于结构生物学研究单域抗体结合抗原可以稳定抗原的结构,并且单域抗体本身分子量小,对抗原的影响小,所以单域抗体被用于稳定一些结构不稳定的蛋白,辅助解析蛋白的结构。G蛋白偶联受体GPCRs (G protein coupled receptors)是一大类膜蛋白受体的简称,是最著名的药物靶标分子。它参与了很多细胞信号转导的过程,可以调节人体许多生理学机能。相同的GPCRs可以结合不同亲和力的激动剂分子,并激活不同的下游信号通路。为了更好地理解不同的激动剂分子为何可以激活相同的受体,GPCRs的晶体结构解析是非常重要的手段。β2肾上腺素受体(β2-adrenoceptor,β2AR)是GPCRs的成员,它可以被许多天然激动剂,如肾上腺素(Adrenaline)等低亲和力地结合并激活,但不稳定。β2AR也可以和BI-167107 (Boehringer Ingelheim)等商品化激动剂高亲和力地结合并维持稳定的激活状态。G蛋白可以通过与β2AR结合并增强其与激动剂之间的亲和力。Nb80是一株来源于美洲驼(Llama)的单域抗体,它可以与β2AR结合并表现出和G蛋白一样的性质[34-35]。Rasmussen等利用Nb80与β2AR的变体β2AR-T4L (第3个胞内环被替换成T4溶菌酶)结合形成的复合物β2AR-T4L-Nb80成功地解析了BI-167107激活下的β2AR晶体结构,分辨率为3.5 Å[34]。之后,Ring等通过酵母展示技术筛选不同的Nb80变体,并成功得到了一株Nb6B9抗体,这株抗体可以将BI-167107激活下的β2AR晶体结构分辨率提高到2.8 Å,同时也解析了羟苄基异丙肾上腺素(hydroxybenzyl isoproterenol,HBI)和adrenaline这两类低亲和力激动剂结合下的β2AR的晶体结构,分辨率分别为3.1 Å和3.2 Å[36]。Staus等还发现了一株可以显著降低β2AR与激动剂亲和力的抗体Nb60,进一步扩大了β2AR的变构潜力[37]。
3.3 单域抗体用于医学诊断虽然传统的单克隆抗体在标记了放射性元素(99mTc或68Ga)后可以用于医学诊断和显影,但是由于抗体的分子量大,一方面组织的穿透性不好,成像组织受限,另一方面半衰期长,无法在短时间内被清除。单域抗体分子量小,可以更快速地进入组织,缩短检测时间。同时半衰期短只有1–2 h,不会长时间滞留在组织中。Balhuizen等利用放射性同位素99mTc标记的单域抗体追踪胰腺内分泌细胞,因为胰腺内分泌细胞的二肽基肽酶6 (DPP6)的表达量远高于其周围的组织细胞,所以可以通过筛选针对DPP6的单域抗体来实现对胰腺内分泌细胞的定位追踪,并且在过继转移了表达DPP6的Kelly神经母细胞瘤细胞的免疫缺陷小鼠模型上验证了该方法的可行性[38]。PD-1/PD-L1抗体药物是当前备受瞩目且前景较好的肿瘤治疗手段,但是有一部分病人对该类药物无应答,如果能在治疗前预测到患者对该类药物的应答效果,将更有利于对症下药。Broos等通过筛选针对PD-L1的单域抗体并标记99mTc同位素,最终发现了两株可以与PD-L1表达的肿瘤细胞反应而与PD-L1缺失的肿瘤细胞不反应的单域抗体C3和E2,并且证明这两株抗体标记的同位素与PD-L1的表达量存在明显的剂量效应关系[39],这也就说明了单域抗体可以用于肿瘤微环境中目的分子的成像分析。
3.4 单域抗体介导的药物传递目前已有文章报道针对肿瘤特异抗原的单域抗体可用于介导药物特异性地识别肿瘤,从而减少药物对正常细胞的非特异性细胞毒性。单域抗体没有Fc段,因此可以避免被Fc介导的清除作用降解,同时也不会诱发免疫反应[40]。针对肿瘤组织而言,血管内皮细胞生长因子受体(VEGFR)是很好的抗体靶标,因此该类的报道较多[41-45]。例如Ahani等首先构建了外膜包被Sindbis virus E2糖蛋白(cSVE2s),内部包裹针对肿瘤血管内皮生长因子受体2 (VEGFR2或KDR)的慢病毒的假病毒,然后将针对VEGFR2的单域抗体p2.2-Nb与cSVE2s连接,通过单域抗体的靶向作用将假病毒带入肿瘤组织[41]。Deng等通过将针对VEGFR的单域抗体与南瓜蛋白(cucurmosin)连接,利用cucurmosin蛋白的促凋亡作用来杀伤肿瘤,作者直接采用原核表达系统表达了该重组蛋白,并在体外验证了该重组蛋白的抗肿瘤效应[46]。除了针对VEGFR分子外,还有针对肿瘤其他相关分子靶标的单域抗体被报道,例如CD7 (TP-40),CD7分子主要表达于急性淋巴细胞白血病的T细胞,针对CD7分子的抗毒素已经被证明对CD7+恶性肿瘤病人具有潜在治疗效果,Tang等将针对CD7的单域抗体和毒素假单胞菌外毒素A (Pseudomonas exotoxin A,PE38)偶联,同样采用原核表达系统表达该重组蛋白,并在CD7阳性的白血病细胞系Jurkat和CEM细胞以及T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)和急性粒细胞白血病(Acute myeloid leukemia,AML)细胞上验证了其可以显著促进这类细胞的凋亡[47]。
3.5 单域抗体用于疾病治疗单域抗体和传统抗体一样可以用于疾病的治疗,但因为单域抗体发展得比较晚,因此目前用于疾病治疗的单域抗体数量不多,而且多数还处于临床研究阶段,如表 1所示,目前仅有一株单域抗体caplacizumab (ALX-0081)完成了三期临床研究,caplacizumab是一株可用于治疗获得性血栓性血小板减少性紫癜(TTP)的单域抗体,它的靶标分子是血管性血友病因子,通过与该因子结合,抑制该因子和血小板之间的相互作用,从而防止血小板的聚集[48-49]。Ⅱ期临床的结果显示相比于安慰剂,caplacizumab可以显著缓解急性发作的TTP,说明了caplacizumab对病人的血小板有保护作用,但是caplacizumab也同时增加了病人的出血倾向[50-52]。ALX-0171是一株针对呼吸道合胞体病毒的具有潜在治疗效果的单域抗体,相比于传统的帕利珠单抗,这株单域抗体在A型和B型的病毒株中展现出更好的体外中和活性,同时针对病毒的复制也显示出更好的抑制效果[13]。同样值得关注的是KN035单域抗体,KN035是我国第一个自主研发的PD-L1单域抗体药物,它可以诱导机体产生强烈的T细胞应答并抑制肿瘤的生长。对KN035与PD-L1的复合物进行晶体结构解析发现KN035可以竞争性地封闭PD-L1与PD1的几个关键结合位点,例如Ile54、Tyr56和Arg113[53]。在2017年1月,KN035获得临床批准并在3月底开始了第一例临床试验。
| Product | Target | Indication | Stage | Company |
| Caplacizumab (ALX-0081) | vWF | aTTP | Filing | Ablynx |
| Vobarilizumab | IL-6R | SLE | PhaseⅡ | Ablynx |
| Vobarilizumab | IL-6R | RA | PhaseⅡ | Ablynx |
| ALX-0171 | RSV | RSV | PhaseⅡ | Ablynx |
| Ozorralizumab | TNF-α | RA | PhaseⅡ | Taisho |
| ALX-1141/M6495 | ADAMTS-5 | Osteoarthritis | PhaseⅠ | Merck |
| ALX-0716/M1095 | IL-17A/IL-17F | Psoriasis | PhaseⅠ | Merck |
| BI 655088 | CX3CR1 | Chronic kidney disease | PhaseⅠ | BI |
| BI 836880 | VEGF/Ang2 | Oncology | PhaseⅠ | BI |
| KN035 | PD-L1 | Tumors | PhaseⅠ | Alphamab |
| aTTP is short for acquired Thrombotic Thrombocytopenic Purpura, Vwf is short for von Willebrand Factor, SLE is short for Systemic Lupus Erythematosus, RA is short for Rheumatoid Arthritis, RSV is short for Respiratory Syncytial Virus, BI is short for Boehringer-Ingelheim. | ||||
单域抗体相比传统抗体而言不仅拥有更优的理化性质,而且表达和筛选也更加简便。从单域抗体被发现至今已经有20多年,这20年里单域抗体在生物学和医学领域中实现了多方面的应用,不仅促进了某些技术的更新,同时也为疾病的治疗和诊断提供了新的可能性。
虽然单域抗体为抗体研究提供了新的突破口,但也仍然存在一些问题。一方面单域抗体的半衰期短,虽然适用于分子显影,但是如果作为药物治疗的话,可能会导致其过早的被系统代谢,不仅无法起到长期的保护作用,同时也会增加肾脏的代谢压力。另一方面,单域抗体虽然筛选和表达相对简单,但如果要获得理想的具有很好应用价值的单域抗体是一个非常繁琐的过程,噬菌体抗体文库的筛选无法避免丝状噬菌体表面易与抗原结合带来的假阳性,酵母和细菌抗体文库库容小等都是单域抗体筛选的难点。
单域抗体在未来势必还会有更大的应用。1)单域抗体可用于双特异性抗体的构建,双特异性抗体是一类可以同时特异性结合两种不同抗原的人工改造抗体,在肿瘤免疫和自身免疫治疗中有非常广阔的应用前景,单域抗体易于改造和表达的特性在这领域中必然会发挥重要的功能[54]。2)随着胞内抗体技术的发展,以胞内分子为靶标的抗体治疗成为了可能[55],而单域抗体在这方面有着得天独厚的优势,一方面单域抗体分子量小,入胞的效率远高于传统抗体,而传统抗体的入胞一般也会采用scFv (单链抗体可变区)的形式[56-57]以减小抗体分子量。另一方面因为胞内抗体必须要在高还原性的胞内环境中保持活性,因此往往需要对抗体进行适当的改造。单域抗体易于改造并且可以用原核表达系统获得的优势将会展现强大的利用价值。我们团队也在尝试筛选针对乙型肝炎病毒核心颗粒HBcAg的单域抗体,并希望通过已有的抗体入胞技术将其导入细胞内,观察其对胞内病毒复制的影响。3)利用全合成的天然单域抗体合成库筛选抗体的方式不仅可以减少动物免疫的步骤,而且有利于筛选某些构象特异和细胞表面特异的抗原分子[17]。随着建库技术的更新,更高的抗体库库容会有利于建立更加广泛通用的天然抗体库。
| [1] | Liu Z, Gunasekaran K, Wang W, et al. Asymmetrical Fc engineering greatly enhances antibody-dependent cellular cytotoxicity (ADCC) effector function and stability of the modified antibodies. J Biol Chem, 2014, 289(6): 3571–3590. DOI: 10.1074/jbc.M113.513366 |
| [2] | Kinder M, Greenplate AR, Strohl WR, et al. An Fc engineering approach that modulates antibody-dependent cytokine release without altering cell-killing functions. MAbs, 2015, 7(3): 494–504. DOI: 10.1080/19420862.2015.1022692 |
| [3] | Muyldermans S, Lauwereys M. Unique single-domain antigen binding fragments derived from naturally occurring camel heavy-chain antibodies. J Mol Recognit, 1999, 12(2): 131–140. DOI: 10.1002/(ISSN)1099-1352 |
| [4] | Blanc MR, Anouassi A, Ahmed AM, et al. A one-step exclusion-binding procedure for the purification of functional heavy-chain and mammalian-type gamma-globulins from camelid sera. Biotechnol Appl Biochem, 2009, 54(4): 207–212. DOI: 10.1042/BA20090208 |
| [5] | De Simone EA, Saccodossi N, Ferrari A, et al. Development of ELISAs for the measurement of IgM and IgG subclasses in sera from llamas (Lama glama) and assessment of the humoral immune response against different antigens. Vet Immunol Immunopathol, 2008, 126(1/2): 64–73. |
| [6] | Greenberg AS, Avila D, Hughes M, et al. A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks. Nature, 1995, 374(6518): 168–173. DOI: 10.1038/374168a0 |
| [7] | Muyldermans S. Nanobodies: natural single-domain antibodies. Annu Rev Biochem, 2013, 82(1): 775–797. DOI: 10.1146/annurev-biochem-063011-092449 |
| [8] | Harmsen MM, Ruuls RC, Nijman IJ, et al. Llama heavy-chain V regions consist of at least four distinct subfamilies revealing novel sequence features. Mol Immunol, 2000, 37(10): 579–590. DOI: 10.1016/S0161-5890(00)00081-X |
| [9] | Dumoulin M, Conrath K, Van Meirhaeghe A, et al. Single-domain antibody fragments with high conformational stability. Protein Sci, 2002, 11(3): 500–515. |
| [10] | Hussack G, Hirama T, Ding W, et al. Engineered single-domain antibodies with high protease resistance and thermal stability. PLoS ONE, 2011, 6(11): e28218. DOI: 10.1371/journal.pone.0028218 |
| [11] | Hussack G, Mackenzie CR, Tanha J. Characterization of single-domain antibodies with an engineered disulfide bond//Saerens D, Muyldermans S, Eds. Single Domain Antibodies. Totowa, NJ: Humana Press, 2012, 911: 417-429. |
| [12] | Saerens D, Conrath K, Govaert J, et al. Disulfide bond introduction for general stabilization of immunoglobulin heavy-chain variable domains. J Mol Biol, 2008, 377(2): 478–488. DOI: 10.1016/j.jmb.2008.01.022 |
| [13] | Detalle L, Stohr T, Palomo C, et al. Generation and characterization of ALX-0171, a potent novel therapeutic nanobody for the treatment of respiratory syncytial virus infection. Antimicrob Agents Chemother, 2015, 60(1): 6–13. |
| [14] | Crasson O, Rhazi N, Jacquin O, et al. Enzymatic functionalization of a nanobody using protein insertion technology. Protein Eng Des Sel, 2015, 28(10): 451–460. DOI: 10.1093/protein/gzv020 |
| [15] | De Genst E, Chan PH, Pardon E, et al. A nanobody binding to non-amyloidogenic regions of the protein human lysozyme enhances partial unfolding but inhibits amyloid fibril formation. J Phys Chem B, 2013, 117(42): 13245–13258. DOI: 10.1021/jp403425z |
| [16] | Sheehan J, Marasco WA. Phage and yeast display. Microbiol Spectr, 2015, 3(1): AID-0028-2014. |
| [17] | Moutel S, Bery N, Bernard V, et al. NaLi-H1: a universal synthetic library of humanized nanobodies providing highly functional antibodies and intrabodies. eLife, 2016, 5: e16228. DOI: 10.7554/eLife.16228 |
| [18] | Gera N, Hussain M, Rao BM. Protein selection using yeast surface display. Methods, 2013, 60(1): 15–26. DOI: 10.1016/j.ymeth.2012.03.014 |
| [19] | Lipke PN, Kurjan J. Sexual agglutination in budding yeasts: structure, function, and regulation of adhesion glycoproteins. Microbiol Rev, 1992, 56(1): 180–194. |
| [20] | Boder ET, Raeeszadeh-Sarmazdeh M, Price JV. Engineering antibodies by yeast display. Arch Biochem Biophys, 2012, 526(2): 99–106. DOI: 10.1016/j.abb.2012.03.009 |
| [21] | Chao G, Lau WL, Hackel BJ, et al. Isolating and engineering human antibodies using yeast surface display. Nat Protoc, 2006, 1(2): 755–768. DOI: 10.1038/nprot.2006.94 |
| [22] | Benatuil L, Perez JM, Belk J, et al. An improved yeast transformation method for the generation of very large human antibody libraries. Protein Eng Des Sel, 2010, 23(4): 155–159. DOI: 10.1093/protein/gzq002 |
| [23] | Mazor Y, van Blarcom T, Mabry R, et al. Isolation of engineered, full-length antibodies from libraries expressed in Escherichia coli. Nat Biotechnol, 2007, 25(5): 563–565. DOI: 10.1038/nbt1296 |
| [24] | Harvey BR, Georgiou G, Hayhurst A, et al. Anchored periplasmic expression, a versatile technology for the isolation of high-affinity antibodies from Escherichia coli-expressed libraries. Proc Natl Acad Sci USA, 2004, 101(25): 9193–9198. DOI: 10.1073/pnas.0400187101 |
| [25] | Salema V, Marín E, Martínez-Arteaga R, et al. Selection of single domain antibodies from immune libraries displayed on the surface of E. coli cells with two β-domains of opposite topologies. PLoS ONE, 2013, 8(9): e75126. DOI: 10.1371/journal.pone.0075126 |
| [26] | Salema V, López-Guajardo A, Gutierrez C, et al. Characterization of nanobodies binding human fibrinogen selected by E. coli display. J Biotechnol, 2016, 234: 58–65. DOI: 10.1016/j.jbiotec.2016.07.025 |
| [27] | Salema V, Mañas C, Cerdán L, et al. High affinity nanobodies against human epidermal growth factor receptor selected on cells by E. coli display. MAbs, 2016, 8(7): 1286–1301. DOI: 10.1080/19420862.2016.1216742 |
| [28] | Fleetwood F, Devoogdt N, Pellis M, et al. Surface display of a single-domain antibody library on Gram-positive bacteria. Cell Mol Life Sci, 2013, 70(6): 1081–1093. DOI: 10.1007/s00018-012-1179-y |
| [29] | Ries J, Kaplan C, Platonova E, et al. A simple, versatile method for GFP-based super-resolution microscopy via nanobodies. Nat Methods, 2012, 9(6): 582–584. DOI: 10.1038/nmeth.1991 |
| [30] | Beghein E, Gettemans J. Nanobody technology: a versatile toolkit for microscopic imaging, protein-protein interaction analysis, and protein function exploration. Front Immunol, 2017, 8: 771. DOI: 10.3389/fimmu.2017.00771 |
| [31] | Chamma I, Letellier M, Butler C, et al. Mapping the dynamics and nanoscale organization of synaptic adhesion proteins using monomeric streptavidin. Nat Commun, 2016, 7: 10773. DOI: 10.1038/ncomms10773 |
| [32] | Platonova E, Winterflood CM, Junemann A, et al. Single-molecule microscopy of molecules tagged with GFP or RFP derivatives in mammalian cells using nanobody binders. Methods, 2015, 88: 89–97. DOI: 10.1016/j.ymeth.2015.06.018 |
| [33] | Szymborska A, de Marco A, Daigle N, et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science, 2013, 341(6146): 655–658. DOI: 10.1126/science.1240672 |
| [34] | Rasmussen SGF, Choi HJ, Fung JJ, et al. Structure of a nanobody-stabilized active state of the β2 adrenoceptor. Nature, 2011, 469(7329): 175–180. DOI: 10.1038/nature09648 |
| [35] | Saleh N, Ibrahim P, Clark T. Differences between G-protein-stabilized agonist-GPCR complexes and their nanobody-stabilized equivalents. Angew Chem Int Ed, 2017, 56(31): 9008–9012. DOI: 10.1002/anie.201702468 |
| [36] | Ring AM, Manglik A, Kruse AC, et al. Adrenaline-activated structure of β2-adrenoceptor stabilized by an engineered nanobody. Nature, 2013, 502(7472): 575–579. DOI: 10.1038/nature12572 |
| [37] | Staus DP, Strachan RT, Manglik A, et al. Allosteric nanobodies reveal the dynamic range and diverse mechanisms of G-protein-coupled receptor activation. Nature, 2016, 535(7612): 448–452. DOI: 10.1038/nature18636 |
| [38] | Balhuizen A, Massa S, Mathijs I, et al. A nanobody-based tracer targeting DPP6 for non-invasive imaging of human pancreatic endocrine cells. Sci Rep, 2017, 7: 15130. DOI: 10.1038/s41598-017-15417-2 |
| [39] | Broos K, Keyaerts M, Lecocq Q, et al. Non-invasive assessment of murine PD-L1 levels in syngeneic tumor models by nuclear imaging with nanobody tracers. Oncotarget, 2017, 8(26): 41932–41946. |
| [40] | Hu YZ, Liu CX, Muyldermans S. Nanobody-based delivery systems for diagnosis and targeted tumor therapy. Front Immunol, 2017, 8: 1442. DOI: 10.3389/fimmu.2017.01442 |
| [41] | Ahani R, Roohvand F, Cohan RA, et al. Sindbis virus-pseudotyped lentiviral vectors carrying VEGFR2-specific nanobody for potential transductional targeting of tumor vasculature. Mol Biotechnol, 2016, 58(11): 738–747. DOI: 10.1007/s12033-016-9973-7 |
| [42] | Behdani M, Zeinali S, Karimipour M, et al. Development of VEGFR2-specific Nanobody Pseudomonas exotoxin A conjugated to provide efficient inhibition of tumor cell growth. N Biotechnol, 2013, 30(2): 205–209. |
| [43] | Wang YY, Wang YD, Chen GJ, et al. Quantum-dot-based theranostic micelles conjugated with an Anti-EGFR nanobody for triple-negative breast cancer therapy. ACS Appl Mater Interfaces, 2017, 9(36): 30297–30305. DOI: 10.1021/acsami.7b05654 |
| [44] | Ma L, Gu K, Zhang CH, et al. Generation and characterization of a human nanobody against VEGFR-2. Acta Pharmacol Sin, 2016, 37(6): 857–864. DOI: 10.1038/aps.2016.2 |
| [45] | Farasat A, Rahbarizadeh F, Hosseinzadeh G, et al. Affinity enhancement of nanobody binding to EGFR: in silico site-directed mutagenesis and molecular dynamics simulation approaches. J Biomol Struct Dyn, 2017, 35(8): 1710–1728. DOI: 10.1080/07391102.2016.1192065 |
| [46] | Deng CM, Xiong JN, Gu XF, et al. Novel recombinant immunotoxin of EGFR specific nanobody fused with cucurmosin, construction and antitumor efficiency in vitro. Oncotarget, 2017, 8(24): 38568–38580. |
| [47] | Tang JL, Li JL, Zhu XJ, et al. Novel CD7-specific nanobody-based immunotoxins potently enhanced apoptosis of CD7-positive malignant cells. Oncotarget, 2016, 7(23): 34070–34083. |
| [48] | Bartunek J, Barbato E, Heyndrickx G, et al. Novel antiplatelet agents: ALX-0081, a nanobody directed towards von Willebrand factor. J Cardiovasc Transl Res, 2013, 6(3): 355–363. DOI: 10.1007/s12265-012-9435-y |
| [49] | Momi S, Tantucci M, Van Roy M, et al. Reperfusion of cerebral artery thrombosis by the GPIb-VWF blockade with the Nanobody ALX-0081 reduces brain infarct size in guinea pigs. Blood, 2013, 121(25): 5088–5097. DOI: 10.1182/blood-2012-11-464545 |
| [50] | Peyvandi F, Scully M, Hovinga JAK, et al. Caplacizumab for acquired thrombotic thrombocytopenic purpura. N Engl J Med, 2016, 374(6): 511–522. DOI: 10.1056/NEJMoa1505533 |
| [51] | Peyvandi F, Scully M, Hovinga JAK, et al. Caplacizumab reduces the frequency of major thromboembolic events, exacerbations and death in patients with acquired thrombotic thrombocytopenic purpura. J Thromb Haemost, 2017, 15(7): 1448–1452. DOI: 10.1111/jth.2017.15.issue-7 |
| [52] | Holz JB. The TITAN trial-assessing the efficacy and safety of an anti-von Willebrand factor Nanobody in patients with acquired thrombotic thrombocytopenic purpura. Transfus Apher Sci, 2012, 46(3): 343–346. DOI: 10.1016/j.transci.2012.03.027 |
| [53] | Zhang F, Wei HD, Wang XX, et al. Structural basis of a novel PD-L1 nanobody for immune checkpoint blockade. Cell Discov, 2017, 3: 17004. DOI: 10.1038/celldisc.2017.4 |
| [54] | de Bruin RCG, Veluchamy JP, Lougheed SM, et al. A bispecific nanobody approach to leverage the potent and widely applicable tumor cytolytic capacity of Vγ9Vδ2-T cells. Oncoimmunology, 2017, 7(1): e1375641. |
| [55] | Shin YJ, Park SK, Jung YJ, et al. Nanobody-targeted E3-ubiquitin ligase complex degrades nuclear proteins. Sci Rep, 2015, 5: 14269. DOI: 10.1038/srep14269 |
| [56] | Ordóñez A, Pérez J, Tan L, et al. A single-chain variable fragment intrabody prevents intracellular polymerization of Z α1-antitrypsin while allowing its antiproteinase activity. FASEB J, 2015, 29(6): 2667–2678. DOI: 10.1096/fj.14-267351 |
| [57] | Thammasit P, Sangboonruang S, Suwanpairoj S, et al. Intracellular acidosis promotes mitochondrial apoptosis pathway: role of EMMPRIN down-regulation via specific single-chain Fv intrabody. J Cancer, 2015, 6(3): 276–286. DOI: 10.7150/jca.10879 |
 2018, Vol. 34
2018, Vol. 34