中国科学院微生物研究所、中国微生物学会主办
文章信息
- 孙亚楠, 陈纳, 王雪飞, 陈吉龙, 马燕梅
- Sun Yanan, Chen Na, Wang Xuefei, Chen Ji-Long, Ma Yanmei
- Bcr-Abl癌基因与A-MuLV病毒诱导肿瘤发生的机理
- Mechanism underlying tumorigenesis induced by Bcr-Abl oncogene and A-MuLV virus
- 生物工程学报, 2018, 34(12): 1943-1952
- Chinese Journal of Biotechnology, 2018, 34(12): 1943-1952
- 10.13345/j.cjb.180183
-
文章历史
- Received: May 5, 2018
- Accepted: June 29, 2018
2 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室, 北京 100101
2 CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
近年来,针对由Abl癌蛋白诱导肿瘤的分子靶向治疗主要着眼于对Abl抑制剂的研究与开发,在临床上颇有疗效。但人们逐渐发现,传统疗法仍存在一定的局限性。例如,Abl癌基因可产生各种耐药突变以逃逸药物的靶向结合,从而恢复持续活化的激酶活性。因此,许多研究团队将目光转向Abl信号下游的多种关键节点分子,以寻求治疗肿瘤的新思路。Steelman等[1]研究表明,Abl癌蛋白具有极强的非受体酪氨酸激酶活性,可持续活化多条通路,以调控细胞增殖、抗细胞凋亡等相关蛋白,最终诱导肿瘤发生。本文结合了笔者实验室的研究,对Abl癌蛋白调控相关的3条信号通路(JAK/STAT/Pim、PI3K/AKT/mTOR、RAS/RAF/MEK)的活化进而调控肿瘤发生过程进行综述,有助于了解Abl癌基因诱导肿瘤发生的分子机理,为寻找治疗肿瘤的新靶点提供理论基础。
1 Bcr-Abl癌基因与A-MuLV病毒1960年,Nowell和Hungerford首次从慢性髓细胞白血病(Chronic myeloid leukemia,CML)患者的白血病细胞中发现了一条异常的、截短的22号染色体,命名为费城染色体(Philadelphia chromosome,Ph)[2]。随后,Rowley证明Ph染色体是由正常定位于9q34上的c-Abl基因和位于22q11上的Bcr基因,因t (9;22) (q34;q11)易位使相应断裂的基因发生融合,形成的Bcr-Abl嵌合基因[3]。Bcr是一种丝氨酸/苏氨酸激酶,其羧基端具有GTP酶活性。Abl是一种酪氨酸激酶,穿梭于细胞核和细胞质之间,并在许多组织中表达。在正常情况下,c-Abl能够传递来自配体刺激的生长因子受体的信号,影响细胞骨架结构和其他细胞表型[4]。染色体易位的特异性断点导致Bcr/Abl蛋白产生3种不同的形式:p190 Bcr-Abl、p210 Bcr-Abl和p230 Bcr-Abl,所有这些都具有组成型Abl激酶活性,可以诱导免疫细胞的恶性转化,引发不同类型白血病[5]。
1970年,Abelson首次从Moloney鼠白血病病毒(Moloney murine leukemia virus,M-MuLV)感染小鼠的淋巴肉瘤中分离鉴定出一种复制缺陷型逆转录病毒,命名为Abelson鼠白血病病毒(Abelson murine leukemia virus,A-MuLV)[6]。A-MuLV是一种单股正链RNA病毒,能诱导小鼠淋巴细胞转化,导致小鼠Abelson白血病的发生[7]。A-MuLV的特有性质是能够在体内促进淋巴瘤的快速发生发展,并能在体外诱导骨髓、脾脏、胎儿肝脏成纤维细胞和造血细胞的转化,而且A-MuLV转化的淋巴细胞具有前B淋巴细胞的特征[8]。v-Abl是A-MuLV的癌基因,在A-MuLV病毒进化过程中由A-MuLV的Gag基因替换细胞原癌基因c-Abl的SH3区而形成。因此,v-Abl能够编码一个含有A-MuLV Gag序列、SH2结构域和SH1 (酪氨酸激酶区)的融合蛋白。v-Abl蛋白主要位于宿主细胞的细胞质[9],具有较强的酪氨酸激酶活性,可以诱导细胞的转化[10]。
2 JAK/STAT/Pim信号通路 2.1 JAK/STAT/Pim信号通路的简介JAK/STAT/Pim信号通路由4个主要成分组成:Janus酪氨酸激酶(Janus family of tyrosine kinase,JAK)、信号转导和转录活化因子(Signal transducer and activator of transcription,STAT)、丝氨酸/苏氨酸激酶Pim家族(Proviral insertion in murine,Pim)和细胞因子信号抑制因子(Suppressor of cytokine signaling,SOCS)。哺乳动物中JAK家族成员共有4个:JAK1、JAK2、JAK3和Tyk2[11]。JAK蛋白有7个同源结构域JH1–JH7,其中JH1具有激酶功能。STAT家族已经鉴定出7个成员:STAT1–4、STAT5a、STAT5b和STAT6,其主要包含氨基端保守域、coiled-coil结构域、DNA结构域、SH2结构域和羧基端的转录激活结构域[12]。Pim激酶家族共有3个成员:Pim-1、Pim-2以及Pim-3,Pim-1基因最早是作为M-Mu-LV的前病毒插入位点而被发现[13]。SOCS家族目前有8个成员,分别是CIS、SOCS1–SOCS7,它们的中间段都有一个保守SH2结构域,羧基端为一个保守结构域SOCS Box。SOCS Box的功能与泛素化降解有关,能够募集泛素转移酶系统。当SOCS通过SH2结构域或其他区域与靶分子结合后,SOCS Box可以与Elongins B/C、Cullin-5、Rbx-1等分子结合,从而介导靶向分子的降解[14]。
JAK/STAT/Pim信号通路涉及从细胞因子受体到细胞核的信号传导。JAK通过细胞因子与其受体结合被激活,激活的JAK将STAT招募至细胞因子受体处使其磷酸化,磷酸化的STAT形成同源或者异源二聚体进入细胞核,启动一系列基因的转录,其中转录出来的SOCS基因作为负反馈因子负调控JAK/STAT/Pim信号通路的活性。研究证实,在许多实体瘤以及白血病和淋巴瘤等肿瘤细胞中,JAK/STAT/Pim信号通路的持续激活与其发生发展密切相关[15-16]。
2.2 Bcr-Abl、v-Abl能够调控JAK/STAT/Pim信号通路的活化以诱导肿瘤的发生Bcr-Abl作为持续活化的非受体酪氨酸激酶,借助自身SH1激酶特性,活化JAK2,后者通过其JH1激酶区进一步磷酸化STAT5[17]。有研究表明,STAT5的酪氨酸磷酸化也可以不依赖于JAK2的活化,而是被Bcr-Abl直接活化[18]。另外,癌蛋白v-Abl可以使得JAK1处于持续活化的水平,进而活化下游蛋白STAT1和STAT5[19]。经活化的STAT5,可通过其SH2结构域,与另一个STAT5蛋白中磷酸化的酪氨酸相互作用形成二聚体,靶向进入细胞核,并通过其DNA结构域,调控下游基因比如Pim-1、Pim-2基因的表达[20]。本实验团队首次鉴定出eIF4B在Bcr-Abl、A-MuLV转化细胞中,可以作为Pim激酶的一个底物分子。被Pim激酶磷酸化的eIF4B加快了5′UTR具有复杂二级结构的mRNA的翻译,促进细胞增殖并抑制细胞凋亡,进而促进Abl癌蛋白诱导的细胞恶性转化[21]。其中,Pim-1、Pim-2都可上调eIF4B的Ser406和Ser422位点的磷酸化水平,且主要磷酸化位点为eIF4B Ser422,而Pim-3对eIF4B磷酸化的作用不大[21]。除此之外,eIF4B还可以被PI3K/AKT/mTOR和RAS/RAF/MEK信号通路激活,在细胞增殖和抗细胞凋亡中起重要作用[22]。
正常生理状态下,SOCS蛋白可以通过其SH2区结合JAK和细胞因子受体,竞争性抑制STAT与受体的结合,导致STAT不能被JAK激酶磷酸化。同时,SOCS蛋白利用其SOCS box与Elongin B/C复合物等结合,介导与其相连蛋白的泛素化降解。此外,SOCS1和SOCS3可利用其激酶抑制区KIR (Kinase inhibitory region)与JAK直接互作,从而抑制JAKs的激酶活性[23]。研究表明,v-Abl癌蛋白可磷酸化SOCS-1以破坏其负调节JAK的功能,使得JAK1处于持续活化的状态[19]。我们的研究团队还发现,Bcr-Abl癌蛋白可以通过磷酸化SOCS-1的Tyr155、Tyr204和SOCS-3的Tyr211残基使其失去负调节JAK/STAT/Pim信号通路的功能,阐明了Bcr-Abl介导细胞转化的机理[23]。此外,最近的研究报道显示,A-MuLV转化的细胞中,表达上调的Pim-1、Pim-2激酶也可通过磷酸化SOCS1导致细胞的恶性增殖[24]。
肿瘤的发生与细胞周期和细胞抗凋亡作用有着密切联系。细胞周期的缩短,可加快细胞增殖,而抗凋亡特性则有利于癌变中的细胞免受机体的自杀性清除。de Groot等[25]在表达Bcr-Abl的BaF3细胞中发现,抗凋亡蛋白Bcl-xL的基因启动子上存在多个STATs结合位点,活化的STAT5可直接与Bcl-xL启动子结合而启动转录。Yang等[21]研究报道,Bcr-Abl阳性细胞中,持续活化的Pim-1、Pim-2激酶还可通过磷酸化eIF4B,加快与抗凋亡相关的mRNA (如Bcl-2)的翻译,最终诱导肿瘤发生。
3 PI3K/AKT/mTOR信号通路 3.1 PI3K/AKT/mTOR信号通路的简介磷脂酰肌醇3-激酶(Phosphatidylinositol-3-kinase,PI3K)家族由多个类型分子构成,每个分子都由调节亚基和催化亚基组合成异源二聚体。调节亚基主要由氨基末端SH3结构域、断裂点簇区域同源结构域(BCR)、脯氨酸富集区、interSH2 (iSH2)结构域和羧基末端SH2结构域组成[26]。而催化亚基包含p110亚基结构域、RAS结合域、激酶结构域及螺旋结构域。PI3K的调节亚基负责与上游的激酶结合,催化亚基具有激酶活性。丝氨酸/苏氨酸蛋白激酶(AKT)家族主要包括3个成员:AKT1、AKT 2和AKT 3,其主要由氨基端的调节区(Pleckstrin homology,PH区)、中间的激酶区及羧基端的尾部调节区构成。其中,调节区能够和脂质结合,将相关蛋白质定位在细胞膜,并磷酸化一系列特异性底物[27]。雷帕霉素的哺乳动物靶点(Mammalian target of rapamycin,mTOR)是一种丝/苏氨酸蛋白激酶,属于PI3K蛋白家族,在生物体内以两种复合物的形式存在,即mTORC1及mTORC2。p70S6K激酶是mTOR激酶下游的一个重要效应分子,具有多个磷酸化位点,可在mTOR和磷脂酰肌醇依赖激酶(Phosphoinositide- dependent kinase,PDK)的协同作用下而活化[22]。
PI3K/AKT/mTOR信号通路是一条由细胞刺激、毒物损害等激活的细胞内信号传导途径,与转录、翻译、增殖、生长和凋亡等相关[1, 28]。IL-3受体、Grb2和Ras等能够与PI3K结合,使其从细胞质转移到细胞膜并激活,进而在质膜上产生PIP和PIP3。其中,PIP被磷酸酶如PTEN降解,而PIP3与AKT结合并激活PDK,导致AKT的激活并使其激活mTOR等下游底物[1]。PI3K/AKT/mTOR信号通路的异常激活与肺癌、乳腺癌、卵巢癌和白血病等多种肿瘤的发生有关[29-30]。
3.2 Bcr-Abl、v-Abl能够调控PI3K/AKT/mTOR信号通路的活化以诱导肿瘤的发生Bcr-Abl酪氨酸激酶在Grb2等衔接蛋白的帮助下,能够激活PI3K从细胞质到细胞膜的转移过程,并通过与PI3K的p85调节亚基结合,磷酸化p110催化亚基而将其活化,进而激活PI3K/AKT/mTOR信号通路[31]。研究证明v-Abl也与PI3K相关并介导其活化,但具体活化机制还在探索中[32]。经活化的PI3K,其p110催化亚基会识别磷脂酰肌醇二磷酸(PIP2),并将其磷酸化成为PIP3。PIP3的PH结构域为下游蛋白提供锚定位点,可募集含有PH结构域的AKT与PDK1激酶至细胞膜附近[33]。AKT的完全活化需要PDK的参与,PDK-1只能使Thr308位点磷酸化,而对Ser473位点无直接作用,但AKT的PH区与PIP3等脂质产物的高亲和力结合促进了PDK1/PDK2复合体的形成,激活Ser473位点的磷酸化作用,只有AKT的Ser473和Thr308都被磷酸化才能充分发挥其功能[34-35]。
正常情况下,TSC-1和TSC-2形成二聚体复合物,抑制小GTP酶Rheb的活性,而Rheb是mTOR活化所必需的刺激蛋白,因此TSC-1/TSC-2在正常情况下抑制mTOR的功能。当AKT活化后,它可磷酸化TSC-2的Ser939和Thr1462,抑制了TSC-1/TSC-2复合物的形成,从而解除了对Rheb的抑制作用,使得mTOR被激活[36]。活化的mTOR可进一步激活p70S6K激酶。Bcr-Abl、v-Abl转化细胞中,p70S6K激酶可直接磷酸化底物eIF4B的Ser422位点[22]。另外,AKT激酶可不依赖于经典的Akt/mTOR/p70S6K途径,而是通过直接磷酸化eIF4B的Ser422位点,促进相关mRNA的翻译,最终诱导肿瘤发生[22]。
3.2.1 Bcr-Abl能够影响PI3K/Akt/mTOR信号通路调控的细胞周期进程以诱导肿瘤的形成Bcr-Abl导致PI3K/AKT/mTOR信号通路的持续活化,可通过以下两种方式调控细胞周期相关分子,进而缩短细胞周期,加快细胞增殖,最终诱导肿瘤生成。
第一,促进细胞周期正调控因子Cyclin的转录与翻译。de Mattos等[37]报道,表达Bcr-Abl的细胞系BV173中,活化的AKT激酶可通过磷酸化FoxO3a,抑制由其介导的转录抑制因子Bcl-6的表达,进而促进细胞周期正调控因子CyclinD2的转录。Prabhu等[38]证实,多种Bcr-Abl表达的细胞中,活化的mTORC1可通过磷酸化调节mRNA翻译起始过程的4E-BP1的活性,最终加快CyclinD3 mRNA的翻译,以促进细胞周期进程。
第二,抑制细胞周期负调控因子的表达。Gesbert等[39]研究表明,在Bcr-Abl阳性细胞中,活化的AKT激酶,可通过抑制细胞周期负调控因子p27的表达,来解除其对Cyclin D1-CDK复合物的抑制作用,使细胞通过G1/S期转化的位点,最终促进细胞周期进程。
3.2.2 Bcr-Abl能够影响PI3K/AKT/mTOR信号通路调控的凋亡发生过程以诱导肿瘤的形成此外,由Bcr-Abl持续活化的PI3K/AKT/ mTOR信号通路,还可通过以下3种方式调控抗细胞凋亡相关分子,进而抑制细胞凋亡,最终诱导肿瘤生成。
第一,抑制促凋亡基因的转录。FoxO转录因子家族主要存在于细胞核内,通过结合到特异顺式作用元件促进Bim等细胞凋亡相关基因的转录。Essafi等[40]在表达Bcr-Abl的BaF3细胞中发现,活化的Akt激酶可磷酸化FoxO3转录因子使之与抗凋亡结合蛋白14-3-3相结合而停留在细胞质内,以此抑制由其介导的促凋亡基因的转录。
第二,加快抗凋亡蛋白的合成。Carayol等[41]证实,依赖Bcr-Abl持续活化的p70S6K激酶可通过磷酸化PDCD4 Ser67,使其泛素化降解,从中释放的eIF4A在转录起始前复合物处结合于eIF4G,加快抗凋亡蛋白的合成。
第三,抑制促凋亡蛋白的活性与释放抗凋亡蛋白。Trotta等[42]观察到,在表达Bcr-Abl的骨髓前体细胞系中,存在p53下调与MDM2 (p53的负调节蛋白)显著表达的现象,说明依赖Bcr-Abl持续活化的某个或多个关键节点分子,可磷酸化p53的负调控蛋白MDM2,以促进p53的失活,从而抑制p53介导的促凋亡反应。而在此之前,Mayo等[43]已证实MDM2是PI3K/Akt途径中AKT的底物。综合两项研究,我们推测依赖Bcr-Abl持续活化的AKT激酶有可能通过磷酸化MDM2以调控p53的活性,最终抑制细胞凋亡,但具体机制尚待阐明。此外,Neshat等[44]报道,Bcr-Abl阳性细胞中活化的AKT可磷酸化原先与Bcl-2或Bcl-xL结合的凋亡前体蛋白Bad,使其与抗凋亡结合蛋白14-3-3结合,进而释放游离的抗凋亡蛋白Bcl-2、Bcl-xL,发挥抗凋亡的作用。
4 RAS/RAF/MEK信号通路 4.1 RAS/RAF/MEK信号通路的简介RAS家族共有3个成员,分别为H-RAS、N-RAS和K-RAS,定位于细胞膜内侧,正常情况下为与GDP结合的非活化状态,与GTP结合后则变成活化状态[45]。RAF是一种丝氨酸/苏氨酸蛋白激酶,有RAF-1、A-RAF和B-RAF三种类型,目前研究较多的是RAF-1,其在细胞增殖、抗凋亡中有重要作用。RAF的分子结构中含有CR1、CR2和CR3共3个保守区,CR1区是活化的RAS与RAF蛋白激酶结合的主要部位;CR3区具有激酶催化功能,能与下游MEK激酶结合,并将其活化。MEK分为MEK1和MEK2两种,属于少有的酪氨酸和苏氨酸/丝氨酸双重特异性蛋白激酶[46],分子结构中有一段富含脯氨酸的区域,其为RAF与MEK的结合部位。
RAS/RAF/MEK信号通路是一个中心信号转导通路,它将来自多个细胞表面受体的信号传递到核内的转录因子[47],该通路又被称为MAP激酶途径。
4.2 Bcr-Abl、v-Abl能够调控RAS/RAF/ MEK信号通路的活化以诱导肿瘤的发生Bcr-Abl与RAS之间存在着一些接头分子负责传递信号,如Grb2、Shc等,其中研究较为深入的是Grb2,它可通过SH2结构域与Bcr-Abl中Bcr蛋白的Tyr177位点结合,并通过其SH3结构域,与核苷酸交换因子Sos的脯氨酸富集序列结合,形成Bcr-Abl-Grb2-Sos复合物,进而使RAS-GDP转换为RAS-GTP,活化RAS激酶,以此激活RAS/RAF/MEK信号通路[48]。而v-Abl则与Shc/Grb2、Sos形成v-Abl-Shc-Grb2-Sos复合物,进而激活RAS激酶[48]。
RAF的CR1区通过与RAS结合而被募集到细胞膜上,并在涉及磷酸化和多种辅因子的复杂过程中被激活,这些复杂过程尚未被完全理解[46]。活化后的RAF与MEK富含脯氨酸的一段区域结合,通过其CR3激酶区磷酸化MEK的丝氨酸和苏氨酸位点将其激活[49]。MEK属于少有的双重特异性激酶,使ERK的酪氨酸和苏氨酸两个调节位点磷酸化而将其激活[49]。活化的ERK可在PDK1等激酶的帮助下激活RSK。研究表明,Bcr-Abl和v-Abl转化细胞中,RSK激酶可直接磷酸化eIF4B的Ser422位点,促进相关mRNA的翻译,最终诱导肿瘤发生[22],至于是否包括Bcl-2等抗凋亡分子的mRNA,有待实验进一步验证。
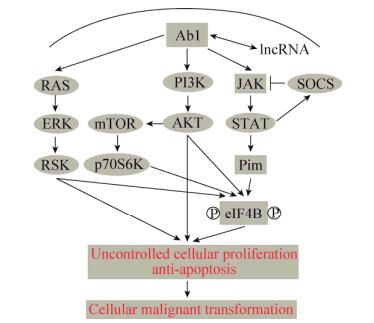
5 总结与展望Bcr-Abl癌基因和A-MuLV病毒诱导肿瘤发生是一个极其复杂的生物学过程,涉及到许多与细胞增殖和凋亡相关信号通路的异常调控。本团队与前人研究成果发现,依赖Abl (如Bcr-Abl、v-Abl)持续活化的JAK/STAT/Pim、PI3K/AKT/mTOR、RAS/RAF/MEK信号通路可以激活下游Pim、AKT、p70S6K、RSK激酶的共同底物分子eIF4B,以此加强5′-cap具有复杂二级结构的mRNA (包含一些细胞周期调控因子和抗凋亡分子)的翻译[21-22],从而促进细胞增殖并抑制细胞凋亡(图 1)。此外,Abl癌蛋白诱导肿瘤发生也可不依赖于eIF4B,而通过调控细胞周期和抗细胞凋亡的相关蛋白促进细胞的增殖并抑制凋亡,诱导细胞转化,最终形成肿瘤[37-44]。除了重要蛋白在调控Bcr-Abl癌基因和A-MuLV病毒诱导的肿瘤发生过程发挥重要作用,我们的研究表明长链非编码RNA (Long noncoding RNA,lncRNA)也参与其中。Guo等[50-51]利用lncRNA表达谱芯片技术筛选出了两条表达量变化显著且依赖Bcr-Abl的lncRNA,分别为lncRNA-BGL3和H19。深入研究发现,lncRNA-BGL3可以作为竞争性内源RNA (Competitive endogenous RNA,ceRNA)调控PTEN的表达,进而发挥抑癌功能,影响Abl肿瘤细胞的凋亡以及裸鼠体内诱导的肿瘤生长。干扰H19的表达能够促进Abl转化细胞的凋亡,并且抑制这些细胞在裸鼠体内的肿瘤生长。因此,我们的实验结果表明lncRNA-BGL3和H19在Bcr-Abl诱导细胞转化中均发挥重要作用,为Abl阳性肿瘤的治疗提供了有意义的参考。
|
| 图 1 Abl (如Bcr-Abl、v-Abl)癌基因诱导细胞恶性转化的机理 Figure 1 Mechanism underlying cellular malignant transformation induced by Abl oncogenes such as Bcr-Abl and v-Abl. Abl oncoprotein activates the JAK/STAT/Pim, PI3K/AKT/mTOR and RAS/ERK/RSK pathways, which enhances the cell proliferation and suppresses the cell apoptosis through eIF4B-dependent and eIF4B-independent pathways, thereby promoting the malignant transformation of targeting cells. |
| |
关于v-Abl癌基因诱导肿瘤发生与调控细胞周期、抗凋亡相联系的报道甚少。Guo等[52]首次发现AKT1中的E17K突变存在于部分v-Abl转化细胞中。随后的实验结果表明,与野生型AKT1相比,E17K突变体可以显著促进v-Abl癌蛋白介导的细胞转化,并可通过提高抗凋亡蛋白Bcl-2的表达水平和凋亡前体蛋白Bad的磷酸化水平,延缓由伊马替尼(Imatinib,Abl激酶抑制剂)介导的v-Abl转化细胞的凋亡,也因此证实了AKT1遗传变异与Abl介导淋巴细胞癌变的直接相关性。此外,Pim激酶可以通过磷酸化eIF4B以促进Bcr-Abl、v-Abl癌基因诱导的细胞转化,而且Shahbazian等[53]证明了eIF4B磷酸化可以特异性地上调特定mRNA的翻译,如Cdc25 (细胞周期调控因子)和Bcl-2 (抗凋亡分子)。因此我们推测,依赖v-Abl持续活化的eIF4B可能也通过与细胞周期调控因子和抗凋亡分子相互作用,最终诱导肿瘤的发生。参与v-Abl癌基因诱导细胞转化的具体分子还需进一步的研究去证实。
基于本实验团队前期已经证明eIF4B可作为Pim和Akt的共同底物分子,整合了Abl癌蛋白激活的JAK/STAT/Pim、PI3K/Akt/mTOR两条信号通路。我们发现,在Abl转化的细胞中长时间抑制一条通路能够显著促使另一条通路的活化,从而部分恢复eIF4B的磷酸化水平。因此,针对JAK/STAT/Pim和PI3K/Akt/mTOR中单一一条信号通路的抑制剂对Abl阳性细胞的杀伤效果极为有限[22]。我们将不同药物进行组合,同时阻断这两条通路,能够彻底有效地降低eIF4B的磷酸化,显著抑制了Abl癌蛋白诱导的肿瘤发生。这种两条信号通路抑制剂联用的协同疗法,为治疗Abl阳性肿瘤提供了新的思路[22]。临床研究发现,还有很多恶性肿瘤伴有JAK/STAT/Pim、PI3K/Akt/mTOR等通路的持续活化,如淋巴瘤、肺癌、乳腺癌等。eIF4B是否能在大多数临床肿瘤中发挥关键的作用,在相应癌症模型中能否通过同时阻断两条甚至多条相关通路来降低eIF4B的磷酸化从而抑制肿瘤生长,这些问题还有待进一步探究,这些研究将为肿瘤治疗提供新策略。
| [1] | Steelman LS, Pohnert SC, Shelton JG, et al. JAK/STAT, Raf/MEK/ERK, PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis. Leukemia, 2004, 18(2): 189–218. DOI: 10.1038/sj.leu.2403241 |
| [2] | Nowell PC, Hungerford DA. Minute chromosome in human chronic granulocytic leukemia. Science, 1960, 132(3438): 1497. |
| [3] | Gahrton G, Lindsten J, Zech L. Origin of the Philadelphia chromosome:tracing of chromosome 22 to parents of patients with chronic myelocytic leukemia. Exp Cell Res, 1973, 79(1): 246–247. DOI: 10.1016/0014-4827(73)90513-2 |
| [4] | Hernández SE, Krishnaswami M, Miller AL, et al. How do Abl family kinases regulate cell shape and movement?. Trends Cell Biol, 2004, 14(1): 36–44. DOI: 10.1016/j.tcb.2003.11.003 |
| [5] | Ross TS, Mgbemena VE. Re-evaluating the role of BCR/ABL in chronic myelogenous leukemia. Mol Cell Oncol, 2014, 1(3): e963450. DOI: 10.4161/23723548.2014.963450 |
| [6] | Abelson HT, Rabstein LS. Lymphosarcoma:virus-induced thymic-independent disease in mice. Cancer Res, 1970, 30(8): 2213–2222. |
| [7] | Rosenberg N, Baltimore D, Scher CD. In vitro transformation of lymphoid cells by Abelson murine leukemia virus. Proc Natl Acad Sci USA, 1975, 72(5): 1932–1936. DOI: 10.1073/pnas.72.5.1932 |
| [8] | Baltimore D. Abelson murine leukemia virus-induced transformation of immature lymphoid cells. Prog Clin Biol Res, 1979, 48(1): 3–22. |
| [9] | Yi CR, Rosenberg N. Gag influences transformation by Abelson murine leukemia virus and suppresses nuclear localization of the v-Abl protein. J Virol, 2007, 81(17): 9461–9468. DOI: 10.1128/JVI.00735-07 |
| [10] | Zou XM, Calame K. Signaling pathways activated by oncogenic forms of Abl tyrosine kinase. J Biol Chem, 1999, 274(26): 18141–18144. DOI: 10.1074/jbc.274.26.18141 |
| [11] | Kisseleva T, Bhattacharya S, Braunstein J, et al. Signaling through the JAK/STAT pathway, recent advances and future challenges. Gene, 2002, 285(1/2): 1–24. |
| [12] | Levy DE, Darnell Jr JE. Stats:transcriptional control and biological impact. Nat Rev Mol Cell Biol, 2002, 3(9): 651–662. DOI: 10.1038/nrm909 |
| [13] | Cuypers HT, Selten G, Quint W, et al. Murine leukemia virus-induced T-cell lymphomagenesis:integration of proviruses in a distinct chromosomal region. Cell, 1984, 37(1): 141–150. |
| [14] | Kamura T, Maenaka K, Kotoshiba S, et al. VHL-box and SOCS-box domains determine binding specificity for Cul2-Rbx1 and Cul5-Rbx2 modules of ubiquitin ligases. Genes Dev, 2004, 18(24): 3055–3065. DOI: 10.1101/gad.1252404 |
| [15] | Jatiani SS, Baker SJ, Silverman LR, et al. JAK/STAT pathways in cytokine signaling and myeloproliferative disorders:approaches for targeted therapies. Gene Cancer, 2010, 1(10): 979–993. DOI: 10.1177/1947601910397187 |
| [16] | Vainchenker W, Constantinescu SN. JAK/STAT signaling in hematological malignancies. Oncogene, 2013, 32(21): 2601–2613. DOI: 10.1038/onc.2012.347 |
| [17] | Warsch W, Walz C, Sexl V. JAK of all trades:JAK2-STAT5 as novel therapeutic targets in BCR-ABL1+ chronic myeloid leukemia. Blood, 2013, 122(13): 2167–2175. DOI: 10.1182/blood-2013-02-485573 |
| [18] | Hantschel OD, Eckelhart E, Kaupe I, et al. Bcr-Abl directly activates Stat5 independent of Jak2. Boold, 2010, 116: 511. |
| [19] | Limnander A, Danial NN, Rothman PB. v-Abl signaling disrupts SOCS-1 function in transformed pre-B cells. Mol Cell, 2004, 15(3): 329–341. DOI: 10.1016/j.molcel.2004.06.041 |
| [20] | Nieborowska-Skorska M, Hoser G, Kossev P, et al. Complementary functions of the antiapoptotic protein A1 and serine/threonine kinase pim-1 in the BCR/ABL-mediated leukemogenesis. Blood, 2002, 99(12): 4531–4539. DOI: 10.1182/blood.V99.12.4531 |
| [21] | Yang JL, Wang J, Chen K, et al. eIF4B phosphorylation by pim kinases plays a critical role in cellular transformation by Abl oncogenes. Cancer Res, 2013, 73(15): 4898–4908. DOI: 10.1158/0008-5472.CAN-12-4277 |
| [22] | Chen K, Yang JL, Li JN, et al. eIF4B is a convergent target and critical effector of oncogenic Pim and PI3K/Akt/mTOR signaling pathways in Abl transformants. Oncotarget, 2016, 7(9): 10073–10089. |
| [23] | Qiu XX, Guo GJ, Chen K, et al. A requirement for SOCS-1 and SOCS-3 phosphorylation in Bcr-Abl-induced tumorigenesis. Neoplasia, 2012, 14(6): 547–558. DOI: 10.1596/neo.12230 |
| [24] | Chen JL, Limnander A, Rothman PB. Pim-1 and Pim-2 kinases are required for efficient pre-B-cell transformation by v-Abl oncogene. Blood, 2008, 111(3): 1677–1685. |
| [25] | de Groot RP, Raaijmakers JAM, Lammers JWJ, et al. STAT5-dependent CyclinD1 and Bcl-xL expression in Bcr-Abl-transformed cells. Mol Cell Biol Res Commun, 2000, 3(5): 299–305. DOI: 10.1006/mcbr.2000.0231 |
| [26] | Escobedo JA, Navankasattusas S, Kavanaugh WM, et al. cDNA cloning of a Novel 85 kD protein that has SH2 domains and regulates binding of PI3-kinase to the PDGF β-receptor. Cell, 1991, 65(1): 75–82. |
| [27] | Haslam RJ, Koide HB, Hemmings BA. Pleckstrin domain homology. Nature, 1993, 363(6427): 309–310. |
| [28] | Franke TF, Hornik CP, Segev L, et al. PI3K/Akt and apoptosis:size matters. Oncogene, 2003, 22(56): 8983–8998. DOI: 10.1038/sj.onc.1207115 |
| [29] | Jiang BH, Liu LZ. Chapter 2 PI3K/PTEN signaling in angiogenesis and tumorigenesis. Adv Cancer Res, 2009, 102: 19–65. DOI: 10.1016/S0065-230X(09)02002-8 |
| [30] | Hennessy BT, Smith DL, Ram PT, et al. Exploiting the PI3K/AKT pathway for cancer drug discovery. Nat Rev Drug Discov, 2005, 4(12): 988–1004. DOI: 10.1038/nrd1902 |
| [31] | Ren SY, Xue F, Feng J, et al. Intrinsic regulation of the interactions between the SH3 domain of p85 subunit of phosphatidylinositol-3 kinase and the protein network of BCR/ABL oncogenic tyrosine kinase. Exp Hematol, 2005, 33(10): 1222–1228. DOI: 10.1016/j.exphem.2005.06.030 |
| [32] | Tang XW, Downes CP, Whetton AD, et al. Role of phosphatidylinositol 3-kinase and specific protein kinase B isoforms in the suppression of apoptosis mediated by the Abelson protein-tyrosine kinase. J Biol Chem, 2000, 275(17): 13142–13148. DOI: 10.1074/jbc.275.17.13142 |
| [33] | Asati V, Mahapatra DK, Bharti SK. PI3K/Akt/mTOR and Ras/Raf/MEK/ERK signaling pathways inhibitors as anticancer agents:structural and pharmacological perspectives. Eur J Med Chem, 2016, 109: 314–341. DOI: 10.1016/j.ejmech.2016.01.012 |
| [34] |
Niu GL, Zhang SY. PI3K/Akt signaling pathways and tumor.
Prog Mod Biom, 2010, 10(20): 3994–3996, 3390.
(in Chinese). 牛国梁, 张树友. PI3K/Akt信号传导通路与肿瘤. 现代生物医学进展, 2010, 10(20): 3994-3996, 3390. |
| [35] |
Guo L, Wang Q. Correlation of PI3K/Akt/mTOR signal pathway to infiltration and metastasis of malignant Tumor.
J Mod Onc, 2009, 17(8): 1585–1589.
(in Chinese). 郭琳, 王强. PI3K/Akt/mTOR信号传导通路与恶性肿瘤浸润和转移的研究进展. 现代肿瘤医学, 2009, 17(8): 1585-1589. DOI:10.3969/j.issn.1672-4992.2009.08.079 |
| [36] |
Zheng PS, Ji J. Advance in research on the relationship between mTOR signaling pathway and tumors.
J Xi?an Jiaotong Univ:Med Sci, 2010, 31(1): 1–9.
(in Chinese). 郑鹏生, 冀静. mTOR信号通路与肿瘤的研究进展. 西安交通大学学报:医学版, 2010, 31(1): 1-9. |
| [37] | de Mattos SF, Essafi A, Soeiro I, et al. FoxO3a and BCR-ABL regulate cyclin D2 transcription through a STAT5/BCL6-dependent mechanism. Mol Cell Biol, 2004, 24(22): 10058–10071. DOI: 10.1128/MCB.24.22.10058-10071.2004 |
| [38] | Prabhu S, Saadat D, Zhang M, et al. A novel mechanism for Bcr-Abl action:Bcr-Abl- mediated induction of the eIF4F translation initiation complex and mRNA translation. Oncogene, 2007, 26(8): 1188–1200. DOI: 10.1038/sj.onc.1209901 |
| [39] | Gesbert F, Sellers WR, Signoretti S, et al. BCR/ABL regulates expression of the cyclin-dependent kinase inhibitor p27Kip1 through the phosphatidylinositol 3-Kinase/AKT pathway. J Biol Chem, 2000, 275(50): 39223–39230. DOI: 10.1074/jbc.M007291200 |
| [40] | Essafi A, De Mattos SF, Hassen YAM, et al. Direct transcriptional regulation of Bim by FoxO3a mediates STI571-induced apoptosis in Bcr-Abl-expressing cells. Oncogene, 2005, 24(14): 2317–2329. DOI: 10.1038/sj.onc.1208421 |
| [41] | Carayol N, Katsoulidis E, Sassano A, et al. Suppression of programmed cell death 4 (PDCD4) protein expression by BCR-ABL-regulated engagement of the mTOR/p70 S6 kinase pathway. J Biol Chem, 2008, 283(13): 8601–8610. DOI: 10.1074/jbc.M707934200 |
| [42] | Trotta R, Vignudelli T, Candini O, et al. BCR/ABL activates mdm2 mRNA translation via the La antigen. Cancer Cell, 2003, 3(2): 145–160. |
| [43] | Mayo LD, Donner DB. A phosphatidylinositol 3-kinase/Akt pathway promotes translocation of Mdm2 from the cytoplasm to the nucleus. Proc Natl Acad Sci USA, 2001, 98(20): 11598–11603. DOI: 10.1073/pnas.181181198 |
| [44] | Neshat MS, Raitano AB, Wang HG, et al. The survival function of the Bcr-Abl oncogene is mediated by Bad-dependent and -independent pathways:roles for phosphatidylinositol 3-kinase and Raf. Mol Cell Biol, 2000, 20(4): 1179–1186. DOI: 10.1128/MCB.20.4.1179-1186.2000 |
| [45] | Khan AQ, Kuttikrishnan S, Siveen KS, et al. RAS-mediated oncogenic signaling pathways in human malignancies. Semin Cancer Biol, 2018. DOI: 10.1016/j.semcancer.2018.03.001 |
| [46] | Friday BB, Adjei AA. Advances in targeting the Ras/Raf/MEK/Erk mitogen-activated protein kinase cascade with MEK inhibitors for cancer therapy. Clin Cancer Res, 2008, 14(2): 342–346. DOI: 10.1158/1078-0432.CCR-07-4790 |
| [47] | Chang F, Steelman LS, Lee JT, et al. Signal transduction mediated by the Ras/Raf/MEK/ERK pathway from cytokine receptors to transcription factors:potential targeting for therapeutic intervention. Leukemia, 2003, 17(7): 1263–1293. DOI: 10.1038/sj.leu.2402945 |
| [48] | Cilloni D, Saglio G. Molecular pathways:BCR-ABL. Clin Cancer Res, 2012, 18(4): 930–937. DOI: 10.1158/1078-0432.CCR-10-1613 |
| [49] | Steelman LS, Franklin RA, Abrams SL, et al. Roles of the Ras/Raf/MEK/ERK pathway in leukemia therapy. Leukemia, 2011, 25(7): 1080–1094. DOI: 10.1038/leu.2011.66 |
| [50] | Guo G, Kang Q, Zhu X, et al. A long noncoding RNA critically regulates Bcr-Abl-mediated cellular transformation by acting as a competitive endogenous RNA. Oncogene, 2015, 34(14): 1768–1779. DOI: 10.1038/onc.2014.131 |
| [51] | Guo GJ, Kang QZ, Chen QH, et al. High expression of long non-coding RNA H19 is required for efficient tumorigenesis induced by Bcr-Abl oncogene. FEBS Lett, 2014, 588(9): 1780–1786. DOI: 10.1016/j.febslet.2014.03.038 |
| [52] | Guo G, Qiu X, Wang S, et al. Oncogenic E17K mutation in the pleckstrin homology domain of AKT1 promotes v-Abl-mediated pre-B-cell transformation and survival of Pim-deficient cells. Oncogene, 2010, 29(26): 3845–3853. DOI: 10.1038/onc.2010.149 |
| [53] | Shahbazian D, Parsyan A, Petroulakis E, et al. Control of cell survival and proliferation by mammalian eukaryotic initiation factor 4B. Mol Cell Biol, 2010, 30(6): 1478–1485. DOI: 10.1128/MCB.01218-09 |
 2018, Vol. 34
2018, Vol. 34