中国科学院微生物研究所、中国微生物学会主办
文章信息
- 邵婕, 潘娇, 瞿芳, 刘子昊, 丁易颖, 罗莎, 张学文, 陈金军
- Shao Jie, Pan Jiao, Qu Fang, Liu Zihao, Ding Yiying, Luo Sha, Zhang Xuewen, Chen Jinjun
- 蜘蛛多肽毒素JZTX-51和JZTX-26的重组表达和纯化
- Recombinant expression and purification of spider toxin, JZTX-51 and JZTX-26, from Chilobrachys jingzhao
- 生物工程学报, 2018, 34(10): 1668-1678
- Chinese Journal of Biotechnology, 2018, 34(10): 1668-1678
- 10.13345/j.cjb.170529
-
文章历史
- Received: December 29, 2017
- Accepted: June 20, 2018
动物毒液是有重要研究价值的生物活性物质, 许多深入研究的毒素多肽、蛋白已成为开展神经生物学、细胞生物学和蛋白质化学基础理论研究、天然创新药物开发以及农业生物技术应用的良好材料[1-3]。然而, 天然节肢动物肽类毒素资源有限, 生化分离和纯化过程繁琐且得率低, 化学合成成本高, 且不易大规模生产。随着分子生物学的发展, 生物合成为毒素研究开辟了一条新的途径。大肠杆菌表达系统是目前最为成熟也是应用最广泛的原核表达体系, 具有遗传背景清楚、操作简便、便于大规模生产等优点[4]。但是, 采用大肠杆菌表达系统表达外源蛋白, 会造成一些不溶性包涵体的形成, 这些包涵体会阻碍蛋白的表达。为提高靶蛋白的可溶性表达效率, 将靶蛋白与一些易于表达和纯化的标签进行融合表达, 常用的表达标签有:MBP (麦芽糖结合蛋白), TRX (硫氧还蛋白), GST (谷胱甘肽-S-转移酶), SUMO (小泛素相关修饰蛋白)和HaloTag蛋白, GB1 (链球菌G蛋白B1结构域)[5-7]。Zhu等提供了在大肠杆菌重组表达系统中合成α-芋螺毒素LvIA的有效方法[8]。Moon等在大肠杆菌表达体系中成功表达了笋螺毒素Tgu6.1, 并检测证明对沙蚕有麻痹作用[9]。
蜘蛛种类繁多, 而且不同蜘蛛的毒液所含成分及其性质差别很大, 因此, 蜘蛛毒液是一个巨大的发现新的潜在生物活性分子的重要资源。敬钊缨毛蛛(Chilobrachys jingzhao, Chilobrachys guangxiensis)是在我国海南省琼中县境内发现的, 属捕鸟蛛科(Theraphosidae)、棒刺蛛亚科(Selenocosmiinae)、缨毛蛛属(Chilobrachys)。敬钊缨毛蛛雌、雄个体都较大, 体型与海南捕鸟蛛和虎纹捕鸟蛛相似, 背甲红褐色, 密布灰白色细毛, 边缘具较长而且粗的硬毛, 腹部浅黄褐色, 有稀疏的棕色长毛和浓密的浅黄褐色短细毛, 穴居地下, 主要以昆虫和其他节肢动物、蚯蚓、蜗牛或小型脊椎动物为食。该蜘蛛毒腺中的粗毒好比一个丰富的毒素肽库, 具有大量的毒素肽物质。通过对敬钊缨毛蛛毒腺转录组和多肽组的研究, 获得大量毒素的分子遗传学数据, 发现了104个新型毒素分子[10-12]。目前, 关于敬钊缨毛蛛毒素的研究主要集中在其作为修饰剂对离子通道的作用[13-20]。而由于蜘蛛毒液的量非常少, 每只蜘蛛每次取毒仅10 μL左右, 而其中包含上百种成分, 因此, 重组表达获得活性多肽的技术成为尤其重要的途径[21-24]。pMAL-p2x是一种原核分泌型表达载体, 能在大肠杆菌中实现高效分泌表达。pMAL-p2x的5′端带有一段信号肽与麦芽糖结合蛋白的融合蛋白, 将表达产物分泌到大肠杆菌的胞间质, 以可溶的形式存在[25-29]。文中以敬钊缨毛蛛毒素中的两个多肽为主要目标蛋白, MBP为融合伴侣和纯化标签, 构建到原核表达载体pMAL-p2x上, 通过原核表达途径实现了敬钊缨毛蛛毒素的基因工程高表达, 为采用基因工程的手段大量获得蜘蛛毒素奠定了基础。
1 材料与方法 1.1 材料与试剂菌株:大肠杆菌Escherichia coli菌株DH5α、BL21 (DE3)和TB1为本实验室保存。
质粒:原核细胞融合表达载体质粒pMAL-p2x由中山大学皮灿辉博士惠赠。
实验动物为Sprague-Dawley品系大白鼠, 简称SD大鼠, 由湖南师范大学生物化学与分子生物学实验室动物房饲养提供。
培养液:DMEM干粉288 mg+NaCl 43 mg。溶于20 mL双蒸水后, 用1 mol/L NaOH调pH至7.40。如果DMEM中不含HEPES, 则需要按体积比2:l的比例加入。溶液配好后用99.9%的氧气饱和10 min, 并于34 ℃水浴预热备用。
消化液:含胶原酶(Co11agenase IA, 3.7-4.3 mg)、胰蛋白酶(Trypsin, 1.7-2.0 mg)和脱氧核糖核酸酶(Dnase IV, 0.3 mg)。用上述5 mL充氧饱和的DMEM液体溶解, 并于34 ℃水浴预热备用。
消化抑制剂:胰蛋白酶抑制剂(Inhibitor), 5.5-7.6 mg。
试剂:限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶、10×缓冲液购自深圳晶美公司; QIAGEN DNA胶回收试剂盒购自安比奥公司; TIANGEN的普通DNA产物纯化试剂盒, DNA ladder购自宝生物公司; 低分子标准蛋白(14 000- 97 000)购自华美生物公司; 超低分子标准蛋白(2 060-81 000)购自鼎国公司; Factor Xa蛋白酶购自Novagen或GE公司; 异丙基-β-D-硫代半乳糖苷(IPTG)、丙烯酰胺(Ultra Pure Grade)、N, N-亚甲双丙烯酰胺(Ultra Pure Grade)、过硫酸铵、N, N, N, N′-四甲基乙烯二胺、考马斯亮蓝R-250、考马斯亮蓝G-250、β-巯基乙醇、DTT、SDS、甘氨酸、Tricine和Tris碱等均购自AMRESCO公司; 三氟乙酸(TFA)为ALDRICH公司产品, 购自生工生物工程(上海)股份有限公司; DMEM干粉、胶原酶、胰蛋白酶、脱氧核糖核酸酶和胰蛋白酶抑制剂购自Sigma公司; 氨苄青霉素钠盐购自华北制药厂; 胰蛋白胨和酵母提取物购自Oxoid公司; PCR扩增jztx-26和jztx-51基因引物由生工生物工程(上海)股份有限公司合成; 其他试剂均为国产分析纯试剂。
1.2 载体制备活化E.coli DH5α (pMAL-p2x), 根据质粒小提试剂盒(离心柱型)说明书的步骤, 提取质粒pMAL-p2x, 置于-20 ℃中保存备用。
XmnⅠ和Hind Ⅲ酶切质粒, 根据普通DNA产物纯化试剂盒(离心柱型)说明书的步骤进行纯化。
1.3 jztx-26和jztx-51基因的克隆与测序为了简便有效地获得目的基因进行蛋白的原核表达, 我们根据蜘蛛毒素的氨基酸序列和大肠杆菌的密码子偏好性合成了相应的基因。针对原核表达载体pMAL-p2x设计克隆蜘蛛毒素基因jztx-26和jztx-51的引物, 5′端将进行平末端化, 在3′端引入酶切位点Hind Ⅲ。所设计的引物序列如表 1所示。
| Primer name | Primer sequence (5′-3′) |
| UP51 | CGTTGCGAACCGTCCGGCAAACCG TGTCGTCCGCTGATGCGTATCC |
| LP51 | CCCAAGCTTAGCGCATTTACACAGA ACGCAGGAGCCAC |
| UP26 | GACGACTGCCTGGGCCTGTTCTCCT CTTG |
| LP26 | CCCAAGCTTACCACAGTTTCAGTTT ACACCATTTGTCACGACGGTTAC |
采用PCR方法扩增jztx-26和jztx-51基因, PCR体系组成如下:无菌ddH2O, 38.1 μL; 10×PCR缓冲液, 5.0 μL; 25 mmol/L MgCl2, 2 μL; cDNA, 0.5 μL; Taq 酶, 0.4 μL; 总体积50.0 μL。PCR反应的条件为:94 ℃预变性5 min; 94 ℃变性1 min, 54 ℃退火1 min, 72 ℃延伸1 min, 30个循环; 72 ℃延伸5 min。反应结束后, 用1%琼脂糖凝胶电泳检测PCR产物。T4 DNA聚合酶形成平末端:PCR纯化产物44 μL; 缓冲液2.5 μL; BSA 0.5 μL; dNTPs 0.2 μL; T4 DNA聚合酶, 0.5 μL, 置于12 ℃水浴中15 min。按试剂盒说明纯化以上核酸后, Hind Ⅲ酶切, 通过1.7%低熔点胶电泳进行分离, 并进行切胶回收目的片段, 回收产物与pMAL-p2x载体在16 ℃过夜连接, 连接产物转化, 在含氨苄青霉素的培养基上进行筛选, 随机挑取单菌落进行菌落PCR, 筛选出阳性克隆, 由生工生物工程(上海)股份有限公司进行测序鉴定。
1.4 目的蛋白JZTX-26和JZTX-51的表达表达流程如图 1所示。将重组表达质粒分别转化DH5α、TB1和BL21(DE3)三种感受态细胞, 挑取转化后的单菌落于含葡萄糖的5 mL富营养培养基(含0.1 mg/mL Amp)的试管中培养过夜, 次日按比积以1:100的比例在500 mL同样的培养基里放大培养至OD600值0.4-0.6之间时, 加入IPTG至终浓度为6×10-4 mol/L, 诱导表达4-6 h。
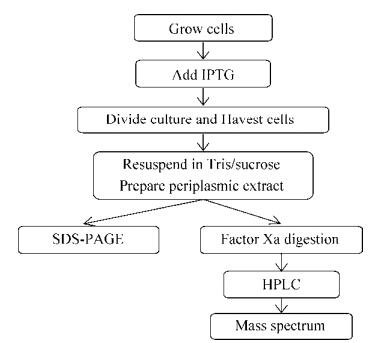
|
| 图 1 蛋白融合表达流程图 Figure 1 Flow chart for fusion expression. |
| |
利用蔗糖梯度渗透压改变裂解细胞壁, 由于目的蛋白与MBP融合表达, 因此可与Amylose树脂亲和吸附, 然后用麦芽糖进行洗脱, 收集洗脱峰, 得到该融合蛋白的初步纯化产物, 并测定蛋白浓度。
1.5 Amylose亲和层析柱纯化、透析及SDS-PAGE分析将亲和纯化得到的溶液进行透析, 除去溶液中的小分子蛋白及盐类物质, SDS-PAGE分析。然后冻干, 以备酶切。
1.6 酶切、分子筛纯化及反相色谱纯化将冻干得到的融合蛋白用Factor Xa进行酶切, 切去前面的MBP, 采用分子筛进行分离。将浓缩后的样品, 采用C18反向柱(10 mm×250 mm)进一步纯化。反相得到的洗脱峰经质谱鉴定后, 取其中与目的蛋白理论分子量一致的峰进行冻干以备活性鉴定。
1.7 JZTX-26和JZTX-51对DRG钠离子通道电流的影响挑选出生4周左右, 体重约为140-200 g的SD大鼠, 麻醉后断颈处死, 迅速挑出脊椎并将其剪成2-4段, 将椎管沿与肋骨垂直的方向剪开, 然后在盛有少量培养液的烧杯中浸泡椎管, 仔细撕破附在椎管内壁上的无色黏膜, 暴露椎管和肋骨交汇处的背根神经纤维。在胸椎和腰椎部分, 可挑选10-15个较好的背根神经节放入装有2 mL临时培养液的培养皿中。分离出神经节以及神经纤维后, 用维娜斯剪切除神经节外的絮状物和轴索, 放入盛有约0.5 mL临时培养液的培养皿中。倒去临时培养液, 用维娜斯剪将分离的神经节剪碎。然后将剪碎后神经细胞转入含有15 mL消化液的指形管中, 在34 ℃、110 r/min的环境中用消化液酶解20-30 min。酶解期间每隔8-10 min取出指形管吹打细胞以防细胞成团, 酶解终止后向消化液中加入胰蛋白酶抑制剂, 终止酶解反应。将酶解后的溶液转入离心管中离心(1 000 r/min, 2-5 min), 去除上清。用含10%小牛血清的培养液重悬细胞, 重悬后的细胞分成3-4皿, 每皿加入2 mL培养液, 放入37 ℃恒温培养(5% CO2, 95%空气)中, 培养3-4 h后可用于记录电流。
倒置显微镜下选择细胞膜较为光滑、细胞质均匀的细胞, 在室温20-25 ℃条件下进行膜片钳实验。选用100 μL硼硅酸盐玻璃毛细管为玻璃电极材料, 待电极与细胞膜之间形成高阻抗的京欧(GΩ)封接后, 补电极快电容。然后将细胞钳制在-60 mV, 给予一短而有力的负压, 将钳制在电极中的细胞膜迅速打破, 再补偿细胞慢电容。形成全细胞记录模式后将细胞钳制为-80 mV, 细胞稳定4-6 min开始记录电流。
2 结果与分析 2.1 JZTX-26和JZTX-51基因序列及分析目的蛋白基因来源于蜘蛛毒素cDNA文库[11]。两个毒素的前体都含有信号肽、中间肽和成熟肽(图 2、图 3)。JZTX-26成熟肽(35 aa)和JZTX-51成熟肽(27 aa)均含3对二硫键, 但两者的序列同源性非常低, 分属于两个不同家族。根据同源性分析, 确定两个多肽均为ICK分子, 二硫键的连接方式分别为:JZTX-51:C2-C18, C9-C21, C17-C26; JZTX-26:C3-C18, C10-C23, C17-C30[11]。本实验是将成熟肽序列分别构建到表达载体pMAL-p2x上。

|
| 图 2 JZTX-51的cDNA和氨基酸序列 Figure 2 Amino acid and cDNA sequence of JZTX-51.The sequence of signal peptide was marked in italic font.The sequence of mature peptide was underlined by solid line. |
| |

|
| 图 3 JZTX-26的cDNA和氨基酸序列 Figure 3 Amino acid and cDNA sequence of JZTX-26.The sequence of signal peptide was marked in italic font.The sequence of mature peptide was underlined by solid line. |
| |
琼脂糖凝胶电泳检验cDNA文库片段jztx-26和jztx-51的PCR扩增, 结果如图 4所示, 纯化与预测大小相符PCR产物, 用T4 DNA聚合酶补齐末端, 纯化, 用Hind Ⅲ酶切, 再次纯化备用。

|
| 图 4 jztx-26和jztx-51基因的PCR电泳图 Figure 4 2.0% agarose gel electrophoresis of PCR products of jztx-26 and jztx-51.lane M:100 bp DNA ladder; lane 1:JZTX-26;lane 2:JZTX-51;lane 3:negative control. |
| |
载体制备, 将纯化的pMAL-p2x质粒分别用XmnⅠ和Hind Ⅲ先后酶切, 纯化备用。
将酶切好的毒素基因片段与线性化载体连接, 转化到大肠杆菌感受态细胞TB1和BL21。氨苄青霉素抗性筛选, 菌落PCR检测阳性克隆(图 5), 进行测序。将测序正确的克隆分别命名为pMAL-jz26和pMAL-jz51。
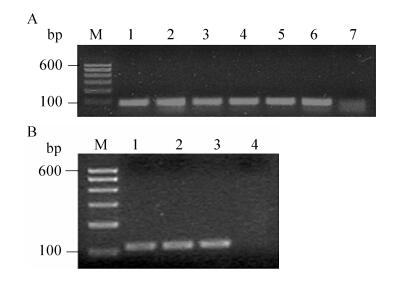
|
| 图 5 阳性克隆子菌落PCR电泳图 Figure 5 Colong PCR analysis of recombinants.(A) JZTX-51.lane M:100 bp DNA ladder; lanes 1-6:recombinants; lane 7:negative control.(B) JZTX-26.lane M:100 bp DNA ladder; lanes 1-3:recombinants; lane 4:negative control. |
| |
宿主菌TB1是该表达系统中配套的表达宿主菌株。而宿主菌BL21 (DE3)因所含的内源蛋白酶较少, 是用于E.coli重组表达的通用菌株。比较两种宿主菌BL21 (DE3)和TB1在相同条件下重组蛋白的表达量及可溶性, 结果表明, 两种转化菌都能表达重组可溶性较好的融合蛋白, 宿主菌BL21 (DE3)菌株的表达量高, 但是出现3条重组蛋白带; TB1菌株表达的产物都可得到特异的重组蛋白带, 最终我们选择TB1作为重组表达用工程菌株。由于表达的小肽富含二硫键, 选用较低浓度的IPTG, 低温并长时间诱导。当工程菌生长至OD600=0.8时, 添加终浓度为1×10-4 mol/L的IPTG, 在24 ℃诱导3 h左右, 离心收取菌体, 冷冻渗透处理。SDS-PAGE检测外源蛋白的表达量及可溶性(图 6)。
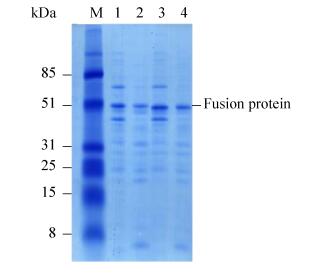
|
| 图 6 SDS-PAGE检测蛋白质表达 Figure 6 SDS-PAGE analysis of recombinants expression.lane M:protein marker; lane 1:JZTX-26 expressed by BL21(DE3);lane 2:JZTX-26 expressed by TB1;lane 3:JZTX-51 expressed by BL21(DE3);lane 4:JZTX-51 expressed by TB1. |
| |
由于重组敬钊毒素融合蛋白在氨基端有MBP标签, 因此可与Amylose树脂亲和吸附, 然后用麦芽糖进行洗脱。含MBP-JZTX的上清液流过Amylose亲和柱, 然后用浓度为0.01 mol/L的麦芽糖(缓冲体系为0.02 mol/L Tris-HCl, pH 8.0)溶液洗脱, 收集洗脱峰, 得到该融合蛋白的初步纯化产物, 并采用BCA法测定蛋白浓度。初步纯化产物过夜透析, 冻干。
2.5 融合蛋白的酶切与目的蛋白的纯化重组敬钊毒素和融合伴侣MBP之间有蛋白酶Factor Xa的酶切位点。纯化的融合蛋白通过Factor Xa蛋白酶切使目的蛋白与融合伴侣分离。经过对酶切实验条件的摸索, 我们最终选择20 ℃作为最适酶切温度。
酶切后的蛋白采用凝胶过滤和超滤手段进行分离纯化和浓缩。由于目的小肽与未切割融合蛋白和融合伴侣体的分子量差别较大, 因此利用分子筛效应, 根据蛋白分子量的大小将蛋白分开。采用Sepharose G50分子筛凝胶层析来进行分离, 并检测洗脱液在280 nm和215 nm处波长的紫外吸收值。经过Sepharose G50凝胶过滤层析, 我们检测到4个紫外吸收峰, 将这4个峰进行质谱检测, 确定第3个峰中有与目的多肽一致的分子量。按照出峰时间的先后, 大分子量的成分较先洗脱, 因此, 推测这4个峰主要成分依次是Factor Xa酶、MBP、目的蛋白和酶切体系中的小分子化合物(图 7)。
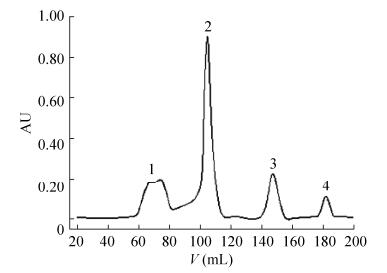
|
| 图 7 凝胶过滤层析检测融合蛋白MBP-JZTX-26酶切 Figure 7 Gel filtration chromatography of cleaved proteins.The chromatography was performed on Sephadex G50 column (1.6 cm×85 cm) with flow rate 0.3 mL/min.Fraction 1:protease Factor Xa and anonymous proteins; Fraction 2:MBP with a little uncleaved fusion protein; Fraction 3:purified recombinant protein JZTX-26;Fraction 4:DTT and others from cleavage buffer. |
| |
我们收集其中的第3个峰进一步纯化。经过冻干浓缩, 然后利用融合伴侣和目的小肽它们在疏水性上的差异, 进行反相高效液相色谱的分离, 从而达到制备高纯度目的小肽的目的。
高效液相色谱层析采用了水和乙腈流动相体系, 并在体系中加入了0.1% TFA作为修饰性离子对物质以增加样品的疏水性。实验结果显示, 随着流动相中乙腈浓度的递增, 通过检测215 nm处的紫外吸收值, 可以得到一个明显的洗脱峰和前后一些小的杂峰(图 8)。

|
| 图 8 HPLC分离纯化重组JZTX-51 (A)和JZTX-26 (B) Figure 8 Reverse Phase HPLC separation of recombinant JZTX-51(A) and JZTX-26 (B). |
| |
取高效液相色谱分离后的目的蛋白峰通过质谱鉴定其分子量。结果显示, 保留时间为13.4 min的洗脱峰中组分(JZTX-51)的分子量与目的小肽的分子量(预测MW=2 902)相吻合(图 9), 保留时间为21.6 min的洗脱峰中组分(JZTX-26)的分子量与目的小肽的分子量(预测MW=4 144)相吻合(图 10)。通过进一步纯化, 多肽和融合伴侣得到了较好的分离。

|
| 图 9 JZTX-51质谱鉴定 Figure 9 MALDI-TOF-TOF analysis of JZTX-51. |
| |

|
| 图 10 JZTX-26质谱鉴定 Figure 10 MALDI-TOF-TOF analysis of JZTX-26. |
| |
在全细胞模式下, 检测毒素对DRG细胞上TTX-S钠离子通道和TTX-R钠离子通道电流-电压(I-U)曲线影响, 以研究毒素对钠离子通道开放的影响。细胞钳制电位-80 mV, 测试电压变化范围-80-+50 mV, 测试电压持续时间50 ms, 跃迁步幅+10 mV。在空白对照条件下, TTX-S钠离子通道的初始激活电压为-40 mV, 电流最大峰值时电压为-20 mV左右, 逆转电位约为+20 mV左右。在细胞外液中分别加入10 μmol/L重组表达的JZTX-51、从粗毒中分离纯化的JZTX-51[13]或重组表达的JZTX-26, 让毒素与细胞作用2 min, 再以相同的去极化脉冲诱导产生电流-电压(I-U)曲线。结果如图 11所示, 加入10 μmol/L重组表达的JZTX-26后, 有10%的TTX-S钠通道电流被抑制, 但是对TTX-R钠通道电流基本上无抑制作用; 加入10 μmol/L重组表达的JZTX-51和粗毒中分离纯化的JZTX-51对TTX-S钠通道和TTX-R钠通道的电流均无抑制作用。

|
| 图 11 重组表达的JZTX-26、分离纯化的JZTX51和重组表达的JZTX-51对大鼠DRG细胞上钠通道的作用 Figure 11 Effects of expressed JZTX-26 (JZTX-26(R)), JZTX-51 purified from venom (JZTX-51(N)) and expressed JZTX-51 (JZTX-51(R)) on the sodium channels in rat DRG neurons.(A) Effects of JZTX-26(R) on tetrodotoxin-sensitive (TTX-S) sodium channels in rat DRG neurons.(B) Effects of JZTX-26(R) on tetrodotoxin-resistant sodium (TTX-R) channels in rat DRG neurons.(C) Effects of JZTX-51(N) and JZTX-51(R) on tetrodotoxin-sensitive (TTX-S) sodium channels in rat DRG neurons.(D) Effects of JZTX-51(N) and JZTX-51(R) on tetrodotoxin-resistant (TTX-R) sodium channels in rat DRG neurons. |
| |
本实验采用了以MBP为融合伴侣的pMAL-p2x融合表达系统, 它具有以下特点:1)采用优化的TIR (Translation-initiation region)和Ptac强启动子, 可进行稳定高效表达。2)含大肠杆菌的分子伴侣MBP, 其构象严紧, 热稳定性好, 当MBP在细胞内被过量表达时仍不被细菌蛋白酶降解, 在细胞内能协助蛋白的正确折叠, 大大提高产量。3)加入了柔韧区, 这样在融合伴侣和外源蛋白之间提供一个过渡, 减少两者在空间结构上的相互干扰以及可能出现的刚性结构, 另外还有利于蛋白酶对融合蛋白的切割。4)具有信号肽, 可分泌到细菌周质空间, 有利于二硫键的形成, 另外通过冷冻渗透提取蛋白可去掉绝大部分杂蛋白。5)最大的缺点是融合蛋白必须经过酶切才能得到目的蛋白, 而酶切条件非常敏感。
针对不同的多肽, IPTG浓度对重组表达产物会有一定的影响, 一方面更高的浓度可以诱导高效的融合蛋白表达, 而有时候表达量过高容易形成包涵体, 不利于正确构型的形成; 另一方面, IPTG对宿主菌也有一定的毒性。再者, 由于目的蛋白要形成3对二硫键, 因此选择较低浓度。
融合蛋白MBP-JZTX经酶切后, 需要将酶、融合伴侣和未切割的融合蛋白与毒素蛋白分离, 根据这些分子量和电荷性质的差异, 我们尝试了分子筛凝胶过滤层析和离子交换层析等进行纯化。但是对于小量的样品, 实验中尝试采用了超滤的方法, 取得了比较理想的结果。通过对酶切后的蛋白进行反相HPLC分析, 出峰单一, 表明体系中在5 kDa分子量以下的杂蛋白较少, 因此, 也可以通过10 kDa超滤膜的分离, 得到主要组分为目的小肽, 除去绝大部分的大分子杂蛋白。利用Factor Xa因子对融合蛋白进行酶切时, 在温度的优化中设置了10 ℃、20 ℃、37 ℃ 3个不同的温度梯度。实验结果表明, MBP-JZTX在20 ℃切割16 h, 目的蛋白可以完全切开; 在10 ℃下切割16 h, 融合蛋白不能完全切开; 而在37 ℃下切割16 h, 容易出现非特异性切割。从而确定了酶切温度为20 ℃。
最后的纯化是采用反相高效液相色谱。在反相色谱分离中, 小肽的疏水性会大于大分子量的蛋白质, 由于差异流动相的pH对样品溶质的电离状态影响很大, 进而影响其疏水性, 所以在分离肽类和蛋白质等生物大分子的过程中, 通常要加入修饰性的离子对物质, 最常用的离子对试剂是TFA (三氟乙酸), 使用浓度为0.1%, 使流动相的pH值为2-3, 这样可以有效地抑制氨基酸上α-羧基的解离, 使其疏水性增加, 延长洗脱时间, 提高分辨率和分离效果。对于检测波长的选择, 由于215 nm波长主要反映蛋白质肽键的情况, 蛋白质肽键含量丰富, 因此灵敏度高, 较适用于小肽检测。280 nm的光吸收主要反映蛋白质中含苯环的氨基酸, 相对于肽键来说, 其含量较低, 灵敏度也相对较低。于是, 实验中采用了水和乙腈流动相体系, 体系中加入了0.1% TFA进行反相高效液相色谱的分离, 洗脱液分别通过215 nm和280 nm两种波长进行检测, 取得了较理想的分离效果。
蜘蛛活性多肽毒素只有在具有正确二硫键时才具有生物活性, 我们采用的是细菌分泌表达的方式, 这种方式表达的蛋白带有一段信号肽, 信号肽引导着蛋白穿过细胞膜进入大肠杆菌的周质空间, 信号肽随后被切除。在转运过程中, 蛋白一般要变成线性分子以穿过细胞膜, 而到了周质空间后, 蛋白在一些分子伴侣的帮助下重新再折叠形成具有空间结构的分子, 因此, 理论上可以得到有正确结构的目标蛋白。从反相HPLC结果可知, 表达的融合蛋白酶切后获得的目的蛋白出峰单一, 表明目的表达产物的构象基本一致。我们采用真核系统表达JZTX-Ⅲ时, 将表达产物与天然分离的产物进行反相HPLC共洗脱, 其洗脱峰能重叠, 表明构象一致[30]。由于天然分离的这两种毒素成分都非常少, 我们未能进行进一步实验确认其构象。
大部分蜘蛛毒素作用于细胞膜上的各种离子通道或配体门控通道。DRG细胞是脊椎动物脊髓背根内的一种假单极感觉神经元。到目前为止所发现的离子通道类型在DRG上几乎都有表达, DRG上发现的通道数目不下于20种。实验结果显示, 分离纯化的JZTX-51和重组表达的JZTX-51对DRG细胞的TTX-S钠通道和TTX-R钠通道的阻断均没有明显作用, 重组表达的JZTX-26能抑制小部分TTX-S钠通道的电流, 对于TTX-R钠通道的电流没有抑制作用。这两种多肽毒素的作用机制还有待进一步研究。
在海洋生物毒素中, 芋螺毒素与蜘蛛毒素有很多相似之处, 如分子量小、二硫键丰富等, 并且两者都是多肽类神经毒素[31-32], 另外, 还有河豚毒素也具有同样的特性, 并且它还具有耐高温的优点[33]。这为蜘蛛等昆虫毒素后期的研究提供了方向。
| [1] | Casewell NR, Wolfgang W, Vonk FJ, et al. Complex cocktails:the evolutionary novelty of venoms. Trends Ecol Evolut, 2013, 28(4): 219–229. DOI: 10.1016/j.tree.2012.10.020 |
| [2] | Yan S, Wang XC. Recent advances in research on widow spider venoms and toxins. Toxins, 2015, 7(12): 5055–5067. DOI: 10.3390/toxins7124862 |
| [3] | Zhang Y. Why do we study animal toxins. Zool Res, 2015, 36(4): 183–222. |
| [4] |
Su P, Gong GL. Research progress on optimizing the expression of exogenous proteins in Escherichia coli.
Biotechnol Bull, 2017, 33(2): 16–23.
(in Chinese). 苏鹏, 龚国利. 优化大肠杆菌表达外源蛋白的研究进展. 生物技术通报, 2017, 33(2): 16-23. |
| [5] | Gopal GJ, Kumar A. Strategies for the production of recombinant protein in Escherichia coli. Protein J, 2013, 32(6): 419–425. DOI: 10.1007/s10930-013-9502-5 |
| [6] | Zhou P, Wagner G. Overcoming the solubility limit with solubility-enhancement tags:successful applications in biomolecular NMR studies. J Biomol NMR, 2010, 46(1): 23–31. DOI: 10.1007/s10858-009-9371-6 |
| [7] | Young CL, Britton ZT, Robinson AS. Recombinant protein expression and purification:a comprehensive review of affinity tags and microbial applications. Biotechnol J, 2012, 7(5): 620–634. DOI: 10.1002/biot.201100155 |
| [8] | Zhu XP, Bi JP, Yu JP, et al. Recombinant expression and characterization of α-Conotoxin LvIA in Escherichia coli. Mar Drugs, 2016, 14(1): 11. DOI: 10.3390/md14010011 |
| [9] | Moon J, Gorson J, Wright M, et al. Characterization and recombinant expression of terebrid venom peptide from terebra guttata. Toxins, 2016, 8(3): 63–75. DOI: 10.3390/toxins8030063 |
| [10] | Chen JJ, Zhao LQ, Jiang LP, et al. Transcriptome analysis revealed novel possible venom components and cellular processes of the tarantula Chilobrachys jingzhao venom gland. Toxicon, 2008, 52(7): 794–806. DOI: 10.1016/j.toxicon.2008.08.003 |
| [11] | Chen JJ, Deng MC, He Q, et al. Molecular diversity and evolution of cystine knot toxins of the tarantula Chilobrachys jingzhao. Cell Mol Life Sci, 2008, 65(15): 2431–2444. DOI: 10.1007/s00018-008-8135-x |
| [12] | Liao Z, Cao J, Li SM, et al. Proteomic and peptidomic analysis of the venom from Chinese tarantula Chilobrachys jingzhao. Proteomics, 2007, 7(11): 1892–1907. DOI: 10.1002/(ISSN)1615-9861 |
| [13] | Yuan CH, Liu ZH, Hu WJ, et al. JZTX-XⅢ, a Kv channel gating modifier toxin from Chinese tarantula Chilobrachys jingzhao. Toxicon, 2012, 59(2): 265–271. DOI: 10.1016/j.toxicon.2011.11.021 |
| [14] | Wei P, Xu CX, Wu QQ, et al. Jingzhaotoxin-35, a novel gating-modifier toxin targeting both Nav1.5 and Kv2.1 channels. Toxicon, 2014, 92: 90–96. DOI: 10.1016/j.toxicon.2014.10.008 |
| [15] | Tao H, Wu YY, Deng MC, et al. Molecular determinants for the tarantula toxin jingzhaotoxin-Ⅰ interacting with potassium channel Kv2.1. Toxicon, 2013, 63: 129–136. DOI: 10.1016/j.toxicon.2012.12.001 |
| [16] | Tao H, Chen X, Deng MC, et al. Interaction site for the inhibition of tarantula Jingzhaotoxin-Ⅺ on voltage-gated potassium channel Kv2.1. Toxicon, 2016, 124: 8–14. DOI: 10.1016/j.toxicon.2016.10.019 |
| [17] | Tang C, Zhou X, Huang Y, et al. The tarantula toxin jingzhaotoxin-Ⅺ (κ-theraphotoxin-Cj1a) regulates the activation and inactivation of the voltage-gated sodium channel Nav 1.5. Toxicon, 2014, 92: 6–13. DOI: 10.1016/j.toxicon.2014.09.002 |
| [18] | Deng MC, Kuang F, Sun ZH, et al. Jingzhaotoxin-Ⅸ, a novel gating modifier of both sodium and potassium channels from Chinese tarantula Chilobrachys jingzhao. Neuropharmacology, 2009, 57(2): 77–87. DOI: 10.1016/j.neuropharm.2009.04.009 |
| [19] |
Huang Y.Molecular mechanism of the tarantula toxin jingzhaotoxin-Ⅱ interacting with voltage-gated sodium channel subtype Nav l.5[D].Changsha: Hunan Normal University, 2015 (in Chinese). 黄颖.敬钊毒素-Ⅱ与钠通道1.5作用的分子机制研究[D].长沙: 湖南师范大学, 2015. |
| [20] | Tao H, Chen JJ, Xiao YC, et al. Analysis of the interaction of tarantula toxin Jingzhaotoxin-Ⅲ (β-TRTX-Cj1α) with the voltage sensor of Kv2.1 uncovers the molecular basis for cross-activities on Kv2.1 and Nav1.5 channels. Biochemistry, 2013, 52(42): 7439–7448. DOI: 10.1021/bi4006418 |
| [21] |
Zhao LQ.Eukaryotic expression and function study of toxins from the venom of the spider Chilobrachys jingzhao[D].Changsha: Hunan Normal University, 2009 (in Chinese). 赵立群.敬钊缨毛蛛多肽毒素基因的真核表达及功能研究[D].长沙: 湖南师范大学, 2009. |
| [22] |
Jiang QQ, Li HL, Liu LL, et al. The expression and purification of Jingzhao toxin in Pichia pastoris.
J Anhui Agric Sci, 2014, 42(19): 6166, 6169.
(in Chinese). 蒋倩倩, 李慧玲, 刘莉莉, 等. 重组敬钊毒素在毕赤酵母中的表达与纯化研究. 安徽农业科学, 2014, 42(19): 6166, 6169. DOI:10.3969/j.issn.0517-6611.2014.19.016 |
| [23] |
Bao SH.Heterologous expression and electrophysiological activity research of Chilobrachys jingzhao spider toxins[D].Changsha: National University of Defense Technology, 2014 (in Chinese). 鲍邵衡.敬钊缨毛蛛毒素的异源表达及其电生理活性研究[D].长沙: 国防科学技术大学, 2014. |
| [24] | Chen JJ, Zhang YQ, Rong MQ, et al. Expression and characterization of jingzhaotoxin-34, a novel neurotoxin from the venom of the tarantula Chilobrachys jingzhao. Peptides, 2009, 30(6): 1042–1048. DOI: 10.1016/j.peptides.2009.02.018 |
| [25] | Wang S, Shen MQ, Xu Y, et al. Rational and efficient preparation of a chimeric protein containing a tandem dimer of thrombopoietin mimetic peptide fused to human growth hormone in Escherichia coli. Appl Microbiol Biotechnol, 2013, 97(7): 2885–2894. DOI: 10.1007/s00253-012-4553-7 |
| [26] | Liu XN, Zhang L, Zhang XT, et al. Molecular cloning and recombinant expression of cytochrome P450 CYP6B6 from Helicoverpa armigera in Escherichia coli. Mol Biol Rep, 2013, 40(2): 1211–1217. DOI: 10.1007/s11033-012-2163-1 |
| [27] | Liu H, Li CQ, Ling BD, et al. Expression, purification and identification of LBD domain of human PPARδ in E.coli. J Med Colleges PLA, 2009, 24(2): 76–83. DOI: 10.1016/S1000-1948(09)60021-6 |
| [28] | Qian YR, Sheng LX, Yao YT, et al. Structures and homology modeling of chicken major histocompatibility complex protein class Ⅰ (BF2 and β2m). Mol Immunol, 2005, 43(7): 1040–1046. |
| [29] | Gao FS, Bai J, Zhang Q, et al. Construction of multiple recombinant SLA-I proteins by linking heavy chains and light chains in vitro and analyzing their secondary and 3-dimensional structures. Gene, 2012, 502(2): 147–153. DOI: 10.1016/j.gene.2012.04.038 |
| [30] | Rong MQ, Chen JJ, Tao H, et al. Molecular basis of the tarantula toxin jingzhaotoxin-Ⅲ (β-TRTX-Cj1α) interacting with voltage sensors in sodium channel subtype Nav1.5. FASEB J, 2011, 25(9): 3177–3185. DOI: 10.1096/fj.10-178848 |
| [31] |
Gao BM.Studies on recombinant expression of novel conotoxin gene[D].Haikou: Hainan University, 2012 (in Chinese). 高炳淼.芋螺毒素基因重组表达研究[D].海口: 海南大学, 2012. |
| [32] | Kapono CA, Thapa P, Cabalteja CC, et al. Conotoxin truncation as a post-translational modification to increase the pharmacological diversity within the milked venom of Conus magus. Toxicon, 2013, 70: 170–178. DOI: 10.1016/j.toxicon.2013.04.022 |
| [33] |
Deng YJ.Study on tetrodotoxin and insecticidal metabolites from two marine microbes[D].Shenyang: Shenyang Pharmaceutical University, 2008 (in Chinese). 邓燚杰.海洋微生物源河豚毒素和杀虫活性物质的研究[D].沈阳: 沈阳药科大学, 2008. |
 2018, Vol. 34
2018, Vol. 34




