中国科学院微生物研究所、中国微生物学会主办
文章信息
- 赵春霖, 金莉莉, 邰思佳, 张学敏, 史天聪, 吴飞, 王秋雨
- Zhao Chunlin, Jin Lili, Tai Sijia, Zhang Xuemin, Shi Tiancong, Wu Fei, Wang Qiuyu
- 重组融合多肽hEGF-AWRK6的纯化及对小鼠烫伤感染创面愈合的影响
- Purification of recombinant fusion polypeptide hEGF-AWRK6 and effect on wound healing and infection of burn model mice
- 生物工程学报, 2018, 34(10): 1642-1649
- Chinese Journal of Biotechnology, 2018, 34(10): 1642-1649
- 10.13345/j.cjb.180007
-
文章历史
- Received: January 18, 2018
- Accepted: February 26, 2018
创面感染常贯穿烧伤、烫伤患者治疗的全过程, 目前临床上的抗生素治疗常引发耐药菌感染及二重感染, 而后者是烧烫伤后继发败血症及脓血症的主要原因[1]。
抗菌肽是一类由20-60个氨基酸残基组成的碱性多肽, 分子量在2 000-7 000 Da左右, 具有广谱抗菌活性, 其独特的抗菌机制使细菌不易对其产生耐药性。近期研究发现, 多数抗菌肽还具有选择性免疫激活特性和调节功能, 对败血症有良好的预防和治疗作用, 这使抗菌肽有望成为潜在的抗菌治疗药物[2-3]。此外, 重组DNA技术的日益成熟, 也使抗菌肽的大量生产成为可能[4]。
抗菌肽AWRK6 (SWVGKHGKKFGLKKHKKH)是对东北林蛙抗菌肽Dybowskin-2CDYa (SAVGRHS RRFGLRKHRKH, GenBank Accession No.ACF08009.1)进行改造获得具有性能更稳定和抗菌活性更广谱的新型肽[5-7]。人表皮生长因子(Human epidermal growth factor, hEGF)属于促生长因子家族成员之一, 是上皮和间充质等细胞的敏感细胞丝裂原, 为促进细胞增殖分化最有力的细胞因子之一。hEGF重组蛋白已广泛用于皮肤烧伤、烫伤、角膜损伤及胃溃疡等方面且效果明显[8]。我们在前期研究中克隆了长度为54 bp的AWRK6和153 bp的hEGF基因, 中间由6个氨基酸构成的连接肽连接而成, 构建了原核表达载体hEGF-AWRK6/ pET-30a (+), 以期获得具有促创面愈合及抗感染的双功能融合肽hEGF-AWRK6 (以下简称EK), EK基因序列长度为225 bp。前期体外实验表明, EK具有抗大肠杆菌O157、金黄色葡萄球菌及铜绿假单胞菌等广谱抗菌活性及显著地促成纤维细胞细胞增殖和迁移的作用[9]。
本研究中, 我们纯化了重组表达的EK, 并构建了Ⅱ度烫伤感染小鼠模型, 并用EK对其施以干预治疗, 从而探索EK对模型小鼠促创面愈合及抗创面感染中的功效, 为其进一步的临床应用奠定基础。
1 材料与方法 1.1 材料与试剂含有His-hEGF-AWRK6/pET-30a (+)的E. coli BL21 (DE3)、绿脓杆菌Pseudomonas aeruginosa临床分离株均由本实验室保存。TEV蛋白酶、BCA试剂盒、ECL发光试剂盒、Mouse Anti-His Tag单克隆抗体、hEGF和Ⅰ型胶原抗体购自Sigma公司。AWRK6由吉尔生化(上海)有限公司合成。烫伤膏为天津达仁堂京万红药业有限公司产品。其他试剂购自国药化学试剂集团, 均为分析纯度。
1.2 实验动物昆明小白鼠, 雄性, 平均体重20 g/只, 购自辽宁长生生物技术有限公司。
1.3 EK诱导表达将含有His-hEGF-AWRK6/pET-30a (+)的E.coli BL21 (DE3)菌株经37 ℃振摇过夜复苏, 1:20比例接种500 mL LB液体培养基, 37 ℃培养2.5 h至对数生长期。加入终浓度1 mmol/L异丙基-β-硫代半乳糖苷(Isopropyl-beta-galactosidase, IPTG)诱导4 h, 8 000 r/min离心10 min收集菌体。
1.4 包涵体蛋白复性及表达产物纯化和Western blotting鉴定菌体经液氮反复冻融及超声破碎, 12 000 r/min离心10 min收集包涵体沉淀。包涵体沉淀于变性缓冲液(50 mmol/L Tris-HCl, 1 mmol/L EDTA, 100 mmol/L NaCl, 10 mmol/L β-巯基乙醇/DTT, 2 mmol/L脱氧胆酸钠, 8 mol/L尿素, pH 8.5)中4 ℃过夜溶解, 12 000 r/min离心10 min收集上清, 在梯度复性缓冲液(50 mmol/L Tris-HCl, 100 mmol/L NaCl, 6、4、2 mol/L尿素, 1%甘氨酸, 5%甘油, 0.2% PEG, pH 8.5)中, 4 ℃缓慢透析24-36 h, 再在结合缓冲液中透析约6 h, 确保融合蛋白稳定可溶。可溶蛋白采用His-Trap FF亲和层析纯化, 以含500 mmol/L咪唑的洗脱液(50 mmol/L Tris-HCl (pH 8.5), 150 mmol/L NaCl)洗脱, 收集液使用BCA试剂盒法测定蛋白浓度, 并利用12% SDS-PAGE检测纯度, 透析脱盐。使用抗His标签鼠单克隆抗体进行Western blotting实验, 鉴定重组EK6的表达。
1.5 EK的His标签去除及活性检测按TEV蛋白酶使用说明书进行操作, 反应体系:0.1 mg EK、10 μL 10×酶切缓冲液(500 mmol/L Tris-HCl, 5 mmol/L EDTA, 1% Tween-20, 10 mmol/L DTT, pH 8.0)、20 U TEV蛋白酶, 总反应体积100 μL, 4 ℃过夜, 酶切去除His标签。酶切结束后进行二次His-Trap FF亲和层析, 收集洗脱液, 透析除盐、冻干, 获得融合多肽EK干粉。以0.1 mol/L PBS作为阴性对照组, 利用牛津杯法检测不同浓度EK (10、20、30 mg/L)对铜绿假单胞菌的抑菌活性。
1.6 烫伤感染模型建立及给药方式昆明小鼠经10%水和氯醛腹腔麻醉, 8%硫化钠背部脱毛, 常规消毒。采用自制水浴烫伤板, 沸水停留10 s, 在背部腰椎正中的左右两侧烫取直径0.85 cm圆形创面各一个(皮肤病理切片证实为Ⅱ度烫伤)[10], 两相邻创面相距1 cm。创面涂抹绿脓杆菌0.05 mL (1×108 CFU/mL)。烫伤模型小鼠随机分4组, 每组12只。于伤后2 h在实验组创面均匀滴注0.05 mL的EK (30 mg/L), 对照组分别滴注0.05 mL的PBS、hEGF (100 μg/L)、烫伤膏(10 mg/L), 作用5 min后用灭菌纱布包扎, 每日给药一次至伤后第10天。相关药品所用剂量参考使用说明和前期预实验研究结果。
1.7 EK的创面抑菌功能及促烫伤愈合功能检测创面抑菌功能测定:分别于伤后3、6、10 d处死小鼠, 每组取3只。无菌条件下剪取创面表层组织1 g左右, 称重并加入等渗盐水l mL, 匀浆。倍比稀释后接种在LB固体琼脂平板上, 置于37 ℃温箱中孵育24 h。计数平板菌落数并计算每克组织的克隆形成单位(CFU)。
含菌量(CFU/g) =平皿菌落数×稀释倍数÷ 10 μL/组织重量(g)。
创面愈合检测:于烫伤第1天开始, 每天记录小鼠创伤面的面积。每组取平均值, 以每组平均面积的减小程度来反映创面面积愈合情况, 计算创面愈合率。
创面愈合率(%)=(原始创面面积-未愈合创面面积)/原始创面面积。
创面的组织结构观察:取给药10 d小鼠创面皮肤组织, 经4%多聚甲醛固定后制备常规病理切片, 苏木素-伊红(HE)染色, 光镜观察皮肤的病理组织学结构。
EK对烫伤皮肤Ⅰ型胶原蛋白表达的影响:提取于伤后2、4、6、8、10 dEK组小鼠烫伤处皮肤总蛋白, 取40 μg总蛋白进行SDS-PAGE, 转移至NC膜, 经过BSA封闭、一抗二抗孵育、ECL发光后曝光, Western blotting检测Ⅰ型胶原蛋白表达, 也利用同种方式检测伤后第10天4组小鼠的Ⅰ型胶原蛋白表达, 结果利用Image J软件进行灰度值分析。
2 结果与分析 2.1 表达EK的分离纯化SDS-PAGE结果显示, His-hEGF-AWRK6/ pET-30a (+)转化的E.coil BL21菌株包涵体在分子量约为14.3 kDa附近具有特异蛋白条带, 与预期的分子量相符, 而空白菌株、诱导的pET-30a (+)转化菌株、及未经诱导的转化菌无相应的蛋白条带(图 1A)。复性后的目的蛋白经Histrap FF镍离子螯合亲和层析, 获得单一条带的目的蛋白(图 1B)。此结果说明融合多肽在大肠杆菌BL21 (DE3)中成功表达, 纯化效果良好。

|
| 图 1 融合多肽EK的诱导表达及纯化 Figure 1 SDS-PAGE analysis of expression and purification of fusion polypeptide EK.(A) SDS-PAGE analysis of EK.1:vacuolar BL21 (DE3);2:uninduced pET-30a(+) transformed strain; 3:induced pET-30a(+) transformed strain; 4:uninduced hEGF-AWRK6/pET-30a(+) transformed strain; 5:induced hEGF-AWRK6/pET-30a(+) transformed strain.M:premixed protein marker.(B) Purified results of EK by SDS-PAGE.1:purified target protein; M:premixed protein marker. |
| |
利用抗His标签的鼠单克隆抗体进行Western blotting分析, 可见诱导的hEGF-AWRK6/pET-30a (+)转化菌株具有重组蛋白EK的表达, 而未转化的BL21 (DE3)中没有特异蛋白检出(图 2A)。去除His标签后抑菌实验结果显示, 重组表达的EK对铜绿假单胞菌均具有显著抑菌活性, 且与浓度呈正相关(图 2B)。

|
| 图 2 重组表达蛋白EK的Western blotting鉴定及抑菌活性 Figure 2 Identification of EK by Western blotting and activity detection of recombinant expressed EK.(A) Identification of recombinant expression EK by Western blotting.1-4:induction 1-4 h of hEGF-AWRK6/pET-30a(+) bacteria; 5:normal bacteria.(B) Bacteriostasis of EK on Pseudomonas aeruginosa.1:PBS (0.1 mol/L); 2:EK (10 mg/L); 3:EK (20 mg/L); 4:EK (30 mg/L).(C) The dose-response curve of EK's antibacterial effect. |
| |
在给药处理的第1天和第3天, EK组小鼠烫伤创面绿脓杆菌菌落数虽有减少, 但与PBS对照组差异无统计学意义。在给药第6天和第10天, EK组小鼠创面菌落数显著降低, 与PBS对照组差异极显著(P < 0.01), 但与烫伤膏组小鼠创面菌落数无显著差异(P > 0.05) (图 3)。
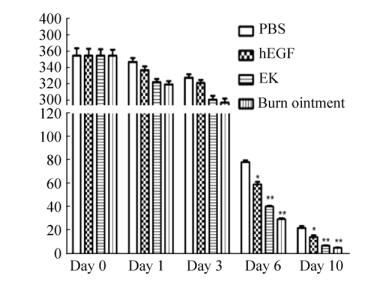
|
| 图 3 hEGF-AWRK6对模型小鼠烫伤皮肤细菌数量的影响(×106 CFU/g) Figure 3 Effect of hEGF-AWRK6 on burned skin bacterial count of model mice (×106 CFU/g). |
| |
由图 4可见, 各组小鼠初始创面直径为(0.85±0.02) cm, 随着时间推移, 各组创面逐渐缩小, 但于第6天开始, EK组小鼠创面愈合加快, 至第10天时, EK组小鼠创面直径显著小于PBS组(P < 0.01), 结果显示EK可以促进小鼠皮肤创面愈合, 缩短愈合时间。

|
| 图 4 hEGF-AWRK6对模型小鼠皮肤创面愈合的影响(n=12) Figure 4 Effect of hEGF-AWRK6 on skin wound healing in model mice (n=12). |
| |
对烫伤小鼠给药处理后的第10天组织切片结构显示, EK组小鼠创面表皮较薄, 毛囊生长较多, 有部分角质上皮, 真皮层细胞排列规则, 而PBS组小鼠创面表皮与真皮脱离, 无毛囊生长(图 5A)。小鼠在烫伤后第10天烫伤处皮肤进行Ⅰ型胶原蛋白的Western blotting检测(图 5B), 与PBS对照组相比, Ⅰ型胶原蛋白在EK组、烫伤膏组、hEGF组显著表达(P < 0.01)。在给药期间内, EK组的Ⅰ型胶原蛋白表达量与给药时间呈正相关(图 5C)。此结果表明, 融合多肽EK对小鼠皮肤创伤面修复过程具有促进作用且与促胶原蛋白表达相关。

|
| 图 5 给药10 d后皮肤创面的组织学变化(10×10)及Ⅰ型胶原蛋白的表达 Figure 5 Histological changes of the skin wound after administration of 10 d and the expression of typeⅠcollagen.(A) Histological structure of the skin wound after administration of 10 d.1:PBS group; 2:hEGF group; 3:EK group; 4:burn ointment group.(B) TypeⅠcollagen expression analysis of Western blotting results in the tenth day.(C) TypeⅠcollagen expression analysis of Western blotting in 10 days. |
| |
创面感染是临床常见的严重并发症, 其多数病原菌的耐药性随着抗生素的广泛使用呈逐年上升趋势[11]。阳离子抗菌肽可以结合带负电荷的细菌菌膜并使之裂解, 此独特的抗菌机制, 使细菌不易对其产生抗药性, 因而被认为是一类新型的抗菌药物[12-14]。Daptomycin等抗菌肽已应用于生物医药及临床治疗等领域[15-17]。
AWRK6由18个氨基酸组成, 是从东北林蛙皮肤提取并经改良获得的阳离子多肽, 富含赖氨酸, 具有广谱抗菌活性和较好的稳定性[7, 18]。人表皮生长因子(hEGF)是由51个氨基酸组成的小分子多肽, 在酸、碱、热等环境下均较为稳定, 具有广泛的生物学效应, 能刺激表皮细胞和内皮细胞的增殖, 因而创面愈合速率往往与hEGF的表达有关。hEGF己用于烧烫伤、溃疡、各类创伤以及角膜损伤等的治疗[8]。
研究表明, 可以通过融合表达的方式减少抗菌肽对宿主细胞的毒性, 降低纯化过程的降解, 从而增加表达量及活性[19]。因此, 我们利用基因工程技术构建AWRK6基因与hEGF基因的融合表达载体, 经诱导后获得了稳定表达的融合肽EK。对其功能分析的结果显示, EK具有抗出血性大肠杆菌O157、耐药金黄色葡萄球菌及铜绿假单胞菌等多种细菌的广谱抗菌活性, 并且能够显著促进上皮细胞增殖和成纤维细胞迁移[9]。
基于重组EK的上述功能, 本文进一步对EK在促创面愈合和创面感染中的治疗作用进行研究。铜绿假单胞菌为条件致病菌, 在环境中广泛分布且具有耐抗生素的特性[20], 是烧烫伤感染主要致病菌[21]。因此, 我们创建了铜绿假单胞菌小鼠Ⅱ度烫伤感染模型, 以EK干预治疗, 对创面菌落、创面愈合率及创面组织学改变进行了研究。结果显示, EK可明显缩短小鼠烫伤后的创面愈合时间, 于伤后第6-10天时, EK组小鼠创面愈合速率明显高于PBS组小鼠(P < 0.01)。这与EK分子含有hEGF功能结构域有关。有报道表明, 局部应用EGF结合早期包扎治疗能有效促进创面愈合[22]。hEGF可以与其特异的跨细胞膜表面的EGFR结合, 激活EGFR复合物中的酪氨酸激酶的活性, 从而启动特异基因的表达, 介导角质形成细胞的增殖与迁移活动, 最终可导致迅速上皮化[23-25]。给药处理第6天时, EK组小鼠创面菌落数显著低于对照组(P < 0.01), 说明EK可抑制创面细菌生长。实验结果表明, 重组表达EK治疗组小鼠的创面愈合速率明显高于单纯使用PBS组, 这可能与EK同时具有抗感染功能有关, 从而加快伤口愈合速率(图 4)。
组织在创面修复过程中往往涉及细胞外基质的形成, 其主要成分是成纤维细胞产生的胶原蛋白, 早期胶原表达在创面修复中起主要作用[26]。因此, 我们分析了小鼠创面皮肤Ⅰ型胶原表达情况。结果显示, EK干预组小鼠创面皮肤Ⅰ型胶原表达量随时间上升; 且与对照组相比, EK干预组小鼠伤后10 d时, 创面皮肤Ⅰ型胶原表达显著增加。这可能与EK的组成成分有关, 因为表皮生长因子具有加速上皮再生、促进胶原蛋白合成、刺激血管生成等作用[27]。胶原蛋白可构成创面基质, 为基底细胞的增殖和移行奠定基础, 从而为创面上皮化提供支架, 加快Ⅱ度烫伤小鼠创面的愈合。这一点在创面的组织学切片中也得到支持, 组织学分析表明, EK可促小鼠烫伤处皮肤表皮细胞的生长发育, 促进表皮毛囊的生长(图 5)。本研究还发现, EK组小鼠创面愈后没有出现瘢痕形成, 这与文献报道一致, EGF可能通过抑制TGF-β1自体释放而负调节TGF-β1的水平, 而TGF-β1与愈合瘢痕形成有直接关系[28]。也有报道表明, 创面快速上皮化会抑制成纤维细胞的过度增殖, 促进胶原蛋白的规则排列, 但其具体分子机制尚有待进一步研究[29]。
综上所述, EK可促进Ⅱ度烫伤小鼠创面愈合, 显著缩短愈合所需时间, 控制创面感染, 具有开发成为治疗感染型创伤药物的潜能。
| [1] | Saaiq M, Ahmad S, Zaib MS. Burn wound infections and antibiotic susceptibility patterns at pakistan institute of medical sciences, islamabad, pakistan. World J Plast Surg, 2015, 4(1): 9–15. |
| [2] | Hua LL, Sun C, Wang SG, et al. Lipopolysaccharide neutralization by a novel peptide derived from phosvitin. Inter Biochem Cell Biol, 2013, 45(11): 2622–2631. DOI: 10.1016/j.biocel.2013.09.002 |
| [3] | Brandenburg LO, Merres J, Albrecht LJ, et al. Antimicrobial peptides:multifunctional drugs for different applications. Polymers, 2012, 4(4): 539–560. |
| [4] |
Zhang XM, Jin LL, Wang Z, et al. Fusion expression of antimicrobial peptides in Escherichia coli.
Chin J Biotech, 2014, 30(8): 1172–1181.
(in Chinese). 张学敏, 金莉莉, 王铮, 等. 抗菌肽在大肠杆菌中的融合表达. 生物工程学报, 2014, 30(8): 1172-1181. |
| [5] | Jin LL, Song SS, Li Q, et al. Identification and characterization of a novel antimicrobial polypeptide from the skin secretion of a Chinese frog (Rana chensinensis). Int J Antimicrob Agent, 2009, 33: 538–542. DOI: 10.1016/j.ijantimicag.2008.11.010 |
| [6] | Jin LL, Li Q, Song SS, et al. Characterization of antimicrobial peptides isolated from the skin of the Chinese frog, Rana dybowskii. Comp Biochem Phys, Part B:Biochem Mol Biol, 2009, 154(2): 174–178. DOI: 10.1016/j.cbpb.2009.05.015 |
| [7] | Kim D, Wang Z, Jin LL, et al. Development of a novel antimicrobial peptide AWRK6. Bangladesh J Pharmacol, 2016, 11(2): 460–468. DOI: 10.3329/bjp.v11i2.25031 |
| [8] | Huo YN, Qiu WY, Pan Q, et al. Reactive oxygen species(ROS)are essential mediators in epidermal growth factor(EGF)-stimulated corneal epithelial cell proliferation, adhesion, migration, and wound healing. Exp Eye Res, 2009, 89(6): 876–886. DOI: 10.1016/j.exer.2009.07.012 |
| [9] | Jin L, Jiang C, Zhang X, et al. High-level expression of fusion peptide Dybowskin-2CDYa and hEGF in E.coli and its dual function. Pak J Pharm Sci, 2014, 27(S3): 637–642. |
| [10] | Dai TH, Kharkwal GB, Tanaka M, et al. Animal models of external traumatic wound infections. Virulence, 2011, 2(4): 296–315. DOI: 10.4161/viru.2.4.16840 |
| [11] | Sánchez M, Herruzo R, Marbán A, et al. Risk factors for outbreaks of multidrug-resistant Klebsiella pneumoniae in critical burn patients. J Burn Care Res, 2012, 33(3): 386–392. DOI: 10.1097/BCR.0b013e318231df95 |
| [12] | Zasloff M. Antimicrobial peptides of multicellular organisms. Nature, 2002, 415(6870): 389–395. DOI: 10.1038/415389a |
| [13] | Krugliak M, Feder R, Zolotarev VY, et al. Antimalarial activities of dermaseptin S4 derivatives. Antimicrob Agents Chemother, 2000, 44(9): 2442–2451. DOI: 10.1128/AAC.44.9.2442-2451.2000 |
| [14] | Brogden KA. Antimicrobial peptides:pore formers or metabolic inhibitors in bacteria. Nat Rev Microbiol, 2005, 3(3): 238–250. DOI: 10.1038/nrmicro1098 |
| [15] | Conlon JM, Kolodziejek J, Nowotny N. Antimicrobial peptides from ranid frogs:taxonomic and phylogenetic markers and a potential source of new therapeutic agents. Biochim Biophys Acta (BBA)-Prot Proteom, 2004, 1696(1): 1–14. DOI: 10.1016/j.bbapap.2003.09.004 |
| [16] | Schröder JM, Harder J. Antimicrobial peptides in skin disease. Drug Discov Today Ther Strateg, 2006, 3(1): 93–100. DOI: 10.1016/j.ddstr.2006.02.007 |
| [17] | Zhang LJ, Falla TJ. Antimicrobial peptides:therapeutic potential. Exp Opin Pharmacoth, 2006, 7(6): 653–663. DOI: 10.1517/14656566.7.6.653 |
| [18] |
Zhang HB, Jin LL, Wang QY. Activities of antimicrobial peptides and the reconstruction of the natural antimicrobial peptides.
Chem Life, 2011, 31(2): 227–232.
(in Chinese). 张海波, 金莉莉, 王秋雨. 抗菌肽活性及天然抗菌肽的改造. 生命的化学, 2011, 31(2): 227-232. |
| [19] | Yu FX, Wang JG, Zhang P, et al. Fusion expression of cecropin B-like antibacterial peptide in Escherichia coli and preparation of its antiserum. Biotechnol Lett, 2010, 32(5): 669–673. DOI: 10.1007/s10529-009-0196-x |
| [20] | Moradali MF, Ghods S, Rehm BH. Pseudomonas aeruginosa lifestyle:a paradigm for adaptation, survival, and persistence. Front Cell Infect Microbiol, 2017, 7: 39. |
| [21] | Dai TH, Gupta A, Huang YY, et al. Blue light rescues mice from potentially fatal Pseudomonas aeruginosa burn infection:efficacy, safety, and mechanism of action. Antimicrob Agents Chemoth, 2013, 57(3): 1238–1245. DOI: 10.1128/AAC.01652-12 |
| [22] | Hong JP, Jung HD, Kim YW. Recombinant human epidermal growth factor (EGF) to enhance healing for diabetic foot ulcers. Ann Plast Surg, 2006, 56(4): 394–398. DOI: 10.1097/01.sap.0000198731.12407.0c |
| [23] | Lu X, Kang Y. Epidermal growth factor signaling and bone metastasis. Brit J Cancer, 2010, 102(3): 457–461. DOI: 10.1038/sj.bjc.6605490 |
| [24] | Wong RWC, Guillaud L. The role of epidermal growth factor and its receptors in mammalian CNS. Cytokine Factor Rev, 2004, 15(2/3): 147–156. |
| [25] | Ching YH, Sutton TL, Pierpont YN, et al. The use of growth factors and other humoral agents to accelerate and enhance burn wound healing. Eplasty, 2011, 11: e41. |
| [26] | Javelaud D, Laboureua J, Gabison E, et al. Disruption of basal JNK activity differentially affects key fibroblast functions important for wound healing. J Biol Chem, 2003, 278(27): 24624–24628. DOI: 10.1074/jbc.M301942200 |
| [27] |
Chen BQ, Peng WY, Yu JC, et al. Research on the therapeutic effect of epidermal growth factor gel and collagen dressing in the treatment of facial deep Ⅱ degree burn.
Clin Med Eng, 2013, 20(9): 1127–1128.
(in Chinese). 陈柏秋, 彭文要, 余继超, 等. 联合表皮生长因子(EGF)凝胶和胶原贴敷料治疗面部深Ⅱ度烧伤创面的作用研究. 临床医学工程, 2013, 20(9): 1127-1128. DOI:10.3969/j.issn.1674-4659.2013.09.1127 |
| [28] | Park JS, Kim JY, Cho JY, et al. Epidermal growth factor (EGF) antagonizes transforming growth factor (TGF) -beta1-induced collagen lattice contraction by human skin fibroblasts. Biol Pharm Bull, 2000, 23(12): 1517–1520. DOI: 10.1248/bpb.23.1517 |
| [29] |
Shen J, Jin XB, Ding J, et al. Experiment study of non-mitogenetic human acidic fibroblast growth factor on improving scald wound healing in mice.
China Biotechnol, 2013, 33(3): 68–73.
(in Chinese). 沈娟, 金小宝, 丁静, 等. 非促分裂型人酸性成纤维细胞生长因子促小鼠烫伤愈合的研究. 中国生物工程杂志, 2013, 33(3): 68-73. |
 2018, Vol. 34
2018, Vol. 34




