中国科学院微生物研究所、中国微生物学会主办
文章信息
- 宋洁, 李翠, 李晶, 张爽, 范文辉, 刘丽蓉, 贾泓毅, 俞蔼毕, 郝客, 牛春艳, 王晶, 赵启祖, 刘文军
- Jie Song, Cui Li, Jing Li, Shuang Zhang, Wenhui Fan, Lirong Liu, Hongyi Jia, Yu Aibi, Hao Ke, Niu Chunyan, Wang Jing, Zhao Qizu, Liu Wenjun
- H9N2亚型流感病毒核酸参考品研制及荧光RT-PCR检测验证
- Development and verification of reference nucleic acid materials of H9N2 influenza viruses by real-time RT-PCR
- 生物工程学报, 2018, 34(10): 1579-1586
- Chinese Journal of Biotechnology, 2018, 34(10): 1579-1586
- 10.13345/j.cjb.180034
-
文章历史
- Received: January 21, 2018
- Accepted: March 9, 2018
2 中国科学院大学,北京 100049;
3 中国兽医药品监察所,北京 100081;
4 北京海淀外国语实验学校,北京 100195;
5 中国计量科学研究院,北京 100013
2 University of Chinese Academy of Sciences, Beijing 100049, China;
3 China Institute of Veterinary Drug Control, Beijing 100081, China;
4 Beijing Haidian Foreign Language Experiment School, Beijing 100195, China;
5 National Institute of Metrology, Beijing 100013, China
H9N2亚型流感病毒属于低致病性流感病毒,机体感染该病毒后一般表现为呼吸道或消化道局限性感染症状,并导致条件性致病的继发感染。病毒侵入机体后可在消化道和呼吸道内不断增殖,随粪便或分泌液排出,在外界环境中有很强的抵抗力,可存活相当长的时间,并通过污染水源、饲料或鸡舍内设施而水平传播感染。此外,该病毒可与呼吸道病原菌混合感染,增强其致病性,并加剧临床症状,提高继发感染率。
H9N2亚型流感病毒具有较强的跨宿主传播能力,不仅感染鸟类,同时也可跨宿主感染包括人在内的猪犬等哺乳动物,并在传播过程中不断与其他亚型的禽流感病毒发生重组变异[1]。尽管目前对该疫病的感染溯源还不清楚,但研究人员已从我国多地区检测到H9N2亚型流感病毒[2-3]。该病诊断常采用传统的鸡胚病毒分离法,但该方法检测成本较高,费事、费力,在某些情况下,应用RT-PCR方法来检测病原已逐步替代鸡胚病毒分离法[4],但分子生物学方法因人员操作及检测系统差异等存在较大误差,而以核酸标准物质为参比,可校准检测方法并标定被检样品。目前流感H9N2亚型病毒的核酸标准物质国内外均未见报道,且无该标准物质提供,导致H9N2亚型流感病毒核酸检测标准至今尚未统一。
为校准H9N2亚型流感病毒的分子生物学检测方法,本研究针对H9N2亚型流感病毒最具检测意义的血凝素(HA)基因片段,在扩增克隆的基础上,采用体外转录方法制备RNA,定量分装后经均匀性检验、稳定性监测及协作标定定值等。此外,采用荧光定量检测技术,以该核酸参考品为参比对临床流感样品进行检测验证。本研究旨在为H9N2亚型流感病毒核酸参考品的建立和分子生物学诊断方法标准化等研究奠定基础。
1 材料与方法 1.1 病毒核酸本研究涉及的8株H9N2亚型流感病毒来源见表 1。
| No. | Viruses strain (H9N2) | NCBI ID |
| 1 | A/chicken/NanJing/02/2001 | KF844248.1 |
| 2 | A/chicken/Shandong/LX06/2007 | FJ231865.1 |
| 3 | A/chicken/Guangdong/16/2003 | HM008899.1 |
| 4 | A/chicken/Hunan/661/2015 | Isolated |
| 5 | A/chicken/Hunan/507/2015 | Isolated |
| 6 | A/chicken/Hunan/521/2015 | Isolated |
| 7 | A/duck/Hong-Kong/Y280/1997 | AF156376.1 |
| 8 | A/turkey/Wisconsin/1/1966 | CY130054.1 |
TRIzol LS试剂购自Invitrogen公司;逆转录酶M-MLV购自Promega公司;dNTPs、Oligo dT、Taq DNA聚合酶由北京诺派生物科技有限公司惠赠;SpeⅠ核酸内切酶购自NEB公司;DNA marker、T载体转录试剂盒购自北京全式金生物技术有限公司;DNA纯化试剂盒、荧光定量RT-PCR (SYBR GreenⅠ)试剂盒购自天根生化科技有限公司;7500实时定量PCR仪购自美国应用生物系统公司;NanoDrop 1000核酸蛋白微量测定仪购自赛默飞世尔科技公司。
1.3 引物设计根据毒株HA基因的保守位点,设计引物(表 2),用于HA基因片段的扩增。
| Primers | Primer sequences (5'–3') |
| HA-F | GCTCCACACAGAGCATAAT |
| HA-R | CTTCTGTTGCCACACTCGTT |
| qHA-F | TGGGATGCTGTGTGCAAC |
| qHA-R | GAGTCAACCATCTCATGC |
将H9N2亚型流感病毒临床分离毒株、疫苗毒株与经典毒株通过序列比对,用DNAStar软件包进行遗传分析,用Neighbor-Joining Tree方法建立HA基因遗传进化树,分析毒株进化溯源关系,确定候选毒株。
将候选毒株HA基因的上下游引物进行PCR反应,反应条件为:95 ℃预变性10 min;95 ℃变性30 s,57.5 ℃退火30 s,72 ℃延伸2 min,循环30次;72 ℃延伸10 min。取反应产物用1%琼脂糖凝胶检测。
利用TA克隆法将纯化的cDNA克隆到pEASY-T5克隆载体上,反应结束后将产物转入感受态细胞中,涂布于具有氨苄青霉素(Amp) LB琼脂(2%)平皿,37 ℃倒置培养,待长出菌落后挑取单菌落进行PCR及质粒酶切鉴定。
1.5 核酸参考品的制备将鉴定过的质粒利用SpeⅠ线性化,利用体外转录试剂盒克隆出H9N2亚型流感病毒核酸参考品候选物。通过OD260/OD280的值,利用拷贝数换算公式获得拷贝数。分析其RNA拷贝数,应用RNA保存液(TRIzol:水=3:1)稀释RNA至109拷贝数/μL,将检验合格的候选物无菌、定量分装至冻存管中低温冻存,0.5 mL/管。
拷贝数计算公式为:
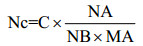
|
其中,Nc=拷贝数(copies/μL),C=浓度(g/μL= 109 ng/μL),NA=阿伏伽德罗常数=6.02×1023,NB=碱基数,MA=平均分子量。
1.6 核酸参考品的检验特异性检验:随机取样进行测序分析。
均匀性检验:随机抽取10支参考品,提取RNA并测定拷贝数,采用方差分析法统计样品均匀性。此方法是通过组间方差和组内方差的比较,来判断各组测量值之间有无系统性差异,如果两者的比小于统计检验的临界值,则认为样品是均匀的。
稳定性检测:随机选取10支参考品,–20 ℃保存,分别于0、1、6、12及24个月随机选取1支提取RNA并测定拷贝数,采用t检验确定其稳定性。
协作标定:组织4家协作标定单位按统一的协作标定方案进行协作标定。
1.7 核酸参考品定值及不确定度分析根据多方数据经统计学分析对核酸参考品进行定值,定值结果表示为:总几何平均值±总标准偏差S。
对参考品的各个不确定度分量进行合成,平均测量样品的不确定度公式为:

|
选定1个拷贝数的模板量,通过改变反应的退火温度、反应体系、引物浓度,确定最适荧光定量RT-PCR的反应条件(引物见表 2)。
将制备的参考品按梯度稀释,每个梯度做3个重复,利用荧光定量RT-PCR测出相应的扩增产物的荧光信号达到设定的阈值时的扩增循环数值(Ct值),以Ct≤35判定为阳性,得到参考品的最小检出拷贝数;以参考品的拷贝数的对数作为横坐标,以Ct值的平均值作为纵坐标做标准曲线。用不同浓度的RNA,利用荧光定量RT-PCR连续检测3次,计算变异系数,验证重复性。
1.9 核酸参考品的应用及临床样品检测临床样本来源为2015年收集于湖南省岳阳部分活禽市场的197份病死禽的组织样品及健康家禽的咽拭子,以核酸参考品为参比进行临床样品检测。
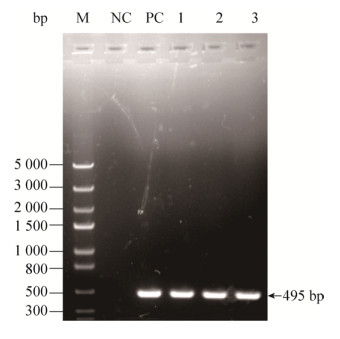
2 结果与分析 2.1 HA基因的扩增、克隆及测序对H9N2亚型流感病毒HA基因扩增鉴定,在495 bp处出现阳性特异性条带,测序成功后确定该毒株为H9N2亚型流感毒株(图 1)。
|
| 图 1 HA基因扩增电泳结果 Figure 1 Identification of HA gene of H9N2 subtype. M: DNA marker; NC: negative control; PC: positive control; 1: A/chicken/Hunan/661/2015(H9N2); 2: A/ chicken/Hunan/507/2015(H9N2); 3: A/chicken/Hunan/ 521/2015(H9N2). |
| |
毒株的进化分析结果显示,本研究中的8株病毒株均属于欧亚谱系,亲缘关系较近,具有共性序列及病毒特性。所以选择A/chicken/Hunan/ 661/2015 (H9N2)毒株作为核酸参考品候选毒株(图 2)。

|
| 图 2 H9N2亚型流感病毒HA基因遗传进化树 Figure 2 Phylogenetic tree analysis of HA genes of H9N2 AIV. ▲: isolates; ●: typical strain; Empty: vaccine strain. |
| |
经体外转录获得H9N2亚型流感病毒核酸参考品,OD260/OD280的值分别为1.99、1.95和2.03,均在2.0±0.1范围内,结果显示RNA浓度较高且稳定。计算其拷贝数为2.306×109 copies/μL。
2.4 核酸参考品的检验 2.4.1 特异性检验测序成功后确定该毒株为H9N2亚型流感毒株。
2.4.2 均匀性检测随机抽取10支参考品,提取RNA并测定拷贝数,作统计量(F,F=S12/S22=1.8,根据自由度(υ1、υ2)及给定的显著性水平α,可由F表得临界的Fα值,Fα=2.037 4 > 1.8,所以F < Fα),认为组内与组间无明显差异,样品是均匀的,均匀性计算公式如下。

|
计算得S(b1)=1.836×106,自由度为3且置信度为0.95的置信区间,t值为3.24,参考品的RNA含量均为109拷贝数/μL (copies/μL)数量级。结果显示斜率不显著,说明–20℃条件下保存24个月制备的参考品候选物稳定。
2.4.4 参考品协作标定及定值结果汇总4家协作标定单位的试验数据与本单位的数据进行统计学分析,平均值为2.102×109 copies/μL。经方差分析,总平均值的标准偏差为0.928×109 copies/μL。H9N2亚型流感病毒HA基因RNA含量的定值结果为(1.918±0.928)×109 copies/μL。
2.5 荧光定量RT-PCR反应体系的优化结果通过荧光定量RT-PCR实验分析得出,最适反应体系为25 μL,其中模板10.0 μL,引物浓度为0.4 μmol/L,Mg2+离子浓度为6 mmol/L;最适循环参数为:42 ℃ 30 min,94 ℃ 3 min;之后92 ℃ 15 s,53 ℃ 10 s,60 ℃ 35 s,40个循环。
将参考品10倍系列稀释为10–109 Copies/μL进行检测,结果显示建立的qRT-PCR方法的检测限可达10个拷贝数(图 3)。对3个不同浓度的cDNA标准模板,用所建立的荧光RT-PCR方法连续检测3次,统计各组Ct值的变异系数(CV%),均小于5%。

|
| 图 3 荧光RT-PCR敏感度检验结果 Figure 3 Sensitivity test of real-time RT-PCR. 1–9: 10–109 copies of RNA standards; 10: negative control. |
| |
用参考品作为阳性对照,对临床样本进行检测,共检出10个H9N2亚型阳性样品,与常规RT-PCR检测方法(《SN/T 1182-2010禽流感检疫技术规范》)[5]进行比较,结果一致。
3 讨论近年来H9N2亚型流感病毒不断出现,对养殖业造成了严重危害,同时也严重威胁了人类的公共卫生安全。例如2013年H9N2亚型变异毒株,鸡群感染病例被发现后,研究人员才注意到该病毒的存在[6-7]。这种被动状态严重制约着流感病毒主动预警研究,其根源是动物源流感病毒的监测技术和预防水平较低,缺乏现场快速、准确、标准化的鉴别诊断方法及计量技术。制定诊断试剂所需的核酸标准物质及建立检验标准,是推动监测技术改进、提高动物源流感病毒生物安全防控能力的根本。针对临床上常见的病毒均会有相应的标准品研发[8-9]。
本试验参考兽用生物制品规程[10],按照国家一级标准物质技术规范中标准物质的制备程序研制核酸参考品[11]。为提高产品质量,本实验采取了以下措施:一是对参考品的候选物进行筛选,尽量保证候选物的质量;二是对参考品进行了均匀性检验,保证了RNA参考品的均匀性;三是对参考品进行稳定性试验,提供了其保存期监测数据;四是组织协作标定,对不同协作标定单位的试验结果进行统计分析,最终确定了核酸参考品的含量数量级为109 copies/μL,保证了其实际使用的量值准确性。
血凝素是流感病毒囊膜纤突的主要成分之一,也是病毒表面最丰富的抗原,负责与宿主的受体结合的表面糖蛋白,能刺激机体产生中和抗体,是流感病毒的保护性抗原[12]。本研究中克隆的HA片段是经过序列比对而筛选出的保守区域。
本研究通过体外转录的方法,制备出了高拷贝的RNA模板,与质粒模板相比,更能够准确地保证转录的准确性。由于待检样品同样是RNA,相比cDNA模板而言保证了待检品与标准物质的一致,同时由于RNA容易降解,可以避免引入核酸污染,不易对环境造成污染或假阴性的结果。
临床中建立的方法通常是利用常规PCR或者多重PCR的方法[13-14],此种方法的弊端在于需要经过多重程序,实验过程中容易造成污染,另外由于该方法对模板要求较高,通常的禽流感病毒浓度偏低,容易出现假阴性,相比此种方法,本实验建立的荧光RT-PCR具有较高的灵敏度,模板浓度为10个拷贝即可检测出流感病毒,同时还可以对其进行定量。本实验建立的方法是SYBR Green Ⅰ染料法,该方法是利用荧光染料与双链DNA的结合的原理,反应中若有引物二聚体也会被收集,与TaqMan探针法相比,特异性较低[15-16]。但由于SYBR Green Ⅰ染料法引物设计容易,操作简便,经济有效。另外此方法可适用于任何形式的模板,省去了实验中不必要的环节[17-18],更适用于推广使用。
本试验建立了最佳的反应条件后,与普通检测方法相比,结果一致且更加灵敏。我们将用商品化荧光定量RT-PCR试剂盒与本研究制备的参考品及荧光定量RT-PCR方法进行平行比对,同时在比对过程中形成H9N2亚型流感病毒荧光定量RT-PCR国家标准建议。另外,临床上分离的样本不会局限于H9N2亚型流感病毒,我们后续会摸索H7及H5等亚型核酸参考品数据,作为下一步的工作重点。
综上,本试验研究的H9N2亚型流感病毒核酸参考品对我国养殖场及临床基础诊断研究领域都具有重大推广意义。
| [1] |
Sun QY, Chen Q, Xia LM. Prevalence status of H9N2 subtype avian influenza.
Prog Vet Med, 2011, 32(10): 107–111.
(in Chinese). 孙泉云, 陈琦, 夏炉明. H9N2亚型禽流感流行现状. 动物医学进展, 2011, 32(10): 107-111. DOI:10.3969/j.issn.1007-5038.2011.10.027 |
| [2] |
Zhang J, Chen LG, Zhang Y, et al. Prevalence of H9N2 subtype avian influenza virus in different regions of China during 1997 to 2015.
China Poultry, 2016, 38(20): 20–27.
(in Chinese). 张静, 陈立根, 张宇, 等. 1997-2015年我国不同地区H9N2亚型禽流感病毒流行情况研究. 中国家禽, 2016, 38(20): 20-27. |
| [3] |
Wu HY, Li MY, Fan GC, et al. Epidemiological characteristics of 33 H9N2 subtype avian influenza virus isolates.
Chin J Animal Health Inspect, 2010, 27(6): 31–33.
(in Chinese). 吴海燕, 李明义, 范根成, 等. 33株H9N2亚型禽流感病毒分离株分子流行特点的研究. 中国动物检疫, 2010, 27(6): 31-33. DOI:10.3969/j.issn.1005-944X.2010.06.019 |
| [4] |
OIE Biological Standards Commission. Manual of diagnostic tests and vaccines for terrestrial animals (Mammals, Birds and Bees). 5th ed. Paris: Office International Des Epizooties, 2004. 世界动物卫生组织著.农业部兽医局/中国动物卫生与流行病学中心译.陆生动物诊断试验和疫苗手册(哺乳动物、禽鸟与蜜蜂). 5版.巴黎: 国际兽疫局, 2007. |
| [5] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Quarantine protocol for avian influenza(SN/T 1182-2010)[EB/OL].[2011-05-01]. http://www.eshian.com/standards/16394.html. 中华人民共和国国家质量监督检验检疫总局.禽流感检疫技术规范(SN/T 1182-2010)[EB/OL].[2011-05-01]. http://www.eshian.com/standards/16394.html. |
| [6] | Qi WB, Shi WF, Li W, et al. Continuous reassortments with local chicken H9N2 virus underlie the human-infecting influenza A (H7N9) virus in the new influenza season, Guangdong, China. Prot Cell, 2014, 5(11): 878–882. DOI: 10.1007/s13238-014-0084-6 |
| [7] | Lin YP, Shaw M, Gregory V, et al. Avian-to-human transmission of H9N2 subtype influenza A viruses: relationship between H9N2 and H5N1 human isolates. Proc Natl Acad Sci USA, 2000, 97(17): 9654–9658. DOI: 10.1073/pnas.160270697 |
| [8] |
Li C, Guan FS, Dai ZH, et al. Preparation and characterization of follwing the national standard anti-Brucella abortus serum, bovine.
Chin J Biotech, 2011, 27(5): 812–816.
(in Chinese). 李翠, 关孚时, 戴志红, 等. 牛布鲁氏菌病阳性血清国家标准品的研制. 生物工程学报, 2011, 27(5): 812-816. |
| [9] |
Li C, Guan FS, Dai ZH, et al. Preparation and characterization of the national standard for Newcastle disease hemagglutination inhibition test positive serum, chicken.
Chin J Vet Drug, 2013, 47(1): 10–13.
(in Chinese). 李翠, 关孚时, 戴志红, 等. 鸡新城疫血凝抑制试验用阳性血清国家标准品的研制. 中国兽药杂志, 2013, 47(1): 10-13. |
| [10] |
Fourth Department of Agriculture Veterinary Biological Products Committee.
People's Republic of Veterinary Biological Products. Beijing: Chemical Industry Press, 2000(in Chinese).
农业部第四届兽用生物制品规程委员会. 中华人民共和国兽用生物制品规程. 北京: 化学工业出版社, 2000. |
| [11] |
National Standard Material Management Committee. Technical norm of primary standard material (JJG 1006–94)[EB/OL].[2010-12-15]. http://naccrm.china-csm.org/news_info.aspx?id=462. 全国标准物质管理委员会.一级标准物质技术规范(JJG 1006–94)[EB/OL].[2010-12-15]. http://naccrm.china-csm.org/news_info.aspx?id=462. |
| [12] | Stevens J, Corper AL, Basler CF, et al. Structure of the uncleaved human H1 hemagglutinin from the extinct 1918 influenza virus. Science, 2004, 303(5665): 1866–1870. DOI: 10.1126/science.1093373 |
| [13] | Wang YJ, Zhu SY, Hong WM, et al. A multiplex PCR for detection of six viruses in ducks. J Virol Methods, 2017, 248: 172–176. DOI: 10.1016/j.jviromet.2017.07.004 |
| [14] | Luan L, Sun ZH, Kaltenboeck B, et al. Detection of influenza A virus from live-bird market poultry swab samples in China by a pan-IAV, one-step reverse-transcription FRET-PCR. Sci Rep, 2016, 6: 30015. DOI: 10.1038/srep30015 |
| [15] | Arikawa E, Sun YY, Jie W, et al. Cross-platform comparison of SYBR®, Green real-time PCR with TaqMan PCR, microarrays and other gene expression measurement technologies evaluated in the MicroArray Quality Control (MAQC) study. BMC Genom, 2008, 9: 328. DOI: 10.1186/1471-2164-9-328 |
| [16] | Tajadini M, Panjehpour M, Javanmard SH. Comparison of SYBR Green and TaqMan methods in quantitative real-time polymerase chain reaction analysis of four adenosine receptor subtypes. Adv Biomed Res, 2014, 3: 85. DOI: 10.4103/2277-9175.127998 |
| [17] |
Zhang JH, Wang ZC, Zheng JS, et al. In vitro transcription of HA, NA and M gene of H5N1 avian influenza virus and preparation of RNA standards.
Infect Dis Info, 2011, 24(1): 26–28.
(in Chinese). 张锦海, 王忠灿, 郑纪山, 等. H5N1禽流感病毒抗原基因的体外转录及RNA标准品构建. 传染病信息, 2011, 24(1): 26-28. DOI:10.3969/j.issn.1007-8134.2011.01.009 |
| [18] | Arya M, Shergill IS, Williamson M, et al. Basic principles of real-time quantitative PCR. Expert Rev Mol Diagn, 2005, 5(2): 209–219. DOI: 10.1586/14737159.5.2.209 |
 2018, Vol. 34
2018, Vol. 34




