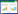中国科学院微生物研究所、中国微生物学会主办
文章信息
- 吴锡华, 李哲敏, 刘会, 王鹏, 王丽, 方雪, 孙小雯, 倪文枫, 杨强, 郑之明, 赵根海
- Wu Xihua, Li Zhemin, Liu Hui, Wang Peng, Wang Li, Fang Xue, Sun Xiaowen, Ni Wenfeng, Yang Qiang, Zheng Zhiming, Zhao Genhai
- 毕赤酵母Gpn12异戊烯基转移酶NovQ催化合成MK-3
- Synthesis of vitamin K2 by isopentenyl transferase NovA in Pichia pastoris Gpn12
- 生物工程学报, 2018, 34(1): 140-148
- Chinese Journal of Biotechnology, 2018, 34(1): 140-148
- 10.13345/j.cjb.170158
-
文章历史
- Received: April 13, 2017
- Accepted: May 31, 2017
2 中国科学技术大学 研究生院,安徽 合肥 230027
2 Graduate School, University of Science & Technology China, Hefei 230027, Anhui, China
维生素K(Vitamin K,VK)是一族含有共同化学结构2-甲基-1, 4-萘醌环的物质统称。根据萘醌环3’位置连接侧链化学结构的不同又分为不同的类别。天然存在的维生素K包括K1 (Phylloquinone,PK)和K2 (Menaquinone,MK),后又人工合成了K3等。在动物体内,维生素K1和维生素K3只有转化为维生素K2才具有生物活性[1-2]。图 1显示了维生素K1、K2及K3的化学结构。维生素K2依据侧链异戊烯单元个数n的不同[3-5],可分为14种,通常以MK-n表示,例如,n为3时称之为MK-3。

|
| 图 1 维生素K1、K2和K3 (从左到右)的化学结构式 Figure 1 Chemical structures of vitamin K1, K2 and K3 (from left to right). |
| |
维生素K2传统生理功能主要体现在促进凝血酶原的产生和增加骨钙素的合成[6-7]。新近发现维生素K2在降低肝硬化转化为肝癌的风险等方面,也有明显作用[8]。维生素K2可以采用化学合成法和微生物发酵法制备,化学法存在高能耗、高污染、副产物多和生物活性低等问题。而微生物法制备维生素K2条件温和、污染少、能耗低,产品本身来源于生物,具有高生物活性和高生物相容性。
目前报道生产维生素K2的菌株主要有黄杆菌(Flavobacterium sp.,产MK-4)[9-12]和枯草芽孢杆菌(Bacillus subtilis natto,产MK-7)[13-17]。维生素K2在生物合成时,关键的萘醌母环异戊烯基化是由异戊烯基转移酶催化完成的。novQ基因来源于球状链霉菌Streptomyces sp.和雪白链霉菌Streptomyces niveus,其产物NovQ是一种异戊烯基转移酶,主要参与合成新生霉素的环A结构。NovQ底物专一性不强,能催化多种萘醌、氢醌、酚类等化合物的异戊烯基化反应[18-19]。
巴斯德毕赤酵母作为一种成熟高效的基因工程蛋白表达系统,具有操作简单、培养方便、生长速度快、蛋白表达量高、成本低廉的优点[20-21]。作者实验室开展了采用毕赤酵母合成MK-3的研究工作[22]。以来源于雪白链霉菌的novQ基因利用pPIC9载体在GS115毕赤酵母中实现了异源表达和优化,并证实了其能使毕赤酵母合成维生素K2,主要是MK-3;虽然使用的是分泌型载体,然而在实验中发现重组毕赤酵母Gpn12在胞内产MK-3具有较大潜力,本研究在此基础上确定重组毕赤酵母全细胞催化合成MK-3的关键因素,优化催化条件,为该菌的进一步扩大生产提供一定的借鉴。
1 材料与方法 1.1 材料 1.1.1 菌种重组巴斯德毕赤酵母Pichia pastoris Gpn12由本实验室保存[22]。
1.1.2 主要试剂维生素K2(MK-4)标品购自Sigma公司;甲萘醌、异戊烯醇等为国产分析纯试剂;色谱级甲醇和二氯甲烷购自上海生工。蛋白提取缓冲液:NaCl 0.5 mol/L,氨基丁三醇0.2 mol/L,pH 7.4。无硫酸铵酵母无氨基酸氮源(YNB)10×母液:用蒸馏水配成3.4%溶液,0.22 μm滤膜过滤除菌后现用。生物素500×母液:蒸馏水配成0.02%溶液,0.22 μm滤膜过滤除菌备用。显影剂:0.1 mol/L Tis-HCl缓冲液(pH 8.5),0.2 mmol/L对羟基苯丙烯酸,1.25 mmol/L 3-氨基苯二甲酰肼,需要时现加0.024%过氧化氢。
1.1.3 培养基MGY培养基:甘油1%,硫酸铵1%,YNB 0.34%,生物素0.000 04%;BMMY培养基:酵母粉1%,YNB 0.34%,生物素4×10-5%,蛋白胨1%,0.1 mol/L磷酸钾缓冲液(pH 6.0),甲醇0.5%-3%,硫酸铵1%;MD固体培养基:YNB 0.34%,硫酸铵1%,生物素0.000 04%,葡萄糖2%,琼脂2%;BMY培养基:酵母粉1%,蛋白胨2%,0.1 mol/L磷酸钾缓冲液(pH 8.0),YNB 0.34%,硫酸铵1%,生物素0.000 04%;高密度发酵培养基:酵母粉1%,蛋白胨2%,甘油4%,0.1 mol/L磷酸钾缓冲液(pH 8.0),YNB 0.34%,硫酸铵1%,生物素0.000 04%。
1.1.4 主要仪器设备G154TW高压蒸汽灭菌锅,致微仪器有限公司;BSA124S万分天平,赛多利斯公司;数显PHS-25型pH计,上海雷磁仪器厂;J2-HS冷冻离心机,贝克曼库尔特公司;HZ200L恒温摇床,瑞华仪器设备有限公司;Essential LC-6高效液相色谱仪,岛津公司。
1.2 方法 1.2.1 重组毕赤酵母Gpn12摇瓶培养活化:28 ℃下在MD固体培养基上划线,静置培养至生长出明显菌落。挑取单菌落接种到含MGY培养基的三角瓶(25 mL/250 mL)中,28 ℃、200 r/min培养36 h。
诱导:按10%接种量,接种到含MGY培养基的三角瓶中,28 ℃、200 r/min培养36 h后,1 800 r/min离心5 min后,弃上清,用同体积BMMY重悬,同样条件培养至发酵结束。
1.2.2 甲醇诱导对重组毕赤酵母Gpn12 NovQ表达优化前期探究了初始pH、诱导温度和诱导时间对表达优化的影响[25]。其对照组条件为pH 6.0、28 ℃、72 h、3%甲醇,本文在此条件下,继续考察甲醇添加量(0.5%-3.0%)对NovQ表达的影响。并将最优甲醇添加量结果用于前期研究获得的优化后条件(pH 8.0、25 ℃、96 h、3%甲醇)。NovQ蛋白半定量以NovQ表达最高的条件为100%,并设定为对照组。
1.2.3 30 L细胞催化剂制备见前期研究文献[22]。
1.2.4 NovQ异戊烯基转移酶半定量毕赤酵母采用冷冻研磨法破碎[23]:取酵母培养物5 mL离心去除上清,用生理盐水洗涤3次,加入3 mL蛋白提取缓冲液于-20 ℃预冻1 h后,转至预冻过的研钵中,加入3 g石英砂研磨10 min。
蛋白提取:转移酵母匀浆至25 mL离心管中,用2 mL蛋白缓冲液洗涤研钵,也并入离心管中。60 ℃水浴30 min,然后13 000 r/min离心5 min,上清转移到新离心管,加入50 μL去氧胆酸溶液(2%),混匀后,4 ℃放置30 min;加入500 μL饱和三氯乙酸溶液,混匀后,4 ℃静置6 h,13 000 r/min、4 ℃离心10 min,弃上清;沉淀加4 ℃丙酮5 mL重悬洗涤,13 000 r/min、4 ℃离心10 min,弃上清,重复3次;通风橱中吹干后,加入1 mL去离子水溶解,即得含NovQ异戊烯基转移酶的胞内蛋白。
蛋白检测半定量:使用蛋白印迹技术对NovQ进行检测,Anti-6×his Tag鼠单抗为一抗,Goat Anti-Mouse IgG H & L为二抗。根据显色强度,对目标蛋白进行半定量。
1.2.5 重组毕赤酵母Gpn12全细胞催化合成MK-3条件单因素优化及响应面优化全细胞催化对照组:发酵培养物10%装液量于250 mL三角瓶中,加入甲萘醌200 mg/L、异戊烯醇2 mL/L、甲醇2%、表面活性剂十六烷基三甲基溴化铵(CTAB) 0.5%,在pH 7.5、28 ℃、200 r/min条件下催化24 h,离心收集菌体,冷冻干燥后甲醇萃取,检测MK-3产量。考察单因素为:1)初始pH 4.5-8.5,梯度为1;2)催化温度20 ℃、24 ℃、28 ℃、32 ℃;3)催化时间0、12、24、36、48 h;4)甲醇添加量0、1%、2%、3%、4%;5)甲萘醌添加量0、50、100、200、300、400 mg/L;6)异戊烯醇添加量0、0.5、1、2、3、4 mL/L;7) CTAB添加量0、0.2%、0.5%、0.8%、1.0%;其他条件同对照组。在单因素试验基础上,根据高点附近单因素方差分析选出具有显著影响的因素(P<0.05)进行Box-Behnken实验优化。
1.2.6 毕赤酵母30 L发酵罐催化合成MK-3在30 L发酵罐中先后考察催化时间和细胞催化剂浓度对MK-3产量的影响。1)催化时间:0、12、18、24、30、36、42、48、60、72、84 h;2)细胞催化剂浓度:100、140、180、220、260 g/L。毕赤酵母培养方法同1.2.3。
1.2.7 MK-3检测方法见前期研究文献[22]。
2 结果与分析 2.1 甲醇诱导条件对Gpn12表达NovQ的影响诱导剂对诱导型转录表达有直接影响,甲醇是重组毕赤酵母Gpn12的诱导剂和诱导阶段的碳源。在前期实验对照组条件下,甲醇浓度对NovQ异戊烯基转移酶的表达影响如图 2所示,NovQ表达量随着甲醇添加量的增加而增多,当甲醇添加量超过2%时,NovQ表达量反而降低,高浓度甲醇可能影响了毕赤酵母的生长代谢进而抑制NovQ的表达。图中3%甲醇添加量的条件与前期实验对照组条件完全相同。

|
| 图 2 甲醇诱导剂添加量对NovQ异戊烯基转移酶表达的影响 Figure 2 Effect of methanol on the expression of NovQ prenyltransferase in shake flask fermentation. |
| |
基于前期实验优化条件,NovQ表达的差异如图 3所示,甲醇浓度为2%时,NovQ表达量提高了36%左右。

|
| 图 3 不同甲醇诱导条件下NovQ表达结果比较(A:前期优化的NovQ表达;B:A基础上甲醇优化后的NovQ表达) Figure 3 Comparison of NovQ expression results under different methanol-induced conditions. A: novQ expression of early optimization; B: novQ expression after methanol optimization based on A. |
| |
在活细胞催化实验中,pH同时影响着酶活性和细胞状态。初始pH对MK-3产量影响如图 4所示,在pH 5.5-8.5范围,随着pH上升,MK-3产量增加;到pH 7.5时,MK-3达到高点,之后MK-3产量随pH上升反而降低。
2.2.2 催化温度对MK-3产量影响温度是影响酶催化反应的重要因素之一。如图 4所示,催化温度28 ℃以下时,MK-3产量随温度升高而降低,28 ℃时MK-3产量仅为75 mg/L左右。随着催化温度升高至32 ℃,MK-3产量达到88 mg/L左右,与20 ℃催化时MK-3产量大致相当。在BRENDA酶数据库中查到,NovQ异戊烯基转移酶(EC 2.5.1.111)最适温度是30 ℃。结合实验结果,选定了与NovQ最适温度较为接近且MK-3产量较高的32 ℃作为下一步探索条件。
2.2.3 催化时间对MK-3产量影响活细胞催化时间对MK-3产量的影响如图 4所示,MK-3产量在催化进行12 h达到高点,之后无明显上升。时间过长时,细胞活力降低,合成速率低于分解速率,导致MK-3产量下降。36、48 h数据波动可能与液体蒸发有一定关系。
|
| 图 4 初始pH、催化温度和时间对MK-3产量的影响 Figure 4 Effect of initial pH, catalytic temperature and time on MK-3 production. |
| |
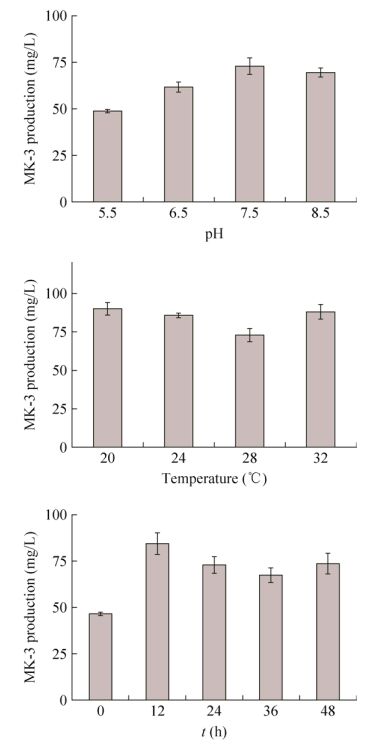
如图 5所示,甲醇添加量在2%以下时,MK-3产量呈微小上升趋势,而后随着甲醇添加量上升,MK-3产量略微下降。维生素K2类化合物生物合成中异戊烯基焦磷酸合成需要能量,甲醇是催化过程中毕赤酵母的碳源和诱导剂,但其添加量对于MK-3产量的影响不明显。
|
| 图 5 甲醇、甲萘醌、异戊烯醇和CTAB对MK-3产量的影响 Figure 5 Effect of methanol, menadione, isopentenol and CTAB on MK-3 production. |
| |
重组毕赤酵母Gpn12通过芳香族异戊烯基转移酶NovQ催化萘醌环异戊烯基化。维生素K2类化合物前体甲萘醌对MK-3产量的影响如图 5所示,MK-3产量随着甲萘醌添加量上升基本呈现上升趋势,当甲萘醌添加量达300 mg/L时达到高点,随后呈下降趋势。
2.2.6 异戊烯醇对MK-3产量的影响Gpn12能自身通过复杂不明确的过程转化异戊烯醇合成寡聚异戊二烯[24],作为MK-n (n<4)的R基侧链。异戊烯醇对MK-3的影响如图 5所示,在其添加量达到3 mL/L时,MK-3产量达到高点。
2.2.7 CTAB对MK-3产量的影响表面活性剂CTAB对MK-3产量影响如图 5所示,随着CTAB添加量增加,MK-3产量上升,在CTAB达到0.8%后不再增加。可能原因是在CTAB达到临界胶束浓度之前,在水中呈单分子状态,不形成胶团,浓度上升可加大对细胞膜磷脂分子层的破坏,提高细胞膜的通透性,使前体进入细胞中,促进MK-3的合成;而随着浓度达到临界胶束浓度,继续增加浓度只会形成胶团,憎水基团隐藏在胶团内核,不具备继续增加细胞膜通透性的作用。
2.2.8 响应面优化在单因素结果高点附近进行单因素方差分析,发现温度、甲萘醌添加量、催化时间具有显著影响(P<0.05),对这3个显著因素继续进行响应面分析。表 1所示为响应面设计实验因素水平和编码。
| Factor | Level | ||
| -1 | 0 | 1 | |
| A (℃) | 30 | 32 | 34 |
| B (h) | 6 | 12 | 18 |
| C (mg/L) | 250 | 300 | 350 |
根据Design-Expert进行Box-Behnken设计,以MK-3产量为响应值,温度(A)、甲萘醌添加量(B)、催化时间(C)为自变量,进行三因素三水平实验。实验设计及结果如表 2所示。
| Trail | A | B | C | Yield (mg/L) |
| 1 | -1 | -1 | 0 | 86.04 |
| 2 | 0 | -1 | -1 | 83.15 |
| 3 | 0 | -1 | 1 | 93.55 |
| 4 | 1 | -1 | 0 | 80.18 |
| 5 | -1 | 0 | 1 | 89.92 |
| 6 | -1 | 0 | -1 | 81.29 |
| 7 | 0 | 0 | 0 | 93.82 |
| 8 | 0 | 0 | 0 | 94.85 |
| 9 | 0 | 0 | 0 | 94.87 |
| 10 | 0 | 0 | 0 | 95.84 |
| 11 | 0 | 0 | 0 | 92.08 |
| 12 | 1 | 0 | 1 | 82.81 |
| 13 | 1 | 0 | -1 | 72.51 |
| 14 | -1 | 1 | 0 | 87.21 |
| 15 | 0 | 1 | 1 | 91.52 |
| 16 | 0 | 1 | -1 | 79.57 |
| 17 | 1 | 1 | 0 | 74.96 |
得到回归方程为:
Y=94.29-4.25A-1.21B+5.16C-1.60AB+0.42AC+ 0.39BC-8.75A2-3.44B2-3.90C2,R2=0.9878。
由表 3方差分析结果可知,模型拟合程度极显著(P<0.001),R2=0.987 8,表明模型与实际拟合良好;Adj-R2=97.22%,表明模型对MK-3产量变化可以很好解释;失拟不显著(P=0.767 8),表明模型不需要添加项,与实验拟合较好。
| Source | MS | F-value | P value | |
| Model | 95.17 | 63.21 | <0.0001 | Significant |
| A | 144.50 | 95.97 | <0.0001 | |
| B | 11.66 | 7.75 | 0.0272 | |
| C | 213.00 | 141.47 | <0.0001 | |
| AB | 10.21 | 6.78 | 0.0352 | |
| AC | 0.70 | 0.46 | 0.5181 | |
| BC | 0.60 | 0.40 | 0.5477 | |
| A2 | 322.72 | 214.33 | <0.0001 | |
| B2 | 49.82 | 33.09 | 0.0007 | |
| C2 | 64.20 | 42.64 | 0.0003 | |
| Lack of Fit | 0.79 | 0.39 | 0.7678 | Not significant |
用Design-Expert预测MK-3在三因素-1到1水平内最大值为96.475 mg/L。对应温度为31.6 ℃,甲萘醌添加量为295.59 mg/L,催化时间为15.87 h。三个平行实验验证MK-3产量为98.29、99.39、97.73 mg/L,平均产量为98.47 mg/L,与MK-3最大预估值相对误差为2.07%。
2.3 毕赤酵母30 L发酵罐催化结果分析 2.3.1 催化时间对MK-3产量的影响毕赤酵母于发酵罐中培养诱导之后,在搅拌速率500 r/min、pH 7.5、温度31.6 ℃、甲醇2%、CTAB 0.8%、异戊烯醇3 mL/L、甲萘醌295.6 mg/L催化条件下,催化时间对MK-3的影响如图 6所示。催化开始,MK-3含量迅速增加,在24 h达到高点,之后呈下降趋势。在相同时间内,发酵罐中产物积累快于摇瓶中积累,高点产量提高,时间延后。可能原因是在发酵罐中,pH、溶氧等条件维持稳定,细胞活力保持较长时间,利于MK-3合成。

|
| 图 6 催化时间和细胞催化剂浓度对发酵罐中MK-3产量的影响 Figure 6 Effect of catalytic time and cell catalyst concentration on MK-3 production in fermenter. |
| |
催化时间24 h、其他同2.3.1催化条件下,毕赤酵母细胞催化剂浓度对MK-3的影响如图 6所示。随着细胞催化剂浓度升高,MK-3产量呈上升趋势,在细胞催化剂浓度220 g/L时达到高点189.67 mg/L,随后不再继续升高。可能原因是细胞催化剂在一定范围内浓度升高有利于MK-3的合成,但是浓度过高会使细胞生存环境恶化,不利于细胞活力的维持。
3 结论重组毕赤酵母Gpn12能异源表达异戊烯基转移酶基因novQ,并催化MK-3的合成。在NovQ表达上,本研究对甲醇添加量进行探究,发现在2%甲醇添加量时,NovQ表达比之前的研究提高了36%左右。在MK-3合成条件优化方面,在摇瓶中探究了催化时间、催化温度和甲醇添加量等7个因素对MK-3产量的影响,并对单因素方差分析筛选出的初始pH、催化温度和甲萘醌添加量3个因素进行了响应面优化,最终优化后条件为初始pH 7.5、催化温度31.6 ℃、甲醇添加量2%、甲萘醌295.59 mg/L、异戊烯醇3 mL/L、催化时间15.87 h和CTAB 0.8%,此时MK-3产量达到98.47 mg/L,比优化前提高了35%;30 L发酵罐中催化合成MK-3,发现在细胞催化剂初始浓度220 g/L和催化时间24 h时,MK-3产量达到189.67 mg/L,比前期研究结果提高了1倍以上,表明高浓度细胞催化明显提高产量,有利于提高设备利用,提升生产强度。鉴于目前毕赤酵母表达和发酵的成熟工艺,本研究可显著推进异戊烯基转移酶NovQ产业化生产及应用进程。
| [1] | Dam H. The antih morrhagic vitamin of the chick: occurrence and chemical nature. Nature, 1935, 135(3417): 652–653. |
| [2] | Meurer J, Meierhoff K, Westhoff P. Isolation of high-chlorophyll-fluorescence mutants of Arabidopsis thaliana and their characterisation by spectroscopy, immunoblotting and northern hybridisation. Planta, 1996, 198(3): 385–396. DOI: 10.1007/BF00620055 |
| [3] | Bentley R, Meganathan R. Biosynthesis of vitamin K (menaquinone) in bacteria. Microbiol Rev, 1982, 46(3): 241–280. |
| [4] | Collins MD. Isoprenoid quinines//Goodfellow M, O'Donnell AG. Chemical Methods in Prokaryotic Systematics. New York: John Wiley & Sons, 1994: 265-309. |
| [5] | Collins MD, Jones D. Distribution of isoprenoid quinone structural types in bacteria and their taxonomic implication. Microbiol Rev, 1981, 45(2): 316–354. |
| [6] |
Lei Z, Fu ZQ, Mu XY, et al. Vitamin K2——a new drug of osteoporosis prevention and treatment.
Chin J Osteoporos, 2010, 16(1): 60–63.
(in Chinese). 雷泽, 付正启, 木晓云, 等. 维生素K2——新型骨质疏松防治药物. 中国骨质疏松杂志, 2010, 16(1): 60-63. |
| [7] | Schapira D, Linn S, Sarid M, et al. Calcium and vitamin D enriched diets increase and preserve vertebral mineral content in aging laboratory rats. Bone, 1995, 16(5): 575–582. DOI: 10.1016/8756-3282(95)00088-U |
| [8] | Habu D, Shiomi S, Tamori A, et al. Role of vitamin K2 in the development of hepatocellular carcinoma in women with viral cirrhosis of the liver. JAMA, 2004, 292(3): 358–361. DOI: 10.1001/jama.292.3.358 |
| [9] | Taguchi H, Kita S, Tani Y. Enzymatic alteration in the shikimate pathway during derivation of menaquinone-4-producing mutants of Flavobacterium sp. 238-7. Agric Biol Chem, 1991, 55(3): 769–773. |
| [10] | 田口久貴, 谷吉樹. ビタミンKの菌体外生産. バイオサイエンスとインダストリー, 1991, 49(5): 510-512. |
| [11] | Tan M, Liu H, Li ZM, et al. Optimization medium composition for vitamin K2 by Flavobacterium sp. using response surface methodology and addition of Arachis hypogaea. Braz Arch Biol Technol, 2016, 59: e16150343. |
| [12] | Taguchi H, Shibata T, Tani Y. Selective release of menaquinone-4 from cells of a mutant of Flavobacterium sp. 238-7 with a detergent. Biosci Biotechnol Biochem, 1995, 59(6): 1137–1138. DOI: 10.1271/bbb.59.1137 |
| [13] | Mahanama R, Berenjian A, Valtchev P. Enhanced production of menaquinone 7 via solid substrate fermentation from Bacillus subtilis. Int J Food Eng, 2011, 7(5). DOI: 10.2202/1556-3758.2314 |
| [14] | Mahanama R, Berenjian A, Regtop H, et al. Modeling menaquinone 7 production in tray type solid state fermenter. Anziam J, 2012, 53: C354–C372. DOI: 10.21914/anziamj.v53i0.5103 |
| [15] | Berenjian A, Mahanama R, Talbot A, et al. Advances in menaquinone-7 production by Bacillus subtilis natto: fed-batch glycerol addition. Am J Biochem Biotechnol, 2012, 8(2): 105–110. DOI: 10.3844/ajbbsp.2012.105.110 |
| [16] | Song JY, Liu HX, Wang L, et al. Enhanced production of vitamin K2 from Bacillus subtilis (natto) by mutation and optimization of the fermentation medium. Braz Arch Biol Technol, 2014, 57(4): 606–612. |
| [17] | Berenjian A, Mahanama R, Talbot A, et al. Designing of an intensification process for biosynthesis and recovery of menaquinone-7. Appl Biochem Biotechnol, 2014, 172(3): 1347–1357. DOI: 10.1007/s12010-013-0602-7 |
| [18] | Ozaki T, Mishima S, Nishiyama M, et al. NovQ is a prenyltransferase capable of catalyzing the addition of a dimethylallyl group to both phenylpropanoids and flavonoids. J Antibiot, 2009, 62(7): 385–392. DOI: 10.1038/ja.2009.48 |
| [19] | Winkelblech J, Fan AL, Li SM. Prenyltransferases as key enzymes in primary and secondary metabolism. Appl Microbiol Biotechnol, 2015, 99(18): 7379–7397. DOI: 10.1007/s00253-015-6811-y |
| [20] |
Zhu TC, Li Y. Recent development of Pichiapastoris system: current status and future perspective.
Chin J Biotech, 2015, 31(6): 929–938.
(in Chinese). 朱泰承, 李寅. 毕赤酵母表达系统发展概况及趋势. 生物工程学报, 2015, 31(6): 929-938. |
| [21] |
Li SY, Zhao GP, Wang J. Enabling technologies in synthetic biology——DNA synthesis, assembly and editing.
Chin J Biotech, 2017, 33(3): 343–360.
(in Chinese). 李诗渊, 赵国屏, 王金. 合成生物学技术的研究进展——DNA合成、组装与基因组编辑. 生物工程学报, 2017, 33(3): 343-360. |
| [22] | Li ZM, Zhao GH, Liu H, et al. Biotransformation of menadione to its prenylated derivative MK-3 using recombinant Pichia pastoris. J Ind Microbiol Biotechnol, 2017, 44(7): 973–985. DOI: 10.1007/s10295-017-1931-2 |
| [23] |
Kong MH, Cao ZW, Xu F. A simple and efficient method to break yeast cell by dry-frozen grinding.
J Anhui Agric Sci, 2010, 38(29): 16124–16126.
(in Chinese). 孔明惠, 曹佐武, 徐放. 一种高效干冻研磨破碎酵母细胞的方法. 安徽农业科学, 2010, 38(29): 16124-16126. DOI:10.3969/j.issn.0517-6611.2010.29.016 |
| [24] | Henry LK, Gutensohn M, Thomas ST, et al. Orthologs of the archaeal isopentenyl phosphate kinase regulate terpenoid production in plants. Proc Natl Acad Sci USA, 2015, 112(32): 10050–10055. DOI: 10.1073/pnas.1504798112 |
| [25] |
Li WN, Shang ZF, Duan ZG, et al. Production of gastric-mucosa protective collagen Ⅲ by Pichia pastoris.
Chin J Biotech, 2017, 33(4): 672–682.
(in Chinese). 李伟娜, 尚子方, 段志广, 等. 毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能. 生物工程学报, 2017, 33(4): 672-682. |
 2018, Vol. 34
2018, Vol. 34