中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李敬达, 余承洁, 王仁军, 付常振, 修志龙, 刘庆平
- Li Jingda, Yu Chengjie, Wang Renjun, Fu Changzhen, Xiu Zhilong, Liu Qingping
- 慢病毒介导CD36基因沉默细胞株的构建及其对caveolin-1蛋白表达的影响
- Construction of CD36 gene silencing cell lines by lentivirus-mediated RNA interference and the effect on protein expression of caveolin-1
- 生物工程学报, 2018, 34(1): 110-121
- Chinese Journal of Biotechnology, 2018, 34(1): 110-121
- 10.13345/j.cjb.170135
-
文章历史
- Received: March 31, 2017
- Accepted: April 20, 2017
2 大连大学 生命科学与技术学院 辽宁省糖脂代谢重点实验室,辽宁 大连 116600
2 Key Laboratory of Glucolipid Metabolism in Liaoning Province & College of Life Science and Technology, Dalian University, Dalian 116600, Liaoning, China
近年来,动脉粥样硬化(Atherosclerosis,AS)所引发的心脑血管疾病已成为导致人类死亡的主要原因[1-2]。脂类代谢紊乱与慢性炎症反应是动脉粥样硬化发病过程中的重要因素[1, 3-4],与其相关的主要事件包括:血管内皮损伤、单核细胞浸润入内皮下转变为巨噬细胞、泡沫细胞的形成、脂质沉积、血小板激活、平滑肌细胞迁移与增生等[2],其中独立致病因子氧化低密度脂蛋白(Oxidized low density lipoprotein,oxLDL)所诱发的巨噬细胞泡沫化在动脉粥样硬化发病机制中发挥了核心作用[3-7]。在动脉粥样硬化发生的起始阶段,单核细胞趋化而来的巨噬细胞能够通过其细胞膜表面的清道夫受体CD36、SR-AI等,大量吞噬血管内膜空间中的oxLDL,并以胆固醇酯的形式存储于细胞中。随着动脉粥样硬化环境的加深,巨噬细胞摄取胆固醇的速度逐渐加快,进而引起胆固醇在细胞中的过度积累,最终导致了巨噬细胞的泡沫化和动脉粥样硬化斑块的形成[3-7]。
CD36作为巨噬细胞表面的主要清道夫受体,介导了约70%的oxLDL摄取作用[3-6]。研究显示,CD36能够特异性识别并结合oxLDL,进而启动细胞内的MAPK (Mitogen-activated protein kinase)信号传导,激活JNK、ERK、p38蛋白激酶活性,导致胆固醇过量吞噬摄取以及泡沫细胞的形成[7-9]。此外,在oxLDL的作用下,CD36还可经由蛋白激酶C (Protein kinase C,PKC)活化核转录因子NF-κB的转录活性,促进肿瘤坏死因子及白介素-6等炎症因子的表达及释放,最终引发血管炎症反应并加速了动脉粥样硬化进程[10-13]。
Caveolin-1作为组成脂筏结构的主要蛋白,密切参与了胆固醇的摄取及细胞内运输作用[14-18]。之前的研究结果表明,在caveolin-1基因敲除小鼠中,CD36的蛋白表达显著下调,并且停留于细胞内高尔基复合体中,不能定向作用于细胞膜,暗示caveolin-1的表达可能是CD36到达膜表面发挥摄取功能所必需的因素[19-20]。为了进一步研究CD36在巨噬细胞泡沫化过程中的作用及其与caveolin-1的关系,本文以小鼠巨噬细胞J774A.1为研究对象,通过慢病毒介导的shRNA干扰技术构建了稳定的CD36基因沉默细胞株,并以此为模型分析了CD36在caveolin-1蛋白表达过程中的作用,为后续研究CD36功能及巨噬细胞泡沫化的机制奠定了基础。
1 材料与方法 1.1 主要材料小鼠巨噬细胞(J774A.1)和人胚肾细胞(HEK293T,后文简称293T)购于美国组织培养中心;Anti-CD36 (sc-9154)抗体购于美国圣克鲁斯公司;Anti-caveolin-1 (610407)抗体购于BD生物公司;Anti-ERK1/2(A0229)、Anti-p-ERK1/2 (AP0472)、Anti-JNK (A0288)抗体购于ABclonal公司;Anti-β-actin (ab8226)、Anti-p-JNK (ab124956)购于Abcam公司;人源LDL、DiI-oxLDL及DiI-LDL购于北京协生生物科技有限公司;FITC及HRP标记的山羊抗兔二抗购于KPL公司;ERK (PD98059)及JNK (SP600125)生物学抑制剂购于Calbiochem公司;psiCHECK™-Ⅱ质粒、双荧光素酶报告基因检测试剂盒及退火缓冲液购于Promega公司;pLKO.1慢病毒shRNA表达载体、慢病毒包装载体psPAX2及PMD2.G购于Addgene公司,Lipofectamin 2000、DMEM medium及Opti-MEM medium购于Invitrogen公司;RIPA细胞裂解液、蛋白预染marker、BCA蛋白浓度检测试剂盒及ECL显色液购于碧云天生物技术有限公司;JM109克隆菌,pMD 19-T simple vector,LA Taq酶,DNA连接试剂盒,限制性内切酶XhoⅠ、NotⅠ、BamHⅠ,DNA marker DL 2000,DNA凝胶回收试剂盒,RT-PCR试剂盒,质粒提取试剂盒均购自TaKaRa公司;超滤管、PVDF薄膜、Amp抗生素及常用试剂均购自生工生物工程(上海)股份有限公司;PCR引物合成及DNA测序由生工生物工程(上海)股份有限公司完成。
1.2 方法 1.2.1 小鼠源CD36的cDNA基因克隆根据GenBank提供的小鼠源CD36的cDNA序列,利用软件Primer5.0设计扩增引物。
上游引物(引物1):5′-CCGCTCGAGATGG GCTGTGATCGGAACTG-3′。
下游引物(引物2):5′-ATAGTTTAGCGGCCGCGCCAGTGTATATGTAGGCTCATCC-3′。
其中引物1中5′端含有保护碱基(斜体)、XhoⅠ酶切位点(下划线)以及CD36 5′端部分氨基酸编码基因序列;引物2中5′端含有保护碱基(斜体)、NotⅠ酶切位点(下划线)以及CD36 3′端部分氨基酸编码基因的互补序列。
使用Trizol抽提法提取J774A.1细胞中的总RNA,之后通过RT-PCR试剂盒反转录为cDNA,并以此为模板,使用引物1、2对CD36的cDNA基因序列进行PCR扩增。反应条件为:95 ℃预变性1 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸1.5 min,共30个循环;72 ℃终延伸10 min。PCR产物经过1%琼脂糖凝胶电泳鉴定后再由凝胶回收试剂盒回收目的基因,并连接至pMD19-T simple vector中。将连接产物转化至JM109感受态菌,涂布于含有Ampicillin (50 μg/mL)抗性的LB平板,获得的菌落进行PCR鉴定,并挑选阳性克隆扩大培养后送至生工生物工程(上海)股份有限公司测序。测序结果与GenBank提供的小鼠CD36的cDNA序列比对,鉴定序列正确后将重组质粒命名为pMD19-T-CD36。
1.2.2 psiCHECK-Ⅱ-CD36重组表达载体的构建及鉴定将含有pMD19-T-CD36及psiCHECK™-Ⅱ质粒的JM109克隆菌分别扩大培养并进行质粒提取,用XhoⅠ、NotⅠ对质粒进行双酶切。切胶回收酶切产物CD36片段和psiCHECK™-Ⅱ载体片段。使用DNA连接试剂盒将二者按照1:10的摩尔比,16 ℃连接过夜。连接产物转化入JM109感受态细胞,培养过夜后挑选阳性菌落扩大培养并提取质粒,使用XhoⅠ、NotⅠ双酶切鉴定连接情况,将构建成功的重组质粒命名为psiCHECK-Ⅱ-CD36。
1.2.3 CD36-shRNA序列设计及慢病毒干扰载体的构建根据GenBank数据库中小鼠CD36基因编码序列(登录号:NM 001159558),按照RNA干扰序列设计原则使用Invitrogen公司在线shRNA序列分析设计软件,设计5对针对目的基因的shRNA干扰序列及一对Scramble shRNA对照序列(表 1)。之后通过BLAST同源性搜索分析,确定干扰序列及对照序列的特异性,所设计的序列由生工生物工程(上海)股份有限公司负责合成。每对合成的互补shRNA序列溶于退火缓冲液中,沸水浴5 min后自然冷却到室温。之后通过DNA连接试剂盒将退火处理后带有黏性末端的双链干扰序列与经BamHⅠ和XhoⅠ双酶切的线性化pLKO.1慢病毒载体进行连接,连接产物转化感受态细胞JM109,挑选阳性克隆,进行测序鉴定。测序正确后根据干扰序列靶向位点将重组干扰载体分别命名为355-shRNA、393-shRNA、992-shRNA、1 325-shRNA、1 329-shRNA及scramble-shRNA。
| Start site | GC% | shRNA sequence (DNA) |
| shRNA-355 | 52.39 | Sense strand: 5′-GATCCGGAGCCATCTTTGAGCCTTCAGAGTACTG TGAAGGCTCAAAGATGGCTCCTTTTTTC-3′ Antisense strand: 3′-GCCTCGGTAGAAACTCGGAAGTCTCATGAC ACTTCCGAGTTTCTACCGAGGAAAAAAGAGCT-5′ |
| shRNA-393 | 42.86 | Sense strand: 5′-GATCCGGATGACAACTTCACAGTTCTGAGTACTG AGAACTGTGAAGTTGTCATCCTTTTTTC-3′ Antisense strand: 3′-GCCTACTGTTGAAGTGTCAAGACTCATGAC TCTTGACACTTCAACAGTAGGAAAAAAGAGCT-5′ |
| shRNA-992 | 42.86 | Sense strand: 5′-GATCCGCAAATGCAAAGAAGGAAAGCGAGTACTG GCTTTCCTTCTTTGCATTTGCTTTTTTC-3′ Antisense strand: 3′-GCGTTTACGTTTCTTCCTTTCGCTCATGAC CGAAAGGAAGAAACGTAAACGAAAAAAGAGCT-5′ |
| shRNA-1 325 | 52.39 | Sense strand: 5′-GATCCGCATGGTAGAGATGGCCTTACGAGTACTG GTAAGGCCATCTCTACCATGCTTTTTTC-3′ Antisense strand: 3′-GCGTACCATCTCTACCGGAATGCTCATGAC CATTCCGGTAGAGATGGTACGAAAAAAGAGCT-5′ |
| shRNA-1 329 | 52.39 | Sense strand: 5′-GATCCGGTAGAGATGGCCTTACTTGGGAGTACTG CCAAGTAAGGCCATCTCTACCTTTTTTC-3′ Antisense strand: 3′-GCCATCTCTACCGGAATGAACCCTCATGAC GGTTCATTCCGGTAGAGATGGAAAAAAGAGCT-5′ |
| shRNA-scramble | 52.39 | Sense strand: 5′-GATCCGGCCTATTTGGACGAAGAGTGGAGTACTG CACTCTTCGTCCAAATAGGCCTTTTTTC-3′ Antisense strand: 3′-GCCGGATAAACCTGCTTCTCACCTCATGAC GTGAGAAGCAGGTTTATCCGGAAAAAAGAGCT-5′ |
293T细胞37 ℃、5% CO2条件下贴壁培养于含有10%胎牛血清的高糖DMEM培养基中。转染前24 h,将处于生长对数期的293T细胞以每孔2×105个细胞的密度接种于24孔板中。培养过夜后,待细胞生长至80%-90%融合度时,将5种干扰质粒及对照质粒(Scramble-shRNA)分别与psiCHECK-Ⅱ-CD36质粒共转染入293T细胞中,转染操作方法参照Lipofectamin 2000 transfection rengent使用说明书。转染48 h后收集细胞,使用双荧光素酶报告基因检测试剂盒及多功能酶标仪测定细胞裂解液中化学发光强度。以单独转染psiCHECK-Ⅱ-CD36质粒作为阴性对照并规定干扰效率为零,计算其他shRNA的干扰效率。
1.2.5 慢病毒的包装与纯化将处于对数生长期的293T细胞以每孔1×106个细胞的密度接种于6孔板中,培养过夜后,待细胞融合度为80%-90%时,参照Lipofectamin 2000 transfection rengent使用说明书将筛选得到的干扰载体及对照载体(Scramble-shRNA)分别与辅助包装载体psPAX2、pMD2.G共转染入293T细胞中。转染48 h后,离心收集富含慢病毒颗粒的细胞上清液。上清液经0.45 μm滤膜过滤去除细胞碎片后,使用100K孔径的超滤管,4 000 r/min离心30 min对毒液进行浓缩。病毒浓缩液分装至EP管中,-80 ℃保存备用。
1.2.6 慢病毒感染及CD36稳定沉默细胞株的建立J774A.1细胞37 ℃、5% CO2条件下贴壁培养于含10%胎牛血清的高糖DMEM培养基中(另外含有100 IU/mL的青霉素、0.1 mg/mL链霉素10 mmol/L碳酸氢钠和1 mmol/L丙酮酸钠)。将处于对数生长期的J774A.1细胞以每孔1×106个细胞的密度接种于6孔板中。培养24 h后,弃去孔中原有培养基,向孔中加入1 mL含有溴化己二甲胺(终浓度8 μg/mL)的培养基及100 μL CD36-shRNA病毒浓缩液(对照细胞组中加入scramble-shRNA病毒浓缩液)。由于所选用的pLKO.1慢病毒干扰载体的骨架中含有嘌呤霉素抗性基因(载体基因图谱如图 2所示),因此病毒感染12 h后,各孔更换为含有嘌呤霉素抗性(终浓度3 μg/mL)的培养基对被感染细胞进行筛选。此后每隔1 d更换嘌呤霉素抗性培养基继续培养。待细胞生长至80%-90%融合度时,将细胞转接至培养瓶中,并使用嘌呤霉素抗性培养基持续培养。嘌呤霉素筛选30 d后,采用Western blotting及激光共聚焦显微镜对稳转细胞株中CD36基因沉默效果进行测定。
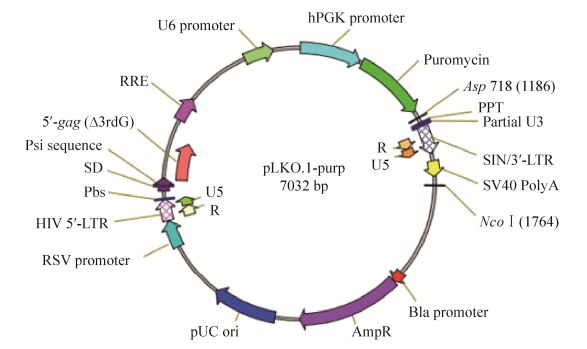
|
| 图 2 pLKO.1载体基因图谱 Figure 2 Map of the pLKO.1 vector. |
| |
使用RIPA裂解液分别提取三组细胞(NCr:野生型J774A.1细胞组;shRNACD36: CD36-shRNA慢病毒感染细胞组;SCr: Scramble-shRNA慢病毒感染细胞组)的全蛋白,并用BCA蛋白检测试剂盒测定各组样品中总蛋白浓度。以每孔80 μg的蛋白量上样,12% SDS-PAGE胶对样品进行电泳分离。转膜、封闭后,抗CD36抗体(1:1 000) 4 ℃孵育过夜。TBST缓冲液洗膜3次,每次10 min,之后室温条件下孵育山羊抗兔的二抗稀释液(1:1 000) 1 h。TBST洗膜后,ECL显色,化学发光成像系统分析检测结果。
1.2.8 激光共聚焦显微镜观察细胞膜表面CD36基因沉默效果将处于对数生长期的3组细胞(野生型J774A.1细胞组、CD36-shRNA慢病毒感染细胞组、Scramble-shRNA慢病毒感染细胞组)分别以每皿2.5×105个细胞的密度接种于激光共聚焦小皿中。培养过夜后,弃去原有培养基,向小皿中央加入200 μL含有DiI-oxLDL或DiI-LDL (终浓度为20 μg/mL)的新鲜培养基,37 ℃继续培养1 h。PBS清洗细胞3次后,使用4%多聚甲醛固定细胞10 min,并用1% gelatin与抗CD16/CD32抗体(1:100)的混合液封闭细胞1 h。PBS洗3次后,加入抗CD36抗体(1:100)。37 ℃孵育2 h后,使用FITC标记的抗兔二抗(1:100),37 ℃条件下孵育细胞1 h。孵育结束后PBS洗去非特异性结合的二抗,最后上机检测。
1.2.9 JNK与EKR的特异性抑制剂对caveolin-1蛋白表达的影响将处于对数生长期的J774A.1细胞以1×106个/孔的密度接种于六孔板。过夜培养后,使用JNK或EKR的特异性抑制剂SP600125 (10 μmol/L)、PD98059 (10 μmol/L)预处理细胞30 min,之后更换含有oxLDL (终浓度为30μg/mL)的新鲜培养基刺激细胞12 h。Western blotting检测抑制剂对caveolin-1蛋白表达的影响情况。
1.2.10 Western blotting检测CD36基因沉默对caveolin-1蛋白表达的影响将处于对数生长期的各组细胞(野生型J774A.1细胞组、CD36-shRNA慢病毒感染细胞组、Scramble-shRNA慢病毒感染细胞组),以1×106个/孔的密度接种于六孔板。过夜培养后,将各孔中原有培养基更换为含有相应浓度oxLDL的培养基,进行给药刺激处理(oxLDL浓度及刺激时间如结果图中所示)。待刺激处理结束后消化收集细胞并提取细胞总蛋白,之后对样品进行Western blotting检测分析。
1.2.11 统计学分析实验数据均来自至少3次重复实验的平均值和标准差(SE),所有实验数据两组间比较均经Student’s-test检验,**P<0.01表示差异具有统计学意义。
2 结果 2.1 小鼠源CD36的cDNA基因克隆及psiCHECK-Ⅱ-CD36重组表达载体的构建PCR扩增得到CD36的cDNA基因片段经琼脂糖凝胶电泳分析,其条带大小与GenBank数据库中一致(图 1A)。将PCR产物回收后连接于pMD19-T simple vector,并送交生工生物工程(上海)股份有限公司测序,使用Sequencher软件对测序结果进行比对分析,结果显示目的片段无突变。
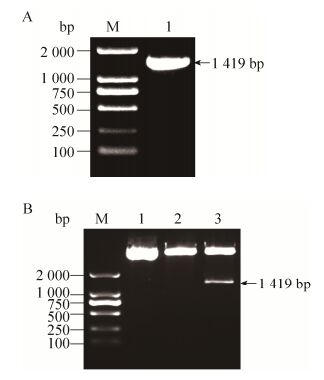
|
| 图 1 psiCHECK-Ⅱ-CD36载体的构建 Figure 1 Construction of psiCHECK-Ⅱ-CD36 vector. (A) Analysis of PCR product of CD36 by agarose gel electrophoresis. M: DL2000 marker; 1: PCR product of CD36 (1 419 bp). (B) Analysis of psiCHECK-Ⅱ-CD36 vector by restriction enzyme digestion. M: DL2000 marker; 1: psiCHECK-Ⅱ-CD36 plasmid; 2: digestion of psiCHECK-Ⅱ-CD36 plasmid by XhoⅠ; 3: digestion of psiCHECK-Ⅱ-CD36 plasmid by XhoⅠ and NotⅠ. |
| |
将构建成功的pMD19-T-CD36载体及psiCHECK-Ⅱ载体分别进行XhoⅠ、NotⅠ双酶切,之后将目的基因片段连接至载体酶切片段并转化入JM109克隆菌中,涂布于Ampicillin抗性平板。挑选平板上阳性菌落扩大培养,并提取重组质粒进行XhoⅠ、NotⅠ双酶切鉴定。经琼脂糖凝胶电泳分析,发现酶切片段大小与预期一致(图 1B),证明CD36的cDNA基因片段已克隆至psiCHECK-Ⅱ载体中,获得psiCHECK-Ⅱ-CD36重组表达载体。
2.2 CD36-shRNA慢病毒干扰载体的构建将设计合成的干扰序列及对照序列进行退火处理,所形成的双链DNA片段连接至含有嘌呤霉素抗性的pLKO.1载体中(图 2),并转化入JM109菌株。挑取阳性克隆菌送至生工生物工程(上海)股份有限公司测序鉴定。测序结果(略)显示插入序列无碱基突变,证明CD36-shRNA慢病毒干扰载体构建成功。
2.3 有效CD36-shRNA序列的筛选由于J774A.1细胞为难转染型细胞,因此很难通过瞬时转染的方法筛选获得有效shRNA。为此,本文使用Promega公司的siCHECKTM系统对shRNA进行筛选。该系统的筛选原理是:psiCHECKTM-Ⅱ载体同时含有萤火虫荧光素酶和海肾荧光素酶报告基因,当目的基因插入到海肾荧光素酶基因下游多克隆位点时,能够形成海肾荧光素酶基因与目的基因的融合序列。将含有目的基因的psiCHECKTM-Ⅱ重组载体与shRNA干扰载体共转染入293T细胞后,萤火虫荧光素酶基因及融合序列得以转录。如果设计的shRNA为无效序列,则融合序列中海肾荧光素酶可被翻译。如果shRNA为有效序列,则能够启动干扰机制降解融合序列,导致融合序列中海肾荧光素酶基因无法翻译,降低海肾荧光素酶的活性,从而达到筛选有效shRNA的目的(有关shRNA筛选的详细原理、方法及步骤参照Promega公司siCHECKTM vectors及Dual-Luciferase® reporter assay system产品说明书)。本文中将5条CD36-shRNA慢病毒干扰载体及对照载体分别与psiCHECK-Ⅱ-CD36质粒共转染入293T细胞中。转染48 h后,收集细胞,使用双荧光素酶报告基因检测试剂盒及多功能酶标仪测定化学发光并计算干扰效率。结果如图 3所示,与Blank对照(未经转染的293T细胞)及SCr对照(转染scramble-shRNA的293T细胞)相比,1 325-shRNA干扰效果最好,CD36的mRNA表达水平降低了97%,可作为有效CD36基因沉默干扰序列。

|
| 图 3 有效shRNA的筛选 Figure 3 The screening of efficient shRNA. ** P < 0.01 versus the Blank control group. |
| |
使用制备好的CD36-shRNA及scramble-shRNA慢病毒颗粒分别感染J774A.1细胞。之后通过嘌呤霉素筛选出具有抗性的CD36基因沉默细胞株及对照细胞株(Scramble-shRNA),并通过Western blotting检测各组细胞中CD36蛋白表达水平。结果如图 4A所示,与野生型J774A.1细胞(NCr)及scramble-shRNA对照细胞(SCr)相比,CD36基因沉默细胞(shCD36)中CD36蛋白表达水平大幅降低。进一步的激光共聚焦结果显示(图 4B),基因沉默细胞株细胞膜表面上的CD36 (绿色)及结合的DiI-oxLDL (红色)含量较野生型J774A.1细胞及scramble-shRNA对照细胞明显减少,并且随着CD36的基因沉默,与CD36相结合的DiI-oxLDL (黄色)的数量也大幅降低。上述结果表明成功构建了具有生物学活性的CD36基因沉默巨噬细胞株。
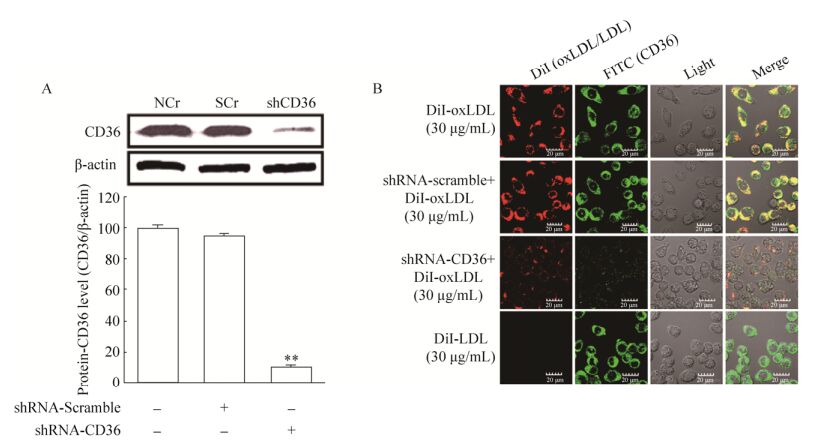
|
| 图 4 CD36基因沉默效率分析 Figure 4 CD36 silencing efficiency assays. (A) The CD36 silencing efficiency assays by Western blotting (NCr: wild J774A.1 cells; SCr: scramble-shRNA infection control; shCD36: CD36-shRNA infection control, **P < 0.01 versus the SCr control group). (B) The CD36 silencing efficiency assays by confocal microscopy. |
| |
Caveolin-1作为脂筏结构中的主要蛋白,在巨噬细胞对oxLDL的摄取及细胞内胆固醇的转运过程中发挥了关键作用[14-18]。研究显示,在巨噬细胞中caveolin-1的蛋白表达受MAPK蛋白激酶家族成员JNK及ERK的调控[21]。本文以J774A.1巨噬细胞为研究对象,观察了oxLDL的刺激作用对巨噬细胞caveolin-1蛋白表达的影响。结果如图 5A-B所示,在不同浓度及不同时间的oxLDL刺激下,J774A.1巨噬细胞中caveolin-1蛋白表达显著上调,且上调作用呈浓度及作用时间依赖性。当使用30 μg/mL oxLDL刺激细胞12 h后,caveolin-1的蛋白表达水平达到顶峰,较未刺激组升高3.25倍(**P<0.01)。此外,oxLDL的刺激作用能够明显上调蛋白激酶JNK及ERK的磷酸化水平(图 6A)。进一步的抑制剂实验结果显示,使用SP600125 (JNK)与PD98059 (ERK)抑制剂预处理J774A.1细胞能够显著抑制oxLDL诱导的caveolin-1蛋白表达上调作用(图 6B)。与对照组相比,SP600125组、PD98059组及联合处理组的caveolin-1蛋白表达分别下调了60%、45%和70% (**P<0.01)。以上结果表明oxLDL能够通过JNK/ERK信号传导上调caveolin-1的表达。

|
| 图 5 oxLDL浓度及时间梯度作用对caveolin-1蛋白表达的影响 Figure 5 The dose-dependent and time-dependent effects of oxLDL in caveolin-1 protein expression. (A) The dose-dependent effect of oxLDL in caveolin-1 protein expression. (B) The time-dependent effects of oxLDL in caveolin-1 protein expression (** P < 0.01 versus the untreated group). |
| |

|
| 图 6 oxLDL经由JNK及ERK信号通路上调caveolin-1的蛋白表达 Figure 6 oxLDL upregulate caveolin-1 protein expression through the JNK/ERK-mediated signal pathway. (A) oxLDL upregulate the phosphorylation level of JNK and ERK. (B) The effects of the inhibitors for JNK and ERK in caveolin-1 protein expression (** P < 0.01 versus the untreated control group). |
| |
为了进一步研究CD36基因沉默对caveolin-1蛋白表达的影响,我们使用30 μg/mL oxLDL分别刺激野生型J774A.1细胞(NCr)、scramble-shRNA对照细胞(SCr)及CD36沉默细胞(shCD36) 12 h。Western blotting结果显示(图 7A),CD36的基因沉默能够显著性抑制oxLDL诱导的caveolin-1蛋白表达。与NCr对照组(野生型J774A.1细胞)及SCr对照组(Scramble-shRNA感染细胞)相比,CD36基因沉默细胞中oxLDL诱导的caveolin-1蛋白表达降低了70% (**P<0.01)。此外,使用30 μg/mL oxLDL分别刺激处理各组细胞30 min后发现,CD36的基因沉默能够明显抑制oxLDL诱导的MAPK蛋白激酶JNK及ERK的磷酸化作用(图 7B)。以上结果表明,在oxLDL的刺激作用下,CD36能够激活巨噬细胞内MAPK蛋白激酶JNK及ERK的磷酸化,从而上调了caveolin-1的蛋白表达。
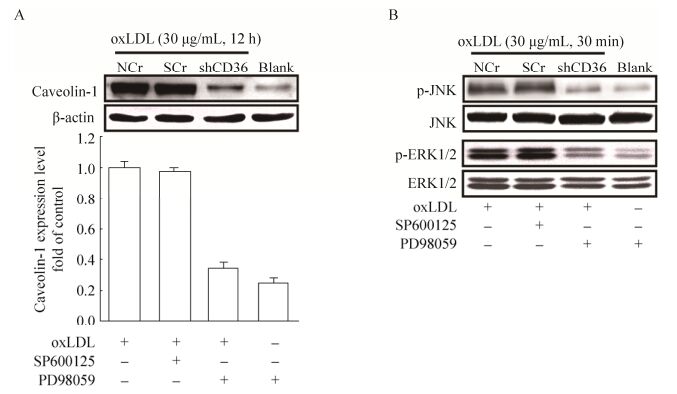
|
| 图 7 CD36经由JNK/ERK信号通路调控caveolin-1的蛋白表达 Figure 7 CD36 modulates the caveolin-1 protein expression through the JNK/ERK-mediated signal pathway. (A) The effect of CD36 in the oxLDL-induced caveolin-1 protein expression. (B) The effect of CD36 in the oxLDL-induced JNK and ERK phosphorylation (NCr: wild J774A.1 cells; SCr: scramble-shRNA infection control; shCD36: CD36-shRNA infection control; Blank: the CD36-shRNA infection cell without oxLDL stimulation, **P < 0.01 versus the SCr control group). |
| |
巨噬细胞的泡沫化是动脉粥样硬化发生与发展的核心环节,目前认为巨噬细胞泡沫化的主要机制包括:胆固醇摄入过多,细胞内胆固醇转运异常、胆固醇过度堆积和胆固醇流出受阻等[4-6]。清道夫受体CD36密切参与了巨噬细胞的泡沫化过程,贡献了大约60%-70%的胆固醇酯聚集[3-6]。Rahaman等的研究结果显示,CD36能够启动细胞内MAPK信号传导通路,活化蛋白激酶JNK及ERK,促进胆固醇的摄入作用[7-8]。此外,CD36还能够通过PKC及p38等蛋白激酶激活过氧化物酶体增殖物激活受体γ (Peroxisome proliferator-activated receptor γ,PPARγ)的转录活性,上调胆固醇酰基转移酶1 (Acyl-CoA:cholesterol acyltransferase 1,ACAT1)及自身的蛋白表达,加速了胆固醇的脂化及积累作用,最终导致巨噬细胞泡沫化的形成[1, 4]。综上所述,CD36所介导的细胞信号传导通路,在巨噬细胞泡沫化过程中发挥了至关重要的作用。
Caveolin-1作为构成脂筏结构的关键蛋白,协同参与了CD36介导的胆固醇摄取过程。研究发现,CD36受体蛋白在细胞膜表面主要定位于由caveolin-1参与组成的胞膜窖(Caveolea)结构中,而caveolin-1的基因沉默能够显著阻止CD36由高尔基复合体向细胞膜的运输作用,进而抑制了由CD36介导的胆固醇摄取作用及相关信号传导的发生[20, 22]。同时,在caveolin-1基因敲除小鼠中,动脉粥样硬化的程度明显减弱,表明caveolin-1的表达能够明显促进动脉粥样硬化的发生[19]。
巨噬细胞中caveolin-1的蛋白表达受MPAK蛋白激酶JNK及ERK的调节[21],而CD36能够调节JNK与ERK的活性,暗示CD36受体与caveolin-1的蛋白表达可能存在着密切的调控关系。为了进一步研究CD36的功能及其在调控caveolin-1蛋白表达过程中的作用,我们构建了CD36基因沉默巨噬细胞模型。由于J774A.1巨噬细胞为难转染型细胞,因此通过普通的瞬时转染技术很难获得高效稳定的基因沉默细胞株。鉴于慢病毒系统在应用过程中的优势,本文选择使用慢病毒介导的shRNA干扰技术进行CD36基因沉默细胞模型的构建。首先我们设计合成了5条针对CD36的shRNA干扰序列,并将其构建入慢病毒干扰载体中,之后使用Promega公司的siCHECKTM系统筛选得到有效的CD36-shRNA干扰序列。将慢病毒干扰载体与病毒包装质粒共转染入293T细胞,包装得到慢病毒颗粒。慢病毒感染J774A.1细胞后,经嘌呤霉素筛选获得稳定的CD36基因沉默细胞株。Western blotting检测证实CD36基因沉默细胞株中CD36的干扰效率可达90%,进一步的激光共聚焦结果显示,基因沉默细胞株表面上的CD36含量显著减少,并且随着CD36的基因沉默,与之相结合的DiI-oxLDL数量也大幅降低,证明构建得到的CD36基因沉默巨噬细胞株具有良好的生物学活性。之后我们以此为平台研究了CD36在caveolin-1蛋白表达过程中的作用。我们的结果显示,CD36的基因沉默显著降低caveolin-1上游的MAPK蛋白激酶JNK及ERK的磷酸化水平,进而抑制了caveolin-1的蛋白表达,证明CD36能够经由JNK及EKR信号传导调节caveolin-1的蛋白表达。考虑到caveolin-1在巨噬细胞泡沫化过程中的促进作用,结合本研究的结果,我们推测CD36作为巨噬细胞表面重要的受体分子,除能够直接参与oxLDL的摄取作用外,还可通过启动细胞内MAPK细胞信号传导上调caveolin-1的蛋白表达,进一步加速细胞泡沫化的进程。本研究首次揭示了CD36在oxLDL诱导的caveolin-1蛋白表达过程中的作用,为全面了解巨噬细胞脂代谢通路以及今后以此为靶点研究治疗动脉粥样硬化的策略奠定了理论基础。
| [1] | Yu XH, Fu YC, Zhang DW, et al. Foam cells in atherosclerosis. Clin Chim Acta, 2013, 424: 45–252. |
| [2] | Weber C, Noels H. Atherosclerosis: current pathogenesis and therapeutic options. Nat Med, 2011, 17(11): 1410–1422. DOI: 10.1038/nm.2538 |
| [3] | Collot-Teixeira S, Martin J, McDermott-Roe C, et al. CD36 and macrophages in atherosclerosis. Cardiovasc Res, 2007, 75(3): 468–477. DOI: 10.1016/j.cardiores.2007.03.010 |
| [4] | Chistiakov DA, Bobryshev YV, Orekhov AN. Macrophage-mediated cholesterol handling in atherosclerosis. J Cell Mol Med, 2016, 20(1): 17–28. DOI: 10.1111/jcmm.12689 |
| [5] | Nicholson AC, Hajjar DP. CD36, oxidized LDL and PPARγ: pathological interactions in macrophages and atherosclerosis. Vasc Pharmacol, 2004, 41(4/5): 139–146. |
| [6] | Nicholson AC. Expression of CD36 in macrophages and atherosclerosis the role of lipid regulation of PPARγ signaling. Trends Cardiovasc Med, 2004, 14(1): 8–12. DOI: 10.1016/j.tcm.2003.09.004 |
| [7] | Rahaman SO, Lennon DJ, Febbraio M, et al. A CD36-dependent signaling cascade is necessary for macrophage foam cell formation. Cell Metab, 2006, 4(3): 211–221. DOI: 10.1016/j.cmet.2006.06.007 |
| [8] | Li WZ, Wang D, Chi Y, et al. 7-Ketocholesteryl-9-carboxynonanoate enhances the expression of ATP-binding cassette transporter A1 via CD36. Atherosclerosis, 2013, 226(1): 102–109. DOI: 10.1016/j.atherosclerosis.2012.10.038 |
| [9] | Feng JW, Han JH, Pearce SFA, et al. Induction of CD36 expression by oxidized LDL and IL-4 by a common signaling pathway dependent on protein kinase C and PPAR-γ. J Lipid Res, 2000, 41(5): 688–696. |
| [10] | Park YM. CD36, a scavenger receptor implicated in atherosclerosis. Exp Mol Med, 2014, 46(6): e99. DOI: 10.1038/emm.2014.38 |
| [11] | Kunz A, Abe T, Hochrainer K, et al. Nuclear factor-κB activation and postischemic inflammation are suppressed in CD36-null mice after middle cerebral artery occlusion. J Neurosci, 2008, 28(7): 1649–1658. DOI: 10.1523/JNEUROSCI.5205-07.2008 |
| [12] | Xie CH, Ng H, Nagarajan S. OxLDL or TLR2-induced cytokine response is enhanced by oxLDL-independent novel domain on mouse CD36. Immunol Lett, 2011, 137(1/2): 15–27. |
| [13] | Zhao M, Liu YW, Wang XF, et al. Activation of the p38 MAP kinase pathway is required for foam cell formation from macrophages exposed to oxidized LDL. APMIS Acta Pathol Microbiol Immunol Scand, 2002, 110(6): 458–468. DOI: 10.1034/j.1600-0463.2002.100604.x |
| [14] | Auriac A, Willemetz A, Canonne-Hergaux F. Lipid raft-dependent endocytosis: a new route for hepcidin-mediated regulation of ferroportin in macrophages. Haematologica, 2010, 95(8): 1269–1277. DOI: 10.3324/haematol.2009.019992 |
| [15] | Sowa G. Caveolae, caveolins, cavins, and endothelial cell function: new insights. Front Physiol, 2012, 2: 120. |
| [16] | Frank PG, Cheung MWC, Pavlides S, et al. Caveolin-1 and regulation of cellular cholesterol homeostasis. Am J Physiol Heart Circ Physiol, 2006, 291(2): H677–H686. DOI: 10.1152/ajpheart.01092.2005 |
| [17] | Ikonen E, Parton RG. Caveolins and cellular cholesterol balance. Traffic, 2000, 1(3): 212–217. DOI: 10.1034/j.1600-0854.2000.010303.x |
| [18] | Gargalovic P, Dory L. Caveolins and macrophage lipid metabolism. J Lipid Res, 2003, 44(1): 11–21. DOI: 10.1194/jlr.R200005-JLR200 |
| [19] | Frank PG, Marcel YL, Connelly MA, et al. Stabilization of caveolin-1 by cellular cholesterol and scavenger receptor class B type Ⅰ. Biochemistry, 2002, 41(39): 11931–11940. DOI: 10.1021/bi0257078 |
| [20] | Frank PG, Lee H, Park DS, et al. Genetic ablation of caveolin-1 confers protection against atherosclerosis. Arterioscler Thromb Vasc Biol, 2004, 24(1): 98–105. DOI: 10.1161/01.ATV.0000101182.89118.E5 |
| [21] | Wu CC, Wang SH, Kuan II, et al. OxLDL upregulates caveolin-1 expression in macrophages: role for caveolin-1 in the adhesion of oxLDL-treated macrophages to endothelium. J Cell Biochem, 2009, 107(3): 460–472. DOI: 10.1002/jcb.v107:3 |
| [22] | Eyre NS, Cleland LG, Tandon NN, et al. Importance of the carboxyl terminus of FAT/CD36 for plasma membrane localization and function in long-chain fatty acid uptake. J Lipid Res, 2007, 48(3): 528–542. DOI: 10.1194/jlr.M600255-JLR200 |
 2018, Vol. 34
2018, Vol. 34