中国科学院微生物研究所、中国微生物学会主办
文章信息
- 何石宝, 殷娅茹, 郑茜, 郭东东, 辛佳, 朱勇
- He Shibao, Yin Yaru, Zheng Xi, Guo Dongdong, Xin Jia, Zhu Yong
- 家蚕保幼激素结合蛋白Bmtol基因的克隆及功能分析
- Expression and characterization of juvenile hormone binding protein Bmtol gene in silkworm, Bombyx mori
- 生物工程学报, 2018, 34(1): 78-89
- Chinese Journal of Biotechnology, 2018, 34(1): 78-89
- 10.13345/j.cjb.170104
-
文章历史
- Received: March 14, 2017
- Accepted: June 7, 2017
家蚕是一种鳞翅目昆虫的模式生物,又是一种重要的经济昆虫,在我国拥有相当长的饲养历史。同时,家蚕又属于变态发育昆虫,在整个生活发育史中要经历卵、幼虫、蛹、成虫4个阶段,从幼虫到成虫的生长、发育等过程主要受到保幼激素(Juvenile hormone,JH)和蜕皮激素(20-hydroxyecdysone,20E)的调控[1]。家蚕激素(保幼激素、蜕皮激素等)的合成分泌器官、生物合成途径及对生长发育调控等的研究,是20世纪内分泌学和昆虫发育生物学研究的典范[2]。而保幼激素结合蛋白(Juvenile hormone binding protein,JHBP)是JH在体内转运和发挥功能的载体,是Takeout/JHBP蛋白家族的一个总称[3-5]。
Takeout (TO)蛋白是昆虫独有的一类蛋白家族,又称保幼激素结合蛋白(Juvenile hormone binding protein,JHBP)。Sarov-Blat L等[6]首先在果蝇Drosophila melanogaster中被鉴定到该蛋白并命名DmTO。to基因家族是昆虫在长期进化过程中形成的,为其独有的一个大的基因家族,其编码的蛋白为分泌蛋白,序列长度为250个氨基酸左右,多数成员在N端有一段18-23个氨基酸残基的信号肽[6-10]。而且TO/JHBP蛋白家族的多数成员在N端都有2个相当保守的Cys残基,参与二硫键的形成,且对配体结合能力也非常重要[6-11],但配体种类还未有明确报道。Hamiaux等[12]利用硫的单波长反常衍射(Sulfur-single wavelength anomalous diffraction,S-SAD)技术首次报道了雄性苹浅褐卷蛾Epiphyas postvittana中EpTO1的晶体结构,该结构包含4个α螺旋和5个β折叠,Cys8和Cys15形成一个二硫键,连接于N末端和α1螺旋的第一个弯曲,并认为该部位是TO蛋白与配体结合的核心部位。2013年,Fujimoto等[13]利用硒代蛋氨酸的单波长反常衍射技术对家蚕JHBP的结构进行了研究,并构建了晶体模型,发现与其他昆虫TO蛋白家族的结构极其相似。在物种中TO和Takeout-like (TOL)都属于TO/JHBP蛋白家族家族成员,它们之间都有相同保守的结构域。
to基因在昆虫体内的表达也具有组织特异性,比如,Sarov-Blat等[6]利用原位杂交技术发现to基因主要在果蝇的前胃和嗉囊中有高量表达,在脑和触角中也有表达。Dauwalder等[8]通过原位杂交发现to在雌果蝇的头部和脂肪体中没有出现,只在雄果蝇的头部和脂肪体中分布。Du等[9]通过原位杂交发现在烟草天蛾Manduca sexta 5龄2 d幼虫的头部、胸及腹部表皮中表达,而其他组织中均没有被检测到。Justice等[14]在研究冈比亚按蚊Anopheles gambiae时发现TOL蛋白主要在触角中表达。Bohbot和Vogt在埃及伊蚊Aedes aegypti雄性的触角中分离出to基因[15]。Fujikawa等[10]通过蛋白印迹发现TOL蛋白在黑花蝇Phormia regina的触角和下唇须中高表达,而在其他组织中没有检测到。Saito等[16]在家蚕中鉴定了几种to家族基因,并通过Northern杂交发现Bman-0128、Bman-0147、Bman-0921、Bmbrp-1649和Bmbrp-2095主要在脂肪体中表达,Bman-0128、Bmbrp-2095和Bmbrp-1649在中肠和丝腺中表达,Bmbrp-1649还在表皮中有表达。Hagai等[17]在意大利蜜蜂Apis mellifera腹部和头部检测到有to表达,而在其他组织中没有检测到。Jordan等[18]从雄性苹浅褐卷蛾中发现了4个TO蛋白家族成员。而Schwinghammer等[19]发现TO蛋白在美洲散白蚁Reticulitermes flavipes的工蚁、兵蚁及若虫的多个组织中也均有表达。
目前,TO/JHBP蛋白在果蝇中的功能研究得比较透彻,其功能研究主要在化学感受器(如触角、下唇须等)和营养组织(如脂肪体、前胃等)。Sarov-Blat等[6]在果蝇中发现了一个新to基因与果蝇取食行为的节律调控有关,随后,So等[7]也发现了一个新的果蝇生物钟调控输出基因。Meunier等[20]在果蝇中发现,Dmto编码了一种类似于JHBP的TO蛋白,通过它可以提高果蝇饥饿时味觉系统对糖分的敏感性,从而增加取食量,进而调节果蝇体内的营养平衡。Dauwalder等[8]研究中发现TO/JHBP蛋白只在雄果蝇的头部和脂肪体表达,却不在雌果蝇的头部和脂肪体中表达,他们还发现,TO受体细胞性别决定通路中2种转录因子的调控,分别为fruitless (fru)和doublesex (dsx),调控与性别特异性功能相关的多种调控因子,故TO/JHBP蛋白主要通过对性别信号进行加工整合,进而影响雄性的求偶行为。Du等[9]发现烟草天蛾的to/JHBP基因家族可以维持表皮细胞中JH的含量,同时也受到JH和营养状况的调控。Bohbot等[15]在埃及伊蚊的触角中发现TO蛋白高量表达,可推测TO蛋白对宿主、食物或信息素气味分子有化学感应。在黑花蝇中通过免疫组织化学实验表明TOL蛋白主要分布于辅助细胞的细胞膜周围和唇瓣味觉感受器的淋巴液中,这表明了TOL蛋白也可能对昆虫的感受系统有调控作用[10]。Hagai等[17]在意大利蜜蜂的研究中发现TO蛋白的表达受到发育相关因子JH调控。Bauer等[21]发现如果TO的表达量增多,会延长果蝇的寿命。那么Bmtol基因在家蚕头部、表皮和精巢中的表达是否也参与生物节律、取食活动、性别分化和求偶行为等调控?这些问题都需要回答。
本研究筛选并鉴定得到了一个新的保幼激素结合蛋白Bmtol基因,并对Bmtol基因进行原核表达、蛋白纯化和制备抗体,同时对该蛋白进行表达情况分析及免疫组化分析,以期为进一步研究在其家蚕头部和精巢中的功能奠定基础。
1 材料与方法 1.1 材料与试剂实验用的家蚕品种大造由西南大学生物技术学院家蚕育种实验室提供。幼虫在(25±1) ℃、相对湿度70%、自然光照条件下桑叶饲养。分别对供试家蚕从收蚁至化蛾各时期和5龄3 d各组织进行取材,置于-80 ℃保存。
取正常生长且健康的5龄起蚕90头,随机分成3组,第1组饲喂不作任何处理的新鲜桑叶;第2组为实验组添食0.1 mg/L JHA浸泡的新鲜桑叶,每天分别添食1次,连续处理3 d,其他为正常桑叶饲喂;第3组为对照组添食0.1 mg/L丙酮溶液浸泡的新鲜桑叶,每天分别添食1次,连续处理3 d,其他为正常桑叶饲喂;然后在第5天开始取材,用4%的多聚甲醛进行固定。
BL21 (DE3)感受态细胞购自北京全式金公司;pMD19-T vector克隆载体、M-MLV反转录酶、Taq DNA聚合酶、限制性内切酶、T4 DNA连接酶等购自TaKaRa公司;pET28a表达载体由本实验室保存;IPTG、Ampicilline、X-Gal、Kanamycin购自生工生物工程(上海)股份有限公司;Ni-NTA亲和层析介质和引物购自南京金斯瑞公司;琼脂糖购自Invitrogen公司;酵母粉、蛋白胨购自OXOID公司;JHA (苯氧威)购自Sigma公司;其他未标明试剂均为国产分析纯。
1.2 Bmtol基因克隆与鉴定从SilkDB和NCBI中获取家蚕Bmtol基因的芯片数据,找出相对应芯片号与基因之间的对应关系,查找基因并整理基因的表达数据,初步对Bmtol基因的表达情况进行预测。同时又通过NCBI数据库进行在线BLAST软件检索找到一条与家蚕数据库相似基因的预测序列,并没有前人报道和克隆该基因的编码序列,故初步判定为新基因。故对编码区设计引物,引物序列见表 1,以大造5龄3 d整蚕的RNA为模板,利用M-MLV反转录酶合成cDNA的第一条链,并用内参基因BmActin3进行检测,反应程序:95 ℃预变性4 min;94 ℃变性35 s,55 ℃退火30 s,72 ℃延伸40 s,反应30个循环;再在72 ℃进行终延伸10 min,用1%的琼脂糖凝胶电泳检测,经染色后观察确认满足后续实验需要。以总cDNA为模板,进行PCR扩增,反应程序:95 ℃预变性4 min;94 ℃变性45 s,55 ℃退火30 s,72 ℃延伸50 s,反应30个循环;再在72 ℃进行终延伸10 min,用1%的琼脂糖凝胶电泳检测,经染色后观察并进行胶回收。将目的片段连接到pMD19-T载体上,转化到DH5α大肠杆菌中,通过菌液PCR筛选阳性克隆菌,送至华大基因进行测序验证。
| Gene name | Primers sequences (5′-3′) | Using |
| Bmtol | F: CTGTTTACTACAAGGGAACACG | Cloning |
| R: TTCATTCGCCTTTAAACATTTT | ||
| Bmtol- BamHⅠ | F: CGGGATCCAAGAAACAGATCCCCGGCTACATAC | Prokaryotic expression |
| Bmtol- XhoⅠ | R: CCGCTCGAGTTAAGGTTTGGGCAGTAGTTCGTTG | |
| BmActin3 | F: AACACCCCGTCCTGCTCACTG | Reference |
| R: GGGCGAGACGTGTGATTTCCT | ||
| Note: the underlined is the restriction site. | ||
将研钵和研棒洗净用160 ℃高温烘4-6 h。研磨前用液氮预冷研钵和研棒,分别将5龄3 d的家蚕各组织和收蚁到化蛾各时期的材料放入研钵中,并在液氮中研磨成粉末,此过程中要反复添加液氮,避免其完全挥发。利用Trizol试剂(TaKaRa)提取家蚕各组织和各时期的总RNA,并利用M-MLV反转录酶,合成cDNA第一链。利用表 1中的内参引物,以家蚕5龄3 d幼虫各组织器官和各时期的cDNA为模板,进行PCR扩增检测,反应程序:95 ℃预变性4 min;94 ℃变性35 s,55 ℃退火30 s,72 ℃延伸40 s,反应30个循环;再在72 ℃进行终延伸10 min,用1%的琼脂糖凝胶电泳检测,经染色后观察确认满足后续实验需要。对检测后的cDNA模板表达特征分析,反应程序:95 ℃预变性4 min;94 ℃变性45 s,55 ℃退火30 s,72 ℃延伸50 s,反应30个循环;再在72 ℃进行终延伸10 min,用1%的琼脂糖凝胶电泳检测,对PCR扩增产物进行1%琼脂糖凝胶电泳,EB染色观察。
1.4 Bmtol基因的原核表达、蛋白纯化及抗体制备对BmTOL序列进行信号肽和跨膜分析发现,该蛋白含有一段信号肽序列,没有跨膜区,故对非信号肽区域设计原核表达引物,见表 1。以家蚕大造5龄3 d整蚕cDNA为模板,进行PCR扩增,扩增条件同1.2。对PCR产物进行扩增和胶回收,克隆到pMD19-T载体上(命名为pMD19-Bmtol),转化到DH5α大肠杆菌中,通过菌液PCR筛选出阳性克隆菌,送至华大基因进行测序验证。将pET28a质粒载体与pMD19-Bmtol重组质粒用BamHⅠ和XhoⅠ限制性内切酶进行双酶切,并回收双酶切产物,构建pET28a-Bmtol重组表达载体,转化至BL21 (DE3)感受态细胞中,并进行测序验证。同时转化pET28a质粒作为原核表达的对照。将重组质粒pET28a-Bmtol和空载体pET28a转化的表达菌在IPTG终浓度为0.4 mmol/L的28 ℃和37 ℃条件培养,间隔2 h取一次样,收集菌体,用PBS重悬,经12% SDS-PAGE检测。同时又对其在不同IPTG终浓度的条件下诱导8 h,分析蛋白表达情况和对重组蛋白进行可溶性分析,最后综合上述表达条件的优化,确定最佳表达条件为28 ℃、IPTG终浓度为0.4 mmol/L、诱导8 h。并进行大量表达,利用Ni-NTA亲和层析进行重组蛋白纯化,用不同溶度的咪唑洗脱重组蛋白,并对重组蛋白进行透析和浓缩,最后送至重庆泽恒生物技术有限公司进行多克隆抗体制备。
1.5 Western blotting检测和免疫组化在液氮中研磨家蚕5龄3 d的头部、表皮、脂肪体、中肠、丝腺、马氏管、血淋巴、精巢和卵巢等组织,研磨后的粉末用蛋白裂解液溶解提取总蛋白,并用Bradford法测定总蛋白浓度。将总蛋白进行SDS-PAGE分析,以α-tubulin为内参,根据蛋白浓度计算上样量。再进行转膜、一抗二抗孵育、显色和曝光处理,步骤如下:
1) 转膜结束后,取出PVDF膜正面(朝向凝胶的面为正面)朝上,用TBST溶液清洗后,浸泡在封闭液中,室温摇荡3 h或4 ℃恒温封闭过夜;2)一抗孵育:将PVDF膜从封闭液中取出,放入一抗稀释液(α-tubulin抗体为1:10 000,一抗以1:20 000)中,37 ℃孵育1 h或4 ℃孵育过夜,用TBST洗膜3-4次,10-15 min/次;3)二抗孵育:BmTOL为羊抗兔,内参为羊抗鼠,稀释比例为1:30 000,37 ℃孵育1 h后,用TBST洗膜3-4次,15 min/次;4) ECL显色:将ECL显色液A液和B液按等比例(1:1)混匀,注意避光,现配现用;将配好的ECL显色液加入到PVDF膜上,并保证显色液覆盖整个PVDF膜,避光显色3-5 min;5)曝光:显色完毕后,在化学发光成像仪上进行曝光处理,曝光时间30-50 s,观察并保存图片。
选取5龄3 d的家蚕头部组织用4% (W/V)多聚甲醛4 ℃固定24 h,然后进行脱水,用石蜡包埋。将石蜡包埋的组织进行切片、摊片和烤片处理。然后进行免疫组化实验,步骤如下:
1) 脱蜡处理:二甲苯Ⅰ (10-15 min)→二甲苯Ⅱ (10-15 min)→100%酒精Ⅰ (5 min)→100%酒精Ⅱ (5 min)→95%酒精Ⅰ (3 min)→95%酒精Ⅱ (3 min) →90%酒精(2 min)→80%酒精(2 min)→70%酒精(2 min)→ddH2O (10 min);
2) 灭活:用3%去离子水孵育或10% H2O2室温/温箱孵育10-15 min,消除内源性过氧化物酶的活性,用PBS溶液冲洗5 min×3次;
3) 抗原修复:0.01 μL柠檬酸缓冲液(pH 0.6)连同容器一起放入水浴锅中加热10 min,期间用温度计测温,待抗原修复液温度达到有效温度(68-70 ℃)后,将切片放入持续40 min,取出恢复至室温,微波修复10 min,防止缓冲液干涸暴露组织。用PBS溶液冲洗5 min×3次;
4) 滴加内源性碱性磷酸酶阻断剂,室温孵育10-15 min,以阻断内源性碱性磷酸酶的活性。用PBS溶液冲洗5 min×3次;
5) 滴加封闭液,37 ℃孵育20-30 min或4 ℃过夜孵育,甩去多余液体,勿洗;
6) 滴加一抗(1:2 000)覆盖组织,并将切片置于湿盒中,37 ℃温箱孵育2-3 h或4 ℃过夜,次日取出后温箱孵育1 h。阴性对照组滴加PBS缓冲液。用PBS溶液冲洗5 min×3次;
7) 滴加AP标记的二抗IgG,在37 ℃温箱孵育30-60 min。用PBS溶液冲洗5 min×3次;
8) 滴加BCIP/NBT显色剂进行显色,室温显色3-30 min,在显微镜下观察显色情况,蒸馏水冲洗;
9) 脱水透明:70%酒精(2 min)→80%酒精(2 min) →90%酒精(2 min)→95%酒精Ⅰ (5 min) →95%酒精Ⅱ (3 min)→100%酒精Ⅰ (5 min) →100%酒精Ⅱ (5 min)→二甲苯Ⅰ (15 min)→二甲苯Ⅱ (15 min);
10)封片:用中性树胶封片,在显微镜下观察并照相。
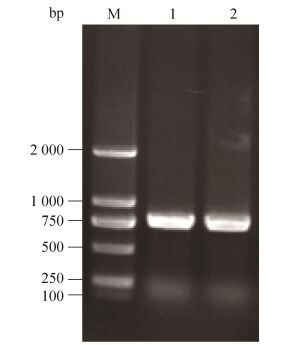
2 结果与分析 2.1 家蚕保幼激素结合蛋白Bmtol基因的克隆与鉴定以大造5龄3 d家蚕表皮组织的cDNA为模板,用Bmtol基因的引物对Bmtol基因进行PCR扩增,利用1%的琼脂糖凝胶电泳检测与分析PCR产物的片段大小,电泳结果显示有特异性条带(图 1)。并对该特异性PCR产物进行胶回收,连接转化,挑选出阳性克隆菌进行测序,确定该片段大小。
|
| 图 1 Bmtol基因的PCR扩增 Figure 1 PCR amplification of Bmtol gene. M: DL2000 DNA marker; 1, 2: PCR amplification of Bmtol gene. |
| |
对Bmtol基因进行测序发现与NCBI上的预测序列基本一致,得到的cDNA序列长度为810 bp (GenBank登录号:KY681053),其中ORF为759 bp,包含6个外显子,5个内含子,编码的氨基酸序列为252个氨基酸,发现该蛋白序列第1-23氨基酸为信号肽。利用protparam软件对该基因编码的蛋白进行预测分析,其理论分子量为27.72 kDa,等电点为6.16。
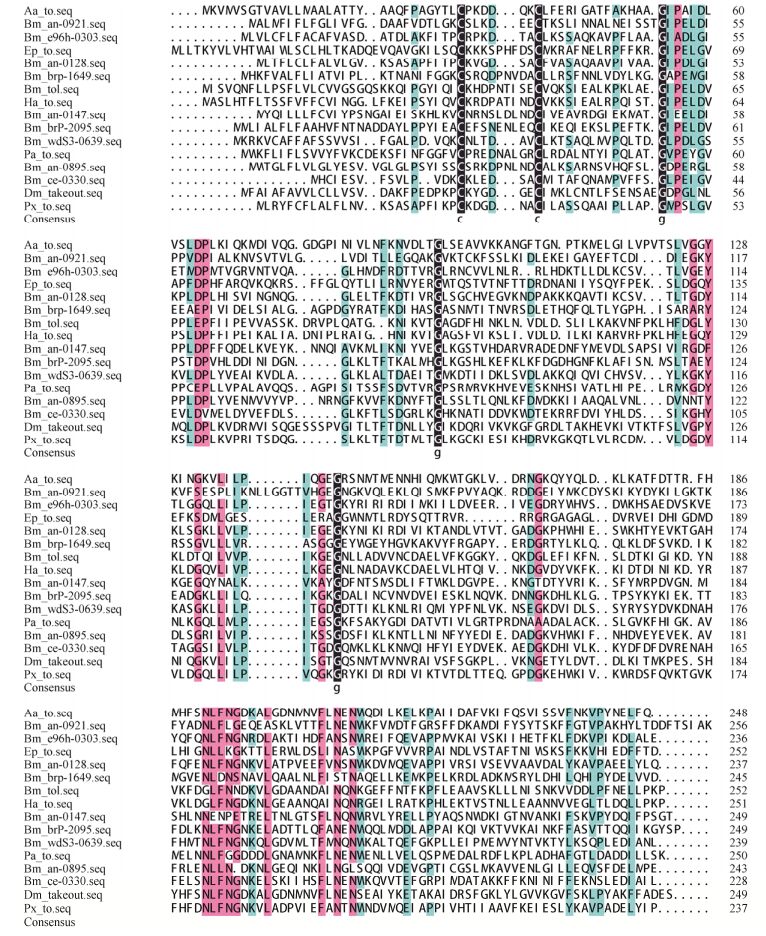
2.3 家蚕保幼激素结合蛋白BmTOL多序列比对从NCBI数据库中获得埃及伊蚊、家蚕、果蝇、苹果褐卷蛾、棉铃虫、斑点木蝶、柑橘凤蝶等物种的TO的氨基酸序列,将这些序列与家蚕BmTOL蛋白进行多序列比对,在比对中与这些昆虫的总相似度为34.54%。家蚕BmTOL蛋白是一种JHBP蛋白,是TO/JHBP家族的一员,在序列比对中发现,在N端含有两个保守的Cys残基,这两个Cys残基参与二硫键的形成,连接于N末端和α1螺旋的第一个弯曲,是TO蛋白结合配体的核心部位(图 2)。
|
| 图 2 昆虫TO蛋白多序列比对结果 Figure 2 Multiple sequence slignment results of TO proteins in insects. Aa: Aedes aegypti; Bm: Bombyx mori; Ep: Epiphyas postvittana; Ha: Helicoverpa armigera; Pa: Pararge aegeria; Dm: Drosophila melanogaster; Px: Papilio xuthus. |
| |
利用RT-PCR对家蚕5龄3 d各组织Bmtol基因的表达量进行检测,发现主要在头部有高量表达,其次在表皮和精巢表达量也较高,而其他组织的表达量很低或没有(图 3)。同时,对Bmtol基因在各时期的表达情况进行RT-PCR检测,发现主要在每个时期的起蚕时表达量较高,从5龄3 d到化蛹7 d Bmtol基因表达量都比较低,到化蛾后又开始上调(图 4)。

|
| 图 3 RT-PCR分析家蚕Bmtol基因在5龄3 d各组织的表达 Figure 3 RT-PCR analysis of Bmtol gene in various tissues of 3 day in 5th instar silkworm larvae. 1: head; 2: epidermis; 3: fat body; 4: midgut; 5: silk gland; 6: malpighian tube; 7: hemolymph; 8: testis; 9: ovary. |
| |

|
| 图 4 家蚕Bmtol基因各时空表达谱 Figure 4 The expression profile of Bmtol gene during whole larvae development. 1: hatching; 2: day-2 1st instar; 3: 1st instar pre-molting; 4: day-1 2nd instar; 5: day-2 2nd instar; 6: 2nd instar pre-molting; 7: day-1 3th instar; 8: day-2 3th instar; 9: 3th instar pre-molting; 10: day-1 4th instar; 11: day-2 4th instar; 12: 4th instar pre-molting; 13: day-1 5th instar; 14: day-3 5th instar; 15: day-5 5th instar; 16: day-7 5th instar; 17: prepupa; 18: day-1 pupa; 19: day-3 pupa; 20: day-5 pupa; 21: day-7 pupa; 22: moth. |
| |
为了对该蛋白进行深入研究,我们对非信号肽区域进行克隆,并送公司测序验证。构建含有该目的片段的原核表达载体,利用BL21 (DE3)大肠杆菌对重组蛋白进行原核表达。由于pET28a表达载体上含有His标签序列,该标签蛋白的分子量大小约为4 kDa,去掉信号肽的目的蛋白分子量大小约为25 kDa。对28 ℃和37 ℃在不同时间的表达情况进行分析,发现重组蛋白在28 ℃和37 ℃的条件下均能表达,在28 ℃条件诱导8 h表达量达到最大值,在37 ℃条件下诱导6 h表达量达到最大值。又对重组表达菌在28 ℃和37 ℃条件下不同IPTG浓度诱导下的表达情况进行分析,图 5和6显示,在28 ℃条件下,IPTG终浓度为0.6 mmol/L时表达量最高;在37 ℃条件下,IPTG终浓度为0.4 mmol/L时表达量最高。为了确定重组蛋白在表达菌中是以什么形式表达的,对上述成功表达的重组蛋白进行可溶性分析,发现在37 ℃和28 ℃诱导条件下,目的蛋白主要以包涵体形式表达,但也有可溶性表达,而且温度越低越有利于可溶性蛋白的形成和表达。根据上述分析,确定一个最佳的表达蛋白的条件(IPTG终浓度为0.6 mmol/L在28 ℃诱导8 h)进行蛋白的大量表达,并对表达的蛋白进行Ni-NTA亲和层析和蛋白纯化(图 7)。对纯化好的重组蛋白进行透析和浓缩,发现获得了较纯的重组蛋白。最后将重组蛋白送至公司制备多克隆抗体,抗体效价检测大于500 000,可用于后续实验。

|
| 图 5 在28 ℃条件下不同IPTG浓度诱导重组蛋白的表达 Figure 5 The aim protein expression induced at different concentrations of IPTG at 28 ℃. M: protein marker; 1: pET28(a) vector induced; 2-7: recombination expression bacterium respectively induced for 0, 0.2, 0.4, 0.6, 0.8 and 1.0 mmol/L. |
| |

|
| 图 6 在37 ℃条件下不同IPTG浓度诱导重组蛋白的表达 Figure 6 The aim protein expression induced at different concentrations of IPTG at 37 ℃. M: protein marker; 1: pET28(a) vector induced; 2-7: recombination expression bacterium respectively induced for 0, 0.2, 0.4, 0.6, 0.8 and 1.0 mmol/L. |
| |

|
| 图 7 目的蛋白纯化SDS-PAGE检测 Figure 7 Purified proteins detected by SDS-PAGE. M: protein marker; 1: pET28(a) vector induced; 2: outflow liquid; 3: 10 mmol/L; 4: 50 mmol/L; 5: 100 mmol/L; 6: 200 mmol/L; 7: 250 mmol/L; 8: 300 mmol/L. |
| |
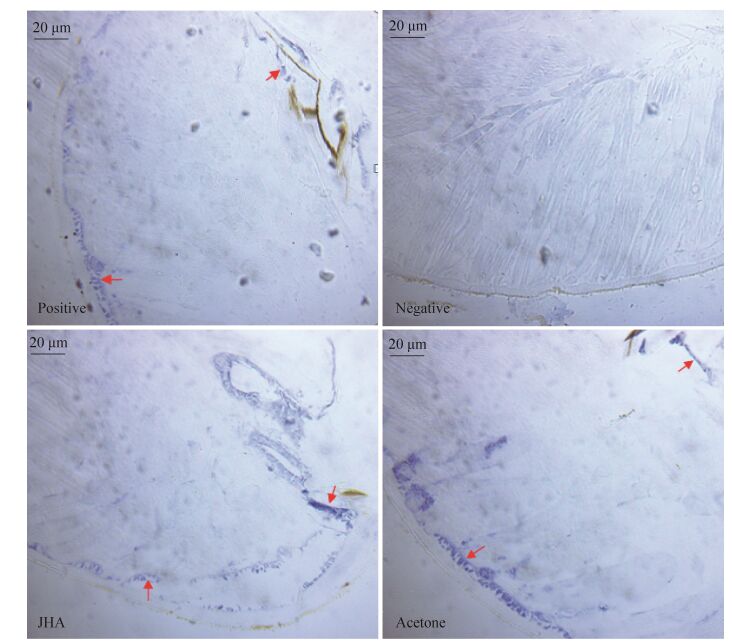
为检查纯化的蛋白是否为目的蛋白及抗体是否符合实验要求,对抗体进行检测,检测发现抗体满足实验要求,并显示提取了目的蛋白(图 8)。通过Western blotting在蛋白水平上对家蚕各组织中BmTOL的表达情况进行分析,BmTOL蛋白主要在家蚕的头部、表皮和精巢有表达(图 9)。为了确定Bmtol在家蚕头发挥功能的位置,我们选择了5龄5 d的家蚕头部,通过免疫组化技术对BmTOL蛋白在头部组织位置进行定位。实验结果发现BmTOL蛋白主要在家蚕头部表皮层和脑中表达,阴性对照组没有。此外对于添食JHA处理组和丙酮对照组中,发现BmTOL蛋白表达量有所上调,但差异不是很显著(图 10)。

|
| 图 8 重组蛋白的Western blotting检测 Figure 8 Western blotting analysis of recombinant proteins. 1, 3: purified protein of concentrated; 2, 4: purified protein of non-concentrated; 5: supernatant protein; 6: pET28(a) vector. |
| |

|
| 图 9 Western blotting检测分析家蚕BmTOL蛋白在各组织的表达 Figure 9 Western blotting analysis of BmTOL expression in various tissues of the silkworm larvae. 1: head; 2: epidermis; 3: fat body; 4: midgut; 5: silk gland; 6: malpighian tube; 7: hemolymph; 8: testis; 9: ovary. |
| |
|
| 图 10 BmTOL蛋白在家蚕头部组织的免疫组化结果 Figure 10 Immunohistochemistry results of BmTOL in silkworm head. The red arrow: BmTOL. Red arrow are the positive results of TO protein. |
| |
家蚕作为鳞翅目昆虫的模式生物,研究其保幼激素结合蛋白在家蚕体内的调控机制,可以为其他昆虫的研究提供理论依据和参考价值。本研究通过SilkDB和NCBI数据库筛选并鉴定到了一个新的Bmtol基因。通过RT-PCR和Western blotting分别对5龄3 d的组织mRNA和蛋白表达情况进行了分析,结果发现Bmtol基因无论在核酸还是蛋白水平上都是在头部高量表达,其次是表皮和精巢中。并对从收蚁到化蛾的各时期进行了RT-PCR检测,发现在幼虫期的各起蚕时高量表达,另外在5龄至蛹期Bmtol基因的表达水平一直都很低,但是化蛾后表达量又突然上调。推测Bmtol基因可能参与生物节律、摄食活动、发育等方面的调控。此外该基因除了参与幼虫期的发育调控外,可能还在化蛾后参与其他方面的调控(如性信息调控、求偶行为等)。
前人的研究表明,在果蝇中to基因参与取食行为和生物节律调控[6-7]。Meunier等[20]在果蝇中发现,通过Dmto编码的TO蛋白,可以提高果蝇饥饿时味觉系统对糖分的敏感性,从而增加取食量,进而调节果蝇体内的营养平衡。Dauwalder等[8]研究发现TO/JHBP蛋白只在雄果蝇的头部和脂肪体表达,却不在雌果蝇的头部和脂肪体中表达。他们还发现,TO受体细胞性别决定通路中2种转录因子的调控,分别为fruitless(fru)和doublesex(dsx),调控与性别特异性功能相关的多种调控因子,同时to基因的表达又能间接调控Fru的作用;此外,在求偶和交配过程中,果蝇头部会分泌TO蛋白来影响雄性的行为,故TO/JHBP蛋白主要通过对性别信号进行加工整合,进而影响雄性的求偶行为。Bauer等[21]发现TO的表达量增多会延长果蝇的寿命。to/JHBP基因家族可以维持烟草天蛾表皮细胞中JH的含量,同时又受到JH和营养状况的调控[9]。在黑花蝇的研究中发现TOL蛋白主要分布于辅助细胞的细胞膜周围和唇瓣味觉感受器的淋巴液中,对昆虫的感受系统有调控作用[10]。
Saito等[16]在家蚕中鉴定了几个to家族基因,通过Northern杂交发现Bman-0128、Bman-0147、Bman-0921、Bmbrp-1649和Bmbrp-2095主要在脂肪体中表达,Bman-0128、Bmbrp-2095和Bmbrp-1649在中肠和丝腺中表达,Bmbrp-1649还在表皮中有表达,但并未对其进一步深入探究。本研究结果表明,Bmtol基因主要在家蚕的头部、表皮和精巢中表达,且在头部高量表达,说明该基因主要在头部发挥功能。JH在昆虫的生长发育过程中起到一个开关的作用,而TO/JHBP间接调控昆虫的生长发育,在胚胎发育过程中如果有新的JHBP合成,那么组织的敏感性也会发生一定的变化,在胚胎期就能决定不同细胞对JH的应答类型[22]。此外,对于Bmtol基因与家蚕体内该家族其他基因在组织中的表达存在差异,说明该家族的基因并不具有功能一致性,可能该家族基因在不同组织中具有不同的功能,对此需要实验加以证明。
本研究通过SilkDB和NCBI数据库筛选并鉴定到了一个新的Bmtol基因,对该蛋白基因进行了克隆、表达并制备了多克隆抗体,通过组织和时期表达分析及免疫组化分析,发现该蛋白只在头部高量表达,其次在表皮和精巢中,其他组织表达量很低或没有。在幼虫期的各起蚕时高量表达,在5龄至蛹期Bmtol基因的表达水平一直都很低,但是化蛾后表达量又突然上调。推测Bmtol基因可能参与生物节律、摄食活动、发育等方面的调控,还可能在化蛾后参与其他方面的调控(如性信息调控、求偶行为等),但需要后续实验对此推测进行进一步验证。同时通过添食JHA处理,免疫组化分析发现该基因的表达量有所上调,但不是很显著,可能激素处理对其作用效果不是太明显,对此可以再从饥饿诱导、生物节律等方面进行进一步功能探究。此外,由于Bmtol基因在家蚕的表皮和精巢中也有表达,在家蚕幼虫期和化蛾时高量表达,故也可以从这些方面再进行其功能的研究,以探究其在家蚕体内的分子调控机制,为更好地应用于蚕丝产业的发展提供理论基础。
| [1] | Whisenton LR, Bowen MF, Granger NA, et al. Brain-mediated 20-hydroxyecdysone regulation of juvenile hormone synthesis by the corpora allata of the tobacco hornworm, Manduca sexta. Gen Comp Endocrinol, 1985, 58(2): 311–318. DOI: 10.1016/0016-6480(85)90347-8 |
| [2] |
Qin J, He NJ, Xiang ZH. Advances in silkworm modeling research.
Sci Sericult, 2010, 36(4): 645–649.
(in Chinese). 秦俭, 何宁佳, 向仲怀. 家蚕模式化研究进展. 蚕业科学, 2010, 36(4): 645-649. |
| [3] | Orth AP, Lan Q, Goodman WG. Ligand regulation of juvenile hormone binding protein mRNA in mutant Manduca sexta. Mol Cell Endocrinol, 1999, 149(1/2): 61–69. |
| [4] | Orth AP, Tauchman SJ, Doll SC, et al. Embryonic expression of juvenile hormone binding protein and its relationship to the toxic effects of juvenile hormone in Manduca sexta. Insect Biochem Mol Biol, 2003, 33(12): 1275–1284. DOI: 10.1016/j.ibmb.2003.06.002 |
| [5] |
He XT, Zhang YN, Li F, et al. Cloning, temporal expression of a juvenile hormone binding protein gene in Laodelphax striatellus (Fallén).
J Nanjing Agric Univ, 2012, 35(2): 59–64.
(in Chinese). 贺秀婷, 张亚楠, 李飞, 等. 灰飞虱保幼激素结合蛋白基因的克隆及表达动态. 南京农业大学学报, 2012, 35(2): 59-64. |
| [6] | Sarov-Blat L, So WV, Liu L, et al. The Drosophila takeout gene is a novel molecular link between circadian rhythms and feeding behavior. Cell, 2000, 101(6): 647–656. DOI: 10.1016/S0092-8674(00)80876-4 |
| [7] | So WV, Sarov-Blat L, Kotarski CK, et al. takeout, a novel Drosophila gene under circadian clock transcriptional regulation. Mol Cell Biol, 2000, 20(18): 6935–6944. DOI: 10.1128/MCB.20.18.6935-6944.2000 |
| [8] | Dauwalder B, Tsujimoto S, Moss J, et al. The Drosophila takeout gene is regulated by the somatic sex-determination pathway and affects male courtship behavior. Genes Dev, 2002, 16(22): 2879–2892. DOI: 10.1101/gad.1010302 |
| [9] | Du JG, Hiruma K, Riddiford LM. A novel gene in the takeout gene family is regulated by hormones and nutrients in Manduca larval epidermis. Insect Biochem Mol Biol, 2003, 33(8): 803–814. DOI: 10.1016/S0965-1748(03)00079-1 |
| [10] | Fujikawa K, Seno K, Ozaki M. A novel Takeout-like protein expressed in the taste and olfactory organs of the blowfly, Phormia regina. FEBS J, 2006, 273(18): 4311–4321. DOI: 10.1111/ejb.2006.273.issue-18 |
| [11] | Wojtasek H, Prestwich GD. Key disulfide bonds in an insect hormone binding protein: cDNA cloning of a juvenile hormone binding protein of Heliothis virescens and ligand binding by native and mutant forms. Biochemistry, 1995, 34(15): 5234–5241. DOI: 10.1021/bi00015a037 |
| [12] | Hamiaux C, Stanley D, Greenwood DR, et al. Crystal structure of Epiphyas postvittana takeout 1 with bound ubiquinone supports a role as ligand carriers for takeout proteins in insects. J Biol Chem, 2009, 284(6): 3496–3503. DOI: 10.1074/jbc.M807467200 |
| [13] | Fujimoto Z, Suzuki R, Shiotsuki T, et al. Crystal structure of silkwormBombyx mori JHBP in complex with 2-methyl-2, 4-pentanediol: plasticity of JH-binding pocket and ligand-induced conformational change of the second cavity in JHBP. PLoS ONE, 2013, 8(2): e56261. DOI: 10.1371/journal.pone.0056261 |
| [14] | Justice RW, Dimitratos S, Walter MF, et al. Sexual dimorphic expression of putative antennal carrier protein genes in the malaria vector Anopheles gambiae. Insect Mol Biol, 2003, 12(6): 581–594. DOI: 10.1046/j.1365-2583.2003.00443.x |
| [15] | Bohbot J, Vogt RG. Antennal expressed genes of the yellow fever mosquito (Aedes aegypti L.); characterization of odorant-binding protein 10 and takeout. Insect Biochem Mol Biol, 2005, 35(9): 961–979. DOI: 10.1016/j.ibmb.2005.03.010 |
| [16] | Saito K, Su ZH, Emi A, et al. Cloning and expression analysis of takeout/JHBP family genes of silkworm, Bombyx mori. Insect Mol Biol, 2006, 15(3): 245–251. DOI: 10.1111/imb.2006.15.issue-3 |
| [17] | Hagai T, Cohen M, Bloch G. Genes encoding putative takeout/juvenile hormone binding proteins in the honeybee (Apis mellifera) and modulation by age and juvenile hormone of the takeout-like gene GB19811. Insect Biochem Mol Biol, 2007, 37(7): 689–701. DOI: 10.1016/j.ibmb.2007.04.002 |
| [18] | Jordan MD, Stanley D, Marshall SDG, et al. Expressed sequence tags and proteomics of antennae from the tortricid moth, Epiphyas postvittana. Insect Mol Biol, 2008, 17(4): 361–373. DOI: 10.1111/imb.2008.17.issue-4 |
| [19] | Schwinghammer MA, Zhou XG, Kambhampati S, et al. A novel gene from the takeout family involved in termite trail-following behavior. Gene, 2011, 474(1/2): 12–21. |
| [20] | Meunier N, Belgacem YH, Martin JR. Regulation of feeding behaviour and locomotor activity by takeout in Drosophila. J Exp Biol, 2007, 210(Pt8): 1424–1434. |
| [21] | Bauer J, Antosh M, Chang CY, et al. Comparative transcriptional profiling identifies takeout as a gene that regulates life span. Aging, 2010, 2(5): 298–310. DOI: 10.18632/aging.v2i5 |
| [22] |
Wang YC.
Insect Biochemistry. Beijing: China Agriculture Press, 2001(in Chinese).
王荫长. 昆虫生物化学. 北京: 中国农业出版社, 2001. |
 2018, Vol. 34
2018, Vol. 34