中国科学院微生物研究所、中国微生物学会主办
文章信息
- 庞亚如, 胡智慧, 肖冬光, 于爱群
- Pang Yaru, Hu Zhihui, Xiao Dongguang, Yu Aiqun
- 柠檬烯和红没药烯的微生物代谢工程
- Advances in metabolic engineering for the microbial production of naturally occurring terpenes-limonene and bisabolene: a mini review
- 生物工程学报, 2018, 34(1): 24-33
- Chinese Journal of Biotechnology, 2018, 34(1): 24-33
- 10.13345/j.cjb.170150
-
文章历史
- Received: April 10, 2017
- Accepted: June 10, 2017
柠檬烯是一种来源于植物的天然活性化合物。它在自然界中分布较为广泛,主要存在于柑橘类(如橙子、柠檬、柑橘、西柚)精油中,并且已被FDA鉴定为安全的(Generally regarded as safe,GRAS)化合物[1]。
柠檬烯属于单环单萜类化合物,化学式为C10H16。柠檬烯分子内只含有一个手性碳原子,因此柠檬烯有右旋柠檬烯(D-柠檬烯,如图 1A所示)和左旋柠檬烯(L-柠檬烯,如图 1B所示)两种光学异构体,此外还存在一种外消旋体(D/L-柠檬烯,如图 1C所示)[2]。
近年来的研究表明,柠檬烯具有多种重要的应用价值。D-柠檬烯有类似柠檬或甜橙的悦人香味;L-柠檬烯则有类似松油和松脂的芳香气味,因此柠檬烯可作为优质的香料被广泛应用于食品、饮料、化妆品中,具有很高的市场价值。在工业上,D-柠檬烯还是一种天然、绿色、环保的工业清洗剂,被广泛应用于印刷、机械、航空、电子和电器工业部件的清洗。在农业上,D-柠檬烯还被用作农作物的生物杀虫剂。在卫生医疗领域中,D-柠檬烯具有抑菌、抗菌活性,可以作为良好的天然抗菌活性物质;同时,它还具有很好的药用价值,如具有抗癌活性、促进消化和减肥作用等[9-13]。在能源领域中,氢化柠檬烯具有低溶点和不溶于水的优良特性,可以用作航空燃油或者燃油添加剂[14]。此外,柠檬烯还可以作为多种具有重要应用价值的单萜类衍生物如紫苏醇、薄荷醇、松油醇、香芹醇、香芹酮的前体物[15]。
红没药烯也是一种植物来源的天然活性化合物,它在自然界中分布也较为广泛,主要存在于天然的植物精油中,如红没药油、柠檬油等。
红没药烯属于单环倍半萜类化合物,化学式为C15H24,根据双键位置的不同可分为3种同分异构体:α-红没药烯、β-红没药烯、γ-红没药烯(图 1D,E,F)。
在用途和功能上,红没药烯与柠檬烯有许多相似之处,同样具有很高的市场价值。例如,红没药烯有类似果香和香脂的气味,其中β-红没药烯有类似香油的气味,可以作为食用香精及日化香精;红没药烯也是极具潜力的新型生物燃料;β-红没药烯和γ-红没药烯还具有抗痒、消炎的功能和抗癌活性。此外,红没药烯也是多种高附加值工业产品合成的前体物质,如生物燃料、生物塑料、化妆品、保健品及药品等[16-17]。
目前柠檬烯和红没药烯的工业生产主要还是通过植物提取法实现的。但是,这一方法存在诸多弊端,如原料来源有限、目标物质含量低、分离提取难度大等;利用化学方法也能够合成柠檬烯和红没药烯,但化学合成法需要采用高温、高压和昂贵的催化剂,而且生产设备复杂、原料利用率低、环境污染严重。近年来,随着人们对健康、能源和环境问题越来越关注,从而掀起了对有着重要生物学功能的萜类化合物的研究热潮。因此利用微生物代谢工程技术生产柠檬烯和红没药烯已经成为一个研究热点。相比植物提取法和化学合成法,微生物合成法具有反应条件温和、底物转化率高、低碳环保和可持续发展等优点,因此具有广阔的发展前景。
本文系统总结了代谢工程技术在微生物法生产柠檬烯和红没药烯中的应用,包括所涉及的宿主菌株、关键酶和代谢途径,尤其重点介绍了代谢途径改造思路。最后,本文展望了利用代谢工程技术构建柠檬烯和红没药烯生产菌株未来的发展趋势。
1 柠檬烯和红没药烯的生物合成途径植物中柠檬烯和红没药烯的合成途径已经研究得较为清楚(图 2)。植物细胞主要依靠甲基赤藓醇-4-磷酸(The methylerythritol phosphate,MEP)途径,以丙酮酸和甘油醛-3-磷酸作为底物,在一系列酶的共同催化下,最终生成异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)。IPP和DMAPP在香叶基香叶基焦磷酸合成酶(Geranylgeranyl diphosphate synthase)作用下进一步合成香叶基焦磷酸(Geranyl diphosphate,GPP)和法尼基焦磷酸(Farnesyl diphosphate,FPP)。以来自MEP途径的GPP作为底物,在L-柠檬烯合酶(L-limonene synthase)和D-柠檬烯合酶(D-limonene synthase)催化下分别合成L-柠檬烯和D-柠檬烯;以来自MEP途径的FPP作为底物,在α-红没药烯合酶(α-bisabolene synthase)、β-红没药烯合酶(β-bisabolene synthase)和γ-红没药烯合酶(γ-bisabolene synthase)催化下分别合成3种红没药烯——α-红没药烯、β-红没药烯和γ-红没药烯[18]。
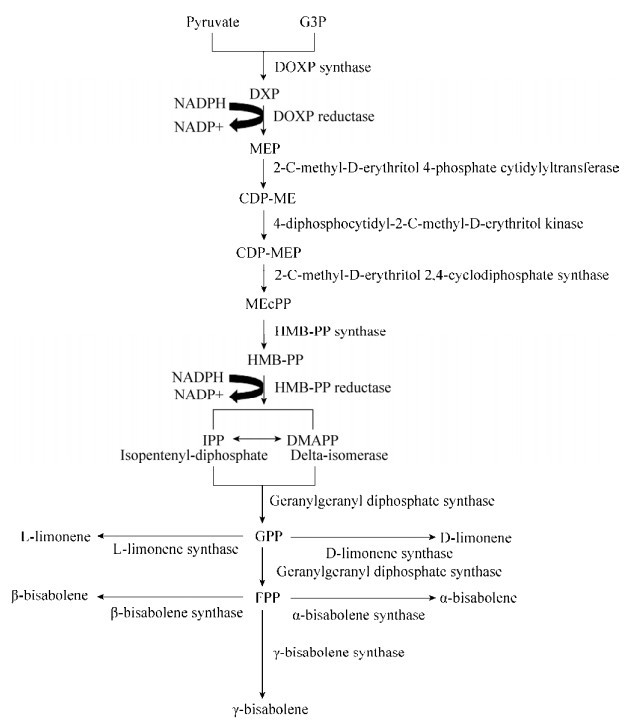
|
| 图 2 植物中柠檬烯和红没药烯的合成途径 Figure 2 The biosynthetic pathways of limonene and bisabolene in plants. |
| |
与植物不同,酿酒酵母依靠以乙酰辅酶A为底物的甲羟戊酸途径(Mevalonate pathway,MVA)合成IPP和DMAPP。3个乙酰辅酶A (Acetyl-CoA)在乙酰辅酶A硫解酶(Acetyl-CoA thiolase)和羟甲基戊二酸单酰辅酶A合成酶(HMG-CoA synthase)的作用下缩合成3-羟基-3甲基戊二酸单酰辅酶A (HMG-CoA);随后HMG-CoA在HMG-CoA还原酶的作用下生成甲羟戊酸(Mevalonate);再经过焦磷酸化和脱羧化生成IPP;IPP在异构化酶的作用下生成DMAPP,IPP和DMAPP又在香叶基香叶基焦磷酸合成酶的作用下进一步合成GPP和FPP (图 3)。

|
| 图 3 酿酒酵母的MVA途径 Figure 3 The MVA pathway of Saccharomyces cerevisiae. |
| |
柠檬烯和红没药烯现已成为食品、能源、化工和医药等许多领域的研究热点。利用微生物开发生产柠檬烯和红没药烯的可再生资源,用其来补充甚至代替原有的植物资源,具有很好的应用价值。
到目前为止,研究者已经从多种不同的植物中克隆得到了柠檬烯合酶基因和红没药烯合酶基因。1993年,Colby等从绿薄荷Mentha spicata中分离得到了L-柠檬烯合酶基因(GenBank Accession No. L13459.1)[19];1996年,Yuba等从紫苏Perilla frutescens中分离得到了L-柠檬烯合酶基因(GenBank Accession No. D49368.1)[20];1997年,Bohlmann等从北美冷杉Abies grandis中分离得到了L-柠檬烯合酶基因(GenBank Accession No. AF006193.1)[21];2001年,Maruyama等从荆芥Schizonepeta tenuifolia中分离得到了D-柠檬烯合酶基因(GenBank Accession No. AF282875.2)[22];2002年,Lücker等从柠檬Citrus limon中分离得到了D-柠檬烯合酶基因(GenBank Accession No. AF514287.1)[23];2004年,Shimada等从蜜柑Citrus unshiu中分离得到了一个D-柠檬烯合酶基因(GenBank Accession No. AB110636.1)[24];2005年,Shimada等从蜜柑Citrus unshiu中分离得到了另一个D-柠檬烯合酶基因(GenBank Accession No. AB110637.1)[25];1998年,Bohlmann等从北美冷杉中分离得到了α-红没药烯合酶基因(GenBank Accession No. AF006195.1)[26];2004年,Martin等从欧洲云杉Picea abies中分离得到了α-红没药烯合酶基因(GenBank Accession No. AY473619.1)[27];2015年,Parveen等从银杏叶Ginkgo biloba中分离得到了α-红没药烯合酶基因(GenBank Accession No. KM248384.1)[28];2010年Fujisawa等从铁皮石斛Zingiber officinale中分离得到了β-红没药烯合酶基因(GenBank Accession No. AB511917.1)[29];2011年,Jones等从新克里多尼亚檀香Santalum austrocaledonicum中分离得到了β-红没药烯合酶基因(GenBank Accession No. HQ343279.1)[30];2015年,Srivastava等从檀香Santalum album中分离得到了β-红没药烯合酶基因(GenBank Accession No. KJ665778.1)[31];2005年,Huber等从花旗松Pseudotsuga menziesii中分离得到了γ-红没药烯合酶基因(GenBank Accession No. AY906868.1)[32];2006年,Ro等从拟南芥Arabidopsis thaliana中分离得到了两个γ-红没药烯合酶基因(AtTPS12和AtTPS13)[33]。2016年,Aschenbrenner等从向日葵Helianthus annuus中分离得到了两个γ-红没药烯合酶基因(GenBank Accession No. KU674382.1和KU674381.1)[34]。
近年来,研究者们纷纷利用代谢工程和合成生物学的方法在不同微生物宿主中成功构建了柠檬烯和红没药烯的生物合成途径。萜类合成酶已成为影响单萜、倍半萜产量的关键酶,因此筛选高活性的柠檬烯合成酶、红没药烯合成酶至关重要。2011年,Keasling研究组为了筛选到高活性的红没药烯合成酶,分别选择了来自北美冷杉的α-红没药烯合酶基因(Ag1)、来自欧洲云杉的α-红没药烯合酶基因(TPS-BIS)、来自花旗松的γ-红没药烯合酶基因(TPS3)和两个来自拟南芥的γ-红没药烯合酶基因(AtTPS12和AtTPS13),利用已构建的高产FPP平台,通过分别表达以上5个红没药烯合成酶基因,从而成功地在大肠杆菌Escherichia coli和酿酒酵母Saccharomyces cerevisiae两种模式菌株中分别构建了α-红没药烯和γ-红没药烯的合成途径。最终,筛选出高产红没药烯的合成酶基因——来自北美冷杉的α-红没药烯合酶基因(Ag1)。在宿主大肠杆菌中,通过对来自酿酒酵母MVA途径的4个基因tHMGR、HMGS、MK、PMK进行密码子优化,增加了前体物甲羟戊酸的产量,并采用了强启动子(Ptrc)策略,推动甲羟戊酸流向FPP,同时再表达经密码子优化的α-红没药烯合酶基因(Ag1),α-红没药烯的终产量为912 mg/L;在宿主酿酒酵母中,通过表达甾醇合成途径的全局转录因子upc2-1、已密码子优化的α-红没药烯合酶基因(Ag1)和弱化鲨烯合成途径中的关键酶——鲨烯合成酶基因(ERG9)后,α-红没药烯的最高产量达到994 mg/L[16]。
2013年,Lee研究组在大肠杆菌中构建了L-柠檬烯的合成途径。具体策略为:1)引入来自金黄色葡萄球菌Staphylococcus aureus的HMGS和HMGR基因,来自酿酒酵母的MK、PMK和PMD基因,从而构建异源的MVA途径,以增加IPP和DMAPP的产量;2)同时引入来自绿薄荷的trGPPS基因,从而表达高活性的GPP合酶,强化IPP和DMAPP流向GPP;3)再引入来自北美冷杉的LS基因,从而表达高活性的L-柠檬烯合酶,以促进GPP转化成L-柠檬烯。最终,L-柠檬烯的终产量为430 mg/L[35]。
2014年,Davies研究组在聚球蓝细菌Synechococcus sp. PCC 7002中分别引入一个来自绿薄荷的L-柠檬烯合酶基因(MsLS)和一个来自北美冷杉的α-红没药烯合酶基因(AgBIS),从而成功构建了L-柠檬烯和α-红没药烯的合成途径。L-柠檬烯和α-红没药烯的终产量分别为4 mg/L和0.6 mg/L[17]。
2015年,Beekwilder研究组在酿酒酵母中分别引入一个来自紫苏的L-柠檬烯合酶基因和一个来自柠檬的D-柠檬烯合酶基因,再加上一个突变的香叶基香叶基焦磷酸合成酶基因,成功构建了L-柠檬烯和D-柠檬烯的合成途径。L-柠檬烯和D-柠檬烯的终产量分别为0.49 mg/L和0.12 mg/L[36]。
3 结论和展望由此可见,目前关于利用代谢工程合成柠檬烯和红没药烯的研究主要还是集中在大肠杆菌和酿酒酵母这两种模式菌株中,但是柠檬烯和红没药烯产量并不高,难以实现工业化。针对柠檬烯和红没药烯等萜类物质合成产量低的问题,研究者已开展很多探索。本文将从以下几点介绍萜类合成代谢网络改造的新思路。
3.1 萜类合成途径的酶分子改造在萜类代谢途径中,目的产物的产量往往受限于限速步骤。限速步骤的解除将有助于提高前体物的供应量,从而增加目的产物的积累量。目前,限速步骤的解除主要有两种方法:一种是提高限速酶的表达量;另一种是提高限速酶的酶活。酶的过量表达可以通过密码子优化或者选择高拷贝质粒实现,操作方法相对简单、方便;但是该法主要是通过增加酶的浓度来强化代谢途径的通量,往往会给细胞带来较大的代谢负担,影响细胞的正常生长。而且,限速酶的过量表达还可能会引发新的限速点,消耗更多的碳源和能量。因此,如何通过精细调控实现代谢途径的平衡对提高目的产物的合成量具有重要的意义。比较而言,提高限速酶的酶活能够更有效地解除限速步骤。近年来,一些研究者利用酶工程技术极大地提高了萜类代谢途径中某些限速酶的酶活。如2010年,Stephanopoulos和Prather课题组在利用大肠杆菌合成左旋海松二烯的研究中,利用番茄红素作为颜色指示剂,对来源于红豆杉Taxus chinensis的香叶基香叶基焦磷酸合成酶(GGPP)和来源于银杏的左旋海松二烯合成酶(LPS)进行了定向进化。通过平板筛选法获得了一株目的产物产量最高的正向突变菌株(GGPPSS239C/G295D LPS M593I/Y700F),再结合其他的代谢工程策略,左旋海松二烯的产量提高了2 600倍,终产量达到700 mg/L[15];2017年,元英进课题组在利用酿酒酵母合成香叶醇的研究中,通过蛋白结构分析结合定点突变技术,成功提高了关键酶法尼基焦磷酸合成酶(Erg20F96W-N127W)的酶活;同时通过酶融合技术,将来源于长春花Catharanthus roseus的香叶醇合成酶与Erg20F96W-N127W融合表达,最终香叶醇的产量达到1.68 g/L[37]。
3.2 代谢途径的平衡调控由于萜类合成途径中涉及了多个基因、多个限速酶和多步反应,所以单个基因的过表达或敲除往往难以产生理想性状,比如萜类化合物的异源高产,因此,如何实现萜类合成途径的平衡调控对于提高萜类化合物的产量具有非常重要的现实意义。萜类合成途径的基因表达可以从转录、转录后和翻译后3个水平进行调控。相比较而言,转录水平上的调控能量损耗少、操作简单,因此应用最为广泛。本文将从以下几个方面对其进行简要介绍。
1) 启动子工程。主要是采用易错PCR在启动子的–10和–35区段引入随机突变从而构建具有不同启动效率的启动子文库。将这种方法应用到萜类化合物合成途径中,能够梯度调控基因的表达。2011年,Alper课题组在解脂耶氏酵母Yarrowia lipolytica中设计了一套可调控启动效率的启动子系统,其由多个重复的上游增强序列(UASS)和核心元件构成。这个动态的启动子文库成功地应用到了萜类化合物合成途径的平衡调控中[38]。
2) 建立代谢途径多模块系统。例如,可以将萜类代谢途径首先分成多个模块,然后通过优化启动子、RBS结合位点、终止子、基因的拷贝数等策略分别或者组合调控各个模块,以强化多模块之间的协调作用。2010年,Stephanopoulos课题组将酿酒酵母紫杉烯的合成途径分为上游模块,即由MEP途径至IPP、DMAPP和下游模块,即由IPP、DMAPP至目的产物紫杉烯(或者柠檬烯和红没药烯),如图 4。通过控制和优化目标模块的启动子和质粒的拷贝数,进而对紫杉烯的合成途径进行了精确调控,最终紫杉烯产量提高了15 000倍。这是利用模块系统调控萜类代谢途径的经典实例[39]。
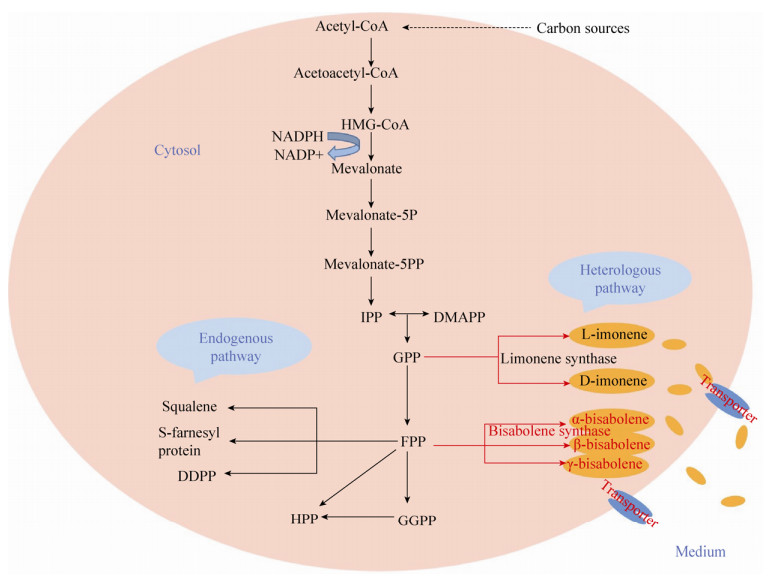
|
| 图 4 代谢工程技术改造酵母合成柠檬烯和红没药烯的代谢途径 Figure 4 Overview of metabolic pathways that lead to the production of limonene and bisabolene in yeast. |
| |
3) 全局转录因子调控。萜类合成途径在整个代谢网络中的具体作用和地位目前尚不清楚,因此萜类化合物的代谢工程很难从局部通路水平上升到整体水平,全局转录因子调控则提供了一个很好的解决方案。2006年,Sarpong课题组和Keasling课题组在酿酒酵母中构建青蒿酸合成途径的研究中,通过过表达全局转录因子upc2-1p激活了甾醇合成基因(ERG13、ERG12、ERG8),从而强化了MVA途径,青蒿酸的终产量达到100 mg/L[40]。
3.3 萜类合成途径的区域化工程调控代谢途径相关酶的共区域化工程可以加强酶的协同催化效应,这也是一种提高目的代谢产物产量的有效途径。其策略主要有两种:一是通过构建蛋白支架或者酶的自身融合将多个酶集合在一起。2009年,Prather课题组和Keasling课题组在大肠杆菌中将甲羟戊酸合成途径的3个酶(AtoB、HMGS、HMGR)通过蛋白支架的方法构建了一个酶的复合体,从而极大提高了酶的活性,最终甲羟戊酸的产量提高了77倍[41]。二是将分散在不同细胞域的酶集合在同一细胞区域内,如线粒体工程。线粒体作为独立的亚细胞结构,在其中进行萜类代谢调控具有乙酰辅酶A (萜类合成前体物)供应充足、ATP含量丰富等优势。此外,线粒体体积较小,能增加底物和中间产物的浓度,从而提高反应速率和产物产量。2016年,于洪巍课题组将酿酒酵母MVA途径的酶采用酶融合的方法定位于线粒体中,同时结合其他代谢工程策略,最终异戊二烯的产量达到2.527 g/L[42]。以上这些方法对于微生物合成柠檬烯和红没药烯的代谢工程改造具有重要的指导意义。
目前,柠檬烯和红没药烯在所构建的微生物细胞工厂中的产量还远远没有达到工业化生产的要求。这主要是因为微生物萜类合成的代谢及调控机制比较复杂,存在诸多限制因素:1)乙酰-CoA作为柠檬烯和红没药烯生物合成的前体物,其持续供应能力存在严重不足。在酿酒酵母中,一方面可以通过过量表达乙酰-CoA合成酶基因ACS1和ACS2,以强化丙酮酸代谢旁路,进而增加乙酰-CoA的通量[43];另一方面也可以通过异源构建丙酮酸脱氢酶途径,以替换原有高耗能、反馈抑制强的丙酮酸代谢旁路,减少合成乙酰-CoA的能耗,增加能源的利用率,进而提高乙酰-CoA的产量[44-45]。2)柠檬烯和红没药烯的大量合成势必需要消耗大量的辅酶NADPH,因此会引起细胞内辅酶水平的不平衡。NADPH的再生可通过强化磷酸戊糖途径、异柠檬酸脱氢酶途径及乙醛脱氢酶途径实现,也可以通过葡萄糖-葡萄糖脱氢酶(FDH)等酶偶联辅酶循环系统来完成[46]。3)柠檬烯和红没药烯生物合成途径中关键性限速酶的活性不足。可以采取定点突变、定向进化和融合表达等技术手段对相关限速酶进行改造,获得催化活性更高的酶蛋白分子,这对提高柠檬烯和红没药烯等萜类化合物的产量和产率至关重要[37]。4)柠檬烯和红没药烯等萜类物质的积累对微生物自身具有毒害作用。如何及时、快速地把它们从细胞内转运到细胞外,这也是亟待解决的问题。
综上所述,微生物异源合成柠檬烯和红没药烯的代谢及调控机制比较复杂,单一代谢调控手段很难实现柠檬烯和红没药烯的高产。优化、协同多种代谢调控手段,从而实现代谢途径的平衡调控,将是今后在不同微生物宿主中利用代谢工程技术合成柠檬烯和红没药烯的主流策略。
| [1] | Sun J. D-limonene: safety and clinical applications. Altern Med Rev, 2007, 12(3): 259–264. |
| [2] |
Du FL. Construction and optimization of (-)-limonene biosynthesis pathways in Escherichia coli[D]. Shanghai: East China University of Science and Technology, 2014 (in Chinese). 杜府亮. 大肠杆菌MEP途径的改造及用于(-)-柠檬烯生物合成的研究[D]. 上海: 华东理工大学, 2014. |
| [3] | National Center for Biotechnology Information. PubChem Substance Database[EB/OL]. [2017-06-05]. https://pubchem.ncbi.nlm.nih.gov/substance/319222027. |
| [4] | National Center for Biotechnology Information. PubChem Substance Database[EB/OL]. [2017-06-05]. https://pubchem.ncbi.nlm.nih.gov/substance/249928896. |
| [5] | National Center for Biotechnology Information. PubChem Substance Database[EB/OL]. [2017-06-05]. https://pubchem.ncbi.nlm.nih.gov/substance/319078015. |
| [6] | National Center for Biotechnology Information. PubChem Substance Database[EB/OL]. [2017-06-05]. https://pubchem.ncbi.nlm.nih.gov/substance/319297517. |
| [7] | National Center for Biotechnology Information. PubChem Substance Database[EB/OL]. [2017-06-05]. https://pubchem.ncbi.nlm.nih.gov/substance/319220468. |
| [8] | National Center for Biotechnology Information. PubChem Substance Database[EB/OL]. [2017-06-05]. https://pubchem.ncbi.nlm.nih.gov/substance/316964431. |
| [9] | Johnson TJ, Jahandideh A, Johnson MD, et al. Producing next-generation biofuels from filamentous cyanobacteria: an economic feasibility analysis. Algal Res, 2016, 20: 218–228. DOI: 10.1016/j.algal.2016.10.020 |
| [10] | Ciriminna R, Lomeli-Rodriguez M, Carà PD, et al. Limonene: a versatile chemical of the bioeconomy. Chem Commun, 2014, 50(97): 15288–15296. DOI: 10.1039/C4CC06147K |
| [11] | Jongedijk E, Cankar K, Buchhaupt M, et al. Biotechnological production of limonene in microorganisms. Appl Microbiol Biotechnol, 2016, 100(7): 2927–2938. DOI: 10.1007/s00253-016-7337-7 |
| [12] | Inouye S, Takizawa T, Yamaguchi H. Antibacterial activity of essential oils and their major constituents against respiratory tract pathogens by gaseous contact. J Antimicrob Chemother, 2001, 47(5): 565–573. DOI: 10.1093/jac/47.5.565 |
| [13] | Miller JA, Thompson PA, Hakim IA, et al. d-Limonene: a bioactive food component from citrus and evidence for a potential role in breast cancer prevention and treatment. Oncol Rev, 2011, 5(1): 31–42. DOI: 10.4081/oncol.2011.31 |
| [14] | Tracy NI, Chen DC, Crunkleton DW, et al. Hydrogenated monoterpenes as diesel fuel additives. Fuel, 2009, 88(11): 2238–2240. DOI: 10.1016/j.fuel.2009.02.002 |
| [15] | Leonard E, Ajikumar PK, Thayer K, et al. Combining metabolic and protein engineering of a terpenoid biosynthetic pathway for overproduction and selectivity control. Proc Natl Acad Sci USA, 2010, 107(31): 13654–13659. DOI: 10.1073/pnas.1006138107 |
| [16] | Peralta-Yahya PP, Ouellet M, Chan R, et al. Identification and microbial production of a terpene-based advanced biofuel. Nat Commun, 2011, 2: 483. DOI: 10.1038/ncomms1494 |
| [17] | Davies FK, Work VH, Beliaev AS, et al. Engineering limonene and bisabolene production in wild type and a glycogen-deficient mutant of Synechococcus sp. PCC 7002. Front Bioeng Biotechnol, 2014, 2: 21. |
| [18] | Kitaoka N, Lu X, Yang B, et al. The application of synthetic biology to elucidation of plant mono-, sesqui-, and diterpenoid metabolism. Mol Plant, 2015, 8(1): 6–16. DOI: 10.1016/j.molp.2014.12.002 |
| [19] | Colby SM, Alonso WR, Katahira EJ, et al. 4S-limonene synthase from the oil glands of spearmint (Mentha spicata). cDNA isolation, characterization, and bacterial expression of the catalytically active monoterpene cyclase. J Biol Chem, 1993, 268(31): 23016–23024. |
| [20] | Yuba A, Yazaki K, Tabata M, et al. cDNA cloning, characterization, and functional expression of 4S-(-)-limonene synthase from Perilla frutescens. Arch Biochem Biophys, 1996, 332(2): 280–287. DOI: 10.1006/abbi.1996.0343 |
| [21] | Bohlmann J, Steele CL, Croteau R. Monoterpene synthases from grand fir (Abies grandis). cDNA isolation, characterization, and functional expression of myrcene synthase, (-)-(4S)-limonene synthase, and (-)-(1S, 5S)-pinene synthase. J Biol Chem, 1997, 272(35): 21784–21792. DOI: 10.1074/jbc.272.35.21784 |
| [22] | Maruyama T, Ito M, Kiuchi F, et al. Molecular cloning, functional expression and characterization of d-limonene synthase from Schizonepeta tenuifolia. Biol Pharm Bull, 2001, 24(4): 373–377. DOI: 10.1248/bpb.24.373 |
| [23] | Lücker J, El Tamer MK, Schwab W, et al. Monoterpene biosynthesis in lemon (Citrus limon): cDNA isolation and functional analysis of four monoterpene synthases. Eur J Biochem, 2002, 269(13): 3160–3171. DOI: 10.1046/j.1432-1033.2002.02985.x |
| [24] | Shimada T, Endo T, Fujii H, et al. Molecular cloning and functional characterization of four monoterpene synthase genes from Citrus unshiu Marc. Plant Sci, 2004, 166(1): 49–58. DOI: 10.1016/j.plantsci.2003.07.006 |
| [25] | Shimada T, Endo T, Fujii H, et al. Isolation and characterization of a new d-limonene synthase gene with a different expression pattern in Citrus unshiu Marc. Sci Hortic, 2005, 105(4): 507–512. DOI: 10.1016/j.scienta.2005.02.009 |
| [26] | Bohlmann J, Crock J, Jetter R, et al. Terpenoid-based defenses in conifers: cDNA cloning, characterization, and functional expression of wound-inducible (E)-α-bisabolene synthase from grand fir (Abies grandis). Proc Natl Acad Sci USA, 1998, 95(12): 6756–6761. DOI: 10.1073/pnas.95.12.6756 |
| [27] | Martin DM, F ldt J, Bohlmann J. Functional characterization of nine Norway spruce TPS genes and evolution of gymnosperm terpene synthases of the TPS-d subfamily. Plant Physiol, 2004, 135(4): 1908–1927. DOI: 10.1104/pp.104.042028 |
| [28] | Parveen I, Wang M, Zhao JP, et al. Investigating sesquiterpene biosynthesis in Ginkgo biloba: molecular cloning and functional characterization of (E, E)-farnesol and α-bisabolene synthases. Plant Mol Biol, 2015, 89(4): 451–462. |
| [29] | Fujisawa M, Harada H, Kenmoku H, et al. Cloning and characterization of a novel gene that encodes (S)-beta-bisabolene synthase from ginger, Zingiber officinale. Planta, 2010, 232(1): 121–130. DOI: 10.1007/s00425-010-1137-6 |
| [30] | Jones CG, Moniodis J, Zulak KG, et al. Sandalwood fragrance biosynthesis involves sesquiterpene synthases of both the terpene synthase (TPS)-a and TPS-b subfamilies, including santalene synthases. J Biol Chem, 2011, 286(20): 17445–17454. DOI: 10.1074/jbc.M111.231787 |
| [31] | Srivastava PL, Daramwar PP, Krithika R, et al. Functional characterization of novel sesquiterpene synthases from Indian sandalwood, Santalum album. Sci Rep, 2015, 5: 10095. DOI: 10.1038/srep10095 |
| [32] | Huber DPW, Philippe RN, Godard KA, et al. Characterization of four terpene synthase cDNAs from methyl jasmonate-induced Douglas-fir, Pseudotsuga menziesii. Phytochemistry, 2005, 66(12): 1427–1439. DOI: 10.1016/j.phytochem.2005.04.030 |
| [33] | Ro DK, Ehlting J, Keeling CI, et al. Microarray expression profiling and functional characterization of AtTPS genes: duplicated Arabidopsis thaliana sesquiterpene synthase genes At4g13280 and At4g13300 encode root-specific and wound-inducible (Z)-gamma-bisabolene synthases. Arch Biochem Biophys, 2006, 448(1/2): 104–116. |
| [34] | Aschenbrenner AK, Kwon M, Conrad J, et al. Identification and characterization of two bisabolene synthases from linear glandular trichomes of sunflower (Helianthus annuus L., Asteraceae). Phytochemistry, 2016, 124: 29–37. DOI: 10.1016/j.phytochem.2016.01.009 |
| [35] | Alonso-Gutierrez J, Chan R, Batth TS, et al. Metabolic engineering of Escherichia coli for limonene and perillyl alcohol production. Metab Eng, 2013, 19: 33–41. DOI: 10.1016/j.ymben.2013.05.004 |
| [36] | Jongedijk E, Cankar K, Ranzijn J, et al. Capturing of the monoterpene olefin limonene produced in Saccharomyces cerevisiae. Yeast, 2014, 32(1): 159–171. |
| [37] | Jiang GZ, Yao MD, Wang Y, et al. Manipulation of GES and ERG20 for geraniol overproduction in Saccharomyces cerevisiae. Metab Eng, 2017, 41: 57–66. DOI: 10.1016/j.ymben.2017.03.005 |
| [38] | Blazeck J, Liu LQ, Redden H, et al. Tuning gene expression in Yarrowia lipolytica by a hybrid promoter approach. Appl Environ Microbiol, 2011, 77(22): 7905–7914. DOI: 10.1128/AEM.05763-11 |
| [39] | Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70–74. DOI: 10.1126/science.1191652 |
| [40] | Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086): 940–943. DOI: 10.1038/nature04640 |
| [41] | Dueber JE, Wu GC, Malmirchegini GR, et al. Synthetic protein scaffolds provide modular control over metabolic flux. Nat Biotechnol, 2009, 27(8): 753–759. DOI: 10.1038/nbt.1557 |
| [42] | Lv XM, Wang F, Zhou PP, et al. Dual regulation of cytoplasmic and mitochondrial acetyl-CoA utilization for improved isoprene production in Saccharomyces cerevisiae. Nat Commun, 2016, 7: 12851. DOI: 10.1038/ncomms12851 |
| [43] |
Chen FJ, Zhou JW, Shi ZP, et al. Effect of acetyl-CoA synthase gene overexpression on physiological function of Saccharomyces cerevisiae.
Acta Microbiol Sin, 2010, 50(9): 1172–1179.
(in Chinese). 陈孚江, 周景文, 史仲平, 等. 乙酰辅酶A合成代谢对酿酒酵母生理功能的影响. 微生物学报, 2010, 50(9): 1172-1179. |
| [44] | Lian JZ, Zhao HM. Functional reconstitution of a pyruvate dehydrogenase in the cytosol of Saccharomyces cerevisiae through lipoylation machinery engineering. ACS Synth Biol, 2016, 5(7): 689–697. DOI: 10.1021/acssynbio.6b00019 |
| [45] | Kozak BU, van Rossum HM, Luttik MAH, et al. Engineering acetyl coenzyme A supply: functional expression of a bacterial pyruvate dehydrogenase complex in the cytosol of Saccharomyces cerevisiae. mBio, 2014, 5(5): e01696–14. |
| [46] |
Jiang JP, Wu XR, Chen YJ. Strategy to solve cofactor issues in oxidoreductase catalyzed biocatalytic applications.
Chin J Biotech, 2012, 28(4): 410–419.
(in Chinese). 江金鹏, 吴旭日, 陈依军. 解决氧化还原酶反应体系中辅酶问题的策略及其应用. 生物工程学报, 2012, 28(4): 410-419. |
 2018, Vol. 34
2018, Vol. 34