中国科学院微生物研究所、中国微生物学会主办
文章信息
- 丁浩, 何光军, 王琳淇
- Hao Ding, Guangjun He, Linqi Wang
- 人类环境病原真菌——新生隐球菌的社会行为
- Party for killing:the social behaviors in Cryptococcus neoformans
- 生物工程学报, 2017, 33(9): 1555-1566
- Chinese Journal of Biotechnology, 2017, 33(9): 1555-1566
- 10.13345/j.cjb.170128
-
文章历史
- Received: March 29, 2017
- Accepted: June 15, 2017
2 中国科学院大学, 北京 100049
2 University of Chinese Academy of Sciences, Beijing 100049, China
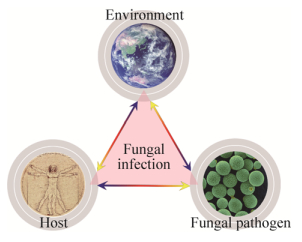
人类病原真菌代表了病原微生物一个重要类群。由于其致死、致残率高(感染致死率往往在20%以上,每年造成超过200万人死亡),严重威胁了人类公共健康安全。近年来,由于艾滋病、器官移植、癌症患者增多以及老龄化等因素,由人类病原真菌感染所导致的死亡病例大幅度激增,这为该类病原微生物的防控构成了极大挑战。绝大多数人类病原真菌属于环境来源的病原微生物(每年导致约150万人死亡),它们与人类宿主并无长期共进化史也不存在紧密的共生关系,主要栖居于自然生境,进化出了丰富的适应行为或策略(Adaptation behavior)以应对生境环境的动态变化[1-3]。该类病原真菌被称为环境病原真菌(Environmental fungal pathogen)。越来越多的证据表明,该类致病菌的宿主侵染和高效的毒力进化能力,可能就是衍生于其对于生境环境出色的适应策略(图 1)。这些环境病原真菌如何将出色的环境适应能力应用于致命感染被认为是环境真菌病原学的核心问题。
|
| 图 1 环境适应策略参与维系了环境病原真菌对生境和宿主压力的适应 Figure 1 Fungal adaptation strategies coordinate their survival both inside and outside of hosts. |
| |
如同大多数环境微生物一样,环境病原真菌在自然界中经常以群落(Community)的方式存在。而生物被膜(Biofilm)是其中研究最为透彻的一种具有分化特征的群落生存方式[4]。越来越多的研究发现,生物被膜的形成与人类病原真菌的感染、耐药甚至毒力进化皆高度相关[5-7]。基于此,生物被膜的形成、维持、解聚以及相关的生物学机制成为人类病原真菌的研究热点之一。最近的一系列研究表明,在一些人类病原真菌生物被膜群落中,细胞呈现了高度的社会性(Sociality)[3, 8]:群落中的个体细胞即使遗传物质完全相同,却由于代谢和生理调控水平(基因表达调控、表观遗传调控)的不同,导致它们在形态与功能上存在显著差异。根据形态或功能的不同,这些群落内细胞可被分成不同的形态或功能细胞亚群。不同细胞亚群利用细胞通讯策略进行交流、协作,并可相互转换。这些细胞分工和协作的手段代表了真菌主要社会性或群体策略。环境病原真菌正是借助这些策略,实现对高变的生境压力的快速适应以及对种群优势(Population fitness)的最大化维系,对其生境压力适应和宿主侵染方面进行平衡[3]。本文以人类环境病原真菌模式菌新生隐球菌为范例,针对生物被膜以及生物被膜样群落(Biofilm-like community)的形成和分化,重点讨论其中社会行为的研究进展。
1 新生隐球菌——人类环境病原真菌模式菌新生隐球菌Cryptococcus neoformans是人类环境病原真菌的模式菌,每年因其感染而死亡的人数在该类病原真菌中位列首位[1, 9]。据统计,该菌每年导致的新发感染病例数超过了100万例,其中约60万人死亡[10]。此外,在绝大多数的国家和地区,新生隐球菌偏好感染免疫缺陷的患者,然而在我国以及一些东南亚国家,该菌倾向于感染免疫健全人群[11-13]。并且在我国的一些省市地区,该菌已成为感染性脑膜炎的主要感染病原体[14],这为我国隐球菌的防控带来了特殊而严峻的挑战。作为环境来源的病原真菌,新生隐球菌主要以孢子和干酵母的形式,通过人类宿主的呼吸道进入肺部,进而可通过血液扩散入侵患者所有脏器,最终通过血脑屏障进入脑部引发致命的隐球菌脑膜炎。相对于其进化地位临近的非致病种而言,新生隐球菌能够产生包裹细胞的多糖荚膜以及抵抗宿主氧自由基压力的黑色素,且可在接近或高于宿主体温(37 ℃)的温度下快速生长[1],这些被认为是新生隐球菌的核心毒力因子。当前针对新生隐球菌的药物极为有限,近30年内并无任何新药面市。不仅如此,作为真核微生物,新生隐球菌具有完整的有性生殖周期[15]。最近的研究表明,隐球菌有性生殖参与了其多种病原表征[16-18],并可作为重要的环境适应手段加速毒力进化过程,导致高毒和药物抗性菌株不断涌现。基于此,全面理解新生隐球菌的致病机制对于人类公共健康安全十分重要。
2 新生隐球菌生物被膜与临床感染新生隐球菌在自然界中分布极广,包括植被表面、腐树树洞、动物皮毛、鸽子粪便和大气微尘等。这种“泛生态分布”的特点可能是造就其成为全球致病菌(Global pathogen)重要原因。作为“成功”的环境病原菌,新生隐球菌发展出了多样的生存策略以应对其宽泛的生境压力。依靠多细胞分工、协作的群体或社会行为被认为作为重要生物学策略以应对多变的生境或宿主压力[3]。其中,生物被膜以及生物被膜样群落相关的细胞群体行为在新生隐球菌的感染和有性生殖进程中皆扮演了关键的角色[3, 7, 19]。针对新生隐球菌生物被膜的首次临床报道发生在20世纪80年代中期[20]。在一个28岁成年男子的脑室-心房分流管检测到新生隐球菌生物被膜样结构,这导致该男子感染了严重的新生隐球菌脑膜炎[20]。随后,生物被膜参与粘附多种不同植入医疗器械(包括腹膜透析瘘管、人工心脏瓣膜等)的事件相继被报道[21-22]。不仅是参与粘附植入医疗器械,新生隐球菌也被报道以生物被膜的方式参与从巨噬细胞内的逃逸[23-24]。
在发育分化上,新生隐球菌的生物被膜形成和成熟与细菌相似,涉及了连续多个不同的生物学过程。首先,隐球菌细胞可附着在固体界面表面。随后,细胞开始大量繁殖并产生丰富的胞外多糖,这些多糖一部分结合在细胞壁组分(几丁质和α葡聚糖)上形成耐受宿主免疫攻击的荚膜,另一部分可脱离于胞外构成胞外基质层(Extracellular matrix layer)参与生物被膜的构成[25]。早期研究显示,生物被膜能够帮助新生隐球菌拮抗来自自然生境的多种生物和非生物来源的压力。例如,生物被膜能够帮助新生隐球菌抵御其天然捕食者(如变形虫(Amoeba)的吞食)[26]。除此之外,生物被膜中的新生隐球菌细胞比游离细胞更具有药物耐受性[27]。Casadevall研究组的研究表明,相对于游离细胞,生物被膜细胞对两性霉素和卡泊芬净更加耐受[27-28]。在自然界中,大量微生物能够产生拮抗真菌生长的化合物,包括两性霉素。生物被膜可能为新生隐球菌针对该类微生物“竞争者”提供生存优势。生物被膜不仅帮助新生隐球菌适应生境压力,在宿主微环境的适应过程中同样也扮演着重要的角色。前期研究显示,生物被膜细胞相对于游离细胞展现了对宿主微环境中的氧自由基更好的抗性。这些结果说明,生物被膜是新生隐球菌的重要环境适应策略(Adaptation strategy),在抵御生境压力以及适应宿主微环境中扮演了至关重要的角色。
3 新生隐球菌生物被膜和有性生殖有性生殖是真核生物特有的基础生命繁殖方式[29]。该生命繁殖方式在不同进化地位的真核生命中广泛存在[30]。在人类环境病原真菌中,有性生殖被认为是关键生物学策略导致高毒和药物抗性表征的产生,从而快速推动毒力进化进程[1, 15]。其中,理解最为透彻的致病菌之一就是新生隐球菌。有性生殖与其多个病原表征高度相关。首先,有性生殖的产物性孢子(Sexual spore)可作为重要的感染繁殖体(Infectious propagule)参与早期宿主肺脏定植[17];其次,通过群体遗传策略,Joseph Heitman实验室证实有性生殖可作为关键的进化动力通过创建遗传内容和核型(Karyotype)多样化,推动了毒力进化,并造成了北美严重的隐球菌爆发性感染[16, 18, 31];再次,有性生殖能够加速非整倍体子裔(Aneuploidy progeny)的产生,后者展现了显著的临床一线治疗药物(氟康唑)抗性,因而有性生殖被认为是隐球菌抗药菌株产生的关键因素之一[18]。新生隐球菌具有两种交配型(α和a),可通过α-a异性生殖(α-a bisexual reproduction)和α同性生殖(α unisexual reproduction)两种模式进行有性生殖[32]。由于自然界中99%的菌株是α交配型,故α同性生殖被认为是新生隐球菌主要的有性生殖方式。然而相对于α同性生殖,α-a异性生殖发现更早,研究得也更为清楚[33]。早期研究表明,将α和a两种细胞混合以后,细胞分泌大量性信息素(Pheromone),该分子与异性细胞表面的性信息素受体(Ste3α或Ste3a)特异性结合,有效地诱导异性(α,a)细胞之间的融合,进而促进有性菌丝、减数分裂、有性孢子产生等一系列有性生殖相关的生物学过程的发生[34-35]。α同性生殖方式在发育上与异性生殖十分相似[18, 36],然而在染色体倍化(Diploidization)方式上有明显差异,α同性生殖被认为可通过细胞周期调控(例如核内复制,Endoreplication)的方式完成染色体倍化[37-39]。除此之外,性菌丝在形态学上也有显著差别:异性菌丝细胞之间具有锁状联合(Clamp connection),该结构反映了担子菌双核菌丝的典型特征;然而,同性菌丝由于其单核的性质,并无锁状联合结构。在新生隐球菌有性生殖过程中,性群落(Mating community)中的底层细胞侵入培养基中,上层细胞构成的菌落可进行有序的发育分化,一部分酵母细胞分化成菌丝,一旦菌丝形成,菌丝细胞开始大量产生黏附蛋白Cfl1,该蛋白促进了菌丝细胞之间的黏连[40]。Xiaorong Lin研究组的研究表明,Cfl1蛋白能够进一步受到剪切,游离的Cfl1构成胞外基质层包裹了部分菌丝以及酵母细胞。基于此,性群落展现出高度类似生物被膜的相关特征[19],在该文中我们将其表述为生物被膜样菌落(Biofilm-like community)。近期研究表明,性群落的生物被膜样特征能够帮助新生隐球菌抵御变形虫的吞食[26],说明性群落的形成可能是新生隐球菌适应环境压力的重要生存策略。
4 新生隐球菌生物被膜和性群落社会调控:细胞功能分工在一个分化的隐球菌性群落当中(图 2A),细胞形态呈现明显的异质性(Heterogeneity),多样的细胞形态共存其中(图 2A)[3]。近期研究表明,隐球菌性群落中不同形态的细胞能够承载截然不同的生物学功能,具体如图 2B所示。

|
| 图 2 分化的新生隐球菌同性生殖群落中多种细胞形态共存(图 2B源自文献[3]). (A)新生隐球菌的同性生殖群落呈现高度分化特征. (B)不同细胞形态承载不同的生物学功能 Figure 2 During the differentiation of unisexual community, cells exhibit remarkable heterogeneity in cellular morphotype. (A) Cryptococcal unisexual community can undergo remarkable differentiation. (B) The different morphologies of C. neoformans are tightly linked with different biological functions[3]. |
| |
当有性生殖开始发生时,性群落中的一部分酵母细胞分化成一种梨状细胞,该细胞形态被称为shmoo形态(图 2B)[41]。在酿酒酵母中,该类细胞主要参与感应来自异性细胞的性信息素以及与异性细胞进行细胞融合[42]。尽管现在没有证据支持该细胞形态在新生隐球菌中参与了相同的生物学过程,但是前期的研究表明,该类细胞受控于性信息素MAPK信号通路的核心调控蛋白Mat2和Mat2的过表达可导致该细胞形态组成型形成[41]。鉴于Mat2在性信息素信号转导过程中的关键角色[43],其调控的shmoo细胞形态很可能直接参与了有性生殖过程。
4.2 假菌丝和菌丝形态除了shmoo细胞形态以外,一部分新生隐球菌细胞可分化成假菌丝和菌丝形态(图 2B)。早期的研究认为假菌丝和菌丝形态的生物学功能相似,皆参与生态位的扩展以及抵御掠食者吞食。由于新生隐球菌和绝大多数真菌相同,并不具备鞭毛和纤毛等用于游动的分子马达。菌丝和假菌丝形成被认为是生态位扩展的重要手段。我们近期的研究表明,与假菌丝不同,菌丝发育与有性生殖的减数分裂过程在遗传和发育上高度相关[31]。一个RNA结合蛋白Pum1可作为一个核心因子链接了菌丝发育和有性生殖过程。此外,借助单克隆扫描成像技术,我们直接观测到菌丝发育与减数分裂过程偶联。因此,菌丝形态可作为一个重要的发育阶段参与了新生隐球菌的有性生殖过程。最近的研究发现,菌丝形态能够刺激小鼠产生免疫反应,经过菌丝处理的小鼠展现出对高毒酵母细胞完全的免疫保护[44]。这说明对于菌丝细胞形态的研究有助于为新生隐球菌免疫疗法的研发提供线索。
4.3 Titan细胞形态Titan形态细胞最初在感染患者的肺部病理切片中被发现。随后,Kirsten Nielsen实验室发现氮饥饿也能驱动该形态的产生[45-46]。典型酵母细胞是单倍体,直径大概在5-7 μm。而该形态细胞直径往往超过15 μm (图 2B),甚至能够达到100 μm左右,一些Titan细胞的染色体倍数可达到64倍以上。Kirsten Nielsen的研究组利用小鼠模型发现该形态的形成主要发生在肺部,在脑部感染中较为罕见[47]。Titan形态细胞通过其巨大细胞体积能够有效规避宿主巨噬细胞的吞噬[48]。除此之外,该形态细胞也展现了对宿主氧压力的显著抗性。我们前期观察显示,该形态在性群落中同样存在,但其在性群落中扮演何种角色尚不清楚。但鉴于其巨大体积,推测其可能参与帮助新生隐球菌抵御天然捕食者的捕食。
相对于性群落,新生隐球菌生物被膜中细胞形态的异质性并不显著,主要由酵母形态细胞构成。尽管在形态上相似,生物被膜中一些代谢和生理状态不同的细胞可能参与执行不同功能。Zdena Palková研究组对于真核微生物模式生物——酿酒酵母的研究支持了这个假说[49]。她们发现,在一个成熟的菌落中(培养20 d以上),细胞在垂直空间上能够分化成两个功能细胞亚群:上层细胞亚群(Upper subpopulation)和下层细胞亚群(Lower subpopulation)。下层细胞亚群一些降解代谢途径的基因表达十分活跃,这个特征保障下层细胞群能够为上层细胞群提供易于利用的营养。这些结果说明,细胞功能的异质性可能作为一个保守的环境适应策略帮助微生物在不同生境压力下维系群体生存优势。
5 新生隐球菌生物被膜和性群落社会调控:细胞-细胞协作多细胞生物建立起了复杂的细胞通讯网络在时空层面上参与细胞识别以及信息传递,保障有序生命活动的进行。与多细胞生物相同,白色念珠菌、新生隐球菌等单细胞致病真菌同样存在多个细胞通讯系统。这些细胞通讯系统参与了病原菌生境压力应答、宿主微环境适应、发育分化以及基础生命繁殖过程。这些细胞通讯系统的核心部分由不同胞外信号分子构成,如群感信号分子、性信息素以及胞外基质信号分子。
5.1 群感信号分子在单细胞微生物中,群体感应(Quorum sensing)是研究得最为透彻的细胞通讯行为[50]。进化地位迥异的微生物均能持续向胞外分泌特定的信号分子(群体感应分子),在细胞密度达到一定程度时其分泌的群体感应分子浓度能够达到阈值,随后改变相关基因的表达强度,从而启动或关闭特定的群体生物学行为,这一过程被称为群体感应(Quorum sensing)。与细菌相比,群体感应现象在真核微生物中发现较晚,最早鉴定的群感分子来自于白色念珠菌的法尼醇(Farnesol)[51]。该群体感应因子控制着菌丝到酵母形态之间的转变,并影响其致病性以及生物被膜的形成。随后,Fink实验室在白色念珠菌中鉴定了另一种群体感应分子——酪醇(tyrosol)[52]。该信号分子的作用方式与法尼醇截然相反,其促进白色念珠菌从酵母到菌丝形态的转换。与白色念珠菌相似,新生隐球菌具有至少两套群感效应系统:多肽信号Qsp1群感系统[53]以及泛酸(Pantothenic acid)群感系统[54]。Albuquerque等在研究调控因子TUP1基因缺失对隐球菌影响时发现,该突变体当接种量小于103时,细胞生长相对于野生型菌株明显滞后,高接种量则无此现象发生[54]。加入高接种量细胞的上清液同样能够使低密度tup1Δ突变体细胞正常生长,说明一个未知信号分子参与了该过程。通过对高细胞密度突变体上清液进行分离得到了一种由11个氨基酸组成的小肽Qsp1,该小肽的加入能够弥补低接种量tup1Δ突变体的生长缺陷[54]。该小肽代表了新生隐球菌中第一个被发现的群感信号分子。最近,Hiten Madhani实验室发现,Qsp1能够参与调控新生隐球菌的毒力过程,并鉴定了一个多肽运输蛋白Opt1参与Qsp1的信号转导过程,指出了群感系统在隐球菌感染中的关键角色[55]。2013年,Albuquerque等发现了隐球菌另一种群体感应分子——泛酸[54]。他们收集稳定生长隐球菌的培养上清(CM)进行实验,发现CM可诱导新生隐球菌生物被膜中的细胞生长,并参与激发细胞合成毒力因子黑色素(Melanin)以及大量分泌荚膜和生物被膜胞外基质层的组分——葡萄糖醛酸木糖甘露聚糖(GXM)。我们未发表的实验结果显示,大接种量的酵母细胞能够分泌一种未知因子,该因子能够拮抗新生隐球菌从酵母到菌丝的转换。有趣的是,泛酸和Qsp1并无该功能,暗示该因子可能代表了一个未被鉴定的群感或群感样信号分子(Quorum sensing-like signal)。
5.2 性信息素1956年,Homer等发现,当将不同交配型的酿酒酵母混合后,酿酒酵母能发生形态变化,启动交配反应。随后的研究发现,在酵母交配过程中,细胞能够分泌一种多肽,该多肽能够有效诱导交配(有性生殖)过程。该多肽被命名为性信息素(Pheromone)[55]。经过50多年的研究,酿酒酵母中性信息素信号通路以及相关分子机制已经十分清楚。性信息素通过结合在细胞表面的G蛋白偶联受体,激活了下游的MAPK级联信号途径,从而激发了交配应答。因此,性信息素途径又称为性信息素MAPK途径[56]。该途径在子囊菌门和担子菌门的真菌中高度保守。前期研究表明,性信息素MAPK途径对于新生隐球菌性群落的形成至关重要。该途径关键基因的缺失能够完全阻断异性生殖的发生,细胞也丧失了侵入培养基以及产生胞外基质的能力[39]。有趣的是,该途径的上游基因尽管对异性生殖十分关键,但对新生隐球菌的同性生殖过程并不必需。早期研究发现,当敲除性信息素受体基因STE3α以及其转运蛋白编码基因STE6对同性菌丝(同性生殖一个重要发育阶段)的分化并无影响[57]。性信息素MAPK途径下游组分不论对同性生殖还是异性生殖均十分重要。这个现象似乎暗示可能存在一个独特的细胞通讯系统能够替代性信息素,通过整合性信息素MAPK途径的下游组分特异性地参与同性生殖性群落的分化。
5.3 胞外基质蛋白信号胞外基质分子在高等真核生物中往往作为信号分子调控基因表达,借此指导多样的生物学行为。在微生物中,胞外基质分子往往作为重要的结构组分参与生物被膜的形成。例如,在酿酒酵母中,粘附因子Flo11可通过剪切游离于胞外,参与胞外基质层形成以及生物被膜的分化和扩展[58-59]。然而,一些基于分子遗传学的研究暗示,在一些微生物中,胞外基质分子可能直接作为信号分子参与微生物发育分化过程。例如,Roberto Kolter实验室发现,胞外基质蛋白编码基因tasA的缺失导致了枯草芽胞杆菌产孢缺陷,暗示胞外基质分子可能具有调控活性[60]。最近,Matthew R. Parsek研究组的研究为上述假说提供了更为直接的证据[61]。他们发现,铜绿假单胞菌能够直接利用胞外基质多糖Psl作为信号分子激活产生二级信使c-di-GMP的相关基因,导致细胞大量合成c-di-GMP进而诱导生物被膜形成[61]。不仅是胞外基质多糖,我们近期的研究发现胞外基质蛋白也可激活新生隐球菌性群落分化。当新生隐球菌性群落开始分化时,胞外基质蛋白Cfl1编码基因被极大诱导,导致大量Cfl1蛋白形成[19]。Cfl1蛋白具有双功能:一方面可锚定在细胞壁上作为细胞粘附蛋白指导细胞粘附;另一方面,其可通过剪切形成胞外游离蛋白,参与胞外基质层形成。重要的是,胞外基质层中Cfl1蛋白可作为信号分子通过Znf2菌丝形成途径直接参与性群落的分化。然而,Cfl1信号分子的受体以及信号转导机制仍尚待揭示。Cfl1信号分子量超过20 kDa,代表了一个新颖的蛋白信号分子[19]。单克隆扫描成像结果显示,Cfl1特异性地激活了性群落外层细胞的基因表达,内层细胞并不能应答Cfl1产生菌丝。这说明Cfl1属于空间信号分子。最近,Xiaorong Lin实验室鉴定了另一个蛋白类信号分子——分泌乙酰辅酶A结合蛋白Acb1[62]。Acb1并不包含信号肽序列,因此并不能通过经典的内质网-高尔基体途径进行外排,而是依赖Golgi reassembly stacking蛋白依赖的途径进行分泌。与Cfl1相似,外泌Acb1同样对性群落的正常分化非常重要。
6 结语与展望绝大多数人类病原真菌并不是专性病原菌,而是腐生微生物。这些“环境微生物”的毒力进化并不由宿主因素驱动,其“致命感染”被认为就是简单衍生于其对生境环境出色的适应性策略或行为。绝大多数人类病原真菌进化出多样的群体或社会调控策略,包括细胞功能异质性(Functional heterogeneity)、功能(形态)转换以及细胞-细胞交流。这些相互联系和彼此交织的环境适应策略不仅保障了环境病原真菌在自然生境下的存活,同样也维系了其在不同宿主微环境中的生存优势。然而,当前对于该类病原菌的研究主要围绕单一致病性状或致病形态来开展,对于真菌群体或社会调控的研究尽管有一些突破,但对其遗传基础以及相关分子或细胞机制的理解仍非常有限。
大多数环境人类病原真菌能够通过改变形态去适应不同的生境压力以及宿主微环境。不同形态的细胞由于生理、代谢和细胞亚结构(细胞壁组分)的不同,导致它们对于宿主感染以及生境或宿主压力适应存在显著差异。例如,酵母形态作为高毒形态参与隐球菌对宿主的侵染。与酵母形态相反,菌丝形态完全无毒,但能刺激小鼠产生免疫保护以及作为重要的分化阶段参与隐球菌有性生殖过程。这反映了两个信息:1) 形态和细胞功能高度相关,两种形态承载了两个截然不同的生物学功能;2) 存在形态特异的抗原和病原分子,抗原和病原基因在两种形态中差异表达。值得注意的是,在新生隐球菌感染和性群落分化过程中,多种不同形态或功能的细胞亚群共存其中,除了酵母和菌丝形态还包括其他多种形态。这种显著的形态异质性可为新生隐球菌在细胞功能上提供多样的选择和组合。不仅如此,这些形态或功能的细胞可借助细胞通讯信号进行相互转换,极大扩展了新生隐球菌细胞在功能选择或组合上的可塑性。这些复杂多样的社会调控方式和策略可能为新生隐球菌作为环境微生物和致命病原菌双重角色提供了生物学基础。了解真菌群体或社会调控机制有助于揭示环境真菌感染宿主的核心病原学机制,可为开发抗真菌疫苗、鉴定药物靶点和发展防控真菌感染的新型疗法奠定重要的理论基础。
| [1] | May RC, Stone NR, Wiesner DL, et al. Cryptococcus:from environmental saprophyte to global pathogen. Nat Rev Microbiol, 2016, 14(2): 106–117. |
| [2] | Casadevall A. Amoeba provide insight into the origin of virulence in pathogenic fungi. Adv Exp Med Biol, 2012, 710: 1–10. DOI: 10.1007/978-1-4419-5638-5 |
| [3] | Wang L, Lin X. The morphotype heterogeneity in Cryptococcus neoformans. Curr Opin Microbiol, 2015, 26: 60–64. DOI: 10.1016/j.mib.2015.06.003 |
| [4] | Nadell CD, Drescher K, Foster KR. Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol, 2016, 14(9): 589–600. DOI: 10.1038/nrmicro.2016.84 |
| [5] | Finkel JS, Mitchell AP. Genetic control of Candida albicans biofilm development. Nat Rev Microbiol, 2011, 9(2): 109–118. DOI: 10.1038/nrmicro2475 |
| [6] | Desai JV, Mitchell AP. Candida albicans biofilm development and its genetic control. Microbiol Spectr, 2015, 3(3). DOI: 10.1128/microbiolspec.MB-0005-2014 |
| [7] | Martinez LR, Casadevall A. Biofilm formation by Cryptococcus neoformans. Microbiol Spectr, 2015, 3(3). DOI: 10.1128/microbiolspec.MB-0006-2014 |
| [8] | Scaduto CM, Bennett RJ. Candida albicans the chameleon:transitions and interactions between multiple phenotypic states confer phenotypic plasticity. Curr Opin Microbiol, 2015, 26: 102–108. DOI: 10.1016/j.mib.2015.06.016 |
| [9] | Kronstad JW, Attarian R, Cadieux B, et al. Expanding fungal pathogenesis:Cryptococcus breaks out of the opportunistic box. Nat Rev Microbiol, 2011, 9(3): 193–203. DOI: 10.1038/nrmicro2522 |
| [10] | Idnurm A, Bahn YS, Nielsen K, et al. Deciphering the model pathogenic fungus Cryptococcus neoformans. Nat Rev Microbiol, 2005, 3(10): 753–764. DOI: 10.1038/nrmicro1245 |
| [11] | Zhu LP, Wu JQ, Xu B, et al. Cryptococcal meningitis in non-HIV-infected patients in a Chinese tertiary care hospital, 1997-2007. Med Mycol, 2010, 48(4): 570–579. DOI: 10.3109/13693780903437876 |
| [12] | Liao Y, Chen M, Hartmann T, et al. Epidemiology of opportunistic invasive fungal infections in China:review of literature. Chin Med J (Engl), 2013, 126(2): 361–368. |
| [13] | Fang W, Fa ZZ, Liao WQ. Epidemiology of Cryptococcus and cryptococcosis in China. Fungal Genet Biol, 2015, 78: 7–15. DOI: 10.1016/j.fgb.2014.10.017 |
| [14] | Xie Y, Tan Y, Chongsuvivatwong V, et al. A population-based acute meningitis and encephalitis syndromes surveillance in Guangxi, China, May 2007-June 2012. PLoS ONE, 2015, 10(12): e0144366. DOI: 10.1371/journal.pone.0144366 |
| [15] | Ene IV, Bennett RJ. The cryptic sexual strategies of human fungal pathogens. Nat Rev Microbiol, 2014, 12(4): 239–251. DOI: 10.1038/nrmicro3236 |
| [16] | Fraser JA, Giles SS, Wenink EC, et al. Same-sex mating and the origin of the Vancouver Island Cryptococcus gattii outbreak. Nature, 2005, 437(7063): 1360–1364. DOI: 10.1038/nature04220 |
| [17] | Velagapudi R, Hsueh YP, Geunes-Boyer S, et al. Spores as infectious propagules of Cryptococcus neoformans. Infect Immun, 2009, 77(10): 4345–4355. DOI: 10.1128/IAI.00542-09 |
| [18] | Ni M, Feretzaki M, Li WJ, et al. Unisexual and heterosexual meiotic reproduction generate aneuploidy and phenotypic diversity de novo in the yeast Cryptococcus neoformans. PLoS Biol, 2013, 11(9): e1001653. DOI: 10.1371/journal.pbio.1001653 |
| [19] | Wang LQ, Tian XY, Gyawali R, et al. Fungal adhesion protein guides community behaviors and autoinduction in a paracrine manner. Proc Natl Acad Sci USA, 2013, 110(28): 11571–11576. DOI: 10.1073/pnas.1308173110 |
| [20] | Walsh TJ, Schlegel R, Moody MM, et al. Ventriculoatrial shunt infection due to Cryptococcus neoformans:An ultrastructural and quantitative microbiological study. Neurosurgery, 1986, 18(3): 373–375. DOI: 10.1227/00006123-198603000-00025 |
| [21] | Ingram CW, Haywood Ⅲ HB, Morris VM, et al. Cryptococcal ventricular-peritoneal shunt infection:clinical and epidemiological evaluation of two closely associated cases. Infect Control Hosp Epidemiol, 1993, 14(12): 719–722. DOI: 10.2307/30148351 |
| [22] | Braun DK, Janssen DA, Marcus JR, et al. Cryptococcal infection of a prosthetic dialysis fistula. Am J Kidney Dis, 1994, 24(5): 864–867. DOI: 10.1016/S0272-6386(12)80683-4 |
| [23] | Alvarez M, Saylor C, Casadevall A. Antibody action after phagocytosis promotes Cryptococcus neoformans and Cryptococcus gattii macrophage exocytosis with biofilm-like microcolony formation. Cell Microbiol, 2008, 10(8): 1622–1633. DOI: 10.1111/cmi.2008.10.issue-8 |
| [24] | Alvarez M, Casadevall A. Phagosome extrusion and host-cell survival after Cryptococcus neoformans phagocytosis by macrophages. Curr Biol, 2006, 16(21): 2161–2165. DOI: 10.1016/j.cub.2006.09.061 |
| [25] | Martinez LR, Casadevall A. Specific antibody can prevent fungal biofilm formation and this effect correlates with protective efficacy. Infect Immun, 2005, 73(10): 6350–6362. DOI: 10.1128/IAI.73.10.6350-6362.2005 |
| [26] | Lin JF, Idnurm A, Lin XR. Morphology and its underlying genetic regulation impact the interaction between Cryptococcus neoformans and its hosts. Med Mycol, 2015, 53(5): 493–504. DOI: 10.1093/mmy/myv012 |
| [27] | Martinez LR, Casadevall A. Susceptibility of Cryptococcus neoformans biofilms to antifungal agents in vitro. Antimicrob Agents Chemother, 2006, 50(3): 1021–1033. DOI: 10.1128/AAC.50.3.1021-1033.2006 |
| [28] | Martinez LR, Christaki E, Casadevall A. Specific antibody to Cryptococcus neoformans glucurunoxylomannan antagonizes antifungal drug action against cryptococcal biofilms in vitro. J Infect Dis, 2006, 194(2): 261–266. DOI: 10.1086/jid.2006.194.issue-2 |
| [29] | Goodenough U, Heitman J. Origins of eukaryotic sexual reproduction. Cold Spring Harb Perspect Biol, 2014, 6(3): a016154. DOI: 10.1101/cshperspect.a016154 |
| [30] | Bachtrog D, Mank JE, Peichel CL, et al. Sex determination:why so many ways of doing it?. PLoS Biol, 2014, 12(7): e1001899. DOI: 10.1371/journal.pbio.1001899 |
| [31] | Wang L, Tian X, Gyawali R, et al. Morphotype transition and sexual reproduction are genetically associated in a ubiquitous environmental pathogen. PLoS Pathog, 2014, 10(6): e1004185. DOI: 10.1371/journal.ppat.1004185 |
| [32] | Lin X, Hull CM, Heitman J. Sexual reproduction between partners of the same mating type in Cryptococcus neoformans. Nature, 2005, 434(7036): 1017–1021. DOI: 10.1038/nature03448 |
| [33] | Kwon-Chung KJ. Morphogenesis of Filobasidiella neoformans, the sexual state of Cryptococcus neoformans. Mycologia, 1976, 68(4): 821–833. DOI: 10.2307/3758800 |
| [34] | Lin XR, Heitman J. The biology of the Cryptococcus neoformans species complex. Annu Rev Microbiol, 2006, 60: 69–105. DOI: 10.1146/annurev.micro.60.080805.142102 |
| [35] | Ni M, Feretzaki M, Sun S, et al. Sex in fungi. Annu Rev Genet, 2011, 45: 405–430. DOI: 10.1146/annurev-genet-110410-132536 |
| [36] | Sun S, Billmyre RB, Mieczkowski PA, et al. Unisexual reproduction drives meiotic recombination and phenotypic and karyotypic plasticity in Cryptococcus neoformans. PLoS Genet, 2014, 10(12): e1004849. DOI: 10.1371/journal.pgen.1004849 |
| [37] | Lin XR, Patel S, Litvintseva AP, et al. Diploids in the Cryptococcus neoformans serotype A population homozygous for the α mating type originate via unisexual mating. PLoS Pathog, 2009, 5(1): e1000283. DOI: 10.1371/journal.ppat.1000283 |
| [38] | Lin X, Huang JC, Mitchell TG, et al. Virulence attributes and hyphal growth of C. neoformans are quantitative traits and the MATα allele enhances filamentation. PLoS Genet, 2006, 2(11): e187. DOI: 10.1371/journal.pgen.0020187 |
| [39] | Wang L, Lin X. Mechanisms of unisexual mating in Cryptococcus neoformans. Fungal Genet Biol, 2011, 48(7): 651–660. DOI: 10.1016/j.fgb.2011.02.001 |
| [40] | Lin XR, Alspaugh JA, Liu HP, et al. Fungal morphogenesis. Cold Spring Harb Perspect Med, 2014, 5(2): a019679. |
| [41] | Wang LQ, Zhai B, Lin XR. The link between morphotype transition and virulence in Cryptococcus neoformans. PLoS Pathog, 2012, 8(6): e1002765. DOI: 10.1371/journal.ppat.1002765 |
| [42] | Tkacz JS, MacKay VL. Sexual conjugation in yeast. Cell surface changes in response to the action of mating hormones. J Cell Biol, 1979, 80(2): 326–333. DOI: 10.1083/jcb.80.2.326 |
| [43] | Lin X, Jackson JC, Feretzaki M, et al. Transcription factors Mat2 and Znf2 operate cellular circuits orchestrating opposite-and same-sex mating in Cryptococcus neoformans. PLoS Genet, 2010, 6(5): e1000953. DOI: 10.1371/journal.pgen.1000953 |
| [44] | Zhai B, Wozniak KL, Masso-Silva J, et al. Development of protective inflammation and cell-mediated immunity against Cryptococcus neoformans after exposure to hyphal mutants. mBio, 2015, 6(5): e01433–15. |
| [45] | Zaragoza O, García-Rodas R, Nosanchuk JD, et al. Fungal cell gigantism during mammalian infection. PLoS Pathog, 2010, 6(6): e1000945. DOI: 10.1371/journal.ppat.1000945 |
| [46] | Okagaki LH, Strain AK, Nielsen JN, et al. Cryptococcal cell morphology affects host cell interactions and pathogenicity. PLoS Pathog, 2010, 6(6): e1000953. DOI: 10.1371/journal.ppat.1000953 |
| [47] | Zaragoza O, Nielsen K. Titan cells in Cryptococcus neoformans:cells with a giant impact. Curr Opin Microbiol, 2013, 16(4): 409–413. DOI: 10.1016/j.mib.2013.03.006 |
| [48] | Okagaki LH, Nielsen K. Titan cells confer protection from phagocytosis in Cryptococcus neoformans infections. Eukaryot Cell, 2012, 11(6): 820–826. DOI: 10.1128/EC.00121-12 |
| [49] | ČápM, ŠtěpánekL, HarantK, 等. Cell differentiation within a yeast colony:metabolic and regulatory parallels with a tumor-affected organism. Mol Cell, 2012, 46(4): 436-448. |
| [50] | Bassler BL. How bacteria talk to each other:regulation of gene expression by quorum sensing. Curr Opin Microbiol, 1999, 2(6): 582–587. DOI: 10.1016/S1369-5274(99)00025-9 |
| [51] | Hornby JM, Jensen EC, Lisec AD, et al. Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol. Appl Environ Microbiol, 2001, 67(7): 2982–2992. DOI: 10.1128/AEM.67.7.2982-2992.2001 |
| [52] | Albuquerque P, Casadevall A. Quorum sensing in fungi-a review. Med Mycol, 2012, 50(4): 337–345. DOI: 10.3109/13693786.2011.652201 |
| [53] | Lee H, Chang YC, Nardone G, et al. TUP1 disruption in Cryptococcus neoformans uncovers a peptide-mediated density-dependent growth phenomenon that mimics quorum sensing. Mol Microbiol, 2007, 64(3): 591–601. DOI: 10.1111/mmi.2007.64.issue-3 |
| [54] | Albuquerque P, Nicola AM, Nieves E, et al. Quorum sensing-mediated, cell density-dependent regulation of growth and virulence in Cryptococcus neoformans. mBio, 2013, 5(1): e00986–13. |
| [55] | Homer CM, Summers DK, Goranov AI, et al. Intracellular action of a secreted peptide required for fungal virulence. Cell Host Microbe, 2016, 19(6): 849–864. DOI: 10.1016/j.chom.2016.05.001 |
| [56] | Mordret G. MAP kinase kinase:a node connecting multiple pathways. Biol Cell, 1993, 79(3): 193–207. DOI: 10.1016/0248-4900(93)90138-5 |
| [57] | Chacko N, Zhao YB, Yang EC, et al. The lncRNA RZE1 controls cryptococcal morphological transition. PLoS Genet, 2015, 11(11): e1005692. DOI: 10.1371/journal.pgen.1005692 |
| [58] | Reynolds TB, Fink GR. Bakers' yeast, a model for fungal biofilm formation. Science, 2001, 291(5505): 878–881. DOI: 10.1126/science.291.5505.878 |
| [59] | Karunanithi S, Vadaie N, Chavel CA, et al. Shedding of the mucin-like flocculin Flo11p reveals a new aspect of fungal adhesion regulation. Curr Biol, 2011, 20(15): 1389–1395. |
| [60] | Vlamakis H, Aguilar C, Losick R, et al. Control of cell fate by the formation of an architecturally complex bacterial community. Genes Dev, 2008, 22(7): 945–953. DOI: 10.1101/gad.1645008 |
| [61] | Irie Y, Borlee BR, O'Connor JR, et al. Self-produced exopolysaccharide is a signal that stimulates biofilm formation in Pseudomonas aeruginosa. Proc Natl Acad Sci USA, 2012, 109(50): 20632–20636. DOI: 10.1073/pnas.1217993109 |
| [62] | Xu X, Zhao Y, Kirkman E, et al. Secreted acb1 contributes to the yeast-to-hypha transition in Cryptococcus neoformans. Appl Environ Microbiol, 2015, 82(4): 1069–1079. |
 2017, Vol. 33
2017, Vol. 33