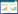中国科学院微生物研究所、中国微生物学会主办
文章信息
- 向绪稳, 刘星宇, 陶辉, 崔紫宁, 张炼辉
- Xuwen Xiang, Xingyu Liu, Hui Tao, Zining Cui, Lianhui Zhang
- 环二鸟苷酸信号分子抑制剂的研究进展
- Progress in c-di-GMP inhibitors
- 生物工程学报, 2017, 33(9): 1466-1477
- Chinese Journal of Biotechnology, 2017, 33(9): 1466-1477
- 10.13345/j.cjb.170123
-
文章历史
- Received: March 28, 2017
- Accepted: May 3, 2017
2 华南农业大学农学院 群体微生物研究中心, 广东 广州 510642;
3 广东省微生物信号与作物病害防控重点实验室, 广东 广州 510642
张炼辉 教授,国际群体感应研究权威专家,国家“千人计划”特聘专家、长江讲座特聘教授、“973”首席科学家(微生物群体感应通讯系统及病害防控应用基础)、国务院学位委员会第七届学科评议组成员、广东省领军人才、新加坡2005年度“国家科学奖”得主,2017年当选为美国微生物科学院(American Academy of Microbiology, AAM)院士(Fellow),被认为是群体感应领域的奠基者之一,群体淬灭防治植物病害新理论的建立者。2013年协调华南农业大学校内多个单位组建“广东省微生物信号与作物病害防控重点实验室”;同年协助引进广东省“群体微生物基础理论与前沿技术创新团队”;2016年组建了首个华南农业大学校级研究中心——“群体微生物研究中心”
2 Integrative Microbiology Research Centre, College of Agriculture, South China Agricultural University, Guangzhou 510642, Guangdong, China;
3 Guangdong Province Key Laboratory of Microbial Signals and Disease Control, Guangzhou 510642, Guangdong, China
环二鸟苷酸(Bis-(3′-5′) cyclic diguanylic acid, c-di-GMP)是一类非常重要的核酸类第二信使,普遍存在于各种细菌中,参与并调节细菌多种生理功能,其对细胞分化、生物被膜的形成以及致病因子的产生等有着重要的调节作用。阐明c-di-GMP对细菌生理活动的调控机理,对于寻找新的作用靶点、开发新型抗菌药物和解决细菌耐药问题具有非常重要的意义。
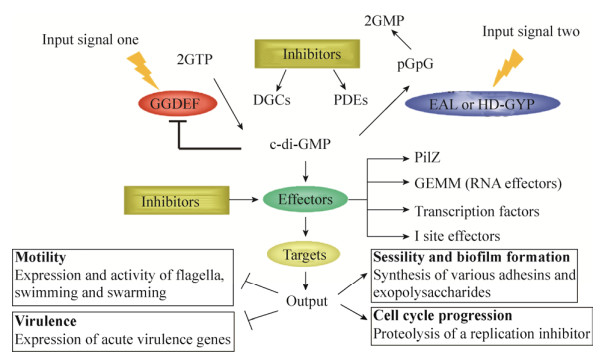
现有研究结果表明:c-di-GMP介导的信号通路由4部分组成(图 1):1) 感应外界信号而促进c-di-GMP合成的二鸟苷酸环化酶(Diguanylate cyclases, DGCs);2) 降解c-di-GMP的磷酸二酯酶(Phosphodiesterases, PDEs);3) 结合c-di-GMP的效应分子(Effectors);4) 受效应分子直接调控的下游靶标(Targets)。细菌通过二鸟苷酸环化酶GGDEF和磷酸二酯酶EAL结构域N-末端相连的感受结构域接收外来信号[1-2],并通过两种酶的拮抗作用调节细菌内c-di-GMP的水平。二鸟苷酸环化酶和磷酸二酯酶对c-di-GMP的合成和降解作用是整个信号通路的核心。
|
| 图 1 c-di-GMP介导的信号调控通路及对应的抑制剂 Figure 1 The c-di-GMP mediated signaling pathway and the corresponding inhibitors. DGCs and PDEs respond to different input signals through their amino-terminal sensory domains and balance the c-di-GMP level by their antagonistic activities. Multiple numbers of DGCs and PDEs are often found associated with sensor domains such as PAS for sensing gaseous ligands such as O2, CO2, NO etc. and BLUF for sensing light. |
| |
由于c-di-GMP介导的信号通路与细菌的多种生理活动有密切关系,因此,阻断c-di-GMP信号的传导对于发展新型抗菌药物具有重要的意义。从c-di-GMP介导的信号通路可以看出,基于c-di-GMP调控的信号通路开发新型抗菌药物具有3类潜在的靶点,分别是c-di-GMP合成酶抑制剂、c-di-GMP降解酶抑制剂以及c-di-GMP受体抑制剂。本文将根据上述3类关键靶点,介绍相关小分子抑制剂的研究进展。
1 c-di-GMP合成酶(二鸟苷酸环化酶)抑制剂的研究进展c-di-GMP作为细菌的第二信使,其在细菌内是级联式传导。因此,相比于直接作用于c-di-GMP的下游靶点,控制其内源合成显得更加高效。二鸟苷酸环化酶是合成c-di-GMP的关键酶,该酶催化2分子的鸟苷三磷酸(Guanosinetriphosphate,GTP)生成1分子的c-di-GMP并释放2分子的焦磷酸盐。现有的研究表明,大部分的二鸟苷酸环化酶具有GGDEF或GGEEF结构域[3-5],该结构域是其催化的活性位点(A-site);除该活性位点外,一些二鸟苷酸环化酶还具有抑制位点(I-site),c-di-GMP能够以二聚体的形式与I位点或A位点结合,从而抑制二鸟苷酸环化酶的活性[6-7],这种反馈抑制不仅能够有效地避免GTP的过度消耗,而且还能维持胞内c-di-GMP水平的稳定[8]。迄今为止,研究人员已经合成并筛选出一批能够抑制二鸟苷酸环化酶的小分子化合物,按照其化学结构特点可以分为3类:环状二核苷酸衍生物、电中性核苷酸衍生物和非核苷酸类化合物。
1.1 环状二核苷酸衍生物酶的催化活性受其所催化反应的产物反馈调节,二鸟苷酸环化酶同样如此。因此,环二鸟苷酸及其衍生物是一种潜在的DGCs抑制剂,通过对c-di-GMP的衍生不仅有利于发现新的二鸟苷酸环化酶抑制剂,而且还有利于弄清楚c-di-GMP与二鸟苷酸环化酶作用的分子机制。近年来,研究人员已经设计合成出许多环状二核苷酸类化合物,包括碱基的替换、磷酯键和糖基的修饰等。
早在2010年,Ching等[9]就已经合成了一系列不同碱基的环状二核苷酸,通过研究发现环二肌苷酸(c-di-IMP,图 2)能够抑制集胞藻Synechocystis sp.的环二鸟苷酸合成酶Slr1143,并且抑制作用明显高于c-di-GMP,从而导致对生物被膜的形成具有较好的抑制作用。
2013年,Sintim课题组[10]通过分析c-di-GMP与DGC、PDE和PilZ蛋白的复合物晶体结构,发现c-di-GMP糖基的2′-OH对于结合代谢酶和受体蛋白PilZ具有非常重要的作用。在此基础上,他们设计并合成了3种2′位取代基不同的化合物,并且通过实验发现2′位被氟原子取代的衍生物2′-F-c-di-GMP (图 2)对铜绿假单胞菌Pseudomonas aeruginosa的二鸟苷酸环化酶WspR具有很好的抑制作用,其对二鸟苷酸环化酶的抑制作用是c-di-GMP的4倍。但是,该衍生物缺乏很好的选择性,实验表明该化合物对磷酸二酯酶RocR也具有很强的抑制作用(IC50=0.7 μmol/L)。
弥散序列核磁共振谱(DOSY)表明c-di-GMP五元糖环2号位羟基的改变并不影响其聚合状态。因此,他们认为2′-F-c-di-GMP可能是以二聚体的状态结合二鸟苷酸环化酶的抑制位点而产生抑制作用。
1.2 电中性核苷酸类似物由于环二鸟苷酸类似物具有负电性,相比于中性分子来说,带电的化合物更不易通过被动扩散的形式进入细胞[11-12]。在这种情况下,电中性的核苷酸衍生物显得尤为重要。
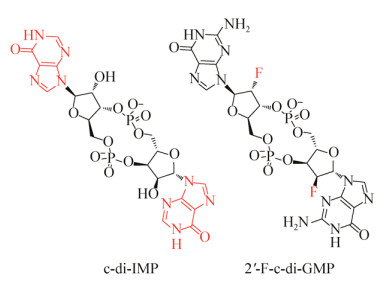
2015年,Fernicola等[13]对环二鸟苷酸的化学结构进行了一次大胆的改造,将整个磷酸酯键用非经典的生物电子等排体1, 2, 3-三氮唑替换,并且从中筛选出了2个电中性的磷酸二酯酶抑制剂DCI061和DCI058 (图 3)。实验显示,这两个化合物不仅能够抑制新月柄杆菌Caulobacter crescentus的环二鸟苷酸合成酶(PleD)的活性,而且对铜绿假单胞菌的磷酸二酯酶(RocR)也具有抑制作用。其中,DCI058对新月柄杆菌环二鸟苷酸合成酶(PleD)的抑制作用远强于其对磷酸二酯酶RocR的抑制作用。通过进一步研究发现,DCI061对I位点退化的环二鸟苷酸合成酶基本没有抑制作用。由此,他们推断该化合物通过结合二鸟苷酸环化酶的I位点而抑制酶的活性。
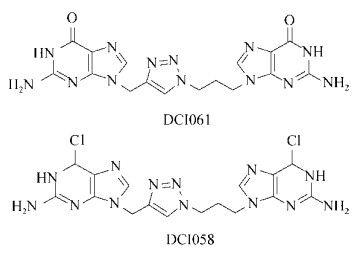
早在1998年,Ohana等[14]通过研究发现,豌豆的粗提物能够抑制木醋杆菌Acetobacter xylinum环二鸟苷酸酶的活性。他们通过分离纯化该粗提物得到了几种五环三萜类化合物,并通过活性测试确定其中的三萜皂苷类化合物(GTS,图 5)对木醋杆菌环二鸟苷酸酶具有抑制作用。同一年,Ohana等又发现球孢阜孢霉Papularia sphaerosperma的次生代谢产物阜孢霉素B (Papulacandin B) (图 5)也能够抑制木醋杆菌DGCs的活性[15]。
最近几年,随着基于结构的虚拟筛选、高通量筛选以及基于片段的药物设计等手段的广泛应用,一批全新的二鸟苷酸环化酶小分子抑制剂被发现。筛选得到的一些小分子化合物不仅能够抑制二鸟苷酸环化酶的活性,同时能够对细菌的表型产生影响。
2014年,Sambanthamoorthy等[16]通过一种基于药效团的高通量筛选发现了4个能够抑制鲍氏不动杆菌Acinetobacter baumannii和铜绿假单胞菌二鸟核苷酸环化酶(DGCs)的化合物(LP1062、LP3134、LP3145、LP4010,图 5)。研究显示,4个化合物都能够分散铜绿假单胞菌已经形成的生物被膜。其中,LP-3134还能够影响铜绿假单胞菌的黏附作用以及生物被膜的形成。
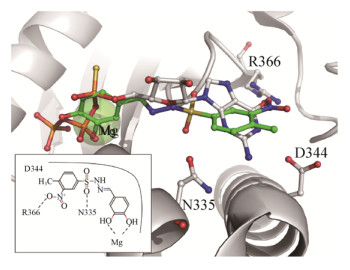
2016年,Fernicola等[17]以新月柄杆菌二鸟苷酸环化酶PleD的3D结构(PDB: 2V0N[18]和4H54[19])为基础,运用虚拟筛选的方法,对ZINC数据库中的2.3×107个化合物进行了筛选,最终得到7个具有潜在抑制活性的磺酰肼Schiff碱类化合物。但是,最终的活性测试实验显示仅有化合物2 (IC50=(11.1±1.2) μmol/L)和化合物7 (IC50=(11.1±1.1) μmol/L) (图 4)对PleD具有很好的抑制作用。随后,他们利用分子对接模拟了化合物2和7与PleD蛋白活性腔的互作模式。结果显示,苯磺酰基苯环上的硝基与磺酸基团上的氧原子分别与关键氨基酸活性位点R366和N335形成氢键,对该化合物结合酶的活性位点是必不可少的。同时,苄基苯环上3、4号位的2个羟基则与Mg2+发生螯合作用,从而抑制了该位点结合三磷酸腺苷(GTP)并催化形成磷酸酯键的能力(图 4)。
过去的研究表明,传统的高通量筛选和基于结构的虚拟筛选不仅需要分离纯化相应蛋白,而且经常会导致假阳性的产生,因此,开发合适的筛选方法显得尤为重要。
在2012年,Sambanthamoorthy等[20]利用霍乱弧菌Vibrio cholerae中高浓度的c-di-GMP抑制荧光素酶VC1673-lux[21]的表达这一特性筛选得到了7个能够抑制霍乱弧菌二鸟苷酸环化酶的小分子拮抗剂,进而对霍乱弧菌生物被膜的形成产生抑制作用。该筛选方法不需要分离纯化DGCs蛋白,大大提高了筛选效率。在这7个小分子化合物中,有2个(DI-3和DI-10,图 5)能够通过抑制二鸟苷酸环化酶显著降低霍乱弧菌细胞内c-di-GMP的含量。
实验表明,化合物DI-3不仅对霍乱弧菌生物被膜的形成有抑制作用,而且对铜绿假单胞菌生物被膜的形成表现出同样的抑制作用,表现出广谱的抗生物被膜活性。
2014年,Lieberman等[22]通过基于微分径向毛细管作用的配体分析方法(Differential radial capillary action of ligand assay, DRaCALA)[23-24],筛选得到了依布硒啉(Eb)和依布硒啉氧化物(EbO)两个二鸟苷酸环化酶的抑制剂(图 5),依布硒啉和布硒啉氧化物对铜绿假单胞菌的二鸟苷酸环化酶WspR和新月柄杆菌的二鸟苷酸环化酶PleD都具有很好的抑制活性。通过进一步的研究,他们推测依布硒啉(Eb)和依布硒啉氧化物(EbO)可能是通过共价结合位于DGC酶的活性位点上的半胱氨酸残基而抑制二鸟苷酸环化酶的活性。虽然实验证明依布硒啉和布硒啉氧化物能够抑制新月柄杆菌和铜绿假单胞菌中二鸟苷酸环化酶的活性,但是表型实验显示:Eb和EbO仅能够改变铜绿假单胞菌PA14菌株的运动状态和生物被膜的形成,而对新月杆菌生物被膜的形成并没有影响。
2 c-di-GMP降解酶(磷酸二酯酶)抑制剂的研究进展磷酸二酯酶(PDEs)具有水解第二信使的功能,存在多种亚型。细菌内负责降解c-di-GMP的磷酸二酯酶(PDEs)一般含有EAL结构域或者HD-GYP结构域,其中EAL结构域水解c-di-GMP为2分子GMP[25-26];HD-GYP则水解其为链状二核苷酸5′-pGpG[27];磷酸二酯酶(PDEs)是控制c-di-GMP代谢的关键酶。因此,该酶也是开发c-di-GMP信号分子抑制剂的重要作用靶点之一。
第一个能够选择性抑制磷酸二酯酶(PDEs)活性的化合物是Sintim课题组[28]设计合成的endo-S-c-di-GMP (图 6),其仅对铜绿假单胞菌的磷酸二酯酶RocR具有很明显的抑制作用,而对DGC蛋白WspR和PilZ蛋白Alg44没有任何影响;根据c-di-GMP与DGC、PilZ以及PDE活性腔结合的复合物晶体结构(PDB:3I5A[4]、3KYF[29-30]、3HV8[31-32]、3N3T[33]),他们认为:相比于c-di-GMP,endo-S-c-di-GMP在一价金属存在的溶液中大多以单体的形式存在,这种单体的“开放”状态对于结合DGCs的GGDEF结构域和PilZ是不利的,而对于结合磷酸二酯酶RocR的EAL结构域是有利的。因此,该化合物表现出很好的选择性。在随后的研究中Sintim课题组也发现c-di-GMP衍生物2′-H-c-di-GMP和2′-OMe-c-di-GMP (图 6)对磷酸二酯酶RocR具有一定的抑制作用[10]。
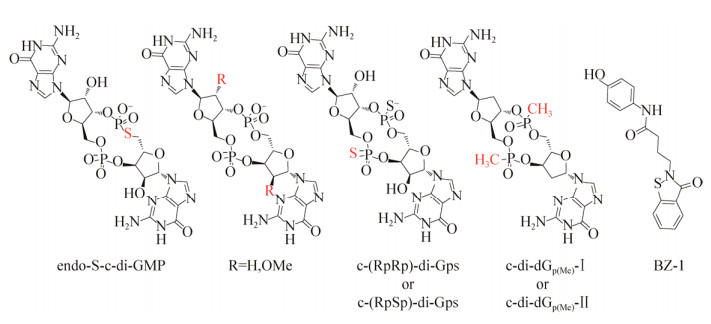
2013年,Strobel课题组[34]在研究环二鸟苷酸衍生物对磷酸二酯酶EAL结构域蛋白的耐受性时发现,双取代的硫代磷酸酯衍生物c-(RPRP)-di-Gps/c-(RPSP)-di-Gps (图 6)能够抵抗磷酸二酯酶的水解作用,并且仍然可以结合c-di-GMP核糖开关。紧接着他们在此基础上,设计合成了电中性的2′-H的甲基磷酸酯类化合物c-di-dGp(Me)-Ⅰ/ c-di-dGp(Me)-Ⅱ(图 6),该衍生物同样能够抵抗磷酸二酯酶的水解作用和结合核糖开关的能力。
虽然Sintim课题组[28]和Strobel课题组[34]分别在2011年和2013年就已经成功合成并筛选出了能够竞争性抑制磷酸二酯酶活性的环状二鸟苷酸衍生物,但是他们并没有测试这些化合物对不同细菌种类c-di-GMP降解酶的抑制作用,以及对细菌表型的影响。直到2016年,Sintim课题组[35]利用分子对接实验高通量地从250 000种化合物中筛选得到了1个具有高度选择性的磷酸二酯酶抑制剂——苯并异噻唑啉酮衍生物(BZ-1,图 6)。
实验表明,该化合物仅对磷酸二酯酶蛋白RocR具有抑制作用,而对其他PDEs蛋白无影响。表型实验显示,该化合物对铜绿假单胞菌的涌动(Swarming)具有很强的抑制作用,对其泳动(Swimming)和生物被膜的形成并没有影响。同时,实验发现磷酸二酯酶蛋白RocR的抑制并不会影响铜绿假单胞菌c-di-GMP的整体水平。
这些发现暗示c-di-GMP代谢酶对c-di-GMP浓度的调控既有全局水平又有局部水平。同时,苯并异噻唑啉酮BZ-1也是第一个被发现的能够通过抑制磷酸二酯酶的活性进而影响细菌表型的小分子抑制剂。
3 c-di-GMP受体抑制剂的研究进展c-di-GMP结合下游的受体分子是其发挥信使功能的关键,迄今为止已经发现了c-di-GMP的4种受体分子:1) PilZ结构域蛋白;2) 具有Ⅰ位点的结构域蛋白;3) 转录因子;4) 核糖体开关GEMM。这些受体分子通过结合c-di-GMP并作用于相应的靶点而直接控制细菌某些生理活动。因此,相比于控制c-di-GMP的代谢,通过调控c-di-GMP与受体分子的相互作用将能够更精确更直接地控制细菌的生理活动。然而,由于c-di-GMP与受体分子之间的作用机制尚未完全清晰,因此,对c-di-GMP受体分子抑制剂的研究仍然处于探索阶段。迄今为止,研究人员仅仅对PilZ结构域蛋白和核糖体开关抑制剂做了相应的研究。本节将对这两种抑制剂的研究进展进行论述。
3.1 PilZ结构域蛋白抑制剂PilZ结构域蛋白是细菌内广泛存在的一类c-di-GMP受体,该结构域蛋白由于其保守的RXXXR20–30(D/N)X(S/A)XXG (X代表任意氨基酸)序列而得名[36],PilZ蛋白结合c-di-GMP后引起结构域构象的变化,并通过蛋白-蛋白相互作用发挥其生物学作用[37]。
铜绿假单胞菌P. aeruginosa中的Alg44蛋白是典型的PilZ结构域蛋白[38-39],2013年,Sintim课题组[10]在研究二鸟苷酸环化酶的抑制剂时发现,2′-F-c-di-GMP和2′-H-c-di-GMP (图 2和图 6)能够与c-di-GMP竞争性结合Alg44蛋白;其中2′-F-c-di-GMP (图 2)对Alg44蛋白的抑制作用是c-di-GMP的2倍,但是2′-F-c-di-GMP对WspR蛋白同样具有很强的抑制作用,缺乏选择性。这些研究表明c-di-GMP衍生物可以作为PiLZ结构域蛋白的潜在抑制剂。
3.2 核糖体开关抑制剂核糖体开关(Riboswitch)能够和c-di-GMP相结合从而调控基因的表达,其主要是根据细胞内c-di-GMP信号分子的浓度变化而调节目标蛋白的mRNA转录水平。2008年,Breaker课题组[40]发现了第一类c-di-GMP核糖体开关Vc2RNA,该核糖体开关结合c-di-GMP有利于下游基因的转录。2010年,他们又发现了第二类c-di-GMP核糖体开关CdA RNA,这类核糖体开关与c-di-GMP具有很好的亲和力,并且参与mRNA的自我剪切[41]。
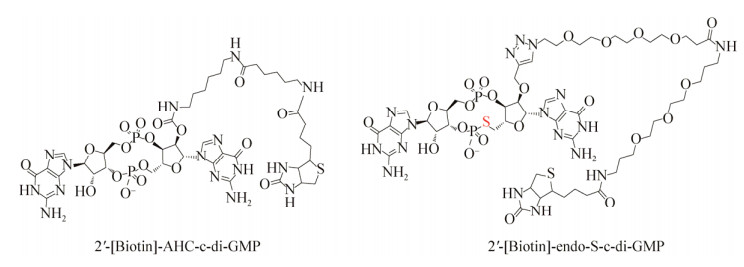
2011年,Strobel课题组[42]在研究c-di-GMP及其衍生物与两种核糖体开关的结合能力时发现,c-di-GMP的碱基、2′-OH和磷酸酯键是c-di-GMP结合核糖体开关的关键基团。其中,鸟嘌呤是c-di-GMP特异性识别Ⅰ类核糖体开关Vc2RNA所必需的。各种研究表明,c-di-GMP中2′-OH和磷酸酯键的改变虽然明显降低了c-di-GMP与Vc2 RNA、CdA RNA和WspR的结合能力,但是这种改变却提高了对两种核糖体开关的识别能力。例如,2′-OMe-c-di-GMP (图 6)能够特异性结合Ⅱ类核糖体开关[43],endo-S-c-di-GMP (图 6)能够特异性识别Ⅰ类核糖体开关[44],基于这一发现Strobel课题组通过对c-di-GMP的2′-OH和磷酸酯键进行修饰,筛选出了两种能够特异性结合Vc2 RNA (Ⅰ类核糖体开关)的小分子化合物2′-[biotin]-endo-S-c-di-GMP和2′-[biotin]-AHC-c-diGMP (图 7)[45],这些小分子化合物能够与c-di-GMP竞争性结合Ⅰ类核糖体开关,是潜在的核糖体开关抑制剂。
4 展望c-di-GMP是细菌所特有一类核酸类第二信使,对c-di-GMP信号通路的研究以及针对这一通路的小分子抑制剂的开发对于发展新一代抗菌药物具有重要的意义和价值。迄今为止,由于c-di-GMP代谢酶的缺失所引起细菌表型的变化已经被观察到,而对c-di-GMP受体分子的作用机制尚未完全清楚。因此,对于c-di-GMP信号分子抑制剂的研究仍将主要集中在c-di-GMP的代谢酶上;虽然目前为止已经报道了一批能够抑制c-di-GMP代谢酶的小分子化合物,但是这些小分子化合物在生物活性方面往往缺乏很好的选择性;同时在化学结构多样性方面仍有很大的发掘空间。因此,弄清楚c-di-GMP信号的作用机制,开发高效结构多样且具有高度选择性的小分子化合物将是发展c-di-GMP信号分子抑制剂的前进方向。同时,在更多的细菌中阐明这些小分子抑制剂的生物学功能也将是潜在的研究课题。伴随着生物学的发展,以及对c-di-GMP受体分子作用机制的进一步深入研究,将会为开发c-di-GMP受体抑制剂带来蓬勃的发展。
| [1] | Galperin MY, Nikolskaya AN, Koonin EV. Corrigendum to "novel domains of the prokaryotic two-component signal transduction systems". FEMS Microbiol Lett, 2001, 204(1): 213–214. |
| [2] | Galperin MY. Bacterial signal transduction network in a genomic perspective. Environ Microbiol, 2004, 6(6): 552–567. DOI: 10.1111/emi.2004.6.issue-6 |
| [3] | Tal R, Wong HC, Calhoon R, et al. Three cdg operons control cellular turnover of cyclic di-GMP in Acetobacter xylinum:genetic organization and occurrence of conserved domains in isoenzymes. J Bacteriol, 1998, 180(17): 4416–4425. |
| [4] | De N, Navarro MVAS, Raghavan RV, et al. Determinants for the activation and autoinhibition of the diguanylate cyclase response regulator WspR. J Mol Biol, 2009, 393(3): 619–633. DOI: 10.1016/j.jmb.2009.08.030 |
| [5] | Simm R, Morr M, Kader A, et al. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility. Mol Microbiol, 2004, 53(4): 1123–1134. DOI: 10.1111/j.1365-2958.2004.04206.x |
| [6] | Yang CY, Chin KH, Chuah LC, et al. The structure and inhibition of a GGDEF diguanylate cyclase complexed with (c-di-GMP)2 at the active site. Acta Crystallogr, 2011, 67(12): 997–1008. |
| [7] | Seshasayee ASN, Fraser GM, Luscombe NM. Comparative genomics of cyclic-di-GMP signalling in bacteria:post-translational regulation and catalytic activity. Nucleic Acids Res, 2010, 38(18): 5970–5981. DOI: 10.1093/nar/gkq382 |
| [8] | Christen B, Christen M, Paul R, et al. Allosteric control of cyclic di-GMP signaling. J Biol Chem, 2006, 281(42): 32015–32024. DOI: 10.1074/jbc.M603589200 |
| [9] | Ching SM, Tan WJ, Chua KL, et al. Synthesis of cyclic di-nucleotidic acids as potential inhibitors targeting diguanylate cyclase. Bioorg Med Chem, 2010, 18(18): 6657–6665. DOI: 10.1016/j.bmc.2010.07.068 |
| [10] | Zhou J, Watt S, Wang JX, et al. Potent suppression of c-di-GMP synthesis via I-site allosteric inhibition of diguanylate cyclases with 2'-F-c-di-GMP. Bioorg Med Chem, 2013, 21(14): 4396–4404. DOI: 10.1016/j.bmc.2013.04.050 |
| [11] | Varma RS. Synthesis of oligonucleotide analogues with modified backbones. ChemInform, 1994, 25(5). DOI: 10.1002/chin.199405298 |
| [12] | Rozners E. Carbohydrate chemistry for RNA interference:synthesis and properties of RNA analogues modified in sugar-phosphate backbone. Curr Org Chem, 2006, 10(6): 675–692. DOI: 10.2174/138527206776359720 |
| [13] | Fernicola S, Torquati I, Paiardini A, et al. Synthesis of triazole-linked analogues of c-di-GMP and their interactions with diguanylate cyclase. J Med Chem, 2015, 58(20): 8269–8284. DOI: 10.1021/acs.jmedchem.5b01184 |
| [14] | Ohana P, Delmer DP, Carlson RW, et al. Identification of a novel triterpenoid saponin from Pisum sativum as a specific inhibitor of the diguanylate cyclase of Acetobacter xylinum. Plant Cell Physiol, 1998, 39(2): 144–152. DOI: 10.1093/oxfordjournals.pcp.a029351 |
| [15] | Ohana P, Delmer DP, Volman G, et al. Glycosylated triterpenoid saponin:a specific inhibitor of diguanylate cyclase from Acetobacter xylinum. Biological activity and distribution. Plant Cell Physiol, 1998, 39(2): 153–159. DOI: 10.1093/oxfordjournals.pcp.a029352 |
| [16] | Sambanthamoorthy K, Luo CY, Pattabiraman N, et al. Identification of small molecules inhibiting diguanylate cyclases to control bacterial biofilm development. Biofouling, 2014, 30(1): 17–28. DOI: 10.1080/08927014.2013.832224 |
| [17] | Fernicola S, Paiardini A, Giardina G, et al. In silico discovery and in vitro validation of catechol-containing sulfonohydrazide compounds as potent inhibitors of the diguanylate cyclase PleD. J Bacteriol, 2016, 198(1): 147–156. DOI: 10.1128/JB.00742-15 |
| [18] | Wassmann P, Chan C, Paul R, et al. Structure of BeF3--modified response regulator PleD:implications for diguanylate cyclase activation, catalysis, and feedback inhibition. Structure, 2007, 15(8): 915–927. DOI: 10.1016/j.str.2007.06.016 |
| [19] | Zähringer F, Lacanna E, Jenal U, et al. Structure and signaling mechanism of a zinc-sensory diguanylate cyclase. Structure, 2013, 21(7): 1149–1157. DOI: 10.1016/j.str.2013.04.026 |
| [20] | Sambanthamoorthy K, Sloup RE, Parashar V, et al. Identification of small molecules That antagonize diguanylate cyclase enzymes to inhibit biofilm formation. Antimicrob Agents Chemother, 2012, 56(10): 5202–5211. DOI: 10.1128/AAC.01396-12 |
| [21] | Srivastava D, Harris RC, Waters CM. Integration of cyclic di-GMP and quorum sensing in the control of vpsT and aphA in Vibrio cholerae. J Bacteriol, 2011, 193(22): 6331–6341. DOI: 10.1128/JB.05167-11 |
| [22] | Lieberman OJ, Orr MW, Wang Y, et al. High-throughput screening using the differential radial capillary action of ligand assay identifies ebselen as an inhibitor of diguanylate cyclases. ACS Chem Biol, 2014, 9(1): 183–192. DOI: 10.1021/cb400485k |
| [23] | Roelofs KG, Wang JX, Sintim HO, et al. Differential radial capillary action of ligand assay for high-throughput detection of protein-metabolite interactions. Proc Natl Acad Sci USA, 2011, 108(37): 15528–15533. DOI: 10.1073/pnas.1018949108 |
| [24] | Donaldson GP, Roelofs KG, Luo YL, et al. A rapid assay for affinity and kinetics of molecular interactions with nucleic acids. Nucleic Acids Res, 2012, 40(7): e48. DOI: 10.1093/nar/gkr1299 |
| [25] | Ryan RP, McCarthy Y, Andrade M, et al. Cell-cell signal-dependent dynamic interactions between HD-GYP and GGDEF domain proteins mediate virulence in Xanthomonas campestris. Proc Natl Acad Sci USA, 2010, 107(13): 5989–5994. DOI: 10.1073/pnas.0912839107 |
| [26] | Ryan RP, Fouhy Y, Lucey JF, et al. Cell-cell signaling in Xanthomonas campestris involves an HD-GYP domain protein that functions in cyclic di-GMP turnover. Proc Natl Acad Sci USA, 2006, 103(17): 6712–6717. DOI: 10.1073/pnas.0600345103 |
| [27] | Schmidt AJ, Ryjenkov DA, Gomelsky M. The ubiquitous protein domain EAL is a cyclic diguanylate-specific phosphodiesterase:enzymatically active and inactive EAL domains. J Bacteriol, 2005, 187(14): 4774–4781. DOI: 10.1128/JB.187.14.4774-4781.2005 |
| [28] | Wang JX, Zhou J, Donaldson GP, et al. Conservative change to the phosphate moiety of cyclic diguanylic monophosphate remarkably affects its polymorphism and ability to bind DGC, PDE, and PilZ proteins. J Am Chem Soc, 2011, 133(24): 9320–9330. DOI: 10.1021/ja1112029 |
| [29] | Alm RA, Bodero AJ, Free PD, et al. Identification of a novel gene, pilZ, essential for type 4 fimbrial biogenesis in Pseudomonas aeruginosa. J Bacteriol, 1996, 178(1): 46–53. DOI: 10.1128/jb.178.1.46-53.1996 |
| [30] | Ko J, Ryu KS, Kim H, et al. Structure of PP4397 reveals the molecular basis for different c-di-GMP binding modes by Pilz domain proteins. J Mol Biol, 2010, 398(1): 97–110. DOI: 10.1016/j.jmb.2010.03.007 |
| [31] | Galperin MY, Nikolskaya AN, Koonin EV. Novel domains of the prokaryotic two-component signal transduction systems. FEMS Microbiol Lett, 2001, 203(1): 11–21. DOI: 10.1111/fml.2001.203.issue-1 |
| [32] | Navarro MVAS, De N, Bae N, et al. Structural analysis of the GGDEF-EAL domain-containing c-di-GMP receptor FimX. Structure, 2009, 17(8): 1104–1116. DOI: 10.1016/j.str.2009.06.010 |
| [33] | Tchigvintsev A, Xu XH, Singer A, et al. Structural insight into the mechanism of c-di-GMP hydrolysis by EAL domain phosphodiesterases. J Mol Biol, 2010, 402(3): 524–538. DOI: 10.1016/j.jmb.2010.07.050 |
| [34] | Shanahan CA, Gaffney BL, Jones RA, et al. Identification of c-di-GMP derivatives resistant to an EAL domain phosphodiesterase. Biochemistry, 2013, 52(2): 365–377. DOI: 10.1021/bi301510v |
| [35] | Zheng Y, Tsuji G, Opoku-Temeng C, et al. Inhibition of P. aeruginosa c-di-GMP phosphodiesterase RocR and swarming motility by a benzoisothiazolinone derivative. Chem Sci, 2016, 7(9): 6238–6244. DOI: 10.1039/C6SC02103D |
| [36] | Ryjenkov DA, Simm R, Römling U, et al. The PilZ domain is a receptor for the second messenger c-di-GMP:the PilZ domain protein YcgR controls motility in enterobacteria. J Biol Chem, 2006, 281(41): 30310–30314. DOI: 10.1074/jbc.C600179200 |
| [37] | Amikam D, Galperin MY. PilZ domain is part of the bacterial c-di-GMP binding protein. Bioinformatics, 2006, 22(1): 3–6. DOI: 10.1093/bioinformatics/bti739 |
| [38] | Merighi M, Lee VT, Hyodo M, et al. The second messenger bis-(3'-5')-cyclic-GMP and its PilZ domain-containing receptor Alg44 are required for alginate biosynthesis in Pseudomonas aeruginosa. Mol Microbiol, 2007, 65(4): 876–895. DOI: 10.1111/mmi.2007.65.issue-4 |
| [39] | Remminghorst U, Rehm BH. Alg44, a unique protein required for alginate biosynthesis in Pseudomonas aeruginosa. FEBS Lett, 2006, 580(16): 3883–3888. DOI: 10.1016/j.febslet.2006.05.077 |
| [40] | Sudarsan N, Lee ER, Weinberg Z, et al. Riboswitches in eubacteria sense the second messenger cyclic di-GMP. Science, 2008, 321(5887): 411–413. DOI: 10.1126/science.1159519 |
| [41] | Lee ER, Baker JL, Weinberg Z, et al. An allosteric self-splicing ribozyme triggered by a bacterial second messenger. Science, 2010, 329(5993): 845–848. DOI: 10.1126/science.1190713 |
| [42] | Furukawa K, Gu HZ, Sudarsan N, et al. Identification of ligand analogues that control c-di-GMP riboswitches. ACS Chem Biol, 2012, 7(8): 1436–1443. DOI: 10.1021/cb300138n |
| [43] | Smith KD, Shanahan CA, Moore EL, et al. Structural basis of differential ligand recognition by two classes of bis-(3'-5')-cyclic dimeric guanosine monophosphate-binding riboswitches. Proc Natl Acad Sci USA, 2011, 108(19): 7757–7762. DOI: 10.1073/pnas.1018857108 |
| [44] | Zhou J, Sayre DA, Wang JX, et al. Endo-S-c-di-GMP analogues-polymorphism and binding studies with class Ⅰ riboswitch. Molecules, 2012, 17(11): 13376–13389. |
| [45] | Luo YL, Zhou J, Watt SK, et al. Differential binding of 2'-biotinylated analogs of c-di-GMP with c-di-GMP riboswitches and binding proteins. Mol Biosyst, 2012, 8(3): 772–778. DOI: 10.1039/C2MB05338A |
 2017, Vol. 33
2017, Vol. 33