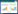中国科学院微生物研究所、中国微生物学会主办
文章信息
- 程寿廷, 王芳芳, 钱韦
- Shouting Cheng, Fangfang Wang, Wei Qian
- 鉴定cyclic di-GMP效应蛋白:高通量筛选策略与实验验证方法
- Identification of cyclic di-GMP protein receptors: high-throughput screening strategies and experimental verification
- 生物工程学报, 2017, 33(9): 1376-1389
- Chinese Journal of Biotechnology, 2017, 33(9): 1376-1389
- 10.13345/j.cjb.170175
-
文章历史
- Received: April 28, 2017
- Accepted: June 12, 2017
2 中国科学院遗传与发育生物学研究所 植物基因组学国家重点实验室,北京 100101
2 State Key Laboratory of Plant Genomics, Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China
细菌环二鸟苷单磷酸(c-di-GMP)的研究始于1987年,Benziman研究组在分析木驹形杆菌Komagataeibacter xylinus (当时称木醋酸杆菌Acetobacter xylinum,后来称木葡糖酸醋杆菌Gluconacetobacter xylinus)纤维素的产生机制时,发现c-di-GMP作为一种别构剂,增强纤维素合成酶的活性[1-3]。这一发现的重要意义被忽视了近10年,直到后续研究表明c-di-GMP是一个广泛分布于各类细菌中、具有重要调控功能的新型第二信使。c-di-GMP参与调控细菌生物被膜的形成与消解、运动性、胞外多糖的产生、致病力、细胞形态、细胞周期及细胞分化等许多重要生理过程[3-4]。近10余年来,c-di-GMP调控功能的研究是细菌信号转导领域的前沿。除c-di-GMP以外,核苷类第二信号分子还包括环二腺苷单磷酸(c-di-AMP)、环鸟苷腺苷单磷酸(c-GAMP)、(五)四磷酸鸟苷[(p)ppGpp]以及研究历史最悠久的环腺苷单磷酸(cAMP)及环鸟苷单磷酸(cGMP)等,其中c-di-GMP是研究最为深入的第二信使分子之一[2]。
2 c-di-GMP的代谢细菌胞内c-di-GMP的浓度会随着胞内或外界环境信号的刺激而改变,胞内c-di-GMP的浓度变化由其合成酶——二鸟苷酸环化酶(Diguanylate cyclases,DGCs)与降解酶——c-di-GMP特异性的磷酸二酯酶(Phosphodiesterases,PDEs)共同调节。其中,具有GGDEF结构域的DGCs能够催化将2分子的GTP合成1分子c-di-GMP[5];具有EAL或HD-GYP结构域的PDEs催化c-di-GMP降解为线性的5′-pGpG,随后再降解为2分子GMP[6-7]。EAL结构蛋白与HD-GYP结构域蛋白酶活性有所不同,前者具有较低的5′-pGpG降解活性,而后者则可以高效地降解5′-pGpG。研究表明EAL结构域广泛分布于多种细菌细胞中,而且往往与GGDEF结构域串联存在于同一个蛋白中。而HD-GYP结构域在细菌中一般分布不多,有些细菌根本不编码HD-GYP结构域蛋白[3]。由于EAL结构域蛋白具有较低的5′-pGpG降解活性,推测在不编码HD-GYP结构域蛋白的细菌细胞内,可能存在催化5′-pGpG降解的其他酶。最近研究表明,寡聚核糖核酸酶(Oligoribonuclease,Orn)可以高效地催化5′-pGpG降解为2分子的GMP[8-9]。这一发现解释了在不含HD-GYP结构域蛋白的细菌中5′-pGpG降解的问题。因此,Orn间接参与胞内c-di-GMP水平的控制。
3 c-di-GMP调控细菌生物被膜形成的分子机制c-di-GMP通过结合效应子(包括RNA类的核糖开关和效应蛋白)来发挥功能。本文主要综述效应蛋白的筛选鉴定方法与研究进展。
鉴于c-di-GMP分子自身构象的多样性,其结合的效应蛋白类型也是多种多样的。c-di-GMP通过别构效应调控效应蛋白的信号输出功能,包括酶活性(如MshE、CckA)[10-11],DNA结合活性(如FleQ、CLP、MrkH)[12-14],蛋白质多聚化状态(如VpsT)[15-16],蛋白质-蛋白质相互作用(PgaC/D、FimX、YajQ)[17-19]。不同类型的效应蛋白通过多种不同的信号输出方式来发挥不同的调控功能。以下简要介绍c-di-GMP通过效应蛋白介导的生物被膜(Biofilm)形成的调控机制。
生物被膜是细菌附着在生物或非生物表面的一种聚集的生活形式,与细菌的群体感应(Quorum-sensing)、营养摄取、抗逆能力等密切相关[20]。生物被膜的形成与消解是一个复杂的过程,与细菌的运动性、胞外基质的产生等密切相关。c-di-GMP可以结合多种不同类型的效应蛋白,进而通过不同的机制调控细菌的生物被膜的形成与消解过程。例如,LapD是荧光假单胞菌Pseudomonas fluorescens Pf0-1中1个包含退化EAL结构域的c-di-GMP效应蛋白,调控Pf0-1生物被膜的形成。Newell等发现在高浓度的c-di-GMP条件下,效应蛋白LapD结合并抑制周质蛋白酶LapG的活性,阻止LapG对黏附蛋白LapA N端的切割,进而促进了Pf0-1生物被膜的产生[20]。
霍乱弧菌Vibrio cholerae的浮游状态与生物被膜形成之间的转换受到c-di-GMP调控,其中c-di-GMP效应蛋白VpsT在这一转换过程中发挥关键作用。c-di-GMP结合VpsT后,导致该转录因子多聚化,与启动子区域结合进而调控vps基因簇的转录。Vps基因簇通过调控V. cholerae胞外基质的产生,来调控其生物被膜的发育[15-16]。除VpsT外,V. cholerae生物被膜的形成还与甘露糖敏感的血球凝聚素(MshA)纤毛相关。Roelofs等发现c-di-GMP可以直接结合ATP酶MshE,提示了c-di-GMP可能通过MshE来影响MshA的合成,进而影响了V. cholerae的运动性,最终调控其生物被膜的发育[10]。研究者从遗传和生化角度阐明了c-di-GMP调控细菌生物被膜发育的新机制。
胞外多糖(Exopolysaccharide,EPS)是细菌生物被膜形成所需胞外基质的主要成分之一。大肠杆菌Escherichia coli中pgaABCD操纵子与EPS的合成与分泌相关,其中PgaC和PgaD参与多聚葡糖胺的合成[21]。Steiner等发现c-di-GMP可以直接结合效应蛋白PgaC和PgaD,维持PgaCD蛋白复合体的稳定性[17]。高浓度c-di-GMP通过稳定PgaCD复合体的方式防止了PgaD的降解,同时激活PgaCD蛋白复合体糖基转移酶活性,促进了E. coli生物被膜的形成。
4 c-di-GMP效应蛋白鉴定策略经过多年的研究,已经发现c-di-GMP效应子主要包括效应蛋白以及RNA类的核糖开关(Riboswitch)。效应蛋白又可以分为PilZ结构域蛋白,退化的GGDEF或EAL结构域蛋白以及转录因子等。近年来陆续鉴定了多个具有c-di-GMP结合活性的ATP酶类效应蛋白,如FleQ、MshE以及CckA[10-12],表明ATP酶类蛋白是一类新的c-di-GMP效应蛋白。
新型效应蛋白的筛选鉴定一直是c-di-GMP研究中的重点和难点。虽然PilZ结构域蛋白和退化的GGDEF或EAL效应蛋白可以通过基于氨基酸序列的生物信息学方法进行预测。但这一方法对不具有氨基酸序列保守性的效应蛋白并不适用。到目前为止,c-di-GMP效应蛋白的鉴定筛选主要有以下4种策略。
4.1 遗传筛选c-di-GMP效应蛋白感应胞内c-di-GMP浓度并调控相关表型。基于这一特性,研究者设计了遗传学方法筛选c-di-GMP效应蛋白。通常采用过表达DGCs或缺失PDEs的方法,创建具有高浓度胞内c-di-GMP且具有明显表型的起始菌株。然后利用规模化突变方法得到突变表型恢复的突变菌株。对表型恢复菌株的突变基因进行测序鉴定即可得到编码效应蛋白的候选基因,通过对候选基因的进一步验证即有可能鉴定到新型c-di-GMP效应蛋白(图 1A)。如伯克霍尔德氏菌Burkholderia cenocepacia中Bcam1349即是通过遗传筛选的方式鉴定得到[22]。

|
| 图 1 c-di-GMP效应蛋白筛选策略.图中红色圆点代表c-di-GMP分子,蓝色、橘色、黄色、褐色、紫色圆点分别代表GTP、GMP、pGpG、cGMP、c-di-AMP等其他类型核苷衍生物.绿色椭圆代表候选的c-di-GMP效应蛋白,灰色、黄色、浅黄色椭圆代表其他蛋白. (A)遗传筛选.获得具有胞内高c-di-GMP浓度,且具有c-di-GMP相关表型的菌株;规模突变后获得表型回复菌株;测序鉴定候选基因并通过实验方法验证其编码蛋白与c-di-GMP的互作. (B)亲和色谱结合LC/MS/MS鉴定.细胞裂解液与biotin-c-di-GMP及链亲合素磁珠共孵育,分步洗涤后进行洗脱,LC/MS/MS鉴定.对照组中加入过量c-di-GMP用于特异性竞争. (C) DRaCALA筛选.首先构建蛋白异源表达的文库,DRaCALA结合实验得到与c-di-GMP结合的候选蛋白.利用竞争性实验确定蛋白与c-di-GMP结合的特异性. (D) 分子对接筛选.根据已有c-di-GMP与效应蛋白结合的结构信息确定c-di-GMP构象,从蛋白数据库选取已有结构信息的蛋白进行分子对接分析.对得到的候选蛋白进行互作检测,并对该蛋白编码基因的功能进行验证. Figure 1 Screening and verification of c-di-GMP effectors. Red dots represents c-di-GMP; blue, orange, yellow, brown and purple dots represent GTP, GMP, pGpG, cGMP and c-di-AMP respectively. Green ellipse represents candidate c-di-GMP effector; gray, yellow and light yellow represent other proteins. (A) Genetic screening. Elevated cellular c-di-GMP concentration mutant was obtained by overexpression a DGC, the candidate genes were screened by transposon mutagenesis and phenotypic test. Candidate genes were sequenced and the coding protein interaction with c-di-GMP was experimental proved in vitro. (B) Pull-down combined LC/MS/MS. Cell lysates, biotin-c-di-GMP and streptavid in beads were incubated at the absence or presence of c-di-GMP, after several times washing, the eluted proteins were analyzed by LC-MS/MS. (C) DRaCALA screening. Proteins expression strains were constructed and used for DRaCALA assay, the candidate effectors were confirmed by nucleotides competition assays. (D) Molecular docking. c-di-GMP conformation information was obtained from previously studied and proteins structure information were obtained for PDB data bank, molecular docking was performed, the candidate protein receptors were confirmed by in vitro interaction assay and genetic functions of the coding genes were analyzed. |
| |
遗传筛选这一策略不依赖效应蛋白的氨基酸序列特征,因此很有可能筛选到除了PilZ结构域蛋白和退化的GGDEF或EAL结构域蛋白之外的新型效应蛋白。但这一策略存在一定的局限性:1) 筛选过程依赖于具有明显表型的起始菌株,在某些细菌中这一起始菌株并不一定可以得到。2) 对于那些c-di-GMP抑制效应蛋白的功能所产生的表型,突变效应蛋白编码基因的策略不可能得到表型恢复菌株,也就无法进行效应蛋白的鉴定。3) 有可能筛选得到抑制和调控上述突变表型,但不直接参与c-di-GMP结合的蛋白。
4.2 亲合色谱结合LC/MS/MS鉴定随着新型亲和色谱磁珠[19, 23]的出现和带亲和标签c-di-GMP衍生物的合成[24],利用亲和色谱结合蛋白质谱鉴定c-di-GMP效应蛋白变得更为便捷。早期研究利用固定有GTP的亲和磁珠来捕获c-di-GMP效应蛋白。如Christen等利用这一方法鉴定到新月柄杆菌Caulobacter crescentus中DgrA是一个新的c-di-GMP效应蛋白[23]。生物素标记的c-di-GMP (Biotin-c-di-GMP)含有biotin基团和c-di-GMP基团,两个功能基团通过柔性的AHC链连接起来,分别结合链亲合素磁珠(Biotin基团)与c-di-GMP效应蛋白(c-di-GMP基团) (图 1B)。An等利用固定链亲合素的磁珠和带生物素标签的c-di-GMP,鉴定到野油菜黄单胞菌Xanthomonas campestris中一个新型的c-di-GMP效应蛋白YajQ[19]。
近年来发展的c-di-GMP捕获复合体(c-di-GMP capture complex,c-di-GMP-CC)[24]通过紫外交联的方式将捕获到的c-di-GMP结合蛋白固定下来,因此可以特异性地捕获具有c-di-GMP结合活性的膜蛋白。Sprecher等利用c-di-GMP-CC鉴定到新月柄杆菌中HfsK是一个定位于细胞膜上的新型c-di-GMP效应蛋白。c-di-GMP结合HfsK后,影响该蛋白与未知膜组分(Membrane component X)的相互作用并控制HfsK的亚细胞定位,最终调控了C. crescentus在固体表面基质的黏着特性[25]。
相较于遗传筛选策略,亲和色谱是一种垂钓式的分析策略,它不依赖于c-di-GMP效应蛋白的调控机制,而是取决于其与c-di-GMP的相互作用力。研究表明这一方法更容易得到与c-di-GMP具有强亲和力的效应蛋白[19, 23-25],而应用于筛选与c-di-GMP具有弱亲和力或者在胞内表达丰度较低的效应蛋白时则有一定的局限性。
4.3 DRaCALA系统筛选差异性配体毛细辐射实验(Differential radial capillary action of ligand assay,DRaCALA)是基于c-di-GMP与效应蛋白互作原理的另一种系统化鉴定方法[26]。利用蛋白质可以被硝酸纤维素膜(Nitrocellulose membrane,NC膜)吸附固定,而小分子配体可以在NC膜上自由扩散,将放射性小分子与蛋白质共同孵育后点到硝化纤维膜上,结合在蛋白质上的小分子会随蛋白固定在NC膜上,形成“内圈”;而游离的小分子则在NC膜上自由向外周扩散,形成“外圈” (图 1C)。DRaCALA操作简单快捷,适用于规模化筛选。Roelofs等利用Gateway方法构建了V. cholerae中3 812个蛋白的表达文库,其中384蛋白可以在大肠杆菌中异源表达。将蛋白表达菌株的裂解液与放射性的[α32P]c-di-GMP共孵育,利用复制器将样品批量点在硝化纤维素膜上,通过检测放射性信号来筛选c-di-GMP结合蛋白。最终鉴定到ATP酶MshE是一个新型的c-di-GMP效应蛋白[10]。
DRaCALA在一定程度上克服了亲和色谱实验中低亲和力效应蛋白或低丰度效应蛋白很难被鉴定到的困扰,但它需要单独表达大量蛋白。由于有些蛋白无法异源表达,该策略同样有一定的局限性。
4.4 基于分子对接预测的筛选方法一般而言,基于氨基酸序列特征的生物信息学方法无法预测除了PilZ结构域蛋白和退化的GGDEF或EAL结构域蛋白之外的c-di-GMP效应蛋白。但是,基于蛋白质三维结构的分子对接是鉴定新型c-di-GMP效应蛋白的可行方法。该方法基于已知的蛋白结构信息和已知的c-di-GMP构象信息,通过反向分子对接的策略筛选与c-di-GMP互作的候选蛋白,经过后续的互作验证及功能分析,即可确定新型的c-di-GMP效应蛋白(图 1D)。例如,Li等利用已知蛋白结构数据库,通过分子对接的生物信息学筛选,鉴定到人源蛋白LCN2是c-di-GMP的效应蛋白[27]。LCN2是继STING和DDX41之后的又一例人源c-di-GMP效应蛋白[28-29]。这一研究为鉴定c-di-GMP效应蛋白的筛选提供了新的思路。
这一筛选策略使研究者的目光不再囿于所研究的细菌自身,还可以关注与细菌存在“跨界”交流的宿主物种中是否存在感应c-di-GMP的效应蛋白。当然,基于分子对接的鉴定策略局限性在于:1) 依赖于蛋白质的结构信息,没有结构数据的蛋白则无法纳入筛选范围。2) 用于分子对接筛选的c-di-GMP自身构象并不容易确定。
综上所述,不同的c-di-GMP效应蛋白的鉴定策略各有其优点,同时也存在一定的固有局限性。对于新型c-di-GMP效应蛋白的鉴定,一方面可以依赖于不同策略之间的联合应用;另一方面,在深入理解c-di-GMP调控机制的基础上,设计出新的筛选策略。
5 c-di-GMP与效应蛋白互作的验证方法经过上述筛选方法获得候选蛋白以后,c-di-GMP与效应蛋白在体外是否存在直接互作是效应蛋白鉴定过程中的关键实验证据。在c-di-GMP效应蛋白的鉴定研究过程中,两者互作的检测方法也得到了长足发展,已有多种生物化学或生物物理学实验技术可以用来检测c-di-GMP与效应蛋白的相互作用。在研究过程中发现,由于效应蛋白生化性质的多样性,有些效应蛋白与c-di-GMP互作的验证局限于某种特定的技术方法[30]。全面掌握c-di-GMP与效应蛋白相互作用的检测方法是十分必要的。
5.1 等温滴定微量热仪检测(Isothermal titration calorimetry, ITC)等温滴定微量热(ITC)是检测分子间互作的经典方法,通过检测滴定过程体系的热量变化来确定分子间的相互作用,得到解离常数(Kd)、反应计量数(n)、焓(△H)和熵(ΔS)等完整的热力学参数。ITC实验中样品无需标记和修饰处理,此外,对于样品的分子大小、结构以及缓冲体系的成分也没有限制。一般而言,由ITC法检测得到的效应蛋白与c-di-GMP的亲合力范围在纳摩尔(nmol/L)到毫摩尔(mmol/L)之间,能够涵盖绝大多数c-di-GMP与效应蛋白的亲和力范围,已成为检测c-di-GMP与效应蛋白互作的常用方法之一[13, 27-28, 31-32]。然而,有些效应蛋白与c-di-GMP互作的检测上,如FliI与c-di-GMP的互作验证,ITC实验并不适用[30],推测可能是由于两者互作的热量变化不明显。此外,在ITC检测过程中,需要获得大量的纯化蛋白,这是限制该方法应用的主要因素之一。
5.2 表面等离子共振(Surface plasmon resonance, SPR)表面等离子共振(SPR)是一种光学现象,通过检测共振角度的动态变化即可确定流动相与固定相中的分子是否存在互作,可以得到配体分子与样品结合的亲和力、动力学、选择性、浓度以及热力学等一系列信息。SPR检测分子间互作的亲和力范围在纳摩尔(nmol/L)和亚毫摩尔(sub mmol/L)之间,广泛应用于蛋白质、核酸、多肽、小分子化合物等生物分子的相互作用,同样可用于c-di-GMP与效应蛋白的互作分析。如铜绿假单胞菌Pseudomonas aeruginosa中的PelD与c-di-GMP互作的证明[33]。SPR实验具有实时、非标记、动态分析分子间互作等优势。但会受限于缓冲体系的选择、流动相分子与芯片基质的非特异性互作等。此外,SPR使用芯片的成本较高,不适用于规模化的鉴定。
5.3 微量热泳动(Microscale thermophoresis, MST)微量热泳动(MST)是近几年发展的检测生物分子相互作用的新技术[34]。其原理是分子在温度梯度的溶液环境下迁移速率会发生显著的改变,对该变化过程进行监控即可确定分子间相互作用,测定分子间的亲和力、化学计量数等指标。MST对互作分子间的亲和力检测范围在皮摩尔(pmol/L)到毫摩尔(mmol/L)之间。对待测蛋白分子进行荧光标记后,即可用于MST实验。Rotem等利用MST技术检测了蛭弧菌Bdellovibrio bacteriovorus中PilZ结构域的蛋白Bd2717、Bd2402、Bd2924与c-di-GMP的相互作用[35]。MST具有灵敏性高、实验样品消耗少、可用溶质多样化、实验准备快速操作简单等优点。此外,MST可用于检测包被在脂质双分子层中的全长膜蛋白与c-di-GMP相互作用关系,这是其他方法很难达到的重要优势,预计该方法在未来鉴定与c-di-GMP互作的膜蛋白时将得到广泛应用。
5.4 生物膜干涉技术(Biolayer interferometry, BLI)生物膜干涉技术(BLI)是基于光干涉现象的非标记生物分子互作检测技术[36]。其基本原理是特定频率的反射光能够与入射光产生相长干涉和相消干涉,从而形成具有一定特征的干涉光谱。因此,当生物分子结合到传感器表面时,会导致传感器表面厚度发生变化,进而引起干涉光谱位移。光谱仪通过检测干涉光谱的位移即可实时地监控分子间的结合过程。BLI能够检测分子之间的亲和力(KD)、结合速率(Ka)、解离速率(Kd)等多种数据,具有实时、非标记以及高通量等诸多优点[37]。该技术已广泛应用于药物筛选、蛋白结构靶点分析、天然产物分析及信号转导等多个研究领域。鉴于BLI在生物分子互作检测中的强大功能,可以预见其能够在c-di-GMP与效应蛋白的互作检测中发挥重要作用。
5.5 核磁共振(Nuclear magnetic resonance, NMR)核磁共振(NMR)是指原子在强磁场作用下会产生的电子自旋的改变,是广泛应用的解析分子结构的实验手段。分子间的互作会对原子周边的化学环境产生影响,在核磁共振实验中表现为局部的核磁共振谱的迁移。这一特性可用于分子间相互作用的检测。Jenal研究组利用NMR方法鉴定了DgrA、CckA等效应蛋白与c-di-GMP的相互作用,并解析了关键的互作位点[6, 11]。NMR实验需要准备同位素(15N, 13C, 1H)标记的蛋白,此外,数据的收集和分析都需要较长的时间。
5.6 基于放射性同位素的互作检测方法随着DGC研究的深入,已开发出包括PleD、Slr1143、WspR、YdeH以及tDGC在内的多个高催化效率和转化效率的DGCs用于c-di-GMP的体外合成[6, 26, 38-40]。利用放射性标记的[32P]-GTP合成[32P]-c-di-GMP,可以用于c-di-GMP与效应蛋白的互作检测[6, 11, 25]。基于放射性标记的c-di-GMP与效应蛋白的检测方法主要有以下3种。
5.6.1 紫外交联(UV-crosslinking)紫外交联实验是利用核苷类分子与蛋白在紫外光处理下发生共价交联、形成稳定的复合物这一特性来进行二者间互作的检测。放射性标记的c-di-GMP与待测蛋白进行紫外交联处理后,经电泳分离,通过放射自显影分析蛋白条带所带有的放射性信号,即可分析二者是否存在互作[11, 22, 26]。
5.6.2 DraCALA实验DRaCALA可以用于c-di-GMP效应蛋白的高通量筛选(详见4.3),也可以用于c-di-GMP与效应蛋白的互作分析,如GIL、HsbD等效应蛋白与c-di-GMP相互作用的证明[41-42]。
5.6.3 c-di-GMP-蛋白共纯化实验此外,还可以通过检测结合在蛋白质上的放射性标记c-di-GMP的量来确定两者间的相互作用。将效应蛋白与放射性c-di-GMP共孵育,然后利用结合特定抗体的磁珠收集蛋白,经漂洗后,通过分析磁珠上结合的放射性同位素来判定c-di-GMP与蛋白的互作。对同位素信号的定量分析,既可利用液闪计数仪直接检测[22],也可以利用薄层层析分离c-di-GMP后通过放射自显影来检测[43]。
5.7 基于荧光标记c-di-GMP的互作检测方法近年来,具有荧光基团标签的c-di-GMP产品的开发(如2'-Fluo-AHC-c-diGMP, Biology,German)为研究提供了便利。基于荧光标记的c-di-GMP (F-c-di-GMP),有多种方法可用于c-di-GMP与效应蛋白的相互作用的检测。
荧光偏振(Fluorescence polarization,FP)是一种定量分析技术,其基本原理是溶液中的荧光物质经入射偏振光照射后,产生激发偏振荧光,偏振荧光的强弱程度与荧光分子的分子量大小呈正相关,蛋白与荧光分子的结合会导致激发的偏振荧光增强。Schumachera等利用F-c-di-GMP,通过FP实验检测了MrkH与c-di-GMP的相互作用[44]。
此外,在DRaCALA实验中,F-c-di-GMP可以替代放射性的c-di-GMP,避免了繁琐的合成与纯化过程[41]。F-c-di-GMP也可以用于MST实验中c-di-GMP与蛋白间互作的检测[45],该方法避免了荧光标记过程可能对蛋白活性产生的影响。
5.8 基于biotin-c-di-GMP的互作检测方法Biotin-c-di-GMP和c-di-GMP-CC除了可用于c-di-GMP效应蛋白的筛选鉴定(详见4.2),还可以用于c-di-GMP-效应蛋白互作的分析,其中c-di-GMP-CC可以检测c-di-GMP与膜蛋白的相互作用[17, 25, 28]。由于蛋白纯化上所受的限制,常规的互作验证方法对于膜蛋白并不适用。因此,基于c-di-GMP-CC的亲和色谱结合Western blotting实验是鉴定c-di-GMP与膜蛋白相互作用的有效方法。
此外,SPR实验中,biotin-c-di-GMP还可以作为固定相结合在链亲合素芯片(SA芯片)上,进行c-di-GMP与效应蛋白的互作分析[30]。BLI实验中也可以采用类似的策略,利用SA芯片和biotin-c-di-GMP来进行检测。参照Li等的实验方法[46],本实验室发展了基于biotin-c-di-GMP和链亲合素抗体的酶联免疫吸附实验(Enzyme linked immunosorbent assay, ELISA),检测c-di-GMP与效应蛋白的相互作用(数据未发表)。
5.9 基于蛋白构象变化的互作检测作为变构剂,c-di-GMP与效应蛋白结合通常会引起蛋白构象发生变化,基于这一特性,可以利用蛋白热迁移实验(Thermal shift assay,TSA)和蛋白酶部分水解实验(Limited proteolysis)来检测c-di-GMP与效应蛋白的互作。
5.9.1 蛋白热迁移实验(TSA)广泛应用于靶向蛋白受体的小分子药物筛选,也常见于蛋白结晶实验前期实验缓冲液的优化[47-48]。当蛋白质因自身不稳定或在热处理时发生构象变化时,疏水性残基大量暴露出来,可以被疏水性荧光染料标记,从而产生可检测的荧光信号。该技术可以提供分子间发生相互作用的间接证明,因此可以用于检测c-di-GMP与效应蛋白的互作[49-50]。该方法简便快捷,可以实现高通量的检测。
此外,近年来发展的非标记差式扫描荧光实验(Nano differential scanning fluorimetry, NanoDSF)的基本原理与Thermal shift实验类似,NanoDSF实验无需使用荧光染料标记蛋白,避免了染料对蛋白质活性的影响。
5.9.2 蛋白酶部分水解实验(Limited proteolysis)蛋白酶部分水解实验是常用的检测蛋白结构组成、折叠特性以及配体结合的生物化学方法[51-52]。c-di-GMP与效应蛋白的结合会造成蛋白构象的变化,进而引发蛋白酶酶切位点的暴露或者隐藏,经过适当条件的酶切处理,通过SDS-PAGE分离酶切产物,对比差异条带即可鉴定c-di-GMP与蛋白之间的互作。结合质谱分析还可以进一步确定发生变构的位置。例如FleQ与c-di-GMP互作研究中就采用了该方法[32]。
6 讨论与展望 6.1 新c-di-GMP效应蛋白筛选策略的设计c-di-GMP效应蛋白的筛选和鉴定是解析c-di-GMP调控机制的重要步骤,尽管已有多种策略用于新型c-di-GMP的效应蛋白的筛选,但现有的策略均存在其固有的局限性。除了不同筛选策略联合使用之外,新型筛选策略的设计是这一研究方向的另一突破口。
新型筛选策略的设计需依赖于扎实的研究基础,以及深入和缜密的研究分析。例如,新月柄杆菌中新型c-di-GMP效应蛋白CckA的鉴定过程可以在这一方面给我们带来启示[11]。
新月柄杆菌是研究原核生物细胞周期调控机制的模式细菌,其中c-di-GMP在细菌的命运决定过程中发挥重要作用。前期的研究表明组氨酸激酶(Histidine kinase,HK) DivK与DivL通过蛋白-蛋白互作的方式负调控HK CckA的磷酸化水平,进而影响与其配对的反应调节蛋白(Response regulator, RR) CtrA的磷酸化水平。此外,研究还表明c-di-GMP通过效应蛋白PopA控制CtrA的降解。
以cdG0 (删除了所有的DGC,完全不含有c-di-GMP的突变菌株)为出发菌株进行遗传筛选和表型分析。Lori等[11]发现c-di-GMP和DivK共同调控细菌的细胞周期,且两者存在功能冗余现象,即只有同时突变popA和divK才会导致细菌停滞在G1期。因而推测c-di-GMP在通过PopA调控CtrA的稳定性的同时,还通过未知途径调控CtrA的磷酸化状态。
考虑到HK CckA可以通过磷酸基团转移蛋白ChpT来调控CtrA的磷酸化状态。研究人员猜测c-di-GMP可能是通过调控CckA的磷酸化状态进而调控CtrA的磷酸化水平。体外紫外交联实验和磷酸化实验表明c-di-GMP可以直接结合CckA,抑制其激酶活性并激活其磷酸酶活性,最终调控了CtrA的磷酸化状态。值得注意的是,这一工作首次发现受体组氨酸激酶也是c-di-GMP效应蛋白之一。
6.2 真核生物中c-di-GMP效应蛋白的鉴定作为细菌第二信使,c-di-GMP主要在原核生物细菌中发挥调控功能,但近年来的研究发现,c-di-GMP可以通过多种方式在真核生物中发挥调控作用。例如在盘基网柄菌Dictyostelium discoideum中,c-di-GMP能够调控柄状细胞的分化过程[53]。c-di-GMP还可以通过结合真核生物中不同类型的效应蛋白来发挥功能,如STING、CDX41以及LCN2等[27-29]。
在病原细菌与真核生物宿主的侵染与防御的较量过程中,识别对方致病或免疫过程中必需的组分是长期进化的必然结果。c-di-GMP作为细菌中最为重要的第二信使,在病原菌与真核宿主互作过程中发挥作用并不在人们的意料之外。如人源的STING蛋白可以识别细菌中c-di-GMP,进而激活Ⅰ型干扰素的合成,启动自身的免疫反应[28, 50]。与之相对,细菌同样可以利用c-di-GMP来达到抑制宿主免疫反应的目的。如细菌利用c-di-GMP靶向结合亚铁血红素结合蛋白LCN2,进而抑制宿主的免疫应答[27]。
因此,利用现有的c-di-GMP效应蛋白的筛选策略,对真核宿主生物中可能存在的效应蛋白进行筛选鉴定,对于细菌c-di-GMP调控机制的解析和宿主免疫机制的阐明均具有重大的理论和实际意义。
| [1] | Ross P, Weinhouse H, Aloni Y, et al. Regulation of cellulose synthesis in Acetobacter xylinum by cyclic diguanylic acid. Nature, 1987, 325(6101): 279–281. DOI: 10.1038/325279a0 |
| [2] | Jenal U, Reinders A, Lori C. Cyclic di-GMP: second messenger extraordinaire. Nat Rev Microbiol, 2017, 15(5): 271–284. DOI: 10.1038/nrmicro.2016.190 |
| [3] | Römling U, Galperin MY, Gomelsky M. Cyclic di-GMP: the first 25 years of a universal bacterial second messenger. Microbiol Mol Biol Rev, 2013, 7(1): 1–52. |
| [4] | Hengge R. Principles of c-di-GMP signalling in bacteria. Nat Rev Microbiol, 2009, 7(4): 263–273. DOI: 10.1038/nrmicro2109 |
| [5] | Chan C, Paul R, Samoray D, et al. Structural basis of activity and allosteric control of diguanylate cyclase. Proc Natl Acad Sci USA, 2004, 101(49): 17084–17089. DOI: 10.1073/pnas.0406134101 |
| [6] | Christen M, Christen B, Folcher M, et al. Identification and characterization of a cyclic di-GMP-specific phosphodiesterase and its allosteric control by GTP. J Biol Chem, 2005, 280(35): 30829–30837. DOI: 10.1074/jbc.M504429200 |
| [7] | Ryan RP, Fouhy Y, Lucey JF, et al. Cell-cell signaling in Xanthomonas campestris involves an HD-GYP domain protein that functions in cyclic di-GMP turnover. Proc Natl Acad Sci USA, 2006, 103(17): 6712–6717. DOI: 10.1073/pnas.0600345103 |
| [8] | Cohen D, Mechold U, Nevenzal H, et al. Oligoribonuclease is a central feature of cyclic diguanylate signaling in Pseudomonas aeruginosa. Proc Natl Acad Sci USA, 2015, 112(36): 11359–11364. DOI: 10.1073/pnas.1421450112 |
| [9] | Orr MW, Donaldson GP, Severin GB. Oligoribonuclease is the primary degradative enzyme for pGpG in Pseudomonas aeruginosa that is required for cyclic-di-GMP turnover. Proc Natl Acad Sci USA, 2015, 112(36): E5048–E5057. DOI: 10.1073/pnas.1507245112 |
| [10] | Roelofs KG, Jones CJ, Helman SR, et al. Systematic identification of cyclic-di-GMP binding proteins in Vibrio cholerae reveals a novel class of cyclic-di-GMP-binding ATPases associated with type Ⅱ secretion systems. PLoS Pathog, 2015, 11(10): e1005232. DOI: 10.1371/journal.ppat.1005232 |
| [11] | Lori C, Ozaki S, Steiner S, et al. Cyclic di-GMP acts as a cell cycle oscillator to drive chromosome replication. Nature, 2015, 523(7559): 236–239. DOI: 10.1038/nature14473 |
| [12] | Baraquet C, Murakami K, Parsek MR, et al. The FleQ protein from Pseudomonas aeruginosa functions as both a repressor and an activator to control gene expression from the pel operon promoter in response to c-di-GMP. Nucleic Acids Res, 2012, 40(15): 7207–7218. DOI: 10.1093/nar/gks384 |
| [13] | Tao F, He Y W, Wu DH, et al. The cyclic nucleotide monophosphate domain of Xanthomonas campestris global regulator CLP defines a new class of cyclic di-GMP effectors. J Bacteriol, 2010, 192(4): 1020–1029. DOI: 10.1128/JB.01253-09 |
| [14] | Wilksch JJ, Yang J, Clements A, et al. MrkH, a novel c-di-GMP-dependent transcriptional activator, controls Klebsiella pneumoniae biofilm formation by regulating type 3 fimbriae expression. PLoS Pathog, 2011, 7(8): e1002204. DOI: 10.1371/journal.ppat.1002204 |
| [15] | Krasteva PV, Fong JCN, Shikuma NJ, et al. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP. Science, 2010, 327(5967): 866–868. DOI: 10.1126/science.1181185 |
| [16] | Shikuma NJ, Fong JCN, Yildiz FH. Cellular levels and binding of c-di-GMP control subcellular localization and activity of the Vibrio cholerae transcriptional regulator VpsT. PLoS Pathog, 2012, 8(5): e1002719. DOI: 10.1371/journal.ppat.1002719 |
| [17] | Steiner S, Lori C, Boehm A, et al. Allosteric activation of exopolysaccharide synthesis through cyclic di-GMP-stimulated protein-protein interaction. EMBO J, 2013, 32(3): 354–368. |
| [18] | Chin KH, Kuo WT, Yu YJ, et al. Structural polymorphism of c-di-GMP bound to an EAL domain and in complex with a type Ⅱ PilZ-domain protein. Acta Crystallogr D Biol Crystallogr, 2012, 68: 1380–1392. DOI: 10.1107/S0907444912030594 |
| [19] | An SQ, Caly DL, McCarthy Y, et al. Novel cyclic di-GMP effectors of the YajQ protein family control bacterial virulence. PLoS Pathog, 2014, 10(10): e1004429. DOI: 10.1371/journal.ppat.1004429 |
| [20] | Newell PD, Boyd CD, Sondermann H, et al. A c-di-GMP effector system controls cell adhesion by inside-out signaling and surface protein cleavage. PLoS Biol, 2011, 9(2): e1000587. DOI: 10.1371/journal.pbio.1000587 |
| [21] | Wang X, Preston Ⅲ JF, Romeo T. The pgaABCD locus of Escherichia coli promotes the synthesis of a polysaccharide adhesin required for biofilm formation. J Bacteriol, 2004, 186(9): 2724–2734. DOI: 10.1128/JB.186.9.2724-2734.2004 |
| [22] | Fazli M, O'Connell A, Nilsson M, et al. The CRP/FNR family protein Bcam1349 is a c-di-GMP effector that regulates biofilm formation in the respiratory pathogen Burkholderia cenocepacia. Mol Microbiol, 2011, 82(2): 327–341. DOI: 10.1111/mmi.2011.82.issue-2 |
| [23] | Christen M, Christen B, Allan MG, et al. DgrA is a member of a new family of cyclic diguanosine monophosphate receptors and controls flagellar motor function in Caulobacter crescentus. Proc Natl Acad Sci USA, 2007, 104(10): 4112–4117. DOI: 10.1073/pnas.0607738104 |
| [24] | Nesper J, Reinders A, Glatter T, et al. A novel capture compound for the identification and analysis of cyclic di-GMP binding proteins. J Proteomics, 2012, 75(15): 4874–4878. DOI: 10.1016/j.jprot.2012.05.033 |
| [25] | Sprecher KS, Hug I, Nesper J, et al. Cohesive properties of the Caulobacter crescentus holdfast adhesin are regulated by a novel c-di-GMP effector protein. mBio, 2017, 8(2): 00294–17. |
| [26] | Roelofs KG, Wang JX, Sintim HO, et al. Differential radial capillary action of ligand assay for high-throughput detection of protein-metabolite interactions. Proc Natl Acad Sci USA, 2011, 108(37): 15528–15533. DOI: 10.1073/pnas.1018949108 |
| [27] | Li WH, Cui T, Hu LH, et al. Cyclic diguanylate monophosphate directly binds to human siderocalin and inhibits its antibacterial activity. Nat Commun, 2015, 6: 8330. DOI: 10.1038/ncomms9330 |
| [28] | Burdette DL, Monroe KM, Sotelo-Troha K, et al. STING is a direct innate immune sensor of cyclic di-GMP. Nature, 2011, 478(7370): 515–518. DOI: 10.1038/nature10429 |
| [29] | Parvatiyar K, Zhang ZQ, Teles RM, et al. The helicase DDX41 recognizes the bacterial secondary messengers cyclic di-GMP and cyclic di-AMP to activate a type Ⅰ interferon immune response. Nat Immunol, 2012, 13(12): 1155–1161. DOI: 10.1038/ni.2460 |
| [30] | Trampari E, Stevenson CEM, Little RH, et al. Bacterial rotary export ATPases are allosterically regulated by the nucleotide second messenger cyclic-di-GMP. J Biol Chem, 2015, 290(40): 24470–24483. DOI: 10.1074/jbc.M115.661439 |
| [31] | Benach J, Swaminathan SS, Tamayo R, et al. The structural basis of cyclic diguanylate signal transduction by PilZ domains. EMBO J, 2007, 26(24): 5153–5166. DOI: 10.1038/sj.emboj.7601918 |
| [32] | Baraquet C, Harwood CS. Cyclic diguanosine monophosphate represses bacterial flagella synthesis by interacting with the Walker a motif of the enhancer-binding protein FleQ. Proc Natl Acad Sci USA, 2013, 110(46): 18478–18483. DOI: 10.1073/pnas.1318972110 |
| [33] | Lee VT, Matewish JM, Kessler JL, et al. A cyclic-di-GMP receptor required for bacterial exopolysaccharide production. Mol Microbiol, 2007, 65(6): 1474–1484. DOI: 10.1111/mmi.2007.65.issue-6 |
| [34] | Wienken CJ, Baaske P, Rothbauer U, et al. Protein-binding assays in biological liquids using microscale thermophoresis. Nat Commun, 2010, 1: 100. DOI: 10.1038/ncomms1093 |
| [35] | Rotem O, Nesper J, Borovok I, et al. An extended cyclic di-GMP network in the predatory bacterium Bdellovibrio bacteriovorus. J Bacteriol, 2016, 198(1): 127–137. DOI: 10.1128/JB.00422-15 |
| [36] | Rich RL, Myszka DG. Higher-throughput, label-free, real-time molecular interaction analysis. Anal Biochem, 2007, 361(1): 1–6. DOI: 10.1016/j.ab.2006.10.040 |
| [37] | Wallner J, Lhota G, Schosserer M, et al. An approach for liposome immobilization using sterically stabilized micelles (SSMs) as a precursor for bio-layer interferometry-based interaction studies. Colloids Surf B Biointerfaces, 2017, 154: 186–194. DOI: 10.1016/j.colsurfb.2017.03.015 |
| [38] | Zähringer F, Massa C, Schirmer T. Efficient enzymatic production of the bacterial second messenger c-di-GMP by the diguanylate cyclase YdeH from E. coli. Appl Biochem Biotechnol, , 163(1): 71–79. DOI: 10.1007/s12010-010-9017-x |
| [39] | Rao F, Pasunooti S, Ng Y, et al. Enzymatic synthesis of c-di-GMP using a thermophilic diguanylate cyclase. Anal Biochem, 2009, 389(2): 138–142. DOI: 10.1016/j.ab.2009.03.031 |
| [40] | Hickman JW, Tifrea DF, Harwood CS. A chemosensory system that regulates biofilm formation through modulation of cyclic diguanylate levels. Proc Natl Acad Sci USA, 2005, 102(40): 14422–14427. DOI: 10.1073/pnas.0507170102 |
| [41] | Fang X, Ahmad I, Blanka A, et al. GIL, a new c-di-GMP-binding protein domain involved in regulation of cellulose synthesis in enterobacteria. Mol Microbiol, 2014, 93(3): 439–452. DOI: 10.1111/mmi.12672 |
| [42] | Valentini M, Laventie BJ, Moscoso JA, et al. The diguanylate cyclase HsbD intersects with the HptB regulatory cascade to control Pseudomonas aeruginosa biofilm and motility. PLoS Genet, 2016, 12(11): e1006473. DOI: 10.1371/journal.pgen.1006473 |
| [43] | Newell PD, Monds RD, O'Toole GA. LapD is a bis-(3', 5')-cyclic dimeric GMP-binding protein that regulates surface attachment by Pseudomonas fluorescens Pf0-1. Proc Natl Acad Sci USA, 2009, 106(9): 3461–3466. DOI: 10.1073/pnas.0808933106 |
| [44] | Schumacher MA, Zeng WJ. Structures of the activator of K. pneumonia biofilm formation, MrkH, indicates PilZ domains involved in c-di-GMP and DNA binding. Proc Natl Acad Sci USA, 2016, 113(36): 10067–10072. DOI: 10.1073/pnas.1607503113 |
| [45] | Sundriyal A, Massa C, Samoray D, et al. Inherent regulation of EAL domain-catalyzed hydrolysis of second messenger cyclic di-GMP. J Biol Chem, 2014, 289(10): 6978–6990. DOI: 10.1074/jbc.M113.516195 |
| [46] | Li L, Wang QY, Zhang H, et al. Sensor histidine kinase is a β-lactam receptor and induces resistance to β-lactam antibiotics. Proc Natl Acad Sci USA, 2016, 113(6): 1648–1653. DOI: 10.1073/pnas.1520300113 |
| [47] | Molina DM, Jafari R, Ignatushchenko M, et al. Monitoring drug target engagement in cells and tissues using the cellular thermal shift assay. Science, 2013, 341(6141): 84–87. DOI: 10.1126/science.1233606 |
| [48] | Huynh K, Partch CL. Analysis of protein stability and ligand interactions by thermal shift assay. Curr Protoc Protein Sci, 2015, 79: 28.9.1–28.9.14. |
| [49] | Jones CJ, Utada A, Davis KR, et al. C-di-GMP regulates motile to sessile transition by modulating MshA Pili biogenesis and near-surface motility behavior in Vibrio cholerae. PLoS Pathog, 2015, 11(10): e1005068. DOI: 10.1371/journal.ppat.1005068 |
| [50] | Ouyang S, Song XQ, Wang YY, et al. Structural analysis of the STING adaptor protein reveals a hydrophobic dimer interface and mode of cyclic di-GMP binding. Immunity, 2012, 36(6): 1073–1086. DOI: 10.1016/j.immuni.2012.03.019 |
| [51] | Chang AL, McKeague M, Liang JC, et al. Kinetic and equilibrium binding characterization of aptamers to small molecules using a label-free, sensitive, and scalable platform. Anal Chem, 2014, 86(7): 3273–3278. DOI: 10.1021/ac5001527 |
| [52] | Dokudovskaya S, Williams R, Devos D, et al. Protease accessibility laddering: a proteomic tool for probing protein structure. Structure, 2006, 14(4): 653–660. DOI: 10.1016/j.str.2006.02.006 |
| [53] | Chen ZH, Schaap P. The prokaryote messenger c-di-GMP triggers stalk cell differentiation in Dictyostelium. Nature, 2012, 488(7413): 680–683. DOI: 10.1038/nature11313 |
 2017, Vol. 33
2017, Vol. 33