中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陈姝承, 孙慧敏, 李素, 刘平黄, 马吉飞, 仇华吉
- Chen Shucheng, Sun Huimin, Li Su, Liu Pinghuang, Ma Jifei, Qiu Huaji
- 针对猪瘟病毒E2蛋白的嵌合猪源化单克隆抗体的表达及抗病毒活性鉴定
- Expression and antiviral activity of a chimeric porcinized monoclonal antibody (cHQ06) against E2 protein of classical swine fever virus
- 生物工程学报, 2017, 33(8): 1235-1243
- Chinese Journal of Biotechnology, 2017, 33(8): 1235-1243
- 10.13345/j.cjb.170251
-
文章历史
- Received: June 24, 2017
- Accepted: July 25, 2017
2 中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150069
2 Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences (CAAS), Harbin 150069, Heilongjiang, China
猪瘟(Classical swine fever,CSF)是严重危害养猪业的一种烈性传染病,常造成巨大的经济损失,该病被世界动物卫生组织(OIE)列为必须申报的一类动物疫病[1]。CSF的病原是猪瘟病毒(Classical swine fever virus,CSFV),CSFV是有囊膜的单股正链RNA病毒,基因组长约12.3 kb,是黄病毒科瘟病毒属的成员[2]。该基因组仅编码一个大的开放阅读框,其编码一个由3 898个氨基酸组成的多聚蛋白。该多聚蛋白被宿主细胞编码的信号肽酶和自身编码的蛋白酶Npro、NS2及NS3切割为4种结构蛋白(C和Erns、E1、E2) 及8种非结构蛋白(Npro、P7、NS2、NS3、NS4A、NS4B、NS5A和NS5B) [3-4]。
衣壳蛋白C和糖蛋白Erns、E1、E2是CSFV的结构蛋白[5]。E2为Ⅰ型跨膜蛋白,其氨基端为胞外区,羧基端为跨膜区,将E2蛋白锚定在囊膜上[6]。E2蛋白在病毒生命周期中有重要作用,影响病毒吸附[7]、组织嗜性[8]和病毒毒力[9]。此外,E2是CSFV的主要保护性抗原蛋白,诱导机体产生中和抗体来抵抗病毒的感染[10]。E2蛋白在氨基端有B、C、D、A四个抗原结构域,构成两个独立的抗原区,按B/C和A/D的顺序排列(aa 690-800和766-865)[11-13]。
E2蛋白的抗原特性已经被许多单克隆抗体所鉴定[14-16]。在本实验室前期的工作中,我们制备了一株鼠源E2蛋白单克隆抗体HQ06,它可以特异性识别CSFV C株和石门株E2蛋白的线性表位,该单克隆抗体重链为免疫球蛋白G (IgG) 1型、轻链为к型[17]。
为了克服产生单克隆抗体的杂交瘤细胞不稳定且抗性易丢失等问题,在本研究中,我们利用单细胞克隆技术获得HQ06重链(HC)、轻链(LC)的基因,将其与猪源抗体恒定区基因相融合,克隆至真核表达载体,并在CHO细胞上稳定、高效表达针对CSFV E2蛋白的嵌合猪源化单克隆抗体(cHQ06)。通过检测实验证实cHQ06与CSFV E2蛋白具有良好的反应活性。而且,通过中和试验证实其可以抑制CSFV的感染。因此,本研究证明,针对CSFV E2蛋白的嵌合猪源化单克隆抗体cHQ06可以稳定、高效表达,为研究CSFV E2蛋白结构、功能以及开发新型的CSFV诊断和治疗制剂奠定基础。
1 材料与方法 1.1 细胞、病毒和质粒人胚肾细胞(HEK293T)、猪肾细胞(PK-15) 购自美国标准菌种收藏中心;中国仓鼠卵巢细胞(CHO)购于中国科学院细胞库。悬浮HEK293细胞由哈尔滨动物生物制品国家工程研究中心有限公司提供。CSFV石门株在PK-15细胞中传代并用Reed-Muench公式计算病毒滴度[18]。慢病毒载体pFUGW及辅助质粒psPAX2、pMD2.G由Addgene提供。表达抗体重链和轻链的真核表达质粒pcDNA-HC和pcDNA-LC由哈尔滨兽医研究所猪烈性传染病创新团队保存。
1.2 主要试剂Prime STAR® HS DNA聚合酶、限制性内切酶BamHⅠ、EcoRⅠ、T4 DNA连接酶、DNA上样缓冲液等购自TaKaRa公司;目的质粒特异性引物由博仕生物公司合成。HiTrap Protein A HP预装柱(5 mL)购于GE Healthcare公司;分子量为10 kDa的超滤管购于Merck公司。辣根过氧化物酶(HRP)标记的兔抗猪免疫球蛋白G (IgG) H & L (Abcam公司);鼠抗猪IgG (BD Pharmingen公司);HRP标记的山羊抗鼠的IgG、3, 3′, 5, 5′-四甲基联苯胺(TMB)底物、4′, 6-二脒基-2-苯基吲哚(DAPI)、伊文斯蓝(Evans blue)、异硫氰酸荧光素(FITC)标记的IgG均购于Sigma-Aldrich公司。
1.3 重组质粒的构建以pcDNA-HC和pcDNA-LC质粒为模板,扩增cHQ06重链(HC)和轻链(LC)基因。琼脂糖凝胶电泳鉴定核酸分子量正确后,将目的条带胶回收并于37 ℃酶切4 h,将其与同样酶切后的pFUGW质粒载体于16 ℃连接8 h,制备重组质粒pFUGW-HC和pFUGW-LC。引物序列见表 1。
| Primer | Sequence (5′-3′) |
| VH/VL-F | CGCggatccGCCACCATGCCGATGGGCTCCCTGCAGCCCCTGG |
| VH-R | CGgaattcTTATTTACCCTGAGTCTTGGAGATGGAC |
| VL-R | CGgaattcCTAAGCCTCACACTCGTTCCTGCTG |
将质粒pFUGW-HC和pFUGW-LC以及辅助质粒pMD2.G和psPAX2共转染到HEK293T细胞中,制备表达抗体HC和LC的慢病毒。将重组慢病毒按照感染复数(MOI)为10感染CHO细胞。48 h之后对细胞计数,应用有限稀释法筛选单细胞克隆,收取其上清用双抗体夹心酶联免疫吸附试验(DAS-ELISA)进行检测,通过检测结果筛选出cHQ06抗体细胞系。
1.5 cHQ06的表达和纯化收集CHO-cHQ06细胞系培养上清,使用制备型液相层析系统ÄKTA explorer对抗体进行纯化。蛋白洗脱后应用非还原性8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测抗体组装,并应用Western blotting等方法分析cHQ06的组装以及与兔抗猪IgG的反应性。
1.6 DAS-ELISA将纯化的鼠抗猪IgG经1:250稀释,在4 ℃条件下,以每孔100 μL包被ELISA板12 h。包被完成后,每孔加入150 μL PBST清洗1次,然后将含有5% FBS的5%脱脂乳加入到ELISA孔板中,每孔100 μL,37 ℃作用2 h。将纯化的cHQ06经2倍系列稀释加入到孔板中,于37 ℃作用1 h后,弃掉抗体,用PBST洗涤3次。将板子中的PBST吸干,加入用辣根过氧化物酶(HRP)标记的兔抗猪IgG H & L (1:4 000),于37 ℃继续孵育1 h。应用PBST洗涤3次后加入TMB底物显色,15 min后加入2 mol/L H2SO4终止反应,最后应用酶标仪在450 nm波长处检测吸光度。
1.7 应用间接ELISA检测cHQ06与CSFV E2蛋白的反应活性分别应用BHK-21细胞表达的CSFV石门株E2蛋白、悬浮HEK293细胞表达的C株E2蛋白或纯化的CSFV石门株包被ELISA板,每孔包被4 ng。在4 ℃放置12 h,然后用5%脱脂乳于37 ℃封闭2 h。将纯化的cHQ06经2倍系列稀释加入孔板中,于37 ℃孵育1 h。应用PBST洗涤3次,加入用HRP标记的兔抗猪IgG H & L (1:4 000),于37 ℃孵育1 h,TMB底物显色后应用酶标仪在450 nm波长处检测吸光度。
1.8 应用Western blotting检测cHQ06与CSFV E2蛋白反应活性将BHK-21细胞表达的CSFV石门株E2蛋白和悬浮的HEK293细胞表达的C株E2蛋白进行SDS-PAGE,将蛋白转印至硝酸纤维素(NC)膜后,用5%脱脂乳于室温孵育2 h。应用PBS洗涤1次后,将NC膜放至HQ06腹水(1:1 000) 及纯化的cHQ06中,室温孵育1.5 h。用PBST洗涤5次,每次5 min,洗涤完毕后,分别于HRP标记的山羊抗鼠(1:1 000)、兔抗猪IgG (1:2 500) 中室温孵育1 h。应用PBST洗涤后,使用多功能荧光化学发光成像分析系统进行扫描,保存灰白图。
1.9 病毒中和试验将纯化的cHQ06抗体2倍系列稀释,做6个稀释梯度和4个重复,与每孔中100 TCID50的CSFV石门株等体积混合,于37 ℃温箱中孵育2 h。应用冷无水乙醇于-20 ℃冰箱中固定细胞15 min,然后将CSFV阳性血清1:100稀释,加入每孔,于37 ℃孵育2 h后,应用PBS洗涤5次,每次5 min。洗涤结束后加入1:100稀释的FITC标记的IgG和1:1 000稀释的伊文斯蓝,放入37 ℃温箱,孵育1 h。孵育结束应用PBST清洗5次,再加入1:1 000稀释的DAPI将细胞核染色,37 ℃放置10 min,用PBS清洗5次后,应用荧光显微镜分析抗体中和效价。
1.10 统计学分析应用GraphPad Prism 5软件分析所有的数据。误差线表示图中所有平均值(x)的标准偏差(s)。
2 结果与分析 2.1 cHQ06重链、轻链重组质粒的构建以质粒pcDNA-HC和pcDNA-LC为模板,分别应用特异性引物分别扩增cHQ06-HC、LC目的基因,如图 1A所示,重链大小为1 500 bp,轻链大小为750 bp,表明目的片段已被成功克隆。重组质粒经BamHⅠ和EcoRⅠ双酶切后在1 500 bp和750 bp处出现特异条带,测序结果显示,其与目标序列一致。结果表明,质粒pFUGW-HC和pFUGW-LC构建成功(图 1B)。

|
| 图 1 重组质粒pFUGW-HC和pFUGW-LC的构建 Figure 1 Construction of recombinant plasmids pFUGW-HC and pFUGW-LC. (A) Amplification results of cHQ06 heavy chain and light chain by RT-PCR; 1-3: the gene of HC and LC; 4: negative control. (B) Identification of plasmids pFUGW-HC and pFUGW-LC; 1: pFUGW-HC; 2: pFUGW-LC; 3: pFUGW. |
| |
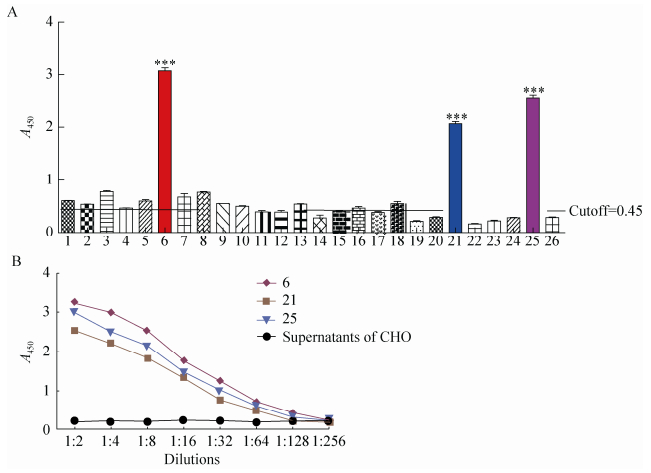
将转导后的细胞接种于96孔板中,应用有限稀释法筛选单克隆细胞,显微镜下共观察到有26株单克隆细胞,收取其上清,应用双抗体夹心ELISA检测抗体与兔抗猪IgG的反应性。检测结果表明,6号、21号和25号细胞克隆的培养上清与兔抗猪的IgG反应性较强,有可能为阳性细胞(图 2A)。将这3株细胞扩大培养,收取上清进行纯化,双抗体夹心ELISA检测结果显示,6号细胞克隆的培养上清与兔抗猪IgG反应性最好,且呈剂量依赖性(图 2B)。
|
| 图 2 cHQ06细胞系的筛选 Figure 2 Screening of cHQ06 cell line. (A) Screening of positive cell clones of cHQ06 using double-antibody sandwich ELISA. (B) Reactivity of different cell clones of cHQ06 with rabbit anti-pig IgG in a dose-dependent manner. |
| |
将纯化后的6号细胞克隆的培养上清(浓度为1 mg/mL)进行非还原性的SDS-PAGE分析,结果表明cHQ06抗体可成功组装成为160 kDa大小的蛋白,与猪源抗体蛋白的分子量一致(图 3A)。为了进一步证明cHQ06抗体是否是猪源化抗体,我们应用8%非还原性SDS-PAGE进行Western blotting试验,在160 kDa处检测到抗体蛋白,这表明,cHQ06可以和抗猪IgG抗体反应(图 3B)。以上结果证明,cHQ06抗体成功组装,并且可被兔抗猪IgG识别,已成功获得猪源化的E2蛋白单克隆抗体。

|
| 图 3 cHQ06猪源抗体活性的检测 Figure 3 Activity measurement of porcinized antibody cHQ06. (A) The generation of cHQ06 was examined using SDS-PAGE. (B) The reactivity of cHQ06 and rabbit anti-pig IgG was examined using Western blotting. |
| |
应用间接ELISA和Western blotting验证cHQ06抗体和CSFV E2蛋白的反应性。间接ELISA结果表明,cHQ06抗体与不同表达系统表达的E2蛋白均具有良好的反应性,并且呈剂量依赖性(图 4A)。为了进一步证明cHQ06抗体的特异性,应用Western blotting试验检测CSFV C株和石门株E2蛋白与cHQ06抗体的反应性,并用鼠源HQ06 (浓度为1 mg/mL)作为阳性对照。结果表明,cHQ06抗体识别CSFV E2蛋白的能力强于亲本抗体HQ06 (图 4B),综上所述,cHQ06抗体与CSFV E2蛋白有良好的反应性。

|
| 图 4 cHQ06抗体的反应性检测 Figure 4 Detection of the reactivity of cHQ06 with the CSFV E2 protein. (A) Indirect ELISA. (B) Western blotting. |
| |
HQ06可以识别CSFV E2蛋白表面的772LFDGTNP778表位[19]。为了鉴别cHQ06是否具有中和病毒的能力,将CSFV以100 TCID50与等体积的2倍系列稀释cHQ06抗体进行孵育,然后感染PK-15细胞,48 h后进行间接免疫荧光试验(IFA)。结果显示,在1:2、1:4和1:8的cHQ06稀释孔中,未检测到CSFV的特异性荧光灶,且在1:16的cHQ06稀释孔中,只检测到少量荧光灶,这表明,cHQ06中和效价为1:12 (图 5)。

|
| 图 5 用中和试验检测cHQ06抗体对CSFV的中和作用 Figure 5 Neutralizing activity of cHQ06 against CSFV infection determined by neutralization test. Scale bars represent 400 μm. |
| |
实验室前期制备了一株针对CSFV E2蛋白的鼠源单克隆抗体HQ06,并证实该抗体识别CSFV E2蛋白772LFDGTNP778上的一个线性表位[19]。由于传统制备单克隆抗体的方法周期过长,并且因杂交瘤细胞不能长期保存,有可能造成分泌抗体的细胞活力下降、抗性丢失。在国内外的研究中,已经有很多制备成功的基因工程嵌合抗体,将鼠源抗体重链和轻链的可变区嵌合到人源抗体的恒定区的报道有很多[20-23],但鲜有将鼠源抗体嵌合到猪源抗体中的报道。因此,在抗CSFV E2蛋白抗体的研究中,考虑到抗体潜在的治疗应用价值,我们将实验室已有的鼠源抗体嵌合入猪源抗体的恒定区,使之成为猪源抗体;并由于CHO细胞表达系统产生杂蛋白较少,能够高效表达cHQ06抗体蛋白,因此成功构建了稳定表达cHQ06的CHO细胞系,并通过大量培养细胞、收集和纯化上清以获得抗体蛋白。
在蛋白纯化方面,我们使用制备型液相层析系统ÄKTA explorer纯化抗体蛋白,现已有很多应用ÄKTA纯化蛋白的报道[24-25]。传统的蛋白纯化方法费时、费力,且蛋白容易降解,洗脱效果不佳。ÄKTA explorer相比于传统纯化蛋白的方法更高效,可在短时间内,在大量流入样品的情况下,根据紫外峰值快速精准地收取纯化的目的蛋白,最大程度地避免抗体蛋白的降解。
在中和试验中,我们应用IFA进行检测,确定了该抗体的中和效价。试验方法参考了欧盟猪瘟诊断标准操作手册,该抗体在1 mg/mL浓度下的中和效价为1:12,中和效价不高,可能是由于单克隆抗体只能识别一个抗原表位,所以中和效价偏低。
我们已经证实了该抗体的反应性和抑制病毒复制的能力,并且有较好的亲和力。因此,cHQ06在检测方面的应用具有很高的研究价值。在下一步研究中,我们计划应用cHQ06抗体建立竞争ELISA检测方法,为开发新型CSFV抗体检测试剂奠定基础。
| [1] | Ji W, Guo Z, Ding NZ, et al. Studying classical swine fever virus: making the best of a bad virus. Virus Res, 2015, 197: 35–47. DOI: 10.1016/j.virusres.2014.12.006 |
| [2] | Becher P, Ramirez RA, Orlich M, et al. Genetic and antigenic characterization of novel pestivirus genotypes: implications for classification. Virology, 2003, 311(1): 96–104. DOI: 10.1016/S0042-6822(03)00192-2 |
| [3] | Collett MS, Moennig V, Horzinek MC. Recent advances in pestivirus research. J Gen Virol, 1989, 70(2): 253–266. DOI: 10.1099/0022-1317-70-2-253 |
| [4] | Thiel HJ, Stark R, Weiland E, et al. Hog cholera virus: molecular composition of virions from a pestivirus. J Virol, 1991, 65(9): 4705–4712. |
| [5] | Rümenapf T, Meyers G, Stark R, et al. Molecular characterization of hog cholera virus. Arch Virol (Suppl), 1991, 3: 7–18. DOI: 10.1007/978-3-7091-9153-8 |
| [6] | Li Y, Wang JM, Kanai R, et al. Crystal structure of glycoprotein E2 from bovine viral diarrhea virus. Proc Natl Acad Sci USA, 2013, 110(17): 6805–6810. DOI: 10.1073/pnas.1300524110 |
| [7] | Wang Z, Nie YC, Wang PG, et al. Characterization of classical swine fever virus entry by using pseudotyped viruses: E1 and E2 are sufficient to mediate viral entry. Virology, 2004, 330(1): 332–341. DOI: 10.1016/j.virol.2004.09.023 |
| [8] | Reimann I, Depner K, Trapp S, et al. An avirulent chimeric Pestivirus with altered cell tropism protects pigs against lethal infection with classical swine fever virus. Virology, 2004, 322(1): 143–157. DOI: 10.1016/j.virol.2004.01.028 |
| [9] | Risatti GR, Borca MV, Kutish GF, et al. The E2 glycoprotein of classical swine fever virus is a virulence determinant in swine. J Virol, 2005, 79(6): 3787–3796. DOI: 10.1128/JVI.79.6.3787-3796.2005 |
| [10] | Beer M, Goller KV, Staubach C, et al. Genetic variability and distribution of classical swine fever virus. Anim Health Res Rev, 2015, 16(1): 33–39. DOI: 10.1017/S1466252315000109 |
| [11] | Hulst MM, Westra DF, Wensvoort G, et al. Glycoprotein E1 of hog cholera virus expressed in insect cells protects swine from hog cholera. J Virol, 1993, 67(9): 5435–5442. |
| [12] | König M, Lengsfeld T, Pauly T, et al. Classical swine fever virus: independent induction of protective immunity by two structural glycoproteins. J Virol, 1995, 69(10): 6479–6486. |
| [13] | Wensvoort G, Terpstra C, de Kluijver EP, et al. Antigenic differentiation of pestivirus strains with monoclonal antibodies against hog cholera virus. Vet Microbiol, 1989, 21(1): 9–20. DOI: 10.1016/0378-1135(89)90014-X |
| [14] | Sandomenico A, Leonardi A, Berisio R, et al. Generation and characterization of monoclonal antibodies against a cyclic variant of hepatitis C virus E2 epitope 412-422. J Virol, 2016, 90(7): 3745–3759. DOI: 10.1128/JVI.02397-15 |
| [15] | Angus AG, Patel AH. Immunotherapeutic potential of neutralizing antibodies targeting conserved regions of the HCV envelope glycoprotein E2. Future Microbiol, 2011, 6(3): 279–294. DOI: 10.2217/fmb.11.9 |
| [16] | Edward S, Sands JJ. Antigenic comparisons of hog cholera virus isolates from Europe, America and Asia using monoclonal antibodies. Dtsch Tierarztl Wochenschr, 1990, 97(2): 79–81. |
| [17] |
Hou Q, Peng WP, Sun Y, et al. Expression of the truncated E2 protein-encoding gene of classical swine fever virus in Escherichia coli and preparation of a monoclonal antibody against E2 protein.
Chin Vet Sci, 2008, 38(1): 1–5.
(in Chinese). 侯强, 彭伍平, 孙元, 等. 猪瘟病毒E2蛋白主要抗原区编码基因的原核表达及其单克隆抗体的制备. 中国兽医科学, 2008, 38(1): 1-5. |
| [18] | Reed LJ, Muench H. A simple method of estimating fifty percent endpoints. Am J Epidemiol, 1938, 27(3): 493–497. DOI: 10.1093/oxfordjournals.aje.a118408 |
| [19] | Peng WP, Hou Q, Xia ZH, et al. Identification of a conserved linear B-cell epitope at the N-terminus of the E2 glycoprotein of classical swine fever virus by phage-displayed random peptide library. Virus Res, 2008, 135(2): 267–272. DOI: 10.1016/j.virusres.2008.04.003 |
| [20] | Steplewski Z, Sun LK, Shearman CW, et al. Biological activity of human-mouse IgG1, IgG2, IgG3, and IgG4 chimeric monoclonal antibodies with antitumor specificity. Proc Natl Acad Sci USA, 1988, 85(13): 4852–4856. DOI: 10.1073/pnas.85.13.4852 |
| [21] | Shaw DR, Khazaeli MB, Sun LK, et al. Characterization of a mouse/human chimeric monoclonal antibody (17-1A) to a colon cancer tumor-associated antigen. J Immunol, 1987, 138(12): 4534–4538. |
| [22] | Hashimoto Y, Tada M, Iida M, et al. Generation and characterization of a human-mouse chimeric antibody against the extracellular domain of claudin-1 for cancer therapy using a mouse model. Biochem Biophys Res Commun, 2016, 477(1): 91–95. DOI: 10.1016/j.bbrc.2016.06.025 |
| [23] | Ji S, Jiang M, Yan B, et al. The chimeric monoclonal antibody MHCSZ-123 against human von Willebrand factor A3 domain inhibits high-shear arterial thrombosis in a Rhesus monkey model. J Hematol Oncol, 2017, 10(1): 111. DOI: 10.1186/s13045-017-0475-2 |
| [24] | Yoo D, Provchy J, Park C, et al. Automated high-throughput protein purification using an ÄKTA purifier and a CETAC autosampler. J Chromatogr A, 2014, 1344: 23–30. DOI: 10.1016/j.chroma.2014.04.014 |
| [25] | Wang FM, Yu F, Zhao MH. A method of purifying intact complement factor H from human plasma. Protein Expr Purif, 2013, 91(2): 105–111. DOI: 10.1016/j.pep.2013.07.014 |
 2017, Vol. 33
2017, Vol. 33