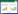中国科学院微生物研究所、中国微生物学会主办
文章信息
- 潘剑茹, 陈莉娟, 何火聪, 苏颖, 王香玲, 李娴, 陈翠煌, 吴伦巧, 刘树滔
- Pan Jianru, Chen Lijuan, He Huocong, Su Ying, Wang Xiangling, Li Xian, Chen Cuihuang, Wu Lunqiao, Liu Shutao
- 全长SOD2重组蛋白的可溶表达、纯化、稳定性与跨膜效应
- Expression, purification, stability and transduction efficiency of full-length SOD2 recombinant proteins
- 生物工程学报, 2017, 33(7): 1168-1177
- Chinese Journal of Biotechnology, 2017, 33(7): 1168-1177
- 10.13345/j.cjb.170007
-
文章历史
- Received: January 7, 2017
- Accepted: March 10, 2017
2 福建省科技厅转化医学重点实验室 福建医科大学附属肿瘤医院 福建省肿瘤医院放射生物学及肿瘤放射治疗学研究室,福建 福州 350014
2 Laboratory of Radiation Oncology and Radiobiology, Fujian Cancer Hospital & Fujian Medical University Cancer Hospital, Fujian Key Laboratory of Tumor Translational Cancer Medicine, Fuzhou 350014, Fujian, China
超氧化物歧化酶(SOD)家族是保护氧利用细胞免受正常代谢过程中产生的活性氧(ROS)毒性所必需的。除了保护性蛋白质,这些酶也是调节细胞生理学信号通路的关键组件。SOD催化反应,然后用过氧化氢酶(CAT)和过氧化物酶除去过氧化氢。在哺乳动物细胞中存在3种已知形式的SOD:主要在细胞质和细胞核中发现的含铜和锌的超氧化物歧化酶(Cu,Zn-SOD,SOD1),在线粒体中发现的含锰超氧化物歧化酶(Mn-SOD,SOD2) 和细胞外超氧化物歧化酶(EC-SOD,SOD3)[1]。定位在线粒体的SOD2被认为是3种SOD中最重要的一个,因为线粒体是主要的ROS生产位点[2]。Mn-SOD不仅对所有需氧生物的存活都是必需的[3],还被证明是一种强大的保护和治疗剂,可用于抗氧化应激相关的疾病,如肾损伤[4]、关节炎[5]、慢性炎症肺纤维化[5]以及电离辐射所引起的辐射损伤[6-8]。
Mn-SOD在细胞中以带有线粒体靶向信号肽的前体形式合成,通过其2 kDa的前导序列进入线粒体基质,该肽随后被切割,产生在线粒体内起关键作用的成熟和具有酶活性的蛋白质[9]。对人脂肪肉瘤细胞LSA中发现的30 kDa的人源SOD2异构体(LSA-type-Mn-SOD)的系列研究结果表明,SOD2的前导肽还具有介导蛋白进入细胞的能力[10-14]。利用原核系统重组表达SOD2时,为了得到可溶并具有酶活的蛋白,通常会把SOD2的前导肽序列去掉,直接表达单体成熟的蛋白,如王峰等曾利用pET15b质粒在大肠杆菌Rosetta-gami菌株中表达得到N端His标签的可溶SOD2重组蛋白,比活为1 890 U/mg[15]。
然而,这种方法虽然可得到成熟和具有酶活性的SOD2,但失去前导肽的SOD2却由于分子量的限制难以进入细胞发挥作用。因此,上述SOD2的应用多是以转基因的形式进行,这限制了SOD2重组蛋白的临床应用。
本研究合成了人源SOD2全长基因,首次将其克隆至带有GST标签的pGEX-4T-1质粒,构建重组质粒pGEX-4T-1-SOD2,转化后表达得到GST-SOD2融合蛋白,并对表达得到的GST-SOD2融合蛋白以及酶切得到的全长SOD2重组蛋白进行纯化、鉴定及稳定性等研究。
1 材料与方法 1.1 材料pGEX-4T-1质粒、大肠杆菌DH5α、大肠杆菌BL21 (DE3) 均为本实验室保存;Taq酶购自TaKaRa公司;质粒提取试剂盒、胶回收试剂盒购自Qiagen公司;各种限制性内切酶购自NEB公司;GST亲和柱购自生工生物工程上海(股份)有限公司;IPTG、考马斯亮蓝R-250购自AMRESCO公司;蛋白marker购于Fermentas公司;DNA marker购自北京天根生化科技有限公司;基因合成与DNA测序由生工生物工程上海(股份)有限公司进行。SOD和GST活力检测试剂盒购自南京建成生物工程研究所。牛凝血酶购自北京博尔西科技有限公司。BCA蛋白含量检测试剂盒购自Thermo Scientific (美国)。L-02人正常肝细胞株购自中国科学院典型培养物保藏委员会细胞库。
1.2 质粒的构建全基因合成人源全长SOD2的基因序列,在其上、下游分别引入EcoRⅠ和XhoⅠ酶切位点,将其与pGEX-4T-1质粒均用EcoRⅠ和XhoⅠ进行双酶切并经胶回收纯化,然后用T4 DNA连接酶将纯化的SOD2基因片段和pGEX-4T-1质粒片段于4 ℃连接过夜,转化大肠杆菌BL21 (DE3),挑取单菌落培养后抽提质粒进行EcoRⅠ和XhoⅠ双酶切鉴定,并将EcoRⅠ和XhoⅠ鉴定正确的阳性克隆进行DNA测序鉴定。
1.3 GST-SOD2融合蛋白的诱导表达将DNA测序正确的阳性克隆菌于37 ℃培养至OD600=0.6−0.8时,分别加入IPTG和MnSO4,诱导GST-SOD2融合蛋白表达,同时探索了诱导条件对表达量的影响。取诱导后的菌液,10 000 r/min离心2 min,弃上清收集菌体沉淀,一部分菌体直接加入SDS-PAGE电泳样品处理液,用于检测全菌蛋白;另一部分加入9倍体积的缓冲液1 (10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,2.7 mmol/L KCl,pH 7.3),冰浴超声破碎30 min,然后10 000 r/min离心20 min,取上清电泳。
用12.5% SDS-PAGE和考马斯亮蓝染色,比较不同条件下的菌体全蛋白与超声破碎上清中的蛋白比例,分析融合蛋白在不同条件下的表达情况,筛选较好的可溶表达条件。
1.4 GST-SOD2融合蛋白与SOD2重组蛋白的纯化在最佳诱导条件下诱导GST-SOD2融合蛋白的表达,收集诱导后菌体超声破碎的上清液,按照GST亲和树脂说明书进行层析,分别收集亲和柱穿透峰和洗脱峰,进行12.5%的SDS-PAGE。
SOD2重组蛋白纯化:将GST-SOD2吸附到亲和树脂上,用大量平衡缓冲液洗去杂质,往亲和树脂中加入牛凝血酶(1 U/mg融合蛋白),22 ℃孵育16 h,放出洗脱峰1。再用1×PBS冲洗柱子,收集洗脱峰2。将洗脱峰1和洗脱峰2合并,加入肝素亲和树脂,按照柱子说明书,收集肝素亲和柱的穿透峰,进行12.5%的SDS-PAGE。
1.5 GST-SOD2融合蛋白与SOD2的鉴定分别使用SOD和GST活力检测试剂盒测定蛋白的相应酶活力,结合SDS-PAGE测定的蛋白分子量,鉴定是否为目标蛋白。
1.6 GST-SOD2融合蛋白与SOD2重组蛋白的稳定性取300 µL GST-SOD2融合蛋白与SOD2重组蛋白,分别置于25 ℃、37 ℃、50 ℃、60 ℃、80 ℃的水浴中保温30 min,取出,待回至室温,取样分别测定残留酶活力,分析融合蛋白的热稳定性。
取300 µL GST-SOD2融合蛋白与SOD2重组蛋白,用广泛缓冲液分别调至pH 4、5、6、7、8,4 ℃下放置30 min,取出,待回至室温,取样分别测定残留酶活力,分析融合蛋白的pH稳定性。
1.7 GST-SOD2融合蛋白与SOD2重组蛋白的跨膜效应参照文献[16],分别用FITC标记GST-SOD2融合蛋白和SOD2重组蛋白。
取对数生长期的L-02细胞用含15%小牛血清的细胞培养液配成单个细胞悬液,将其接种到24孔板,每孔40 000个细胞,培养24 h。吸去培养液,加PBS清洗2次,往每孔中分别加入400 µL 42 µg/mL的FITC-蛋白,37 ℃作用3 h。吸去蛋白液,用PBS清洗2次,加入250 µL细胞裂解液(0.5% Triton-X-100+0.1% SDS),漩涡振荡2 min,放置4 ℃冰箱15 min后,1 200 r/min离心5 min,取200 µL上清液用荧光酶标仪检测,并以BCA试剂盒测定上清液的蛋白含量。以每µg细胞蛋白所对应的荧光强度来比较两种融合蛋白的跨膜效率。
每组数据3个平行孔,采用Excel软件进行统计处理,作标准差计算、t检验等。P > 0.05为无显著性差异。
2 结果与分析 2.1 pGEX-4T-1-SOD2原核表达载体的构建将合成的人源SOD2基因片段和pGEX-4T-1质粒均用EcoRⅠ和XhoⅠ内切酶进行双酶切,胶回收纯化酶切后的SOD2基因片段和pGEX-4T-1质粒片段,通过T4 DNA连接酶将SOD2基因定向插入到pGEX-4T-1质粒的多克隆位点中。挑单菌落培养后抽提质粒进行EcoRⅠ和XhoⅠ酶切鉴定,结果见图 1。重组子经酶切鉴定后得到两条目的带,大约为4 946 bp和669 bp,分别与pGEX-4T-1质粒和SOD2预期分子量一致。将酶切鉴定正确的质粒进行DNA测序鉴定,测序结果与预期的序列一致,证明SOD2基因已经成功插入pGEX-4T-1载体,pGEX-4T-1-SOD2重组质粒构建成功。
|
| 图 1 重组质粒pGEX-4T-1-SOD2的构建 Figure 1 Construction of pGEX-4T-1-SOD2 recombinant plasmid. M: DNA marker; 1: pGEX4T-1-SOD2 recombinant plasmid; 2: digestion identification of pGEX4T-1-SOD2 with EcoRⅠand XhoⅠ. |
| |
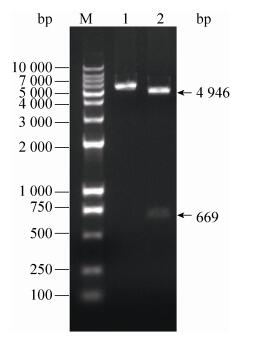
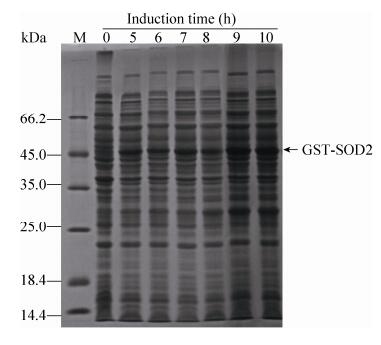
将重组质粒pGEX-4T-1-SOD2转化大肠杆菌BL21 (DE3),收集菌体进行SDS-PAGE分析,结果如图 2、图 3和图 4所示。
|
| 图 2 诱导时间对GST-SOD2融合蛋白可溶表达量的影响 Figure 2 Effect of inducing time on the expression of GST-SOD2 fusion protein. M: protein weight marker. |
| |
|
| 图 3 诱导温度对GST-SOD2融合蛋白可溶表达量的影响 Figure 3 Effect of inducing temperature on the expression of GST-SOD2 fusion protein. M: protein weight marker. |
| |
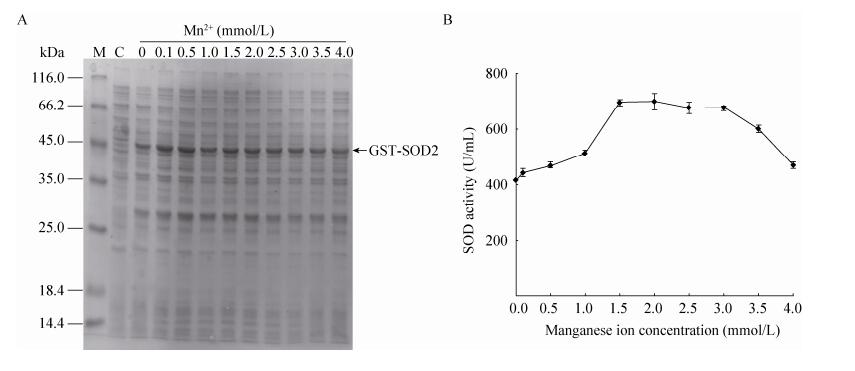
|
| 图 4 Mn2+浓度对GST-SOD2融合蛋白表达量和活性的影响 Figure 4 Effect of the concentrations of Mn2+ on the expression (A) and SOD activity (B) of GST-SOD2 fusion protein. M: protein weight marker; C: pGEX-4T-1 vector control. |
| |
由图 2可知,与未诱导的菌体相比,诱导温度为20 ℃时,当诱导时间超过5 h时,菌体超声破碎液的上清中可溶融合蛋白的表达量变化不大。
由图 3可知,同样诱导6 h,不同的诱导温度对GST-SOD2融合蛋白的表达量与可溶表达有很大影响。诱导温度为16 ℃,融合蛋白的表达量较低,随着诱导温度的增加,融合蛋白的表达量随之增加。但当诱导温度达到37 ℃时,菌体超声破碎液的上清中融合蛋白量开始降低,这表明可能有部分融合蛋白形成了包涵体。由图 3可知,最佳诱导温度为25 ℃。
由图 4可知,Mn2+浓度对GST-SOD2融合蛋白的可溶表达量影响不大(图 4A),但它会影响GST-SOD2融合蛋白的活性(图 4B)。随着Mn2+浓度的增加,GST-SOD2融合蛋白的活性逐渐增加,当Mn2+浓度达到1.5 mmol/L时,融合蛋白的活性达到最大值,随着Mn2+浓度的继续增加(1.5−3.0 mmol/L),融合蛋白的活性基本不变,但当Mn2+浓度继续加大时,融合蛋白的活性反而随Mn2+浓度的加大而减小。为此,将最佳Mn2+浓度定为1.5 mmol/L。
2.3 GST-SOD2融合蛋白与SOD2重组蛋白的纯化与鉴定GST-SOD2表达菌超声破碎后,收集上清,使用GST亲和柱纯化后,最终得到纯化的GST-SOD2融合蛋白,将吸附在GST亲和柱上的GST-SOD2融合蛋白经牛凝血酶柱上酶切及肝素柱去凝血酶后,得到纯化的SOD2重组蛋白,结果如图 5所示。

|
| 图 5 GST-SOD2融合蛋白与SOD2重组蛋白的纯化 Figure 5 Purification of GST-SOD2 fusion protein and SOD2 recombinant protein. M: protein marker; 1: lysate supernatant; 2: GST sepharose eluant (the purified GST-SOD2); 3: eluant following on-column thrombin cleavage; 4: Heparin column flow-through (the purified SOD2). |
| |
GST-SOD2融合蛋白和SOD2重组蛋白的理论分子量分别为51 kDa和25 kDa左右,图 5中GST-SOD2融合蛋白和SOD2重组蛋白的实际分子量分别约为46 kDa和25 kDa。由于GST-SOD2融合蛋白是由SOD2和GST两种抗氧化酶融合而得的独特蛋白,同时具有SOD和GST活力,因此我们进一步使用SOD和GST检测试剂盒分别测定了该蛋白的酶活力。结果表明,纯化所得的GST-SOD2融合蛋白的SOD活力为1 788 U/mg,GST活力为150 U/mg,纯化所得的SOD2重组蛋白的SOD活力为2 000 U/mg。综合分子量与活性分析的结果,可确认GST-SOD2融合蛋白得到正确表达,其酶切所得SOD2重组蛋白为预期的蛋白。
2.4 GST-SOD2融合蛋白与SOD2重组蛋白的稳定性由图 6-A可以看出,温度对两种蛋白的SOD活力影响都很大。随温度的升高,GST-SOD2融合蛋白的SOD活力几乎是直线下降,当热处理温度达到60 ℃时,SOD活力基本完全丧失。与GST-SOD2相比,SOD2重组蛋白的热稳定性相对较高,在热处理温度小于40 ℃时,其活性变化不大,但当热处理温度超过40 ℃时,随温度的升高,SOD2重组蛋白的酶活开始迅速下降,在60 ℃水浴30 min后,活力仅余约9%,在80 ℃水浴30 min后,活力接近于0。

|
| 图 6 GST-SOD2融合蛋白与SOD2重组蛋白的稳定性 Figure 6 Thermal (A) and pH (B) stability of GST-SOD2 fusion protein and SOD2 recombinant protein. |
| |
由图 6-B可以看出,pH对两种蛋白的酶活也有很大影响。GST-SOD2融合蛋白的SOD活力在pH≤7的范围内随pH的降低而降低,在pH 7−8的范围内活力缓慢增加,当pH超过8后,活性随pH的升高而降低。pH对SOD2重组蛋白酶活的影响趋势与GST-SOD2融合蛋白的相似,但SOD2重组蛋白在pH 7−8的范围内活力基本不变,且其整体的pH稳定性高于GST-SOD2融合蛋白。
2.5 GST-SOD2融合蛋白与SOD2重组蛋白的跨膜效应为检测两种蛋白是否能进入细胞,将它们进行FITC标记后通过细胞内荧光强度的变化检测其对正常人肝细胞株L-02的跨膜效果,结果如图 7所示。由图 7可知,与正常对照相比,两种融合蛋白都有显著的跨膜能力(P < 0.05),在42 μg/mL的剂量下,SOD2重组蛋白比GST-SOD2融合蛋白的跨膜效果略强一些,约为后者的1.1倍,但二者之间没有显著差异。
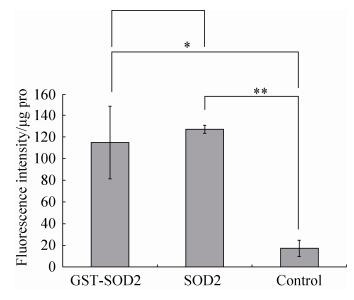
|
| 图 7 GST-SOD2融合蛋白与SOD2重组蛋白的跨膜效应 Figure 7 Transduction of GST-SOD2 fusion protein and SOD2 recombinant protein in vitro. Control: untreated cell. The bars indicate the x±s. (n=3, compared with control group, **P < 0.01, *P < 0.05, compared with GST-SOD2 group, P > 0.05). |
| |
超氧阴离子是引起机体氧化损伤特别是放射副作用的主要原因之一,SOD是唯一一种可以清除超氧阴离子的天然酶,在抗氧化损伤方面具有重要应用价值。人源的3种SOD中,SOD2最为重要,因为其在ROS的发源地线粒体中发挥效用[2],该蛋白在细胞中以前体形式合成,通过其信号肽进入线粒体基质后,去除信号肽,折叠成成熟蛋白质发挥功能[9]。现有的体外重组人源SOD2基本都去除了前导肽片段以得到成熟有活性的酶,但失去前导肽的SOD2是无法进入细胞发挥作用的,故此,SOD2功能研究虽多,但多是以转基因的方式进行,临床应用颇有不便。
本研究选用pGEX-4T-1质粒载体,利用载体自带的GST,融合全长人源SOD2,构建得到GST-SOD2融合蛋白。实验结果表明,在N端融合的GST的帮助下,GST-SOD2融合蛋白实现了可溶表达,其可溶表达量受诱导时间和诱导温度影响。经过诱导条件的优化,最终确定在25 ℃时,往培养基中添加1.5 mmol/L Mn2+,然后利用IPTG诱导得到可溶的GST-SOD2融合蛋白。经GST亲和树脂纯化得到的纯GST-SOD2融合蛋白比活为1 788 U/mg,比王峰等所得到的重组成熟SOD2蛋白的活性[15]略低一些。但其分子量几乎是SOD2蛋白的2倍,因此,在同样的摩尔浓度下,GST-SOD2的酶活为重组成熟SOD2蛋白2倍左右。在此基础上,我们进一步通过超声破碎、GST亲和柱吸附、凝血酶柱内酶切及肝素亲和柱去除凝血酶得到了电泳纯的SOD2重组蛋白,该蛋白分子量与SOD2全长序列的理论分子量相符,比活为2 000 U/mg,比王峰等所得到的重组成熟SOD2蛋白的活性[15]还略高一些。
在顺利得到两种具有酶活性的全长SOD2蛋白后,本研究对两种蛋白的温度和pH稳定性进行了研究。结果表明,温度和pH对两种蛋白都有比较大的影响,但在生理条件(37 ℃,pH 7.0) 下,GST-SOD2融合蛋白分别持有73.7%和91.6%的酶活性,去除GST标签后,SOD2重组蛋白的温度和pH稳定性均有所增强,在37 ℃下,该蛋白具有95.7%酶活性,在pH 7−8的范围内,该蛋白基本保持100%酶活性。
GST是一个高度可溶的蛋白,可以利用它增加外源蛋白的可溶性及其在大肠杆菌中的表达量。作为常用的重组标签之一,GST天然分子量为26 kDa,与His标签要大得多,可能会对融合在一起的外源蛋白的结构和功能产生影响。本研究中两种蛋白稳定性的差异表明GST标签的融合对SOD2重组蛋白的结构产生了一定的影响,这可能也是使GST-SOD2融合蛋白表观分子量和理论分子量有所差别以及两种具有全长序列的SOD2重组蛋白同时具有酶活性但比活又有差异的原因。
Mancini等从人脂肪肉瘤细胞LSA中发现一种具有SOD2酶活性的蛋白(LSA-type-Mn-SOD),30 kDa的LSA-type-MnSOD的序列与正常的人SOD2几乎完全相同,但其N端带有完整的信号肽[10-11]。已在大肠杆菌中生产得到该蛋白的重组蛋白,并已证实这种形式的SOD2可通过N端信号肽的介导进入细胞,其在清除内部和细胞外自由基以及改善与增加的氧化应激相关的病理状况方面非常有效[12-14]。本研究得到的SOD2重组蛋白,N端带有完整的信号肽,具有成熟SOD2的酶活性,还有显著的跨膜能力,与LSA-type-MnSOD十分相似,可知其在防护氧化损伤方面具有很大的潜力。在GST-SOD2融合蛋白中,SOD2的信号肽位于两种蛋白的中间,具有成熟SOD2的酶活性,也有显著的跨膜能力,这表明该信号肽的介导跨膜能力可能像TAT穿膜肽一样,不受其在蛋白中所处的位置影响,这有待进一步的实验来证明。
GST在增加重组蛋白的可溶性之余,本身是一种在解毒过程中具有重要作用的转移酶,具有抗氧化活性,可催化亲核性的谷胱甘肽与自由基的结合反应,起到解毒作用[17-18]。
本所前期实验证实将Cu、Zn-SOD (SOD1) 和TAT融合在一起后可以进入细胞,预防细胞内的自由基过量导致的氧化损伤[19]。由于造成细胞损伤的自由基通常不只1种,我们进一步证实了将GST、穿膜肽和SOD1融合在一起得到的GST-TAT-SOD1融合蛋白比SOD1-TAT融合蛋白具有更好的放射防护效果[16],可知复合抗氧化酶的应用潜力强于单功能抗氧化酶。
与SOD2重组蛋白相比,GST-SOD2融合蛋白还具有GST活力,属于可跨膜的复合抗氧化酶。二者的SOD比活相近,但分子量相差近1倍,在相同的摩尔浓度下后者的SOD活力比前者高出近1倍。因此,GST-SOD2融合蛋白可能具有比SOD2重组蛋白更强的抗氧化损伤方面的潜力。未来将进一步对本研究中两种全长SOD2蛋白进行结构及生物效应的研究,以揭示其结构与功能的关系。
| [1] | McCord JM, Fridovich I. Superoxide dismutase: an enzymic function for erythrocuprein (hemocuprein). J Biol Chem, 1969, 244(22): 6049–6055. |
| [2] | Genova ML, Ventura B, Giuliano G, et al. The site of production of superoxide radical in mitochondrial Complex I is not a bound ubisemiquinone but presumably iron-sulfur cluster N2. FEBS Lett, 2001, 505(3): 364–368. DOI: 10.1016/S0014-5793(01)02850-2 |
| [3] | Gregory EM, Fridovich I. Oxygen toxicity and the superoxide dismutase. J Bacteriol, 1973, 114(3): 1193–1197. |
| [4] | Damiano S, Trepiccione F, Ciarcia R, et al. A new recombinant MnSOD prevents the cyclosporine A-induced renal impairment. Nephrol Dial Transplant, 2013, 28(8): 2066–2072. DOI: 10.1093/ndt/gft020 |
| [5] | Parizada B, Werber MM, Nimrod A. Protective effects of human recombinant mnsod in adjuvant arthritis and bleomycin-induced lung fibrosis. Free Radic Res Commun, 1991, 15(5): 297–301. DOI: 10.3109/10715769109105225 |
| [6] | Epperly MW, Gretton JE, Sikora CA, et al. Mitochondrial localization of superoxide dismutase is required for decreasing radiation-induced cellular damage. Radiat Res, 2003, 160(5): 568–578. DOI: 10.1667/RR3081 |
| [7] | Robbins MEC, Zhao W. Chronic oxidative stress and radiation-induced late normal tissue injury: a review. Int J Radiat Biol, 2004, 80(4): 251–259. DOI: 10.1080/09553000410001692726 |
| [8] | Zhao W, Diz DI, Robbins ME. Oxidative damage pathways in relation to normal tissue injury. Br J Radiol, 2007, 80 Spec No 1: S23-S31. http://europepmc.org/abstract/med/17704323 |
| [9] | Del Maestro R, McDonald W. Subcellular localization of superoxide dismutases, glutatione peroxidase and catalase in developing rat cerebral cortex. Mech Ageing Dev, 1989, 48(1): 15–31. DOI: 10.1016/0047-6374(89)90022-5 |
| [10] | Mancini A, Borrelli A, Schiattarella A, et al. Tumor suppressive activity of a variant isoform of manganese superoxide dismutase released by a human liposarcoma cell line. Int J Cancer, 2006, 119(4): 932–943. DOI: 10.1002/(ISSN)1097-0215 |
| [11] | Mancini A, Borrelli A, Schiattarella A, et al. Biophysical and biochemical characterization of a liposarcoma-derived recombinant MnSOD protein acting as an anticancer agent. Int J Cancer, 2008, 123(11): 2684–2695. DOI: 10.1002/ijc.v123:11 |
| [12] | Borrelli A, Schiattarella A, Mancini R, et al. A recombinant MnSOD is radioprotective for normal cells and radiosensitizing for tumor cells. Free Radic Biol Med, 2009, 46(1): 110–116. DOI: 10.1016/j.freeradbiomed.2008.10.030 |
| [13] | Rahman NA, Mori K, Mizukami M, et al. Role of peroxynitrite and recombinant human manganese superoxide dismutase in reducing ischemia-reperfusion renal tissue injury. Transplant Proc, 2009, 41(9): 3603–3610. DOI: 10.1016/j.transproceed.2009.04.008 |
| [14] | Borrelli A, Schiattarella A, Mancini R, et al. The leader peptide of a human rec. MnSOD as molecular carrier which delivers high amounts of cisplatin into tumor cells inducing a fast apoptosis in vitro. Int J Cancer, 2011, 128(2): 453–459. DOI: 10.1002/ijc.v128:2 |
| [15] | Wang F, Shao M, Yang WJ, et al. High-level soluble expression of recombinant human manganese superoxide dismutase in Escherichia coli, and its effects on proliferation of the leukemia cell. Protein Expr Purif, 2011, 77(1): 46–52. DOI: 10.1016/j.pep.2010.12.008 |
| [16] | Pan JR, He HC, Su Y, et al. GST-TAT-SOD: cell permeable bifunctional antioxidant enzyme—a potential selective radioprotector. Oxid Med Cell Longev, 2016, 2016: 5935080. |
| [17] | Douglas KT. Mechanism of action of glutathione-dependent enzymes. Adv Enzymol Relat Areas Mol Biol, 1987, 59: 103–167. |
| [18] | Leaver MJ, George SG. A piscine glutathione S-transferase which efficiently conjugates the end-products of lipid peroxidation. Mar Environ Res, 1998, 46(1/5): 71–74. |
| [19] | Pan JR, Su Y, Hou XJ, et al. Protective effect of recombinant protein SOD-TAT on radiation-induced lung injury in mice. Life Sci, 2012, 91(3/4): 89–93. |
 2017, Vol. 33
2017, Vol. 33