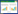中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李华祥, 陆震鸣, 朱青, 耿燕, 史劲松, 许正宏, 马延和
- Li Huaxiang, Lu Zhenming, Zhu Qing, Geng Yan, Shi Jinsong, Xu Zhenghong, Ma Yanhe
- 钙离子调控樟芝深层发酵无性产孢及其分子机制
- Effect of calcium on sporulation of Taiwanofungus camphoratus in submerged fermentation
- 生物工程学报, 2017, 33(7): 1124-1135
- Chinese Journal of Biotechnology, 2017, 33(7): 1124-1135
- 10.13345/j.cjb.170001
-
文章历史
- Received: January 3, 2017
- Accepted: February 24, 2017
2 中国科学院天津工业生物技术研究所 天津市工业生物系统与过程工程重点实验室,天津 300308
2 Tianjin Key Laboratory for Industrial Biological Systems and Bioprocessing Engineering, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
樟芝Taiwanofungus camphoratus又名牛樟芝、牛樟菇,是一种原产于台湾地区的药用真菌,具有保肝护肝、抗炎症、抗癌症、抗乙肝病毒等多种生物活性[1]。由于野生数量少、生长缓慢等原因,樟芝子实体长期供不应求。目前,深层发酵技术由于其周期短、效率高、成本低、易于规模化等优点,已成为樟芝规模化生产的重要方式[1]。已有研究通过培养基组成优化[2-3]、环境因素优化[4-5]、发酵工艺优化[6-7]或添加前体物质[8-9]等提高深层发酵樟芝活性物质的产量。
本课题组报道了樟芝在深层发酵后期合适的环境条件下会大量产生无性节孢子的现象[10],并发现以樟芝无性节孢子作为接种物,可有效缩短樟芝发酵周期,节约种子制备的时间及成本,提高发酵过程可控性与批次稳定性[11]。随后,建立了基于无性繁殖过程的樟芝循环发酵工艺,有利于樟芝活性代谢产物的高效稳定生产,同时可免去不同发酵批次种子制备的步骤[12]。但是目前对于樟芝无性产孢的分子机制尚不明确,对樟芝无性产孢过程无法实现有效控制。
真菌无性产孢受诸多环境因素的影响,包括碳源、氮源、碳氮比、光照、溶氧、钙离子(Ca2+)及pH等[13],其中Ca2+对丝状真菌无性产孢具有显著调控作用,且具有明显的浓度依赖性[14]。Roncal等[15]报道,培养基中添加1−10 mmol/L的Ca2+时,能显著促进多种青霉Penicillium深层发酵无性产孢;Li等[16]报道,50 mmol/L的Ca2+对白僵菌Beauveria bassiana的生长有抑制作用;Soriani等[17]用200 mmol/L的CaCl2对烟曲霉Aspergillus fumigatus进行10 min的短脉冲处理,发现fluG及flbA等无性产孢相关基因的表达量受到显著影响;Schumacher等[18]发现当CaCl2浓度大于300 mmol/L时,对灰霉病菌Botrytis cinerea突变株有毒性作用。但目前对于Ca2+调控丝状真菌无性产孢的分子机制尚缺乏深入研究。本文首先考察Ca2+浓度对樟芝深层发酵过程中无性产孢的影响;其次,通过双向电泳(2-DE)技术,鉴定与樟芝无性产孢过程相关的功能基因,预测樟芝无性产孢信号通路;进一步通过实时定量PCR (RT-qPCR)技术评价不同Ca2+ 浓度调控下产孢信号通路中相关基因的转录水平差异,探究Ca2+促进樟芝无性产孢的分子机制,以期为解析樟芝无性产孢分子机制提供实验依据,同时为实现发酵过程中可控产孢奠定研究基础。
1 材料与方法 1.1 材料 1.1.1 主要试剂及仪器葡萄糖、酵母粉、KH2PO4、MgSO4、HCl、丙酮、三氯乙酸(TCA)、甘油及磷酸等购自国药集团(上海);三羟甲基氨基甲烷(Tris)、尿素、十二烷基硫酸钠(SDS)、二硫苏糖醇(DTT)、碘乙酰胺(IAM)、IPG胶条(24 cm,pH 3−10)、两性电解液(pH 3−10)、低熔点覆盖琼脂糖、甘氨酸、过硫酸铵(APS)及四甲基乙二胺(TEMED)等购自美国伯乐公司(Bio-Rad);考马斯亮蓝R-250、溴酚蓝、苯甲基磺酰氟(PMSF)、30% (W/V)丙烯酰胺/甲叉双丙稀酰胺溶液(29:1)、2D电泳样品提取液Ⅲ、改良型Bradford蛋白浓度测定试剂盒、UNlQ-10柱式Trizol总RNA抽提试剂盒、M-MuLV第一链cDNA合成试剂盒及引物合成等均购自生工生物工程有限公司(上海);A-氰基-4羟基肉桂酸,三氟乙酸及乙腈等质谱分析所用购置于Sigma公司;SYBR荧光染料购自Life Technologies公司;等电聚焦仪(Ettan IPGphor 3 Isoelectric Focusing Unit)、垂直电泳设备(Ettan DALTsix Electrophoresis Unit)及扫描仪(Imagescanner)购自GE Healthcare公司;质谱分析仪(Ultra flex MALDI-TOF/TOF mass spectrometer)购自Bruker-Daltonics公司;NanoDrop 2000C分光光度计购自Thermo Scientific公司;RT-qPCR仪(CFX Connect Optics Module Real-Time System)购自Bio-Rad公司。
1.1.2 菌株樟芝菌株来自美国模式菌种保藏中心(American Type Culture Collection,USA),保藏编号为ATCC 200183。
1.1.3 培养基斜面培养基:PDA培养基;
种子培养基(W/V):葡萄糖2%、酵母粉0.1%、KH2PO4 0.3%、MgSO40.15%,pH 4.5;
发酵培养基(W/V):葡萄糖2%、酵母粉0.4%、KH2PO4 0.3%、MgSO4 0.15%,pH 4.5。
1.2 方法 1.2.1 樟芝发酵培养将PDA斜面上的樟芝菌丝接种到种子培养基中,于26 ℃、150 r/min条件下振荡培养13 d,再将发酵液于无菌条件下用4层纱布过滤,所得滤液(即孢子悬浮液)作为种子以1.0×106孢子/mL的接种量接种到装有100 mL发酵培养基的500 mL锥形瓶中,26 ℃、150 r/min振荡培养11 d。
Ca2+影响产孢实验:于发酵培养基中分别添加1、5、10、50及200 mmol/L的CaCl2,并将培养基初始pH调为4.5,振荡培养8 d,其余条件及操作同上。
1.2.2 产孢量及生物量检测将培养一定时间的发酵液用4层纱布过滤,所得滤液用血球计数板于光学显微镜下进行孢子计数并计算产孢量;所得菌丝体用去离子水清洗3遍后,烘干称重并计算生物量。每组实验设3个生物学重复。
1.2.3 总蛋白及RNA提取将发酵8 d的樟芝发酵液经4层纱布过滤,收集樟芝菌丝体,用TE缓冲液(pH 8.0) 洗涤至滤液澄清后,保存于液氮中待用。
参照相关文献[19-20]采用TCA/丙酮沉淀法提取樟芝菌丝体中的总蛋白,用改良型Bradford蛋白浓度测定试剂盒对总蛋白进行定量。用UNIQ-10柱式Trizol总RNA抽提试剂盒提取樟芝菌丝体中的总RNA,用NanoDrop 2000C分光光度计对总RNA进行浓度及质量检测。
1.2.4 双向电泳及质谱分析每个样品的蛋白上样量为600 µg,2-DE操作条件根据文献方法[19-20]略作修改:1) 胶条主动水化12 h后进行等电聚焦,程序为:0−50 V 30 min,50−100 V 30 min,100−250 V 1 h,250−500 V 1 h,500−1 000 V 1.5 h,1 000−5 000 V 2 h,5 000−10 000 V 2 h,维持10 000 V 9.5 h;2) 依次用平衡液Ⅰ (尿素36%,SDS 2%,30%甘油20%,DTT 2%,pH 8.8的Tris-HCl 50 mmol/L)和平衡液Ⅱ (尿素36%,SDS 2%,30%甘油20%,IAM 2.5%,pH 8.8的Tris-HCl 50 mmol/L)分别平衡15 min;3) 将胶条转移到12%的SDS-PAGE凝胶上,用低熔点覆盖琼脂糖覆盖后进行恒功率垂直电泳分离,程序为:2 W/gel 1 h,14 W/gel 5 h。每个样品做3个生物学重复,电泳实验重复5次。
电泳结束后,凝胶用考马斯亮蓝R-250染色,脱色处理后用扫描仪采集图像。每个样品选择分离效果较好的3张图像,并用PDQuest 8.0软件进行蛋白点定量及比较分析,将差异蛋白点(表达量较对照组上调或下调2倍以上的点)从凝胶上切下后,参照文献[19-20]进行相应的处理及质谱分析。获得的肽段信息分别与樟芝基因组数据库[21]及下载自NCBI的樟芝EST序列数据库(https://www.ncbi.nlm.nih.gov/nucest/)进行匹配,蛋白得分≥30被认为匹配成功。
1.2.5 生物信息学分析通过文献调研及NCBI数据库(https://www.ncbi.nlm.nih.gov/)检索等方式,收集与丝状真菌无性产孢相关的蛋白并构建本地蛋白数据库。将2-DE分析所得的差异蛋白序列与该本地蛋白数据库进行比对,以验证Ca2+诱导樟芝无性产孢的相关信号通路。进一步将文献报道的樟芝基因组蛋白序列[21]分别与本地蛋白数据库进行比对,获得樟芝无性产孢及Ca2+/钙调素信号通路相关的蛋白或基因,E value值≤10–6被认为匹配成功。选择所预测的樟芝Ca2+/钙调素信号通路及FluG介导产孢信号通路上23个功能基因,通过NCBI数据库上的樟芝EST序列及文献报道的樟芝全基因组序列和氨基酸序列[21],获得相应的cDNA序列并采用Beacon Designer 7.0软件设计对应的RT-qPCR引物,各引物序列详见表 1。
| Gene name | Forward (5'–3') | Reverse (5'–3') | Size (bp) |
| caM | AAGGAGGCGTTCAAGGTATTCG | ACCGTCACCATCAACATCAGC | 147 |
| cch1 | CGACACCGCCTTCCTCAAC | GTGCTGACATCACTTGTTCTCC | 178 |
| cnaA | TCTCCTTCCTCTCCCACATCC | CCTGCCATCCACTGCTTCC | 165 |
| cnaB | CGAGAAGAGAAACTACGCTTTGC | CCCGTCACCGTCCCTATCC | 177 |
| crz1 | ACGCACCATCTTGACCTTCTG | GTCCTGCCTTACCTGCTCTG | 127 |
| hsp90 | GACGACTGCGAGGACCTTATC | ACGATGTTCTTGCGGATGACC | 137 |
| mid1 | CTTCCTCAGCACTCGCATCAC | TCGTAGCCAGAGACCTTCGC | 110 |
| fluG | CCAAACCTATCACCGTCAACAATG | CGCCACCAGCCAGAAGATTATC | 114 |
| flbA | TGGCGACTGACTCTGTTCCC | CACCGATGGCGTAGATGTTCC | 134 |
| flbB | CACGCAGGATGAGCCGATG | CCGCCGTTGCCGTTACC | 168 |
| flbC | GACAACCCAAGCAAACCGAAG | TCCTCCCAGCCATTTATATCACG | 158 |
| flbD | AATGTCTGAAGGTCGTGATGCC | GCCGTATCGTTAGCCGTATGG | 126 |
| abaA | TGTGCGAGTGCGGAGACC | GTAGACGACGGACAGGAGGAC | 116 |
| brlA | ACCCGTGTGAAGGATGTAAGAAG | ACCGTGGCTGGAGAGAGTTC | 118 |
| wetA | TTTCCTGTTCCGTCCGTAAGC | GTGGTTGAGGTAGGGATTGATGG | 112 |
| ganB | GGACAGAAGAGCGAGCGTAG | TGAACCACTGCGAATGACATATTG | 172 |
| fadA | TCGGGCAAGGCAAAGATACTC | TAGGTAGCACGGAGGACAGC | 146 |
| sfaD | ACCTGTGCCTACTCACCATCC | CTTGACATTGTTGCCTTCCTTCG | 102 |
| pkaA | AGCACTCAATCCTCAGCGAATAG | TCTTGGTTACGAATGGAGCGATAG | 123 |
| stuA | GGTTGAATGCGACACAGATTTTG | TGATATTTCCCATAACCACCTTGC | 123 |
| veA | CTCGCAGTATGACAGGGATAGG | GTCGGCGGTCGGCTTTAC | 101 |
| velB | AATCGTTCTGGTCGGCATAGC | GGATAGACTTGAGCAGGATAGGC | 128 |
| vosA | GAACGCAAGAGACGCAAGAAG | CGACAGTGGAAGTAGATGAAACG | 127 |
| 18S rRNA | GCTGGTCGCTGGCTTCTTAG | CGCTGGCTCTGTCAGTGTAG | 123 |
通过NanoDrop分光光度计检测,选择质量较佳(2.0 < A260/A280 < 2.1) 的总RNA,稀释到50 ng/μL后用M-MuLV第一链cDNA合成试剂盒进行反转录,获得cDNA模板。RT-qPCR反应体系如下:SYBR染料8.5 μL,正向引物0.425 μL,反向引物0.425 μL,cDNA模板1.25 μL,ddH2O 6.4 μL;反应程序如下:50 ℃ 2 min,95 ℃预变性10 min,95 ℃ 15 s,60 ℃ 60 s,45个循环。以樟芝18 rRNA序列为内参,不添加CaCl2的樟芝菌丝体样品为对照,用2−ΔΔCt计算法[22]对基因的转录水平进行定量。每组设3个重复。
2 结果与分析 2.1 不同浓度Ca2+对樟芝无性产孢的影响首先对樟芝产孢量及生物量在该发酵过程中随发酵时间的变化情况进行了考察(图 1A)。结果表明:0−3 d为适应期,生物量较低;4−8 d为对数生长期,菌体快速生长,生物量快速增加;9 d为稳定期,生物量达到最大值;10 d之后为衰亡期,菌体自溶,生物量下降。发酵0−5 d不产孢;发酵6 d开始产孢;7−9 d为快速产孢期,大量产孢(图 1B);发酵10 d产孢量达到最大值(4.29×106 spores/mL)。由于发酵8 d的樟芝菌丝体处于快速产孢期,产孢速度最快,同时发酵8 d尚处于对数生长期末期及稳定期前期,菌体活性较强,因此,后续实验均以发酵8 d的菌丝体作为研究对象。
|
| 图 1 樟芝产孢量和生物量随发酵时间变化曲线(A)及节孢子形态(B) Figure 1 Time courses of sporulation and biomass in submerged fermentation (A), and arthroconidia (B) of T. camphoratus. |
| |
参考相关文献[15-18],我们选择在培养基中添加0−200 mmol/L的CaCl2,并在发酵8 d时取样进行产孢量检测,来考察Ca2+对樟芝深层发酵无性产孢的影响,结果如表 2所示。在0−50 mmol/L范围内,Ca2+ 浓度对樟芝发酵生物量及pH没有显著影响(P > 0.05)。但是低浓度的Ca2+ (1−10 mmol/L)能够显著促进樟芝无性产孢,而高浓度的Ca2+ ( > 50 mmol/L)则显著抑制樟芝产孢(P < 0.05)。当Ca2+添加浓度为1 mmol/L时,促进产孢效果最为显著,发酵8 d时产孢量与对照组相比提高了4倍以上;当Ca2+添加浓度为200 mmol/L时,抑制产孢效果最为显著,发酵8 d时尚未产孢。该实验结果与文献报道一致[15-18]。
| Ca2+concentration (mmol/L) | Biomass (g/L) | Sporulation (×106 spores/mL) | pH |
| 0 (Control) | 5.88±0.31b | 2.05±0.11c | 3.11±0.16a |
| 1 | 6.24±0.32b | 8.45±0.41e | 3.13±0.16a |
| 5 | 6.19±0.33b | 5.65±0.28d | 3.04±0.16a |
| 10 | 6.15±0.33b | 5.07±0.31d | 3.01±0.16a |
| 50 | 6.11±0.32b | 0.52±0.05b | 2.93±0.16a |
| 200 | 5.14±0.31a | 0.00±0.00a | 2.91±0.15a |
| Note: the cultivations were conducted in 500 mL Erlenmeyer flasks containing 100 mL of fermentation medium, which was composed of 20 g/L of glucose, 4 g/L of yeast extract, 3.0 g/L of KH2PO4, 1.5 g/L of MgSO4, with initial pH of 4.5 and inoculum size of 1.0×106 spores/mL, then incubated for 8 d at 26 ℃ by shaking at 150 r/min. Means in a column followed by different letters are significantly different (P < 0.05) by ANOVA test. | |||
为了解Ca2+促进樟芝无性产孢可能的调控基因或蛋白,本实验选择不添加Ca2+培养8 d的菌丝体(对照样品,记为“CK”)、添加1 mmol/L Ca2+培养8 d的菌丝体(促进产孢效果最显著样品,记为“1 mmol/L”)及添加200 mmol/L Ca2+培养8 d的菌丝体(抑制产孢效果最显著样品,记为“200 mmol/L”)进行2-DE分析,结果如图 2所示。“CK”样品共分离到316个蛋白点,“1 mmol/L”样品共分离到366个蛋白点,“200 mmol/L”样品共分离到293个蛋白点。通过图像分析,挖取了28个表达量差异的蛋白点(图 2,箭头所示)进行质谱鉴定。

|
| 图 2 添加不同浓度Ca2+培养的樟芝菌丝体蛋白2-DE分离结果及鉴定点 Figure 2 2-DE maps and identification spots of the proteins extracted from the mycelia which treated with different concentrations of Ca2+. "CK" means the sample which did not add any Ca2+, "1 mmol/L" means the sample which added 1 mmol/L of Ca2+, "200 mmol/L" means the sample which added 200 mmol/L Ca2+. The arrows indicate the total 28 spots selected to identify, and the cycles indicate the proteins involved in the calcineurin signaling pathway (CaM and HSP90) and FluG-mediated conidiation pathway (AbaA). |
| |
将质谱分析获得的肽段信息分别与樟芝基因组序列[21]及下载自NCBI的樟芝EST序列数据库进行匹配,结果28个蛋白点全部鉴定成功。进一步采用本地蛋白数据库进行比对,发现了3个与产孢功能相关的蛋白(6 832、2 249和1 813)。其中,蛋白点6 832匹配上的EST序列(DR027428.1) 与迷孔菌属Daedalea quercina L-15 889的热休克蛋白HSP90高度同源(E value值为7E-146,同源性87%,覆盖率99%),蛋白点2 249是Ca2+/钙调素信号通路上的关键蛋白CaM,而蛋白点1 813则是FluG介导产孢信号通路上的关键蛋白AbaA。CaM是钙调蛋白(又名钙调素),通过与Ca2+结合而被激活,进而激活钙调磷酸酶[23];AbaA是FluG介导的产孢信号通路上关键蛋白之一,它与BrlA和WetA构成了该信号通路中的中心调控途径[24]。据此结果,我们推测Ca2+影响樟芝无性产孢主要是通过Ca2+/钙调素信号通路以及FluG介导的产孢信号通路实现的。
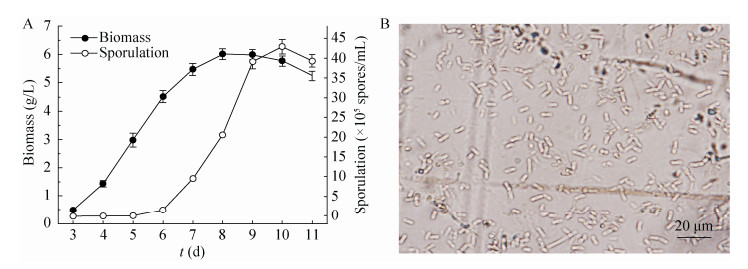
2.3 RT-qPCR分析根据文献报道的Ca2+/钙调素信号通路图[14]及FluG介导的产孢信号通图[24],我们将樟芝基因组蛋白库[21]与利用丝状真菌无性产孢相关蛋白构建的本地蛋白数据库进行比对,在樟芝中获得了目前文献报道的参与上述两条信号通路中除FlbE和GpgA外的所有蛋白。于是,我们选择在Ca2+/钙调素信号通路和FluG介导的产孢信号通路中较为关键的23个基因(cch1、mid1、caM、cnaA、cnaB、crz1、hsp90、fluG、flbA、flbB、flbC、flbD、ganB、fadA、sfaD、pkaA、brlA、abaA、wetA、stuA、veA、velB及vosA)进行转录水平分析。
将菌丝体样品“CK”、“1 mmol/L”和“200 mmol/L”中的总RNA反转录后,以18S rRNA为内参,样品“CK”为对照,分析上述23个基因在样品“1 mmol/L”和“200 mmol/L”中的表达情况(图 3)。结果表明,除了基因caM和ganB在添加低浓度Ca2+ (1 mmol/L)和高浓度Ca2+ (200 mmol/L)时表达量较对照上调外,其余21个基因均呈现出在添加低浓度Ca2+ (促进产孢)的菌丝体样品中表达量上调,添加高浓度Ca2+ (抑制产孢)的菌丝体样品中表达量下调的趋势。其中,以crz1、hsp90、flbB、brlA、abaA、wetA及fadA 7个基因的表达量变化最为显著:在促进产孢的菌丝体中表达量上调约3−9倍,在抑制产孢的菌丝体样品中表达量下调约25−80倍。因此,可以推测这7个基因在Ca2+影响樟芝深层发酵无性产孢的过程中起到了关键作用。
|
| 图 3 添加不同浓度Ca2+对相关基因表达量的影响 Figure 3 Different concentrations of Ca2+ effect on the expressions of the related genes. (A) The genes change less than 8 fold, corresponding to the left vertical axis. (B) The genes change more than 25 fold, corresponding to the right vertical axis; 18S rDNA gene of T. camphoratus was used as an internal reference. The gene expression levels in sample of "CK" were used as control, and it is meaningless to compare the expression levels of different genes in this figure. |
| |
Crz1是一个钙调磷酸酶响应的锌指蛋白,含有一个C2H2锌指结构,可以通过结合在钙调磷酸酶依赖基因的启动子区域来激活处于Ca2+/钙调素信号通路下游的基因,是Ca2+/钙调素信号通路中极其重要的1个转录因子[16];热激蛋白是生物体在胁迫条件下大量合成的一类蛋白,HSP90是其中一员,其序列高度保守,是真菌中1种重要的分子伴侣,参与真菌细胞壁成分合成、无性产孢及侵染等[14, 25];FlbB是1个bZip (Basic leucine zipper)类转录因子,也是FluG介导的产孢信号通路中的上游调节因子之一,其主要作用是激活flbD基因,而FlbD为激活brlA所必需[26];FadA是G蛋白三聚体中的α亚基,其主要作用是通过pkaA抑制brlA的表达[24];brlA基因编码一个转录因子,是FluG介导的产孢信号通路中心调控途径的第一个基因,它主要编码两个C2H2锌指结构,并通过该锌指结构激活abaA[24];abaA基因也编码一个转录因子,由BrlA所激活,其编码的蛋白AbaA含有一个ATTS/TEA DNA结合域,为激活wetA所必需[27];wetA是FluG介导的产孢信号通路中心调控途径中的最后一个基因,由AbaA所激活,直接诱导产孢行为的发生,并参与细胞壁中海藻糖的合成,促进孢子成熟[24]。
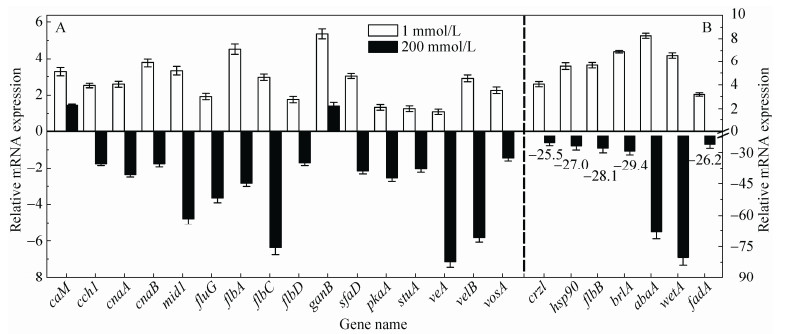
2.4 樟芝无性产孢信号通路模型图的预测Ca2+/钙调素信号通路在真菌的应激反应、抗药性、营养生长、形态控制、无性产孢及侵染等过程中起着重要作用[14]。Ca2+/钙调素信号通路主要包括钙通道蛋白(Cch1和Mid1)、钙调素/钙调蛋白(Calmodulin,CaM)、钙调磷酸酶(Calcineurin)、热激蛋白(如HSP90) 及转录因子(如Crz1) 等[14, 17]。其中,钙调蛋白会与细胞质中的Ca2+结合形成复合体,它是主要的Ca2+信号传感器[23];钙调磷酸酶是1个高度保守的蛋白,也是目前真菌中唯一被鉴定的受Ca2+和CaM调控的磷酸化酶,其主要受体是Crz1。当细胞质中的Ca2+浓度增加时,钙调磷酸酶被Ca2+/CaM复合体激活[14, 28]。钙调磷酸酶被激活时,调节亚基CnaB参与激活催化亚基CnaA,而催化亚基CnaA是钙调蛋白CaM的结合位点[17]。
FluG介导的产孢信号通路是真菌中一条常见的产孢信号通路,该通路主要由两部分组成,即上游调控途径(FluG、FlbA、FlbB、FlbC、FlbD及FlbE等)和中心调控途径(BrlA、AbaA及WetA)组成[24]。FluG在营养生长阶段逐渐积累,当积累到一定浓度或受产孢信号诱导时,便通过移除阻遏因子SfgA的形式来激活上游调节因子FlbA、FlbB或FlbC[29]。随后,FlbA通过抑制G蛋白调控信号通路间接促进brlA表达,而FlbB进一步激活flbD,FlbD和FlbC共同作用激活brlA,从而进入FluG介导的产孢信号通路中心调控途径并最终导致产孢[24]。
根据上述2-DE和RT-qPCR实验结果以及相关文献报道[14, 17-18, 23-24, 26, 29-30],我们预测了樟芝Ca2+/钙调素和FluG介导的樟芝无性产孢信号通路模型图,如图 4所示。环境中的Ca2+通过钙通道蛋白(Cch1和Mid1) 进入细胞质与钙调蛋白(CaM)结合形成Ca2+-CaM复合体后激活钙调磷酸酶,同时热休克蛋白大量合成。后续作用机制可由RT-qPCR分析结果推测:1) 基因abaA的表达量变化极为显著(上调8倍以上或下调70倍以上),激活abaA的上游基因brlA编码2个C2H2锌指结构,而转录因子crz1也编码1个锌指结构,因此,我们认为crz1的作用与brlA类似,可直接激活abaA;2) 基因flbB和brlA的表达量变化也较为显著(上调6倍以上或下调28倍以上),据文献报道[16-17],flbA、flbB和flbC都是cnaA或crz1的下游基因,因此,我们认为钙调磷酸酶直接或间接地作用于flbA、flbB和flbC并促进其表达,进而达到促进brlA表达的目的。因此,我们认为brlA表达量的显著变化不是钙调磷酸酶直接作用的结果,而是由flbB/flbC/flbD表达量的变化所致;3) G蛋白α亚基基因fadA表达量变化亦较为显著(上调3倍以上或下调25倍以上)。因为flbA和fadA的作用是相反的,因此,我们认为钙调磷酸酶是通过促进flbA表达来抑制G蛋白调节信号通路,最终减弱该通路抑制产孢的作用而达到促进产孢的效果;4) 基因wetA的表达量变化也极为显著(上调6倍以上或下调80倍以上),但由于wetA直接受abaA调控,因此,我们认为wetA基因表达量的显著变化是由abaA表达量的变化引起的。此外,WetA参与合成细胞壁组成成分且与孢子成熟有关,HSP90也与细胞壁的完整性有关,因此,我们认为HSP90和WetA一样,也起到促进孢子成熟的作用。
|
| 图 4 Ca2+/钙调素和FluG介导的樟芝无性产孢信号通路模型图 Figure 4 Proposed model for Ca2+/calmodulin-and FluG-mediated submerged conidiation in T. camphoratus. |
| |
本文报道了Ca2+浓度显著影响樟芝深层发酵无性产孢的现象,且具有明显的浓度依赖性,当添加浓度为1 mmol/L时,发酵8 d产孢量较对照提高4倍以上。通过对添加不同浓度Ca2+培养的樟芝菌丝体进行2-DE分析,获得了HSP90、CaM及AbaA 3个产孢功能相关蛋白;采用RT-qPCR技术,对Ca2+/钙调素信号通路及FluG介导无性产孢信号通路上23个功能基因的转录水平进行了分析,发现了受Ca2+调控最为灵敏的7个产孢相关功能基因:crz1、hsp90、flbB、brlA、abaA、wetA及fadA。进而预测了Ca2+促进樟芝无性产孢的信号通路模型:环境中的Ca2+通过钙通道蛋白(Cch1和Mid1) 进入细胞质与钙调蛋白(CaM)结合形成Ca2+-CaM复合体并激活钙调磷酸酶,同时热休克蛋白大量合成。转录因子编码基因crz1被钙调磷酸酶激活后直接作用于abaA基因并促进其表达;钙调磷酸酶或HSP90直接或间接地促进产孢上游调控途径中的flbA、flbB和flbC基因表达,进而促进brlA基因表达或抑制G蛋白介导的信号通路,最终达到促进产孢的效果;HSP90和WetA参与细胞壁组分的合成,都能促进孢子成熟。本研究结果为解析樟芝无性产孢机制提供了实验依据。
| [1] | Lu MC, El-Shazly M, Wu TY, et al. Recent research and development of Antrodia cinnamomea. Pharmacol Therapeut, 2013, 139(2): 124–156. DOI: 10.1016/j.pharmthera.2013.04.001 |
| [2] | Chang CY, Lee CL, Pan TM. Statistical optimization of medium components for the production of Antrodia cinnamomea AC0623 in submerged cultures. Appl Microbiol Biotechnol, 2006, 72(4): 654–661. DOI: 10.1007/s00253-006-0325-6 |
| [3] | Lu ZM, Lei JY, Xu HY, et al. Optimization of fermentation medium for triterpenoid production from Antrodia camphorata ATCC 200183 using artificial intelligence-based techniques. Appl Microbiol Biotechnol, 2011, 92(2): 371–379. DOI: 10.1007/s00253-011-3544-4 |
| [4] | Yang FC, Huang HC, Yang MJ. The influence of environmental conditions on the mycelial growth of Antrodia cinnamomea in submerged cultures. Enzyme Microb Technol, 2003, 33(4): 395–402. DOI: 10.1016/S0141-0229(03)00136-4 |
| [5] | Lin ES, Wang CC, Sung SC. Cultivating conditions influence lipase production by the edible Basidiomycete Antrodia cinnamomea in submerged culture. Enzyme Microb Technol, 2006, 39(1): 98–102. DOI: 10.1016/j.enzmictec.2005.10.002 |
| [6] | Liu CJ, Chiang CC, Chiang BH. The elicited two-stage submerged cultivation of Antrodia cinnamomea for enhancing triterpenoids production and antitumor activity. Biochem Eng J, 2012, 64: 48–54. DOI: 10.1016/j.bej.2012.03.003 |
| [7] | Zhang H, Hu YD, Lu RQ, et al. Integrated strategy of pH-shift and glucose feeding for enhanced production of bioactive Antrodin C in submerged fermentation of Antrodia camphorata. J Ind Microbiol Biotechnol, 2014, 41(8): 1305–1310. DOI: 10.1007/s10295-014-1460-1 |
| [8] | Hu YD, Zhang H, Lu RQ, et al. Enabling the biosynthesis of Antroquinonol in submerged fermentation of Antrodia camphorata. Biochem Eng J, 2014, 91: 157–162. DOI: 10.1016/j.bej.2014.08.012 |
| [9] | Ma TW, Lai YT, Chen LT, et al. The cultivation strategy of enhancing triterpenoid production in submerged cultures of Antrodia cinnamomea by adding monoterpenes. J Taiwan Inst Chem Eng, 2016, 58: 210–218. DOI: 10.1016/j.jtice.2015.07.001 |
| [10] | Geng Y, He Z, Lu ZM, et al. Antrodia camphorata ATCC 200183 sporulates asexually in submerged culture. Appl Microbiol Biotechnol, 2013, 97(7): 2851–2858. DOI: 10.1007/s00253-012-4513-2 |
| [11] | Lu ZM, He Z, Li HX, et al. Modified arthroconidial inoculation method for the efficient fermentation of Antrodia camphorata ATCC 200183. Biochem Eng J, 2014, 87: 41–49. DOI: 10.1016/j.bej.2014.03.020 |
| [12] | Li HX, Lu ZM, Geng Y, et al. Efficient production of bioactive metabolites from Antrodia camphorata ATCC 200183 by asexual reproduction-based repeated batch fermentation. Bioresour Technol, 2015, 194: 334–343. DOI: 10.1016/j.biortech.2015.06.144 |
| [13] | Steyaert JM, Weld RJ, Mendoza-Mendoza A, et al. Reproduction without sex: conidiation in the filamentous fungus Trichoderma. Microbiology, 2010, 156(10): 2887–2900. DOI: 10.1099/mic.0.041715-0 |
| [14] | Juvvadi PR, Lamoth F, Steinbach WJ. Calcineurin as a multifunctional regulator: unraveling novel functions in fungal stress responses, hyphal growth, drug resistance, and pathogenesis. Fungal Biol Rev, 2014, 28(2): 56–69. |
| [15] | Roncal T, Ugalde U. Conidiation induction in Penicillium. Res Microbiol, 2003, 154(8): 539–546. DOI: 10.1016/S0923-2508(03)00168-2 |
| [16] | Li F, Wang ZL, Zhang LB, et al. The role of three calcineurin subunits and a related transcription factor (Crz1) in conidiation, multistress tolerance and virulence in Beauveria bassiana. Appl Microbiol Biotechnol, 2015, 99(2): 827–840. DOI: 10.1007/s00253-014-6124-6 |
| [17] | Soriani FM, Malavazi I, da Silva Ferreira ME, et al. Functional characterization of the Aspergillus fumigatus CRZ1 homologue, CrzA. Mol Microbiol, 2008, 67(6): 1274–1291. DOI: 10.1111/mmi.2008.67.issue-6 |
| [18] | Schumacher J, de Larrinoa IF, Tudzynski B. Calcineurin-responsive zinc finger transcription factor CRZ1 of Botrytis cinerea is required for growth, development, and full virulence on bean plants. Eukaryot Cell, 2008, 7(4): 584–601. DOI: 10.1128/EC.00426-07 |
| [19] | Lin YL, Wen TN, Chang ST, et al. Proteomic analysis of differently cultured endemic medicinal mushroom Antrodia cinnamomea T.T. Chang et W.N. Chou from Taiwan. Int J Med Mushrooms, 2011, 13(5): 473–482. DOI: 10.1615/IntJMedMushr.v13.i5 |
| [20] | Xu WN, Wang JJ, Li Q. Comparative proteome and transcriptome analysis of lager brewer's yeast in the autolysis process. FEMS Yeast Res, 2014, 14(8): 1273–1285. DOI: 10.1111/fyr.2014.14.issue-8 |
| [21] | Lu MY, Fan WL, Wang WF, et al. Genomic and transcriptomic analyses of the medicinal fungus Antrodia cinnamomea for its metabolite biosynthesis and sexual development. Proc Natl Acad Sci USA, 2014, 111(44): 4743–4752. DOI: 10.1073/pnas.1417570111 |
| [22] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [23] | Chen YL, Kozubowski L, Cardenas ME, et al. On the roles of calcineurin in fungal growth and pathogenesis. Curr Fungal Infect Rep, 2010, 4(4): 244–255. DOI: 10.1007/s12281-010-0027-5 |
| [24] | Park HS, Yu JH. Developmental regulators in Aspergillus fumigatus. J Microbiol, 2016, 54(3): 223–231. DOI: 10.1007/s12275-016-5619-5 |
| [25] | Bui DC, Lee Y, Lim JY, et al. Heat shock protein 90 is required for sexual and asexual development, virulence, and heat shock response in Fusarium graminearum. Sci Rep, 2016, 6: 28154. DOI: 10.1038/srep28154 |
| [26] | Oiartzabal-Arano E, Perez-de-Nanclares-Arregi E, Espeso EA, et al. Apical control of conidiation in Aspergillus nidulans. Curr Genet, 2016, 62(2): 371–377. DOI: 10.1007/s00294-015-0556-0 |
| [27] | Tao L, Yu JH. AbaA and WetA govern distinct stages of Aspergillus fumigatus development. Microbiology, 2011, 157(2): 313–326. DOI: 10.1099/mic.0.044271-0 |
| [28] | Stathopoulos-Gerontides A, Guo JJ, Cyert MS. Yeast calcineurin regulates nuclear localization of the Crz1p transcription factor through dephosphorylation. Gene Dev, 1999, 13(7): 798–803. DOI: 10.1101/gad.13.7.798 |
| [29] | Lee MK, Kwon NJ, Lee IS, et al. Negative regulation and developmental competence in Aspergillus. Sci Rep, 2016, 6: 28874. DOI: 10.1038/srep28874 |
| [30] | Park HS, Yu JH. Genetic control of asexual sporulation in filamentous fungi. Curr Opin Microbiol, 2012, 15(6): 669–677. DOI: 10.1016/j.mib.2012.09.006 |
 2017, Vol. 33
2017, Vol. 33