中国科学院微生物研究所、中国微生物学会主办
文章信息
- 黄磊, 赵婷婷, 贺赟, 刘一琳, 刘畅, 靳大耀, 贾晓强
- Huang Lei, Zhao Tingting, He Yun, Liu Yilin, Liu Chang, Jin Dayao, Jia Xiaoqiang
- 两株绿脓杆菌对石油污染土壤的修复作用
- Bioremediation of oil-contaminated field by two Pseudomonas aeruginosa strains
- 生物工程学报, 2017, 33(6): 957-967
- Chinese Journal of Biotechnology, 2017, 33(6): 957-967
- 10.13345/j.cjb.160472
-
文章历史
- Received: December 8, 2016
- Accepted: March 20, 2017
近年来,随着社会的高速发展和科技的不断进步,石油产品逐渐成为能源工业的主要原料,且人们对于石油产品的需求也越来越高。以我国为例,2012年全年石油消耗量为4.7亿t,2015年增长到5.43亿t,2016年石油消耗量更是达到5.56亿t,预计2017年石油全年消耗量将高达5.8亿t。随着石油的大量开采利用,且受到工艺和技术水平的限制以及突发事故的影响,不可避免地导致大量的石油以及含油的废渣废水进入到环境中,造成严重的环境危害,影响生态平衡[1-3]。
石油污染的修复技术有很多,如化学修复、物理修复、生物修复等。其中生物修复是指利用生物特别是微生物来催化降解环境污染物,减小或最终消除环境污染的受控或自发过程,是在微生物降解基础上发展起来的新兴环保技术[4-7]。由于生物修复具有投资小、操作简单、不易产生二次污染等优点,已成为一种经济效益和环境效益俱佳的修复石油污染土壤或水体的有效手段[8]。
1 材料与方法 1.1 石油烃降解菌筛选及优化 1.1.1 菌株筛选从天津滨海新区大港油田,采集矿井周围有明显溢油的土壤,采样点6处,土样总重约100 g,用封口袋封装留存。将土样加入含有以0.5%原油为单一碳源的无机盐培养基中,30 ℃、220 r/min条件下驯化培养;1周后,可见摇瓶内原油有明显降解。弃上清液,加入经高温灭菌含1%原油的无机盐培养基100 mL,继续在30 ℃、220 r/min下250 mL摇瓶培养,重复2-3次。稀释、倒平板、涂板、划线、恒温培养后挑取单菌落,4 ℃保藏[9]。
所用培养基配方:Tryptic Soy Broth (TSB)培养基,蛋白胨17 g;大豆蛋白3 g;NaCl 5 g;葡萄糖2.5 g;K2HPO4 2.5 g,加入1 L去离子水制成液体培养基。无机盐培养基(Minimal medium, MM),NH4NO3 1 g;NaCl 1 g;KH2PO4 1 g;K2HPO4 1 g;MgSO4·7H2O 0.2 g;CaCl2 0.02 g;FeCl3(或FeSO4):0.05 g,加入1 L去离子水制成液体培养基。向100 mL MM培养液中加1 g原油即原油降解培养基。液体培养基中加入质量分数2%的琼脂即可制得固体培养基。
1.1.2 协同降油能力实验在100 mL MM液体培养基中添加1% (W/V)的初始原油(1 g),分为3组进行实验,每组实验的接种量均为1 mL。即第1组单独添加6.32×10-2 mg/mL的实验室筛得,命名为绿脓杆菌SA1 (Pseudomonas aeruginosa SA1) 种子液1 mL,第2组添加细胞浓度为6.32×10-2 mg/mL实验室筛得,命名为绿脓杆菌WB2 (Pseudomonas aeruginosa WB2) 种子液1 mL,第3组为混菌体系(绿脓杆菌SA1/绿脓杆菌WB2),细胞浓度均为6.32×10-2 mg/mL种子液1 mL。在30 ℃、200 r/min的条件下培养10 d之后,测量各组的原油降解率[10]。
1.2 菌剂制备根据摇瓶降解实验结果,选取绿脓杆菌SA1/绿脓杆菌WB2两菌组合制备混合菌剂。具体方法是首先分别将单菌SA1和WB2在100 mL的TSB培养基中活化48 h,再将种子液浓缩至40 mL加入160 mL无菌水混匀,然后倒入200 mL/瓶121 ℃的灭菌20 min的固态培养基中混匀,30 ℃培养若干天,分别得到菌种SA1、WB2单一菌剂。将2种单一菌剂分别用草炭稀释到相同的细菌数量级(107 CFU/g),再等质量混匀即制得混合菌剂。其中固态培养基的配方为麸皮、草炭、蒸馏水,质量比为1:1:1。
1.3 场地试验在天津滨海某地选取总面积约40 m2场地,分为3组依次编号,展开溢油修复试验。场地填充砾石、砂、粉砂、粘土(百分比为:砾石(G)0.00;砂(S)8.78;粉砂(T)50.3;粘土(Y)40.90) 作为基质[11]。为模拟原油污染岸线,分别量取7.0 kg原油放入塑料容器中,再加入7.0 L柴油,快速搅拌至原油均匀分散后喷洒到各长为4.5 m、宽为3 m的修复场地,至每克土壤含油率为0.8% (W/W)左右,依据相关标准(GB15618-2008),此时土壤属于严重污染类型。本实验为双因素单水平[30]:控制因素为是否添加混合石油烃降解菌剂及有机肥(表 1)。其中,l号场地为对照组,需向其中添加水溶性肥料(NH4NO3 2.0 kg;KH2PO4 0.4 kg),混匀后铺撒;其余两个场地为实验组,依次编号为2、3,与1号相比需额外添加1.0 kg的混合菌剂,混匀后铺撒;此外,3号需均匀铺撒2.0 kg的有机肥,未分解的中间产物和无机酸根可作为微生物降解石油烃的电子受体[12]。并且每个场地分别插入温度电极,实时记录温度变化情况。
| Classification | Crude oil (kg) | Diesel (L) | Initial nutrient salt | Bacterium agent (kg) | Organic fertilizer (kg) | |
| NH4NO3 (kg) | KH2PO4 (kg) | |||||
| Site 1 | 7.0 | 7.0 | 2.0 | 0.4 | 0 | 0 |
| Site 2 | 7.0 | 7.0 | 2.0 | 0.4 | 1.0 | 0 |
| Site 3 | 7.0 | 7.0 | 2.0 | 0.4 | 1.0 | 2 |
为使所获得的样品具有代表性,在每一实验场地间隔均等距离选取3个样点,编号A、B、C。用柱状采样器分别采集直径为5 cm、厚度为5 cm的柱状样,混匀后均分成4部分,每周取样1次,用于各个指标的检测。
1.4.2 细菌计数方法采用细菌瓶法测试。即用分析天平称取10 g样品加入到装有100 mL灭菌的无机盐培养基的250 mL三角瓶中,振荡15 min,静置5 min,得到10-2浓度的稀释菌液,然后将稀释菌液用无菌注射器逐级注入试剂瓶中(每次注射量1 mL),稀释后进行培养,直到最后一个细菌瓶无菌生长为止,根据生长指示和稀释倍数计算出细菌的数目。其中以细菌瓶内培养液变浑浊并出现乳化现象、颜色由红变黄为生长指示,37 ℃恒温培养箱培养5 d后,按MPN法进行计数[13]。
1.4.3 土样石油烃含量测试使用气相色谱工作站对样品中石油烃含量进行分析,具体做法是首先取10 g烘干的土样置于小烧杯中,加入适量的正己烷进行多次萃取,萃取液转移至干净的烧杯中,然后在通风橱放置一段时间,待正己烷挥发后,烧杯中残留的即为土样中所含的石油烃,然后方可进行色谱测试[10]。
2 结果与分析 2.1 石油烃降解菌鉴定实验筛选得到两株具有降解石油能力的菌株分别命名为SA1 (菌种保藏编号:CGMCC No.12142)、WB2 (菌种保藏编号:CGMCC No.12141),提取基因组,16S rDNA PCR扩增得到相关序列,通过邻接法分别构建了菌株和同源性较高的菌株的系统进化树[5, 14-15]。由图 1A可知,和菌株SA1同源性最高的都属于绿脓杆菌Pseudomonas aeruginosa,同源性达到99%,由B图可知,和菌株WB2同源性最高的也都属于绿脓杆菌,同源性达到99%。

|
| 图 1 菌株SA1和WB2 16S rRNA基因序列系统进化树 Figure 1 Phylogenetic tree based on 16S rRNA gene sequence of strain SA1 and strain WB2. (A) Strain SA1. (B) Strain WB2. |
| |
结合形态鉴定并根据16S rRNA序列,鉴定菌株SA1为绿脓杆菌,菌株WB2为绿脓杆菌。
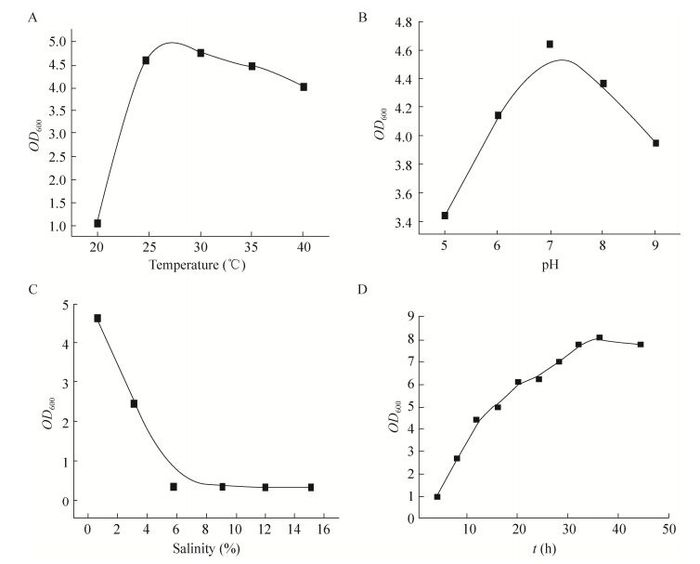
同时对分离得到两株菌在TSB培养基下的生长特性进行了研究,如图 2、图 3所示。图 2表示菌株SA1在TSB培养基下的生长特性,其中A、B、C、D依次表示温度曲线、pH曲线、盐浓度曲线及最适条件下菌株生长曲线。从图中可知,菌株SA1生长的最适温度、酸碱度和盐浓度依次为28 ℃、pH 7和0.5% NaCl。并且,在最适条件下SA1 35 h生长曲线到达稳定期。图 3表示菌株WB2在TSB培养基下的生长特性,由图可知WB2生长的最适温度、酸碱度和盐浓度依次为35 ℃、pH 7和2% NaCl,且在最适条件下18 h生长曲线到达稳定期。
|
| 图 2 菌株SA1生长特性 Figure 2 Growth characteristics of strain SA1. (A) Temperature chart. (B) pH chart. (C) Salinity chart. (D) Growth curve chart. |
| |

|
| 图 3 菌株WB2生长特性 Figure 3 Growth characteristics of strain WB2. (A) Temperature chart. (B) pH chart. (C) Salinity chart. (D) Growth curve chart. |
| |
在无机盐培养基中添加1% (W/V)的初始原油(1 g),分为3组进行实验,每组实验的接种量均为1 mL。实验发现两菌混合10 d原油几乎完全降解,气相色谱检测降解率达到95.67%,比活力为1.51×103 mg/mg,即每毫克菌体降解1.51×103 mg原油。并且肉眼可见培养基中产生大量气泡。然而,单菌培养情况下,WB2原油降解率65.34%,比活力为1.03×103 mg/mg。SA1原油降解率仅为26.71%,比活力为4.2×102 mg/mg。各体系对原油的降解能力如图 4所示。针对混合实验组展开进一步研究:将实验结束后的培养基取样离心、细胞重新悬浮,加入到0.5%体积比的原油培养基中进行降解发现只有少部分的石油烃被降解,降解效率与单菌SA1相当,远远低于混合菌群。然后,在细胞悬液之中分别重新加入WB2、SA1发现,加入SA1的菌群对原油降解能力没有明显变化,然而加入WB2的混合菌群重新获得了降解石油污染物的能力并且降解过程中随着生物表面活性剂的产生而出现大量气泡。这说明在上步实验的最后,能有效降解石油污染物的菌株WB2在培养体系中含量很少,而存活的细胞主要是SA1,并且菌株SA1生长过程中产生大量表面活性剂。

|
| 图 4 各体系对原油的降解能力 Figure 4 The crude oil removal ratio of different strains. |
| |
根据以上实验结果及文献考察,推断协同降解机理可能为:菌株SA1生长过程中产生大量表面活性剂,这些表面活性物质降低了培养体系中的表面张力,使细胞与底物的接触变得容易,降解酶活性增强,促进WB2对原油的降解以及菌株WB2的进一步生长[16-17],即菌株SA1和WB2对原油降解具有协同作用[18-20]。
2.3 场地试验结果分析 2.3.1 温度变化温度是决定微生物种群和数量的重要环境因子,对于好氧菌来说最佳的石油降解温度一般认为在15-30 ℃之间[13]。试验过程中,各试验池基质的表层温度随时间的变化基本一致,这主要是由现场气温所决定。由于中试时间选在7、8月份进行,在整个试验周期内,3个试验场地的温度均随着环境温度的变化而波动,温度大致维持在30 ℃上下浮动,处于好养石油烃降解菌适宜生长的温度范围内(如图 5是每天上午10时记录值)。

|
| 图 5 实验过程中温度变化情况(上午10时) Figure 5 The temperature change during the experiment. |
| |
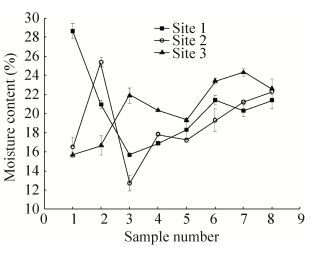
环境介质中的水分条件是影响微生物活性的重要因素之一,适宜的水分环境能够促进微生物的生长,反之,对微生物的生长产生抑制作用[21-22]。实验过程中每周取样1次,采用烘干法测试每个样品的含水率,从而估计试验过程中菌体生长的水分环境。试验过程中各场地的土壤含水率在15%-30%之间浮动(图 6),能够保证石油烃降解菌正常的生长繁殖。
|
| 图 6 场地水分条件变化情况 Figure 6 The moisture content change during the experiment. |
| |
环境介质的pH是影响微生物活性的重要因素之一[23]。一般认为,环境中好氧石油烃降解菌的适宜pH范围为6.5-9.0[13],但石油烃降解菌的活性也会影响基质中的pH,这主要是由于微生物在好氧代谢石油烃污染物过程中,会产生较多的长链或短链的有机酸等中间产物,并最终氧化成CO2,这都可能导致基质pH的降低[6, 24-25]。这表明,基质pH的高低,也可以从侧面反映微生物的活性。在60 d的修复时间内,各试验场地的pH波动不大,基本保持在6.70-7.35之间,图 7可知试验2、3土样pH值略低于试验1。

|
| 图 7 实验过程中基质pH的变化情况 Figure 7 The pH change during the experiment. |
| |
实验过程中3块场地土壤初始石油烃降解菌密度约为100个/g (图 8),随着原油的添加,3个场地石油烃降解菌菌数均增加,其中相较于2、3号场地,1号在额外补充碳源氮源的情况下仅有少量土著菌能利用原油缓慢生长,石油降解菌菌数增加较为缓慢,实验过程中达到的最高值仅为2.5×103个/g;2号、3号场地实验过程中每克土样中菌数增加明显,菌密度能够维持在5×104个/g,且由于添加了额外的有机肥,3号场地增加的幅度要高于2号。

|
| 图 8 石油烃降解菌密度变化 Figure 8 Density variation of petroleum hydrocarbon degrading bacteria. |
| |
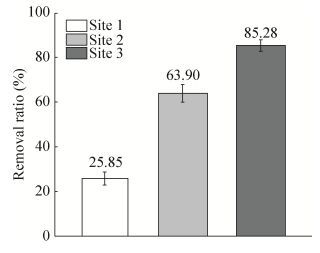
实验过程中由于原油的添加,石油烃降解菌的生长,各场地每克土壤中石油烃的含量均呈下降趋势,其中试验1未添加外来菌剂,但由于土著石油烃降解菌的生长利用原油,导致石油烃含量缓慢降低,每克土壤的含油率由最初的0.8% (W/W)左右降至0.6% (W/W)左右,降解率将近30%;而试验2、3由于添加了高效石油烃降解菌剂,石油烃含量下降趋势明显快于试验1,且60 d后总石油烃降解率分别达到63.9%、85.2%。
随着试验的进行,3块场地的总石油烃含量均出现下降趋势,其中相比于试验1,试验2、3场地土壤中总石油烃含量下降的趋势更为明显(图 9);经土壤中微生物的生长代谢作用,相较于试验1,添加外源菌剂的试验2、3土壤中总石油烃降解率明显要高一些(图 10)。与初始土样相比试验2、3土样色谱图峰的个数减少及峰值明显减小(图 11),这意味着随着试验的进行大多数石油烃组分被降解。此时试验3土壤多环芳烃总量 < 10 mg/kg,达到农业用地标准[30]。

|
| 图 9 各个场地样品石油烃含量的变化 Figure 9 The variation of total petroleum hydrocarbon ratio in samples of each site. |
| |
|
| 图 10 不同试验场地第60天的总石油烃降解率 Figure 10 The degrading ratio of total petroleum hydrocarbon in each site after sixty days. |
| |

|
| 图 11 初始与60 d后土样气相色谱图 Figure 11 The comparison figure of gas chromatogram about soil samples. |
| |
生物修复技术是一种经济效益和环境效益俱佳的治理石油污染土壤或水体的有效手段[4-5, 22, 26]。本文从矿井周围溢油污染土样中筛得两株石油烃降解菌,分别命名为WB2及SA1,保藏编号为CGMCC No.12141、CGMCC No.12142。根据16S rDNA序列与Ezbiocloud数据库内序列比对结果可知,两株均属于绿脓杆菌Pseudomonas aeruginosa。通过摇瓶降解实验发现将两株菌混合后原油的降解能力达到95.67%,比单菌降解提高了至少32%,这表明两株菌具有协同降油能力。
为了进一步模拟环境条件下微生物对石油污染土壤的修复情况,我们在滨海某地人工构建了石油污染场地,并且根据协同实验结果制备了混合修复菌剂,展开中试场地现场试验,模拟不同的操作条件下土壤中原油的降解情况,修复60 d后发现,由于土著微生物的生长代谢利用原油,导致未添加菌剂的场地石油烃含量缓慢降低,由最初的0.8%左右降至0.6%左右,降解率达到30%;而添加了菌剂的场地,石油烃含量下降趋势明显,每克土壤中石油烃含量降至0.1%-0.3%,其中额外添加有机肥作为补充碳氮源的场地,总石油烃降解率最高,达到85.28%,达到农业用地标准[30]。
绿脓杆菌在自然界分布广泛,为土壤中存在的最常见的细菌之一。各种水、空气、正常人的皮肤、呼吸道和肠道等都有此菌存在。绿脓杆菌在环境中大量存在,由于其对石油烃降解能力突出,在国内外被广泛应用于石油污染物降解研究,如Varjani等[27-28]利用绿脓杆菌Pseudomonas aeruginosa NCIM 5514生产表面活性剂,并且发现此菌可以降解C8-C36降解率达到60%;Pugazhendi等[29]利用绿脓杆菌Pseudomon asaeruginosa strain CEES1与芽孢杆菌Bacillus thermosaudiastrain CEES2混合菌群10 d使90% PAH (1.5 g/L)降解。本实验仅研究了环境条件下微生物对石油污染土壤的修复情况,试验过程中微生物群落变化及菌株间协同关系机理需要进一步研究。
| [1] | Shahi A, Aydin S, Ince B, et al. Reconstruction of bacterial community structure and variation for enhanced petroleum hydrocarbons degradation through biostimulation of oil contaminated soil. Chem Eng J, 2016, 306: 60–66. DOI: 10.1016/j.cej.2016.07.016 |
| [2] | Al Shami A, Harik G, Alameddine I, et al. Risk assessment of oil spills along the Mediterranean coast: a sensitivity analysis of the choice of hazard quantification. Sci Total Environ, 2017, 574: 234–245. DOI: 10.1016/j.scitotenv.2016.09.064 |
| [3] | Haghollahi A, Fazaelipoor MH, Schaffie M. The effect of soil type on the bioremediation of petroleum contaminated soils. J Environ Manage, 2016, 180: 197–201. DOI: 10.1016/j.jenvman.2016.05.038 |
| [4] | Hentati D, Chebbi A, Loukil S, et al. Biodegradation of fluoranthene by a newly isolated strain of Bacillus stratosphericus from Mediterranean seawater of the Sfax fishing harbour, Tunisia. Environ Sci Pollut Res, 2016, 23(15): 15088–15100. DOI: 10.1007/s11356-016-6648-7 |
| [5] | Silva-Castro GA, Rodelas B, Perucha C, et al. Bioremediation of diesel-polluted soil using biostimulation as post-treatment after oxidation with Fenton-like reagents: assays in a pilot plant. Sci Total Environ, 2013, 445-446: 347–355. DOI: 10.1016/j.scitotenv.2012.12.081 |
| [6] |
Yang Q, Wu ML, Nie MQ, et al. Effects and biological response on bioremediation of petroleum contaminated soil.
Environ Sci, 2015, 36(5): 1856–1863.
(in Chinese). 杨茜, 吴蔓莉, 聂麦茜, 等. 石油污染土壤的生物修复技术及微生物生态效应. 环境科学, 2015, 36(5): 1856-1863. |
| [7] |
Ren HF, Shan DC, Li SQ. Study progress on microbial remedy technology for contaminated soil by petroleum.
J Northeast Agric Univ, 2004, 35(3): 373–376.
(in Chinese). 任华锋, 单德臣, 李淑芹. 石油污染土壤微生物修复技术的研究进展. 东北农业大学学报, 2004, 35(3): 373-376. |
| [8] |
Lu XX, Li XL, Ma J, et al. Enhanced bioremediation of coking plant soils contaminated with polycyclic aromatic hydrocarbons.
Environ Sci, 2011, 32(3): 864–869.
(in Chinese). 卢晓霞, 李秀利, 马杰, 等. 焦化厂多环芳烃污染土壤的强化微生物修复研究. 环境科学, 2011, 32(3): 864-869. |
| [9] | Pacwa-Płociniczak M, Płociniczak T, Iwan J, et al. Isolation of hydrocarbon-degrading and biosurfactant-producing bacteria and assessment their plant growth-promoting traits. J Environ Manage, 2016, 168: 175–184. DOI: 10.1016/j.jenvman.2015.11.058 |
| [10] | Chen Y, Li C, Zhou ZX, et al. Enhanced biodegradation of alkane hydrocarbons and crude oil by mixed strains and bacterial community analysis. Appl Biochem Biotechnol, 2014, 172(7): 3433–3447. DOI: 10.1007/s12010-014-0777-6 |
| [11] |
He YX, Shi XY, Yang SM, et al. Evaluation on in-situ bioremediation of a shoreline polluted by oil spill.
Environ Sci Technol, 2011, 34(3): 41–45.
(in Chinese). 何云馨, 石晓勇, 杨仕美, 等. 溢油污染海岸线生物修复措施现场应用效果评价. 环境科学与技术, 2011, 34(3): 41-45. |
| [12] | Díez S, Sabaté J, Viñas M, et al. The prestige oil spill. I. Biodegradation of a heavy fuel oil under simulated conditions. Environ Toxicol Chem, 2005, 24(9): 2203–2217. DOI: 10.1897/04-604R.1 |
| [13] |
Zhang S, Bi EP, Chen L, et al. Experimental study on microbial remediation of petroleum polluted groundwater.
Geoscience, 2009, 23(1): 120–124.
(in Chinese). 张胜, 毕二平, 陈立, 等. 微生物修复石油污染地下水的实验研究. 现代地质, 2009, 23(1): 120-124. |
| [14] | Hesham AEL, Alrumman SA, Al-Amari JA. 16S rDNA phylogenetic and RAPD-PCR analyses of petroleum polycyclic aromatic hydrocarbons-degrading bacteria enriched from oil-polluted soils. Arab J Sci Eng, 2016, 41(6): 2095–2106. DOI: 10.1007/s13369-015-1843-2 |
| [15] |
Wang YT, Zhang CB, Qi L, et al. Diversity and antimicrobial activities of cultivable bacteria isolated from Jiaozhou Bay.
Acta Microbiol Sin, 2016, 56(12): 1892–1900.
(in Chinese). 王怡婷, 张传波, 齐麟, 等. 胶州湾沉积物可培养细菌的多样性及其抑菌活性. 微生物学报, 2016, 56(12): 1892-1900. |
| [16] | Arutchelvi J, Joseph C, Doble M. Process optimization for the production of rhamnolipid and formation of biofilm by Pseudomonas aeruginosa CPCL on polypropylene. Biochem Eng J, 2011, 56(1/2): 37–45. |
| [17] | Bezza FA, Chirwa EMN. The role of lipopeptide biosurfactant on microbial remediation of aged polycyclic aromatic hydrocarbons (PAHs)-contaminated soil. Chem Eng J, 2017, 309: 563–576. DOI: 10.1016/j.cej.2016.10.055 |
| [18] | Singleton DR, Adrion AC, Aitken MD. Surfactant-induced bacterial community changes correlated with increased polycyclic aromatic hydrocarbon degradation in contaminated soil. Appl Microbiol Biotechnol, 2016, 100(23): 10165–10177. DOI: 10.1007/s00253-016-7867-z |
| [19] | Kamyabi A, Nouri H, Moghimi H. Synergistic effect of Sarocladium sp. and Cryptococcus sp. co-culture on crude oil biodegradation and biosurfactant production. Appl Biochem Biotechnol, 2016, 182(1): 1–11. |
| [20] | Zhong H, Wang ZQ, Liu ZF, et al. Degradation of hexadecane by Pseudomonas aeruginosa with the mediation of surfactants: relation between hexadecane solubilization and bioavailability. Int Biodeter Biodegra, 2016, 115: 141–145. DOI: 10.1016/j.ibiod.2016.08.008 |
| [21] | Mao J, Luo YM, Teng Y, et al. Bioremediation of polycyclic aromatic hydrocarbon-contaminated soil by a bacterial consortium and associated microbial community changes. Int Biodeter Biodegra, 2012, 70: 141–147. DOI: 10.1016/j.ibiod.2012.03.002 |
| [22] | Binazadeh M, Karimi IA, Li Z. Fast biodegradation of long chain n-alkanes and crude oil at high concentrations with Rhodococcus sp. Moj-3449. Enzyme Microb Technol, 2009, 45(3): 195–202. DOI: 10.1016/j.enzmictec.2009.06.001 |
| [23] | Nguyen TA, Fu CC, Juang RS. Effective removal of sulfur dyes from water by biosorption and subsequent immobilized laccase degradation on crosslinked chitosan beads. Chem Eng J, 2016, 304: 313–324. DOI: 10.1016/j.cej.2016.06.102 |
| [24] | Valentino F, Riccardi C, Campanari S, et al. Fate of β-hexachlorocyclohexane in the mixed microbial cultures (MMCs) three-stage polyhydroxyalkanoates (PHA) production process from cheese whey. Bioresour Technol, 2015, 192: 304–311. DOI: 10.1016/j.biortech.2015.05.083 |
| [25] | Ranjbar M, Rotondi MA, Ardern CI, et al. Urinary biomarkers of polycyclic aromatic hydrocarbons are associated with cardiometabolic health risk. PLoS ONE, 2015, 10(9): e0137536. DOI: 10.1371/journal.pone.0137536 |
| [26] | Tiwari B, Manickam N, Kumari S, et al. Biodegradation and dissolution of polyaromatic hydrocarbons by Stenotrophomonas sp. Bioresour Technol, 2016, 216: 1102–1105. DOI: 10.1016/j.biortech.2016.06.047 |
| [27] | Varjani SJ, Upasani VN. Biodegradation of petroleum hydrocarbons by oleophilic strain of Pseudomonas aeruginosa NCIM 5514. Bioresour Technol, 2016, 222: 195–201. DOI: 10.1016/j.biortech.2016.10.006 |
| [28] | Varjani SJ, Upasani VN. Carbon spectrum utilization by an indigenous strain of Pseudomonas aeruginosa NCIM 5514: production, characterization and surface active properties of biosurfactant. Bioresour Technol, 2016, 221: 510–516. DOI: 10.1016/j.biortech.2016.09.080 |
| [29] | Pugazhendi A, Wazin HA, Qari H, et al. Biodegradation of low and high molecular weight hydrocarbons in petroleum refinery wastewater by a thermophilic bacterial consortium. Environ Technol, 2016, 5: 1–11. DOI: 10.1080/21622515.2016.1147615 |
| [30] |
GB/T 15618-2008. Soil environmental quality standard (in Chinese). GB/T 15618-2008. 土壤环境质量标准. |
 2017, Vol. 33
2017, Vol. 33




