中国科学院微生物研究所、中国微生物学会主办
文章信息
- 侯胜博, 冯华良, 高教琪, 李益民, 袁文杰, 白凤武
- Hou Shengbo, Feng Hualiang, Gao Jiaoqi, Li Yimin, Yuan Wenjie, Bai Fengwu
- 马克斯克鲁维酵母的木糖和阿拉伯糖发酵
- Fermentations of xylose and arabinose by Kluyveromyces marxianus
- 生物工程学报, 2017, 33(6): 923-935
- Chinese Journal of Biotechnology, 2017, 33(6): 923-935
- 10.13345/j.cjb.160458
-
文章历史
- Received: November 24, 2016
- Accepted: January 6, 2017
2 上海交通大学 微生物代谢国家重点实验室,上海 200240
2 State Key Laboratory of Microbial Metabolism, Shanghai Jiaotong University, Shanghai 200240, China
随着人类对石油等化石资源的大量开采,能源问题日益困扰着我们。燃料乙醇因其具有较高的辛烷值[1],无毒,是公认的最有可能替代化石能源的环境友好型生物质能源之一。此外,纤维素燃料乙醇由于其原料来源广泛、价格低廉、可再生性等特点受到国内外学者的广泛关注[2]。
目前,酿酒酵母Saccharomyces cerevisiae由于其高的乙醇生产率、耐受性和有效的己糖发酵能力在乙醇生产中起主要作用[3-4],但其不能利用木糖和其他的C5糖。虽然通过外源搭建戊糖的代谢途径,酿酒酵母获得了利用戊糖的能力,但戊糖转化率低,乙醇得率低仍是阻碍其在纤维素乙醇生产中应用的主要原因。此外,热带假丝酵母Candida tropicalis也常用到纤维素乙醇的发酵中[5],但由于其代谢途径中存在还原力不平衡的问题更多地用于木糖醇的生产[6-7]。
近年来,非传统酵母包括拜耳接合酵母[8]、东方伊萨酵母[8]、马克斯克鲁维酵母[9-10]和鲁氏酵母等越来越多地应用到纤维素乙醇发酵中。其中的马克斯克鲁维酵母Kluyveromyces marxianus具有在真核微生物中生长速率最大[11],可在高达45-52 ℃温度下生长[12],代谢底物范围广(包括葡萄糖、甘露糖、半乳糖、乳糖等六碳糖和木糖、阿拉伯糖等五碳糖[13])等特点,使其替代酿酒酵母成为发酵木质纤维素生产乙醇的良好选择[14-17]。
在本实验中,以3株不同的马克斯克鲁维酵母为出发菌株,研究了其在不同温度下发酵戊糖(木糖和阿拉伯糖)的情况,对菌体的生长、木糖和阿拉伯糖利用率和乙醇、木糖醇、阿拉伯糖醇产量以及副产物产量分别进行了测定。在此基础上,对其代谢途径中的关键酶基因(木糖代谢途径:木糖还原酶XR、木糖醇脱氢酶XDH和木酮糖激酶XK;阿拉伯糖代谢途径:阿拉伯糖还原酶AR和阿拉伯糖醇脱氢酶LAD)进行了序列测定及深入分析,试图在基因水平上解释其发酵差异,找出其影响发酵结果的关键因素,为构建高发酵性能的菌株奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株马克斯克鲁维酵母(Kluyveromyces marxianus) 9009、1911、1727均购自中国工业微生物保藏中心,编号分别为9009、1911和1727。以上菌株由大连理工大学生命科学学院保藏。
1.1.2 培养基活化培养基(g/L):无水葡萄糖20,酵母浸粉10,蛋白胨20,121 ℃灭菌20 min。
种子培养基同活化培养基。
发酵培养基(g/L):糖类40 (葡萄糖、木糖、阿拉伯糖),其余成分同种子培养基。
1.1.3 引物实验中所用的引物序列见表 1。
| Prime name | Primer sequence (5ʹ-3ʹ) | Size (bp) |
| XR-F | ATGACATACCTCGCACCAAC | 20 |
| XR-R | GGGGAAGGGGAAAGAAAGTA | 20 |
| XDH-F | ATCAACCATGACCAACACTC | 20 |
| XDH-R | CATGTTCATTCTGGACCATC | 20 |
| XK-F | CAGCAATGTCTACCCCATAC | 20 |
| XK-R | CAGGTCAACAGCTTCTCGTT | 20 |
| AR-F | GAGTCCAAGTGTGTCAAGTT | 20 |
| AR-R | TCATGGAGCATTGGTGCAGT | 20 |
| ADH-F | ATGTCCGGATTGAGTCAAGA | 20 |
| ADH-R | TTGAGAATGGGTGATTCACC | 20 |
引物合成和序列测序委托生工生物工程(上海)股份有限公司完成。
Taq DNA聚合酶、限制性内切酶、T4 DNA连接酶、DNA marker等购自TaKaRa (大连)公司;PCR产物纯化试剂盒与琼脂糖凝胶回收试剂盒均购自北京索莱宝科技有限公司。其他试剂为国产分析纯以上。
1.2 方法 1.2.1 菌株培养及发酵条件将菌株接种到活化培养基中进行活化,取1 mL活化发酵液转接到100 mL种子培养基中过夜培养12-16 h。测定OD620值,确定其接入木糖发酵培养基的接种量,保证其起始接种量一致。
经过两级种子活化,将种子液以10%的体积分数接入有效体积为200 mL的500 mL摇瓶培养基中,摇瓶用8层纱布(微量通气)封口。30 ℃、150 r/min培养。定时取样,并测定生物量,5 000 r/min离心5 min,液氮冻存菌体以待后续转录水平分析,上清液用于糖以及各种代谢产物浓度的测定。
1.2.2 分析方法生物量测定方法:采用OD值法,将菌液适当稀释,在波长为620 nm处测定其吸光值。
发酵液代谢产物的分析:发酵液在5 000 r/min下离心5 min,取上清液,用孔径为0.22 μm的水膜过滤,利用高效液相色谱(HPLC)测定木糖、阿拉伯糖、木糖醇、阿拉伯糖醇、甘油、乙酸和乙醇的含量。色谱柱的型号为SUGAR系列SP0810。流动相为纯水,流量为0.7 mL/min,分别使用紫外检测器(检测波长205 nm)和示差检测器。
1.2.3 酵母基因组DNA的提取菌体的培养与收获:从30 ℃培养2 d的酵母菌平板上挑取一个单菌落,接入100 mL YPD液体培养基,于30 ℃培养16 h。10 000 r/min离心3 min收集菌体。
菌体的裂解:用无菌水洗涤菌体2次,向菌体中加入500 μL裂解液, 将菌体悬浮,再加入2/3体积的干净玻璃珠(d=0.5 mm)和25 μL的5 mmol/L NaCl溶液,高速振荡破碎细胞。12 000 r/min离心5 min,将上清转移至干净的离心管中。
基因组DNA的抽提:加入等体积的酚:氯仿:异戊醇(25:24:1),同上振荡,10 000 r/min离心1 min。取上清,加入2倍体积95%乙醇后置于-20 ℃放置l h。
高速离心10 min后,用70%乙醇洗涤沉淀,于室温晾干,并将沉淀溶于适量TE缓冲液(pH 8.0) 中,加入适量RNase消化RNA,即得酵母基因组DNA样品,取5 μL进行琼脂糖凝胶电泳检测,剩余的DNA样品于-20 ℃保存。
1.2.4 引物设计及序列比对引物的设计:采用PrimerPremier 5.0引物设计软件,按照GenBank的K. marxianus NBRC 1777的戊糖代谢途径中关键酶(XR、XDH、XK、AR、ADH、XLR)基因全序列为依据设计上述引物。
序列比对:1) 登陆NCBI网站,利用网站中的Blast工具对所测得的关键酶基因进行序列比对。2) 利用Clustalx 2.1软件进行多序列比对。
1.2.5 酵母RNA提取及Real-time实验RNA的提取:使用总RNA提取试剂盒(天根生化科技股份有限公司)。
Real-time实验委托生工生物工程(上海)股份有限公司完成。
2 结果与分析 2.1 马克斯克鲁维酵母发酵木糖经木糖为碳源的种子培养基培养后,马克斯克鲁维酵母9009、1911、1727在不同温度下(30 ℃和40 ℃)利用木糖的情况如图 1和表 2所示。从图 1可以看出,相同发酵条件下,不同菌株有着不同的生长状态,在耗糖速率、木糖醇产率和乙醇产率上有着明显的不同。30 ℃条件下,消耗木糖最快的菌株为K. m 1727,发酵32.94 g/L木糖,产生9.22 g/L的木糖醇,产生少量乙醇。生物量OD620达到6左右;其次为K. m 1911,生物量OD620达到4左右,6 d消耗29.19 g/L木糖,剩余4.51 g/L残糖,无木糖醇积累,但能产生2.68 g/L的乙醇;消耗木糖最慢的为K. m 9009,虽然生物量最高,OD620达到6.7左右,但6 d内只消耗28.74 g/L木糖,产生1.89 g/L的木糖醇且基本无乙醇产生。
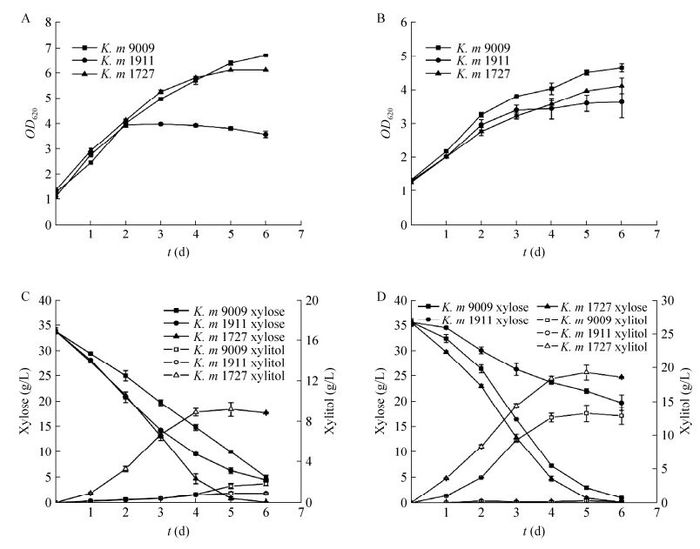
|
| 图 1 三株马克斯克鲁维酵母的木糖发酵结果(A、C为其30 ℃温度下菌体的生长状况和发酵结果;B、D为其40 ℃温度下菌体的生长状况和发酵结果) Figure 1 The xylose fermentation profiles of three Kluyveromyces marxianus strains at different temperatures: 30 ℃ (A, C) and 40 ℃ (B, D). |
| |
| Temperature (℃) | Strains | Time (d) | ρ (Initial sugar) (g/L) | ρ (Sugar consumption) (g/L) | ρ (xylitol) (g/L) | ρ (Glycerol) (g/L) | ρ (Acetic acid) (g/L) | ρ (ethanol) (g/L) |
| 30 | K. m 9009 | 6 | 33.80±0.35 | 28.74 | 1.89±0.19 | 0.24±0.07 | 0.54±0.05 | 0.32 |
| K. m 1911 | 6 | 33.80±0.35 | 29.29 | 0.95±0.86 | 0.52±0.10 | 3.12±0.21 | 2.68±0.27 | |
| K. m 1727 | 5 | 33.80±0.35 | 32.94 | 9.22±0.75 | 0.17 | 1.51±0.13 | 0.65±0.02 | |
| 40 | K. m 9009 | 6 | 35.60±0.31 | 34.61 | 13.22±1.24 | 0.54±0.03 | 0.93±0.12 | 0.52±0.12 |
| K. m 1911 | 6 | 35.60±0.31 | 15.81 | 0.29±0.02 | 0.18±0.01 | 1.24±0.07 | 0.92±0.04 | |
| K. m 1727 | 5 | 35.60±0.31 | 34.67 | 19.25±0.23 | 1.35±0.22 | 0.84±0.10 | 0.24±0.11 |
而40 ℃条件下,消耗木糖最快的也是K. m 1727,虽然最终生物量OD620仅达到4左右,但35.60 g/L木糖可在5 d基本耗完,并能产生19.25 g/L的木糖醇,同样基本无乙醇产生;其次是K. m 9009,生物量OD620最终能达到4.5左右,但35.60 g/L木糖需要6 d才能耗完,产生13.22 g/L的木糖醇,产生少量乙醇;耗糖最慢的为K. m 1911,生物量OD620为3.5左右,35.60 g/L木糖发酵6 d后,还剩余19.79 g/L,产生少量木糖醇和乙醇。
通过比较不同温度下菌株的发酵性能可以看出,菌株K. m 1727和K. m 9009在40 ℃条件下的发酵性能均优于30 ℃,木糖消耗快,并且木糖醇的产量分别由9.22 g/L和1.89 g/L提高至19.25 g/L和13.22 g/L,体现了马克斯克鲁维酵母在高温条件下发酵的优势。
2.2 马克斯克鲁维酵母发酵阿拉伯糖经在酵母膏胨葡萄糖培养基(YPD)种子培养基培养后,接入以阿拉伯糖为唯一碳源的发酵培养基上进行发酵,其在不同发酵温度(30 ℃和40 ℃)下的发酵结果如图 2和表 3所示。从发酵结果来看,3株克鲁维酵母发酵阿拉伯糖时表现出比发酵木糖时更大的差异性。
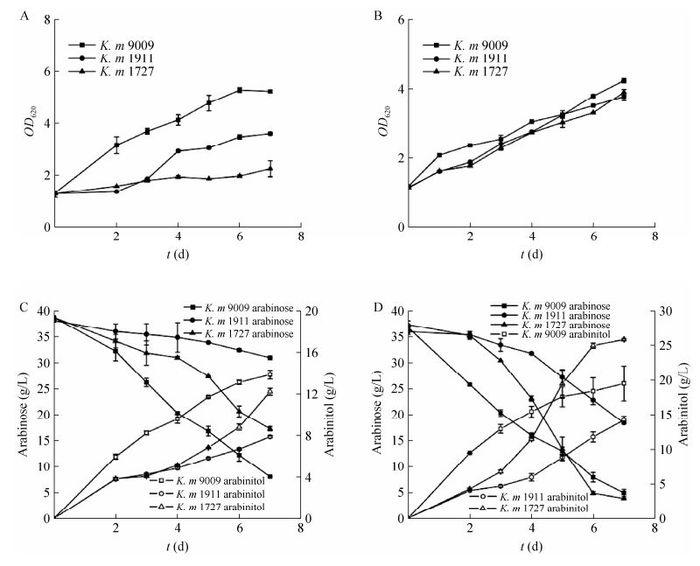
|
| 图 2 三株马克斯克鲁维酵母的阿拉伯糖发酵结果(A、C为其30 ℃温度下菌体的生长状况和发酵结果;B、D为其40 ℃温度下菌体的生长状况和发酵结果) Figure 2 The arabinose fermentation profiles of three Kluyveromyces marxianus strains at different temperatures: 30 ℃ (A, C) and 40 ℃ (B, D). |
| |
| Temperature (℃) | Strains | Time (d) | ρ (Initial sugar) (g/L) | ρ (Residual sugar) (g/L) | ρ (Sugar consumption) (g/L) | ρ (Arabinitol) (g/L) |
| 30 | K. m 9009 | 7 | 38.75±0.16 | 8.05±0.11 | 30.70 | 13.85±0.42 |
| K. m 1911 | 7 | 38.15±0.30 | 30.98±0.36 | 7.17 | 6.06±0.10 | |
| K. m 1727 | 7 | 38.76±0.03 | 17.27±0.42 | 21.49 | 12.22±0.33 | |
| 40 | K. m 9009 | 7 | 36.79±0.14 | 4.91±0.13 | 31.88 | 19.91±2.52 |
| K. m 1911 | 7 | 36.02±0.56 | 12.47±0.21 | 23.55 | 17.96±0.58 | |
| K. m 1727 | 6 | 37.38±0.79 | 3.84±0.29 | 33.54 | 25.86±0.38 |
30 ℃发酵温度下,7 d的发酵时间,发酵阿拉伯糖最快的为K. m 9009,生物量OD620达到5,消耗30.70 g/L的阿拉伯糖,产生13.85 g/L的阿拉伯糖醇。其次为K. m 1727,生物量达到3,消耗21.49 g/L阿拉伯糖,剩余17.27 g/L的阿拉伯糖,但有12.22 g/L的阿拉伯糖醇产生。最慢的为K. m 1911,生物量只达到2左右,剩余30.98 g/L的阿拉伯糖,产生6.06 g/L的阿拉伯糖醇。3株菌均无乙醇产生。
40 ℃发酵温度下,发酵阿拉伯糖速率最快的为K. m 1727,37 g/L的阿拉伯糖发酵6 d剩余4 g/L的阿拉伯糖,产生大约26 g/L的阿拉伯糖醇;其次为K. m 9009,37 g/L的阿拉伯糖发酵7 d剩余5 g/L的阿拉伯糖,产生大约20 g/L的阿拉伯糖醇;最慢的为K. m 1911,36 g/L的阿拉伯糖发酵7 d剩余12.5 g/L的阿拉伯糖,产生18 g/L的阿拉伯糖醇。
比较40 ℃和30 ℃的阿拉伯糖的发酵结果,同样体现了马克斯克鲁维酵母在高温发酵方面的优势。随温度的升高,虽然菌株的生长受到一定影响,但阿拉伯糖醇的产量大幅提高,K. m 1727的阿拉伯糖醇产率由30 ℃的0.56 g/g,提高到40 ℃的0.79 g/g;K. m 9009的阿拉伯糖醇产率由30 ℃的0.45 g/g,提高到40 ℃的0.63 g/g。
2.3 木糖代谢途径中关键酶编码基因的克隆及序列比对采用PCR的方法,获得了马克斯克鲁维酵母中编码木糖代谢途径中关键酶(XR、XDH、XK)基因,送生工生物工程(上海)股份有限公司测序。相应关键酶的基因编码序列已提交到NCBI中,其XR序列登录号(K. m 9009, 1911, 1727) : KX388390-KX388392;XDH序列登录号(K. m 9009, 1911, 1727) : KX455881-KX455883;XK序列登录号(K. m 9009, 1911, 1727) : KX462707-KX462709。以NCBI中已提交的马克斯克鲁维酵母NBRC1777相对应的酶编码序列为基准,以其所编码的氨基酸序列与本文中所用3个菌株的相应基因编码蛋白序列进行Blast比对,结果发现3株菌的3种关键酶氨基酸序列与K. m NBRC1777的相应序列相似性都达98%以上。进行Clustalx多序列比对后,其差异如图 3所示。木糖还原酶的活性位点位于22-24、47、52、81、14、115、173、174、195、221-224、261、276-279、284、287和288处的氨基酸序列[17],而其序列差异存在于其氨基酸序列为15、320-321、325、327位点,不在其活性位点处;木糖醇脱氢酶的活性位点位于42、44、48、54、57等氨基酸处[18],而其序列差异存在于9、12、14、211、277处的氨基酸位点,不在其活性位点处。木酮糖激酶的活性位点位于10、12-15、17-91、93等氨基酸处[19],而其序列差异存在于其氨基酸序列为38、250、414、417、579位点,不在其活性位点处;与其他2株不同的是,在菌株K. m 1727中,检测到与活性位点相关的差异位点包括10、12-15、17处的氨基酸序列。这些序列差异的突变,与K. m 1727的木糖发酵及耐热性之间的相关性尚需进一步深入研究。

|
| 图 3 四株马克斯克鲁维酵母的木糖代谢途径中3个关键酶的氨基酸序列差异位点 Figure 3 The differences sites of amino acid sequences encoding three key enzymes in xylose metabolism pathway between four Kluyveromyces marxianus strains. |
| |
对马克斯克鲁维酵母中编码阿拉伯糖代谢途径中的关键酶的基因序列(AR和LAD)进行了测序,其相应关键酶的编码序列结果已提交到NCBI中,其AR序列登录号(K. m 9009, 1911, 1727) : KX455884-KX455886、LAD序列登录号(K. m 9009, 1911, 1727) : KX591955-KX591957。以NCBI中已提交的马克斯克鲁维酵母DMKU3-1042相对应的酶编码序列为基准,与其所编码的氨基酸序列进行Blast序列进行一一比对,结果发现3株菌与K. m DMKU3-1042的相应序列相似性都达99%以上。并进行Clustalx多序列比对,其差异如图 4所示,其中阿拉伯糖还原酶的活性位点位于28-30、53、58、89、123-124、154-155、178、204-209、230、245-248、253、256-257[20]处的氨基酸序列,而其序列差异存在于其氨基酸序列为163、205、239、271-272位点。阿拉伯糖醇脱氢酶的活性位点位于39、41-42、44、63-65、125-127、149、196-198、213、217、243-246氨基酸处[20],而序列差异为66、115、211处的氨基酸位点。这些序列差异均不在已知蛋白活性位点处。但从序列差异的结果来看,在这两个酶的编码氨基酸中,均是K. m 1911与其他3株不同,并且K. m 1911发酵阿拉伯糖的效果最差,因此,这些突变的位点可能与阿拉伯糖的代谢相关。综上,与木糖代谢类似,在基因水平上仍无法解释3株酵母在阿拉伯糖发酵性能方面的差异,可能存在转录水平或翻译水平的调控。

|
| 图 4 四株马克斯克鲁维酵母的阿拉伯糖代谢途径中2个关键酶的氨基酸序列差异位点 Figure 4 The differences sites of amino acid sequences encoding two key enzymes in arabinose metabolism pathway between four Kluyveromyces marxianus strains. |
| |
为了在基因转录水平上解释其发酵差异,选取了木糖发酵差异最为明显的K. m 1727和K. m 1911,对木糖代谢过程4个关键酶(XR、XDH、XK和ADH)的基因表达量进行测定。选取在40 ℃发酵温度下,木糖发酵时间为0 d、2 d、4 d的菌体,经液氮冷冻后,提取RNA并对其木糖代谢途径中的4个关键酶编码基因(XR、XDH、XK和ADH)进行实时定量PCR实验,以发酵第0天的各基因表达量为1作为标准,得到其不同发酵时间点处的相对表达量,其结果如图 4所示,从图 5A可以看出在K. m 1727中,XR的相对表达量随发酵时间的延长而增加,第4天,XR的相对表达量是其第1天的4.5倍,而XDH和XK的表达量却随发酵时间的延长没有太大变化。这正好与木糖醇的积累相符合,说明菌株木糖代谢途径只走了第一步。而从图 5B可以看出在K. m 1911中,XR、XDH、XK三个基因的表达量随发酵时间的延长变化趋势基本一致。此外,从图 5C我们可以看出K. m 1911的乙醇脱氢酶的基因表达量明显高于K. m 1727,这与其乙醇产率明显高于K. m 1727相一致。
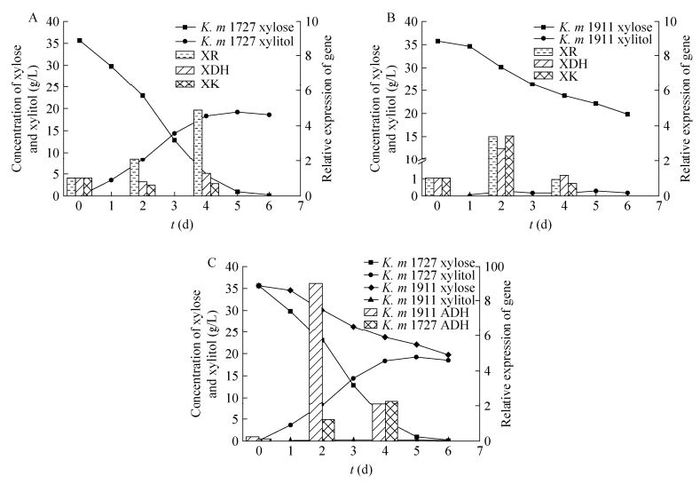
|
| 图 5 三个木糖代谢关键酶的编码基因在不同发酵时间点下的相对表达水平 Figure 5 Relative expression of genes which encoding three key enzymes in xylose metabolism pathway at different fermentation time. |
| |
从结果可以看出,木糖醇脱氢酶和木酮糖激酶的基因表达量低是导致克鲁维酵母发酵木糖过程中木糖醇积累和乙醇产率低的主要原因。文献报道,通过在木糖代谢途径中过表达木酮糖激酶和木糖醇脱氢酶可以提高乙醇产率[21-24],因此采用基因工程的方法提高相关基因的表达量,同样是解决克鲁维酵母快速发酵戊糖生产乙醇的选择。
2.6 马克斯克鲁维酵母的戊糖代谢途径通过与已发表的马克斯克鲁维酵母[17-20]、拜耳结合酵母[25]和热带假丝酵母[26]对应的关键酶编码序列相比对,根据其不同物种之间的差异和同一物种的同源性,我们进一步确定了马克斯克鲁维酵母中的戊糖代谢途径如图 6所示。其中在木糖代谢过程中(图 6, ②),木糖进入细胞内后,首先在木糖还原酶(Xylose reductase,XR)的作用下转化为木糖醇,然后在木糖醇脱氢酶(Xylitol dehydrogenase,XDH)的作用下形成木酮糖,最后再经过木酮糖激酶(Xylulokinase,XK)催化形成木酮糖-5-磷酸,由此进入戊糖磷酸途径(PPP)和糖酵解途径。
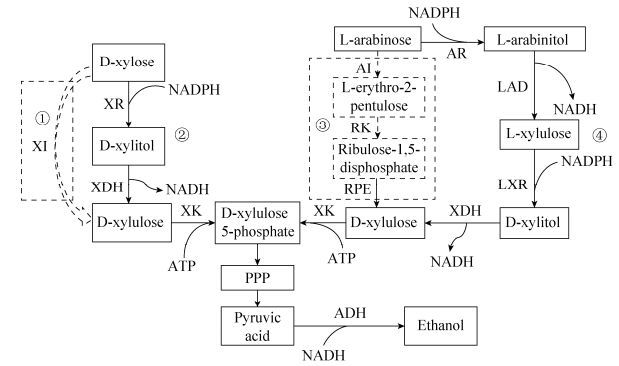
|
| 图 6 木糖和阿拉伯糖代谢途径(①③ 分别为细菌中的木糖和阿拉伯糖代谢途径;②④ 分别为真菌酵母中的木糖和阿拉伯糖代谢途径) Figure 6 Initial metabolic pathway of xylose and L-arabinose in micro-organisms (①③: the metabolic pathway of xylose and L-arabinosein bacteria; ②④: the metabolic pathway of xylose and L-arabinosein yeast). |
| |
相对于木糖代谢途径,L-阿拉伯糖代谢途径(图 6, ④)相对复杂,由4个交替的氧化还原反应组成。L-阿拉伯糖首先被L-阿拉伯糖还原酶(Arabinose reductase,AR)还原成L-阿拉伯糖醇,再被L-阿拉伯糖醇-4-脱氢酶(L-arabinitol-4-dehydrogenase,LAD)转化成L-木酮糖,L-木酮糖经L-木酮糖还原酶(L-xylulose reductase,LXR)还原成木糖醇,木糖醇在木糖醇脱氢酶(D-xylitol dehydrogenase,XDH)和木酮糖激酶(Xylulokinase,XK)作用下生成5-磷酸木酮糖,进入细胞内的磷酸戊糖途径(Pentose phosphate pathway,PPP)进一步被代谢。
3 结论通过比较3株马克斯克鲁维酵母(K. m 9009、K. m 1911、K. m 1727) 在不同温度下(30 ℃和40 ℃)的戊糖发酵性能,发现克鲁维酵母是适于同步糖化发酵纤维素生物质生产生物能源的出发菌株。马克斯克鲁维酵母具有天然发酵戊糖的能力,并且K. m 1727在40 ℃的耗糖速率和木糖醇、阿拉伯糖醇产率明显高于30 ℃,充分体现了马克斯克鲁维酵母在高温下的发酵优势。菌株K. m 1911耗糖速率虽然不如菌株K. m 1727快,但其发酵木糖产乙醇的能力比K. m 1727高,而K. m 9009在戊糖培养基中的生长状况最好。虽然3株菌代谢戊糖时表现出显著差异,但关键酶的编码基因相差不大,其在转录水平的差别是导致不同发酵结果的原因。采用基因工程的方法提高相关基因的表达量,是解决克鲁维酵母快速发酵戊糖生产乙醇的选择。
| [1] | Bai FW, Anderson WA, Moo-Young M. Ethanol fermentation technologies from sugar and starch feedstocks. Biotechnol Adv, 2008, 26(1): 89–105. DOI: 10.1016/j.biotechadv.2007.09.002 |
| [2] |
Yue GJ, Wu GQ, Lin X. Insights into engineering of cellulosic ethanol.
Chin J Biotech, 2014, 30(6): 816–827.
(in Chinese). 岳国君, 武国庆, 林鑫. 纤维素乙醇工程化探讨. 生物工程学报, 2014, 30(6): 816-827. |
| [3] | Matsushika A, Inoue H, Kodaki T, et al. Ethanol production from xylose in engineered Saccharomyces cerevisiae strains: current state and perspectives. Appl Microbiol Biotechnol, 2009, 84(1): 37–53. DOI: 10.1007/s00253-009-2101-x |
| [4] | Ruyters S, Mukherjee V, Verstrepen KJ, et al. Assessing the potential of wild yeasts for bioethanol production. J Ind Microbiol Biotechnol, 2015, 42(1): 39–48. DOI: 10.1007/s10295-014-1544-y |
| [5] | Mattam AJ, Kuila A, Suralikerimath N, et al. Cellulolytic enzyme expression and simultaneous conversion of lignocellulosic sugars into ethanol and xylitol by a new Candida tropicalis strain. Biotechnol Biofuels, 2016, 9(1): 157. DOI: 10.1186/s13068-016-0575-1 |
| [6] | Guo XX, Zhang RH, Li Z, et al. A novel pathway construction in Candida tropicalis for direct xylitol conversion from corncob xylan. Bioresour Technol, 2013, 128: 547–552. DOI: 10.1016/j.biortech.2012.10.155 |
| [7] | Misra S, Raghuwanshi S, Saxena RK. Evaluation of corncob hemicellulosic hydrolysate for xylitol production by adapted strain of Candida tropicalis. Carbohydr Polym, 2013, 92(2): 1596–1601. DOI: 10.1016/j.carbpol.2012.11.033 |
| [8] | Radecka D, Mukherjee V, Mateo RQ, et al. Looking beyond Saccharomyces: the potential of non-conventional yeast species for desirable traits in bioethanol fermentation. FEMS Yeast Res, 2015, 15(6): fov053. DOI: 10.1093/femsyr/fov053 |
| [9] | Lane MM, Morrissey JP. Kluyveromyces marxianus: a yeast emerging from its sister's shadow. Fungal Biol Rev, 2010, 24(1/2): 17–26. |
| [10] | Fonseca GG, Heinzle E, Wittmann C, et al. The yeast Kluyveromyces marxianus and its biotechnological potential. Appl Microbiol Biotechnol, 2008, 79(3): 339–354. DOI: 10.1007/s00253-008-1458-6 |
| [11] | Groeneveld P, Stouthamer AH, Westerhoff HV. Super life-how and why 'cell selection' leads to the fastest-growing eukaryote. FEBS J, 2009, 276(1): 254–270. DOI: 10.1111/j.1742-4658.2008.06778.x |
| [12] | Limtong S, Sringiew C, Yongmanitchai W. Production of fuel ethanol at high temperature from sugar cane juice by a newly isolated Kluyveromyces marxianus. Bioresour Technol, 2007, 98(17): 3367–3374. DOI: 10.1016/j.biortech.2006.10.044 |
| [13] | Rodrussamee N, Lertwattanasakul N, Hirata K, et al. Growth and ethanol fermentation ability on hexose and pentose sugars and glucose effect under various conditions in thermotolerant yeast Kluyveromyces marxianus. Appl Microbiol Biotechnol, 2011, 90(4): 1573–1586. DOI: 10.1007/s00253-011-3218-2 |
| [14] | Ballesteros M, Oliva JM, Negro MJ, et al. Ethanol from lignocellulosic materials by a simultaneous saccharification and fermentation process (SFS) with Kluyveromyces marxianus CECT 10875. Process Biochem, 2004, 39(12): 1843–1848. DOI: 10.1016/j.procbio.2003.09.011 |
| [15] | Castro RCA, Roberto IC. Selection of a thermotolerant Kluyveromyces marxianus strain with potential application for cellulosic ethanol production by simultaneous saccharification and fermentation. Appl Biochem Biotechnol, 2014, 172(3): 1553–1564. DOI: 10.1007/s12010-013-0612-5 |
| [16] | Goshima T, Tsuji M, Inoue H, et al. Bioethanol production from lignocellulosic biomass by a novel Kluyveromyces marxianus strain. Biosci Biotechnol Biochem, 2013, 77(7): 1505–1510. DOI: 10.1271/bbb.130173 |
| [17] | Zhang B, Zhang L, Wang DM, et al. Identification of a xylose reductase gene in the xylose metabolic pathway of Kluyveromyces marxianus NBRC1777. J Ind Microbiol Biotechnol, 2011, 38(12): 2001–2010. DOI: 10.1007/s10295-011-0990-z |
| [18] | Li LL, Zhang L, Wang DM, et al. Identification of a xylitol dehydrogenase gene from Kluyveromyces marxianus NBRC1777. Mol Biotechnol, 2013, 53(2): 159–169. DOI: 10.1007/s12033-012-9508-9 |
| [19] | Wang RL, Zhang L, Wang DM, et al. Identification of a xylulokinase catalyzing xylulose phosphorylation in the xylose metabolic pathway of Kluyveromyces marxianus NBRC1777. J Ind Microbiol Biotechnol, 2011, 38(10): 1739–1746. DOI: 10.1007/s10295-011-0963-2 |
| [20] | Lertwattanasakul N, Kosaka T, Hosoyama A, et al. Genetic basis of the highly efficient yeast Kluyveromyces marxianus: complete genome sequence and transcriptome analyses. Biotechnol Biofuels, 2015, 8(1): 47. DOI: 10.1186/s13068-015-0227-x |
| [21] |
Peng BY, Chen X, Shen Y, et al. Effect of controlled overexpression of xylulokinase by different promoters on xylose metabolism in Saccharomyces cerevisiae.
Acta Microbiol Sin, 2011, 51(7): 914–922.
(in Chinese). 彭炳银, 陈晓, 沈煜, 等. 不同启动子控制下木酮糖激酶的差异表达及其对酿酒酵母木糖代谢的影响. 微生物学报, 2011, 51(7): 914-922. |
| [22] | Goshima T, Negi K, Tsuji M, et al. Ethanol fermentation from xylose by metabolically engineered strains of Kluyveromyces marxianus. J Biosci Bioeng, 2013, 116(5): 551–554. DOI: 10.1016/j.jbiosc.2013.05.010 |
| [23] | Kim SR, Kwee NR, Kim H, et al. Feasibility of xylose fermentation by engineered Saccharomyces cerevisiae overexpressing endogenous aldose reductase (GRE3), xylitol dehydrogenase (XYL2), and xylulokinase (XYL3) from Scheffersomyces stipitis. FEMS Yeast Res, 2013, 13(3): 312–321. DOI: 10.1111/fyr.2013.13.issue-3 |
| [24] | Lee SH, Kodaki T, Park YC, et al. Effects of NADH-preferring xylose reductase expression on ethanol production from xylose in xylose-metabolizing recombinant Saccharomyces cerevisiae. J Biotechnol, 2012, 158(4): 184–191. DOI: 10.1016/j.jbiotec.2011.06.005 |
| [25] | Mira NP, Münsterkötter M, Dias-Valada F, et al. The genome sequence of the highly acetic acid-tolerant Zygosaccharomyces bailii-derived interspecies hybrid strain ISA1307, isolated from a sparkling wine plant. DNA Res, 2014, 21(3): 299–313. DOI: 10.1093/dnares/dst058 |
| [26] | Butler G, Rasmussen MD, Lin MF, et al. Evolution of pathogenicity and sexual reproduction in eight Candida genomes. Nature, 2009, 459(7247): 657–662. DOI: 10.1038/nature08064 |
 2017, Vol. 33
2017, Vol. 33




