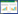中国科学院微生物研究所、中国微生物学会主办
文章信息
- 高宇, 刘中美, 刘克, 周哲敏, 崔文璟
- Gao Yu, Liu Zhongmei, Liu Ke, Zhou Zhemin, Cui Wenjing
- 双酶偶联转化富马酸制备β-丙氨酸的工艺的建立与优化
- Biocatalytic access to β-alanine by a two-enzyme cascade synthesis
- 生物工程学报, 2017, 33(5): 875-879
- Chinese Journal of Biotechnology, 2017, 33(5): 875-879
- 10.13345/j.cjb.160416
-
文章历史
- Received: November 1, 2016
- Accepted: January 24, 2017
β-丙氨酸是自然界中唯一存在的β-型氨基酸,也是一种非蛋白氨基酸,存在于某些细菌、真菌和植物中[1]。β-丙氨酸及其衍生物在医药、食品、化工等领域都有着广泛的应用。在医药方面,β-丙氨酸用于合成泛酸、泛酸钙、肌肽、帕米膦酸钠和巴柳氮等[2];在化工方面应用于电镀、铅中毒解毒剂及合成甜味剂[3]。国内外β-丙氨酸的生产主要以化学合成法为主[4],即以丙烯酸或丙烯腈为底物进行合成,此法生产过程中消耗大量能量,同时对环境和生物体都有一定的毒害作用。另一种生产方法是生物合成法,利用L-天冬氨酸α-脱羧酶(L-aspartate α-decarboxylase,EC4.1.1.11,PanD)、以L-天冬氨酸为底物催化生成β-丙氨酸[5],此法专一性高且环保,缺点是L-天冬氨酸价格偏高。
L-天冬氨酸α-脱羧酶催化L-天冬氨酸脱去α位的羧基生成β-丙氨酸,是生物体内泛酸合成途径中重要的酶。诸多报道对不同来源的PanD进行了详细的研究[6-8],其中来源于谷氨酸棒杆菌的PanD酶是一类依赖于丙酮酰基的四聚体脱羧酶,其特点为酶活高且能够在菌体内进行自裂解。酶法制备β-丙氨酸的研究中,浙江工业大学张潇潇[9]通过将钝齿棒杆菌来源panD基因重组到大肠杆菌中进行表达并优化条件,最终β-丙氨酸的产量达到76.47 mg/L;华东理工大学范海洋[10]优化大肠杆菌来源PanD重组菌,将产量提高至130 mg/L;浙江工业大学楼坚等[11]最终将发酵液中β-丙氨酸的产量提高至649 mg/L。
工业生产天冬氨酸,主要是由天冬氨酸酶(L-Aspartase,EC4.3.1.1,AspA)催化富马酸加氨合成L-天冬氨酸。大肠杆菌来源AspA由4个相同的亚基组成,单体分子量为50 kDa左右。AspA催化富马酸加氨合成L-天冬氨酸的反应为可逆反应,所以富马酸不能完全转化为L-天冬氨酸[12-13]。
因为富马酸价格较天冬氨酸低廉,本研究以富马酸和氨水为底物,构建AspA和PanD双酶偶联制备β-丙氨酸体系。通过条件优化,确定了最适酶比例和最适底物浓度,使整个反应体系中无中间产物L-天冬氨酸积累,将价格低廉的富马酸转化为目的产物。本研究为制备β-丙氨酸提供了新的思路与方法。
1 材料与方法 1.1 材料 1.1.1 菌株与培养基重组菌株E. coli BL21 pET-28a-aspA和E. coli BL21 pET-24a-panD,均为实验室前期构建。
E. coli的种子培养基为Luria-Bertani (LB)培养基,诱导培养基为Terrific-Broth (TB)培养基。
1.1.2 生化试剂富马酸、L-天冬氨酸钠、β-丙氨酸均购自上海生工生物工程有限公司。
1.2 方法 1.2.1 PanD酶的表达将重组大肠杆菌BL21/pET24a-panD接种于4 mL卡那霉素浓度为100 μg/mL的TB培养基,37 ℃、200 r/min振荡过夜培养。将上述过夜培养物按1%的接种量接种于含卡那霉素浓度为100 μg/mL的TB培养基,37 ℃、200 r/min振荡培养至菌液OD600至0.6–0.8,加入IPTG至终浓度0.8 mmol/L,37 ℃诱导培养16–20 h,收集菌体超声破碎,通过Tris-tricine SDS-PAGE方法[14]分析鉴定重组蛋白表达水平。
1.2.2 AspA酶的表达将重组大肠杆菌BL21/pET28a-aspA接种于4 mL卡那霉素浓度为100 μg/mL的TB培养基,37 ℃、200 r/min振荡过夜培养。将上述过夜培养物按1%的接种量接种于含卡那霉素浓度为100 μg/mL的TB培养基,37 ℃、200 r/min振荡培养至菌液OD600为0.6–0.8,加入IPTG至终浓度0.2 mmol/L,24 ℃诱导培养16–20 h,收集菌体超声破碎,通过SDS-PAGE分析鉴定重组蛋白表达水平。
1.2.3 重组蛋白的纯化和鉴定将重组菌体溶于结合缓冲溶液(50 mmol/L Na2HPO4、50 mmol/L NaH2PO4、500 mmol/L NaCl、20 mmol/L咪唑),超声破碎,离心,上清用0.22 μm滤膜过滤。用10倍柱体积的结合缓冲溶液平衡5 mL的His Trap HF柱,取20 mL的破碎上清上样,用10倍柱体积的结合缓冲溶液洗去非特异性吸附的蛋白,分别用8倍柱体积的150、300和500 mmol/L咪唑的缓冲液洗脱蛋白,收集样品后用透析袋密封,置于50 mmol/L Tris-HCl缓冲液(pH 7.0) 中4 ℃透析6–8 h,去除残余咪唑,并用SDS-PAGE分析鉴定。
1.2.4 蛋白浓度的测定蛋白质定量采用常规的Bradford法[15]。
1.2.5 L-天冬氨酸及β-丙氨酸的测定反应液用苯基异硫酸酯(PITC)衍生,具体步骤为:取500 μL反应液于1.5 mL离心管,加入250 μL 0.1 mol/L PITC乙腈溶液和250 μL 1 mol/L三乙胺乙腈溶液,充分混匀,避光室温放置0.5 h,加入700 μL正己烷溶液,涡旋振荡器振荡1 min,静置30–60 min,吸取下层溶液,经0.22 μm有机滤膜过滤,进样量为10 μL[16]。
β-丙氨酸衍生产物用HPLC测定[17]。色谱柱为La Chrom C18 (5 μm,4.6 mm×250 mm);流动相A溶液为80% (V/V)已腈水溶液,B溶液为97:3 (V/V,pH 6.5) 的0.1 mol/L乙酸钠-乙腈溶液;采用梯度洗脱:0–20 min,B溶液由95%下降到65%;20–30 min,B液由65%上升到95%;30–35 min,B溶液梯度不变。检测波长为254 nm,柱温为40 ℃。所测得衍生产物的含量等同于衍生前物质的含量。
1.2.6 富马酸的测定反应液经0.22 μm有机滤膜过滤后用HPLC检测,色谱柱为Prevail Organic Acid (OA)有机酸分析柱(5 μm,4.6 mm×250 mm)。流动相为20%甲醇溶液(磷酸调pH至2.2),流速为0.6 mL/min,检测波长为220 nm,柱温为40 ℃,检测时间为15 min,进样量为10 μL。
1.2.7 AspA催化富马酸生成L-天冬氨酸取20 μL AspA酶液(0.5 mg/mL)加到终浓度为50 mmol/L的NaH2PO4/Na2HPO4 (pH 7.0) 缓冲液中,然后在该体系中加入100 μL浓度为500 mmol/L的富马酸(NH4调pH至7.0)、10 μL浓度为100 mmol/L的MgCl2、无菌水补足1 mL反应体系,37 ℃、200 r/min下进行酶促反应(振荡反应),终止反应时取适量反应液于100 ℃煮沸10 min,12 000 r/min离心10 min,取上清,用0.22 μm微孔有机滤膜过滤,利用HPLC检测产物生成量。
1.2.8 PanD催化L-天冬氨酸合成β-丙氨酸反应进程的测定取200 μL PanD酶液(2 mg/mL)加到终浓度为50 mmol/L NaH2PO4/Na2HPO4缓冲液(pH 7.0) 中,然后在该体系中加入100 μL浓度为500 mmol/L的L-天冬氨酸溶液,最后用无菌水补足至1 mL反应体系,37 ℃、200 r/min下进行酶促反应(振荡反应),终止反应时取适量反应液于100 ℃煮沸10 min,12 000 r/min离心10 min,取上清,用0.22 μm微孔有机滤膜过滤,利用HPLC检测产物生成量。
1.2.9 双酶串联反应在含有一定浓度的底物富马酸和足量氨(调pH至7.0) 的10 mL反应液中,加入一定比例的两种酶,反应体系中含有1 mmol/L的MgCl2,50 mmol/L NaH2PO4/Na2HPO4缓冲液(pH 7.0),37 ℃、200 r/min下进行酶促反应(振荡反应),终止反应时取适量反应液于100 ℃煮沸10 min,12 000 r/min离心10 min,取上清,用0.22 μm微孔有机滤膜过滤,利用HPLC检测反应液中各成分的含量,计算β-丙氨酸的产率。
2 结果与分析 2.1 酶的表达和纯化携带aspA和panD目的基因的重组大肠杆菌经IPTG诱导后表达,细胞超声破碎后的细胞破碎液经亲和柱纯化后,得到电泳纯的重组蛋白。结果如图 1A所示,纯化后的AspA蛋白为50 kDa左右,与AspA的理论分子量一致。
|
| 图 1 重组蛋白及纯化电泳鉴定 Figure 1 SDS-PAGE analysis of recombinant proteins and purified proteins. M: marker; 1: supernatant of E. coli pET28a-aspA cell; 2: purified AspA; 3: supernatant of E. coli pET24a-panD; 4: purified PanD. |
| |
Tris-tricine电泳(图 1B)结果显示大部分PanD单体已自身裂解为α亚基(12.4 kDa)和β亚基(2.8 kDa)。β亚基在Tris-tricine凝胶上发生一定的迁移,是由于分子量小的蛋白形成球形,其较高的多肽内部的电荷不能被结合的SDS电荷所覆盖,所以偏离了相对迁移率和分子量对数的相互关系。电泳结果表明,在大肠杆菌中成功表达了大肠杆菌来源的aspA和谷氨酸棒杆菌来源的panD。
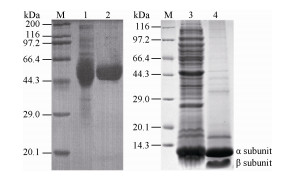
2.2 双酶偶联催化富马酸生成β-丙氨酸 2.2.1 AspA催化富马酸加氨生成L-天冬氨酸10 μg/mL的AspA纯酶催化50 mmol/L的富马酸,结果如图 2所示。催化反应在2 h后即达稳定状态,由于该反应是可逆反应,即使延长反应时间,L-天冬氨酸的摩尔产率仍为75%。

|
| 图 2 AspA催化富马酸生成L-天冬氨酸 Figure 2 AspA catalyzes fumarate. |
| |
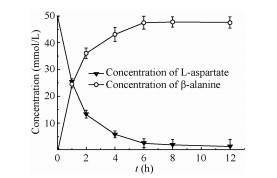
400 μg/mL PanD催化L-天冬氨酸合成β-丙氨酸的反应情况如图 3所示,50 mmol/L底物可在8 h内完全转化为L-天冬氨酸,转化率约为98%。
|
| 图 3 PanD催化L-天冬氨酸生成β-丙氨酸 Figure 3 PanD catalyzes L-aspartate. |
| |
上述结果可知,PanD的酶活较AspA低,催化反应进行较慢,是双酶体系中的限速酶。PanD的最适反应温度为55 ℃,最适pH为7.0左右[18],而AspA的最适条件分别为55 ℃和pH 8.0左右[19]。由于偶联反应时间较长,考虑到蛋白酶在55 ℃条件下的反应12 h酶活损失严重,设定双酶偶联体系反应条件为37 ℃、pH 7.0。
在双酶偶联催化体系中,固定富马酸浓度为50 mmol/L,AspA的添加浓度为10 μg/mL,调整PanD的添加量,使AspA与PanD的加酶质量比分别为1:40、1:60、1:80,进行双酶偶联反应。
结果如图 4所示,在1:40和1:60 (W/W)的反应体系中,反应8 h,β-丙氨酸的产率只有82%和93%,且尚有部分中间产物未完全转化,留在反应体系中,反应至12 h,1:40的反应体系中仍有中间产物。

|
| 图 4 不同酶浓度比例下的双酶偶联催化 Figure 4 Enzyme cascade synthesis with different ratio. (A) AspA: PanD was 1:40 (W:W); (B) The ratio of AspA and PanD was 1:60 (W:W); (C) The ratio of AspA and PanD was 1:80 (W:W). |
| |
而在1:80的反应体系中,反应8 h,富马酸可完全转化为β-丙氨酸,β-丙氨酸的产率 > 95%,中间产物L-天冬氨酸无残余。
随着PanD浓度的提高,β-丙氨酸的合成速度大大增加,且中间产物L-天冬氨酸的残余量减少。综合考虑选择1:80 (W/W)作为最适浓度比。
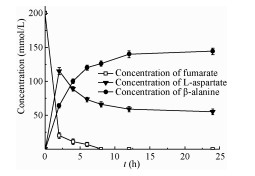
2.4 优化底物富马酸浓度前期研究以50 mmol/L的富马酸为底物进行酶促反应研究,此浓度无法满足高浓度制备β-丙氨酸的要求,故将AspA和PanD按照1:80 (W/W)的比例催化浓度为50、100、200 mmol/L的富马酸,HPLC检测β-丙氨酸含量(表 1)。同时监测了200 mmol/L富马酸反应进程中富马酸、天冬氨酸与β-丙氨酸的变化情况(图 5)。
|
| 图 5 双酶偶联体系催化200 mmol/L富马酸 Figure 5 Enzyme cascade synthesis 200 mmol/L fumarate. |
| |
| Fumarate (mmol/L) | 6 h (mmol/L) | 8 h (mmol/L) | 12 h (mmol/L) | 24 h (mmol/L) |
| 50 | 49.3±2.1 | 49.5±1.8 | 49.6±1.2 | 49.9±1.1 |
| 100 | 87.2±4.4 | 89.5±3.8 | 90.9±2.5 | 94.1±2.6 |
| 200 | 120.0±5.6 | 126±3.4 | 140.6±4.6 | 143.4±3.2 |
表 1结果显示,底物浓度为50 mmol/L时,酶促反应能在8 h内转化率达100%;底物浓度为100 mmol/L时,8 h内摩尔生成率为90%,合成β-丙氨酸的浓度为90 mmol/L,24 h后β-丙氨酸的产率在95%左右;当底物浓度增加至200 mmol/L时,反应速度明显减缓,8 h内β-丙氨酸的摩尔生成率为62%,体系中β-丙氨酸的浓度为126 mmol/L,延长反应时间至24 h后,β-丙氨酸的摩生成尔率为70%。图 5结果显示底物浓度为200 mmol/L时,反应12 h后残余约40 mmol/L的中间产物L-天冬氨酸,我们推测是由于高浓度的β-丙氨酸对PanD酶有抑制作用,使得β-丙氨酸得率在高浓度底物条件下反而降低至62%。
双酶偶联酶促反应的转化率随着时间的延长而增加,但由于反应逐渐趋于平衡,且振荡反应过程中部分酶会失活,24 h后反应体系中可明显观察到白色悬浮物,推断为蛋白酶变性沉淀。
3 结论本文利用AspA和PanD构建双酶偶联反应体系,催化底物富马酸合成β-丙氨酸。通过优化反应条件,确定最佳反应条件:100 mmol/L富马酸,AspA与PanD比例为1:80,其中AspA的浓度为10 μg/mL,温度37 ℃,pH 7.0。此条件下,8 h时β-丙氨酸的浓度为90 mmol/L,约合7 g/L。提高富马酸浓度为200 mmol/L,8 h底物的摩尔生成率为63%,β-丙氨酸的浓度约为126 mmol/L,约合10 g/L,相较之前的研究有显著的提高。然而就工业生产而言,β-丙氨酸的产量仍有很大提升空间。有文献报道真核来源的PanD酶具有更高的催化活性,下一步将考虑用真核来源PanD酶替代谷氨酸棒杆菌来源的PanD酶,进一步提高β-丙氨酸的产量。同时,细胞催化具有可重复利用、操作简便等优点,建立并优化全细胞催化工艺是下一步研究方向。
| [1] | Fouad WM, Altpeter F. Transplastomic expression of bacterial L-aspartate-α-decarboxylase enhances photosynthesis and biomass production in response to high temperature stress. Transgenic Res, 2009, 18(5): 707–718. DOI: 10.1007/s11248-009-9258-z |
| [2] | Stuecker TN, Tucker AC, Escalante-Semerena JC. PanM, an acetyl-coenzyme A sensor required for maturation of L-aspartate decarboxylase (PanD). mBio, 2012, 3(4): e00158–12. |
| [3] |
Luo JX, Xue JP, Shen YC. Synthesis and application of β-alanine.
Amino Acids Biotic Resour, 2005, 27(1): 52–55.
(in Chinese). 罗积杏, 薛建萍, 沈寅初. β-氨基丙酸的合成与应用. 氨基酸和生物资源, 2005, 27(1): 52-55. |
| [4] | Buc SR, Ford JH, Wise EC. An improved synthesis of β-alanine. J Am Chem Soc, 1945, 67(1): 92–94. DOI: 10.1021/ja01217a033 |
| [5] | Shen Y, Zhao LZ, Li YR, et al. Synthesis of β-alanine from L-aspartate using L-aspartate-α-decarboxylase from Corynebacterium glutamicum. Biotechnol Lett, 2014, 36(8): 1681–1686. DOI: 10.1007/s10529-014-1527-0 |
| [6] | Williamson JM, Brown GM. Purification and properties of L-Aspartate-α-decarboxylase, an enzyme that catalyzes the formation of β-alanine in Escherichia coli. J Biol Chem, 1979, 254(16): 8074–8082. |
| [7] | Dusch N, Pühler A, Kalinowski J. Expression of the Corynebacterium glutamicum panD gene encoding L-aspartate-α-decarboxylase leads to pantothenate overproduction in Escherichia coli. Appl Environ Microbiol, 1999, 65(4): 1530–1539. |
| [8] | Chopra S, Pai H, Ranganathan A. Expression, purification, and biochemical characterization of Mycobacterium tuberculosis aspartate decarboxylase, PanD. Protein Expr Purif, 2002, 25(3): 533–540. DOI: 10.1016/S1046-5928(02)00039-6 |
| [9] |
Zhang XX. Cloning and expression of L-aspartate α-decarboxylase gene in C. crenatum[D]. Hangzhou: Zhejiang University of Technology, 2008 (in Chinese). 张潇潇. 钝齿棒杆菌L-天冬氨酸α-脱羧酶基因的克隆与表达[D]. 杭州: 浙江工业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10337-2008150524.htm |
| [10] |
Fan HY. Preparation and application of recombinant Escherichia coli L-aspartate-a-decdarboxylase[D]. Shanghai: East China University of Science and Technology, 2013 (in Chinese). 范海洋. 重组大肠杆菌L-天冬氨酸-α-脱羧酶的制备及应用研究[D]. 上海: 华东理工大学, 2013. |
| [11] | Shi WX, Dunbar J, Jayasekera MMK, et al. The structure of L-aspartate ammonia-lyase from Escherichia coli. Biochemistry, 1997, 36(30): 9136–9144. DOI: 10.1021/bi9704515 |
| [12] |
Lou J. Study on production β-alanine by biotransformation[D]. Hangzhou: Zhejiang University of Technology, 2006 (in Chinese). 楼坚. 生物转化法生产β-丙氨酸的研究[D]. 杭州: 浙江工业大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10337-2006169188.htm |
| [13] |
Lin L, Zhang J. The isolation, purification and properties of high activity aspartase.
Acta Sci Nat Univ Jilinensis, 1999(2): 75–78.
(in Chinese). 林琳, 张今. 高活力天冬氨酸酶的分离提纯及性质. 吉林大学自然科学学报, 1999(2): 75-78. |
| [14] |
Cao ZW. An effective method of Tricine-SDS-PAGE for separating the 1kDa peptide.
China Biotechnol, 2004, 24(1): 74–76.
(in Chinese). 曹佐武. 有效分离1kDa小肽的Tricine-SDS-PAGE方法. 中国生物工程杂志, 2004, 24(1): 74-76. |
| [15] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72(1/2): 248–254. |
| [16] |
Yang Y, Qin Q, Guo WZ. Separation and quantitative analysis of amino acids derivatized with phenyl isothiocyanate by high performance liquid chromatography (HPLC).
Chin J Chromatogr, 1994, 12(4): 295–296.
(in Chinese). 杨扬, 秦强, 郭伟忠. 苯基异硫氰酸酯衍生氨基酸的高效液相色谱分析. 色谱, 1994, 12(4): 295-296. |
| [17] | Ramjee MK, Genschel U, Abell C, et al. Escherichia coli L-aspartate-α-decarboxylase: preprotein processing and observation of reaction intermediates by electrospray mass spectrometry. Biochem J, 1997, 323(3): 661–669. DOI: 10.1042/bj3230661 |
| [18] |
Shi ZX, Cui WJ, Zhou L, et al. Cloning and characterization of L-aspartate-α-decarboxylase from Corynebacterium glutamicum.
Biotechnol Bull, 2013(4): 110–115.
(in Chinese). 石增秀, 崔文璟, 周丽, 等. 谷氨酸棒杆菌L-天冬氨酸α-脱羧酶基因的克隆及重组酶性质研究. 生物技术通报, 2013(4): 110-115. |
| [19] |
Ren HY, Li XJ, Yang DY, et al. Study on fusion expression of aspartase in E. coli.
Amino Acids Biotic Resour, 2012, 34(1): 13–15, 20.
(in Chinese). 任慧颖, 黎小军, 杨丹燕, 等. 天冬氨酸酶E. coli融合表达研究. 氨基酸和生物资源, 2012, 34(1): 13-15, 20. |
 2017, Vol. 33
2017, Vol. 33