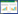中国科学院微生物研究所、中国微生物学会主办
文章信息
- 潘剑茹, 吴伦巧, 何火聪, 陈莉娟, 苏颖, 李玲玲, 刘树滔
- Pan Jianru, Wu Lunqiao, He Huocong, Chen Lijuan, Su Ying, Li Lingling, Liu Shutao
- GST-SOD1-R9融合蛋白的表达、纯化、稳定性与跨膜效应
- Expression, purification, stability and transduction efficiency of GST-SOD1-R9 fusion protein
- 生物工程学报, 2017, 33(5): 828-837
- Chinese Journal of Biotechnology, 2017, 33(5): 828-837
- 10.13345/j.cjb.160401
-
文章历史
- Received: October 26, 2016
- Accepted: December 22, 2016
2 福建医科大学附属肿瘤医院 福建省科技厅转化医学重点实验室 福建省肿瘤医院放射生物学及肿瘤放射治疗学研究室,福建 福州 350014
2 Fujian Cancer Hospital & Fujian Medical University Cancer Hospital, Laboratory of Radiation Oncology and Radiobiology, Fujian Key Laboratory of Tumor Translational Cancer Medicine, Fuzhou 350014, Fujian, China
氧化压力会导致ROS (活性氧自由基)的大量产生,活性氧或活性氮爆发可能影响直接或间接参与氧化代谢的蛋白/基因[1-2]。慢性炎症反应就与这种对正常的氧化代谢持续不断的干扰有关[3-4]。超氧阴离子自由基O2·–是ROS中毒性较大的一种,它不仅产生直接的氧化损伤作用,还会作为信使,将氧化损伤带给受损细胞周围的正常细胞[5]。
生物体内存在维持ROS数量从而防止氧化损伤的天然屏障。这个屏障由各种抗氧化酶组成。超氧化物歧化酶(Superoxide dismutase,SOD)是这些天然抗氧化酶中一种十分重要的胞内酶。它能催化体内不同来源的超氧阴离子生成氧气和过氧化氢,过氧化氢可在过氧化物酶或过氧化氢酶的作用下进一步生成水(H2O)和氧气,从而保护机体免受超氧阴离子自由基O2·–的毒性作用[6],是目前为止所发现的唯一可以清除O2·–的酶。人体内有位于胞浆的Cu, Zn-SOD (SOD1)、位于线粒体的Mn-SOD (SOD2) 和分泌到胞外的EC-SOD (SOD3),它们从不同的部位分工清除O2·–。但由于分子量太大,天然SOD无法进入细胞,清除细胞内的自由基。
起源于HIV-1 Tat蛋白的细胞穿膜肽TAT (YGRKKRRQRRR)可携带大分子跨膜进入细胞[7-12]。前期实验证实SOD1和TAT融合在一起后就可以进入细胞,预防细胞内的自由基过量导致的氧化损伤[13-16]。但胞内自由基并非只有一种,为了进一步增强抗氧化损伤能力,为此,我们设计构建了双效抗氧化酶GST-TAT-SOD1。GST (谷胱甘肽-S-转移酶)是生物体内一种重要的解毒酶,它可以催化亲核性的谷胱甘肽与自由基的结合反应,起到解毒作用[17-18]。实验结果表明,TAT介导的双效抗氧化酶具有比SOD1-TAT更好的预防放射损伤的能力,但前者的跨膜能力不如后者[19-20]。这一方面是由于前者的分子量比后者大,另一方面可能是由于前者的TAT处于融合蛋白的中间部分,影响了其与细胞膜的接触。
为了进一步增强双效抗氧化酶的跨膜能力,以提升其应用潜力,我们引入了TAT衍生物R9取代TAT,R9是带有9个Arg的穿膜肽,其跨膜效率是TAT的20倍[21],并将其融合在双效抗氧化酶GST-SOD1的C端。本研究拟合成SOD1-R9全长基因,将SOD1-R9克隆至带有GST标签的pGEX-4T-1质粒,构建重组质粒pGEX-4T-1-SOD1-R9,转化后表达得到GST-SOD1-R9融合蛋白,优化表达条件,并对表达的蛋白进行纯化、鉴定及稳定性研究,最后对其跨膜效应进行了验证,为进一步研究GST-SOD1-R9融合蛋白抗氧化损伤效应等提供实验基础。
1 材料与方法 1.1 材料pGEX-4T-1质粒、大肠杆菌DH5α、大肠杆菌BL21 (DE3) 均为本实验室保存;Taq酶购自TaKaRa公司;质粒提取试剂盒、胶回收试剂盒购自QIAGEN公司;各种限制性内切酶购自NEB公司;GST亲和柱购自生工生物工程上海(股份)有限公司;IPTG、考马斯亮蓝R-250购自AMRESCO公司;蛋白marker购于Fermentas公司;DNA marker购自北京天根生化科技有限公司;基因合成与DNA测序由生工生物工程上海(股份)有限公司进行。SOD和GST活力检测试剂盒购自南京建成生物工程研究所。BCA蛋白含量检测试剂盒购自Thermo Scientific (美国)。FITC购自Sigma (美国)。L-02人正常肝细胞株购自中国科学院典型培养物保藏委员会细胞库。
1.2 质粒的构建全基因合成SOD1-R9的基因序列,在其上、下游分别引入EcoRⅠ和XhoⅠ酶切位点,将其与pGEX-4T-1质粒均用EcoRⅠ和XhoⅠ进行双酶切,然后用T4 DNA连接酶将酶切后经胶回收纯化的SOD1-R9和pGEX-4T-1于4 ℃连接过夜,转化大肠杆菌BL21 (DE3),挑取单菌落培养后提取质粒进行EcoRⅠ和XhoⅠ双酶切鉴定,并将双酶切鉴定正确的阳性克隆进行DNA测序鉴定。
1.3 GST-SOD1-R9融合蛋白的诱导表达将DNA测序正确的阳性克隆菌于37 ℃培养至OD600=0.6-0.8时,分别加入CuSO4、ZnSO4和IPTG至终浓度为0.5 mmol/L、0.1 mmol/L和0.25 mmol/L,诱导GST-SOD1-R9融合蛋白表达,同时探索诱导时间及诱导温度对表达量的影响。取诱导后的菌液,10 000 r/min离心2 min,弃上清收集菌体沉淀,一部分菌体直接加入SDS-PAGE电泳样品处理液,用于检测全菌蛋白;另一部分加入9倍体积的缓冲液1 (50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl,5%甘油,2 mmol/L DTT),冰浴超声破碎30 min,然后10 000 r/min离心20 min,取上清电泳检测。
用12.5% SDS-PAGE和考马斯亮蓝染色比较不同条件下的菌体全蛋白与超声破碎上清中的蛋白比例,分析融合蛋白在不同条件下的表达量,筛选较好的可溶表达条件。
1.4 GST-SOD1-R9融合蛋白的纯化在最佳诱导条件下诱导GST-SOD1-R9融合蛋白的表达。收集诱导后菌体超声破碎的上清液,按体积在冰浴中缓慢加入硫酸铵(561 g/L),待硫酸铵全部溶解后,继续搅拌30 min后,置于4 ℃冰箱静置过夜。沉淀结束后4 ℃、12 000 r/min离心20 min,收集沉淀,加入2倍体积的缓冲液2 (10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,2.7 mmol/L KCl,pH 7.3) 溶解,4 ℃、12 000 r/min离心10 min,收集上清,利用GST亲和柱,按照柱子说明书进行纯化。分别收集亲和柱穿透峰和洗脱峰,进行12.5%的SDS-PAGE。
1.5 GST-SOD1-R9融合蛋白的鉴定使用SOD和GST活力检测试剂盒,按试剂盒说明书分别测定纯化后的GST-SOD1-R9融合蛋白的SOD和GST活力,结合SDS-PAGE测定的蛋白分子量,鉴定是否为目标蛋白。
1.6 GST-SOD1-R9融合蛋白的稳定性取等份GST-SOD1-R9融合蛋白,分别置于25 ℃、37 ℃、50 ℃、60 ℃、80 ℃的水浴中保温30 min,取出,待回至室温,取样分别测定残留SOD活力和GST活力,分析融合蛋白的热稳定性。
取等份GST-SOD1-R9融合蛋白,用广泛缓冲液分别调至pH 4.0、5.0、6.0、7.0、8.0,4 ℃放置30 min,取出,待回至室温,取样分别测定残留SOD活力和GST活力,分析融合蛋白的pH稳定性。
1.7 GST-SOD1-R9融合蛋白的跨膜效应参照替换文献[19],分别用FITC标记GST-TAT-SOD1和GST-SOD1-R9融合蛋白。
取对数生长期的L-02细胞用含15%小牛血清的细胞培养液配成单个细胞悬液,将其接种到24孔板,每孔40 000个细胞,培养24 h。吸去培养液,加磷酸缓冲液(PBS)清洗2次,往每孔中分别加入400 μL不同浓度的FITC-蛋白,37 ℃作用3 h。吸去蛋白液,用PBS清洗2次,加入250 μL细胞裂解液(0.5% Triton-X-100+0.1% SDS),漩涡振荡2 min,放置4 ℃、15 min后、1 200 r/min离心5 min,取200 μL上清液用荧光酶标仪检测,并以BCA试剂盒测定上清液的蛋白含量。以每μg细胞蛋白所对应的荧光强度来比较2种融合蛋白的跨膜效率。
每组数据3个平行孔,采用Excel软件进行统计处理,作标准差计算、t检验等。以P > 0.05为相差无显著性。
2 结果与分析 2.1 pGEX-4T-1-SOD1-R9原核表达载体的构建将合成的SOD1-R9基因片段和pGEX-4T-1质粒均用EcoRⅠ和XhoⅠ内切酶进行双酶切,胶回收纯化酶切后的SOD1-R9基因片段和pGEX-4T-1质粒片段,通过T4 DNA连接酶将SOD1-R9基因定向插入到pGEX-4T-1质粒的多克隆位点中。挑取单菌落培养后提取质粒进行EcoRⅠ和XhoⅠ酶切鉴定,结果见图 1。重组子经酶切鉴定后得到2条目的带,大约为4 946 bp和492 bp,分别与pGEX-4T-1质粒和SOD1-R9预期分子量一致。将酶切鉴定正确的质粒进行DNA测序鉴定,测序结果与预期的序列一致,证明SOD1-R9基因已经成功插入pGEX-4T-1载体,pGEX-4T-1-SOD1-R9重组质粒构建成功。
|
| 图 1 重组质粒pGEX-4T-1-SOD1-R9的构建 Figure 1 Construction of pGEX-4T-1-SOD1-R9 recombinant plasmid. M: DNA marker; 1: pGEX4T-1-SOD1-R9 recombinant plasmid; 2: digestion identification of pGEX4T-1-SOD1-R9 with EcoRⅠ and XhoⅠ. |
| |
将重组质粒pGEX-4T-1-SOD1-R9转化大肠杆菌BL21 (DE3),收集细菌进行SDS-PAGE分析,结果如图 2和图 3所示。
|
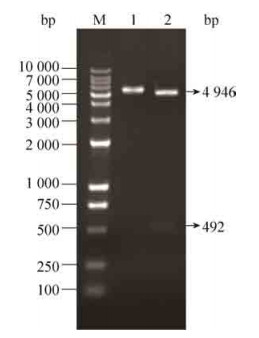
| 图 2 诱导时间对GST-SOD1-R9融合蛋白表达量的影响 Figure 2 Effect of inducing time on the expression of GST-SOD1-R9 fusion protein. (A) Total protein. (B) Soluble fractions. M: protein weight marker; ←: GST-SOD1-R9. |
| |

|
| 图 3 诱导温度对GST-SOD1-R9融合蛋白表达量的影响 Figure 3 Effect of inducing temperature on the expression of GST-SOD1-R9 fusion protein. (A) Total protein. (B) Soluble fractions. M: protein weight marker; ←: GST-SOD1-R9. |
| |
由图 2可知,与未诱导的菌体相比,诱导温度为20 ℃时,随着诱导时间的增加,融合蛋白的表达量也逐渐增加。对比图 2A与图 2B可知,融合蛋白基本处于菌体超声破碎液的上清中,表明诱导而得的GST-SOD1-R9融合蛋白主要以可溶性的形式存在,最佳诱导时间为11 h。
由图 3可知,同样诱导6 h,不同的诱导温度对GST-SOD1-R9融合蛋白的表达量与可溶表达有很大影响。诱导温度为16 ℃,融合蛋白的表达量较低,随着诱导温度的增加,融合蛋白的表达量随之增加。但当诱导温度达到37 ℃时,菌体超声破碎液的上清中的融合蛋白量开始降低,这表明可能有部分融合蛋白形成了包涵体。对比图 3A与图 3B可知,最佳诱导温度为25 ℃。
2.3 GST-SOD1-R9融合蛋白的纯化与鉴定GST-SOD1-R9表达菌超声破碎后,收集上清,进行80%硫酸铵沉淀。沉淀溶解液使用GST亲和柱纯化后,最终得到高纯度的GST-SOD1-R9融合蛋白,结果如图 4所示。

|
| 图 4 GST-SOD1-R9融合蛋白的纯化 Figure 4 Purification of GST-SOD1-R9 fusion protein. 1: precipitation of supernatant with 80% ammonium sulfate; 2-3: flow-through of GST affinity chromatography resin; 4-9: elutions of GST affinity chromatography resin; M: protein marker. |
| |
通过计算,可知图 4中GST-SOD1-R9融合蛋白实际分子量约为46 kDa,GST-SOD1-R9蛋白理论分子量为45 kDa左右,二者基本相符。由于GST-SOD1-R9融合蛋白是由SOD和GST两种抗氧化酶融合而得的独特蛋白,同时具有SOD和GST活力,因此我们进一步使用SOD和GST检测试剂盒分别测定了该蛋白的酶活力。结果表明,纯蛋白的SOD活力为7 800 U/mL,GST活力为740 U/mL。综合分子量与活性分析的结果,可确认GST-SOD1-R9融合蛋白得到正确的表达。
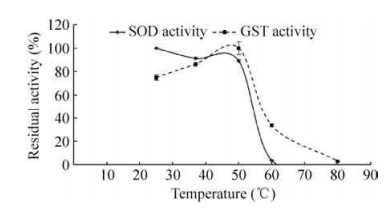
2.4 GST-SOD1-R9融合蛋白的稳定性由图 5可以看出,温度对GST-SOD1-R9融合蛋白酶活的影响很大。融合蛋白的SOD活力在50 ℃以内随温度的升高缓慢降低,当处理温度超过50 ℃后,活性随温度的升高迅速降低,在60 ℃水浴30 min后,SOD活力几乎完全丧失。融合蛋白的GST活力在50 ℃以内随温度的升高缓慢升高,当处理温度超过50 ℃后,活性开始随温度的升高而降低,在60 ℃水浴30 min后,GST活力还有约33%,在80 ℃水浴30 min后,GST活力接近于0。
|
| 图 5 GST-SOD1-R9融合蛋白的温度稳定性 Figure 5 Thermal stability of GST-SOD1-R9 fusion protein. |
| |
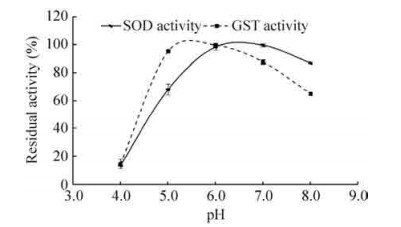
由图 6可以看出,pH对GST-SOD1-R9融合蛋白酶活也有很大影响。融合蛋白的SOD活力在pH≤6的范围内随pH的降低而降低,在pH 6-7的范围内活力基本不变,当pH超过7后,活性随pH的升高而降低。融合蛋白的GST活力在pH≤5.3的范围内随pH的降低而迅速降低,在pH 5-6的范围内活力基本不变,当pH超过6后,活性随pH的升高而降低。
|
| 图 6 GST-SOD1-R9融合蛋白的温度稳定性 Figure 6 pH stability of GST-SOD1-R9 fusion protein. |
| |
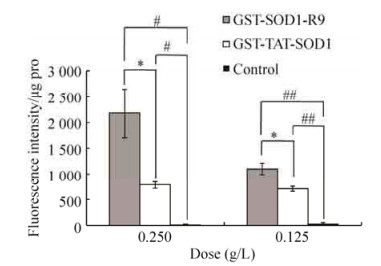
为比较两种融合蛋白的跨膜能力,将它们进行FITC标记后通过细胞内荧光强度的变化检测其对正常人肝细胞株L-02的跨膜效果,结果如图 7所示。由图 7可知,两种融合蛋白都有显著的跨膜能力(P < 0.05)。但无论在0.125 mg/mL还是0.25 mg/mL的剂量下,GST-SOD1-R9融合蛋白进入细胞的量都显著高于GST-TAT-SOD1融合蛋白(P < 0.05),尤其是0.25 mg/mL的剂量下,前者的跨膜量是后者的2.5倍以上(P < 0.05)。这表明GST-SOD1-R9融合蛋白比GST-TAT-SOD1融合蛋白具有更强的跨膜能力。
|
| 图 7 GST-SOD1-R9融合蛋白的跨膜效应 Figure 7 Transduction of GST-SOD1-R9 fusion protein in vitro. The bars indicate the x± s. (n=3, compared with control group, ##P < 0.01, #P < 0.05, compared with GST-TAT-SOD1 group, *P < 0.05). |
| |
超氧阴离子是引起机体氧化损伤的主要原因之一,SOD是唯一一种可以清除超氧阴离子的天然酶,在抗氧化损伤方面具有重要应用价值。然而受分子量限制,SOD对胞内的自由基束手无策。为此,我们先是将其与穿膜肽TAT融合,突破了SOD的应用屏障[13-16],并在此基础上,融合载体自带的GST,设计构建了TAT介导的双效抗氧化酶GST-TAT-SOD1,取得了更好的清除胞内自由基的效果,但它的跨膜能力却不如单纯的SOD1-TAT,约为其80%左右[19-20]。
现有的研究结果表明,TAT可以穿膜的首要原因在于其含有多个碱性氨基酸,这使其带有大量正电荷,易于吸附在细胞膜上,然后诱发细胞内吞实现跨膜[22]。TAT的跨膜能力主要与其精氨酸残基有关,它们不仅提供了正电荷,其特有的胍基使其跨膜能力强于其他几种阳离子氨基酸(组氨酸、赖氨酸和鸟氨酸)。在所有的TAT类似肽衍生物中,L-精氨酸的9聚体(R9) 被证实比TAT的效率高20倍[21, 23-25]。融合了R9穿膜肽的过氧化氢酶(CAT)的跨膜效率是融合了TAT穿膜肽的过氧化氢酶的1.5倍左右[26]。此外,穿膜肽在蛋白中所处的位置也会影响其介导的蛋白的跨膜能力。我所早期研究结果表明,在自由C端融合穿膜肽的GST-GFP (绿色荧光蛋白)-TAT的跨膜效率是将穿膜肽融合在两个蛋白中间的GST-TAT-GFP的2倍以上[27]。
为此,本研究重新设计了可穿膜的双效抗氧化酶。在新的设计中,我们以R9作为穿膜肽,将其融合在SOD1的C端,再在SOD1的N端,融合载体自带的GST,得到可穿膜的新型双效抗氧化酶GST-SOD1-R9融合蛋白。GST-SOD1-R9融合蛋白在其N端融合的GST的帮助下,可实现可溶表达,其可溶表达量受诱导时间和诱导温度影响。经过诱导条件的优化,本研究利用IPTG,在25 ℃时诱导11 h,得到高表达量的可溶性GST-SOD1-R9融合蛋白。然后通过超声破碎,80%硫酸铵沉淀和GST亲和柱纯化得到了电泳纯蛋白,该蛋白分子量与理论分子量相符,同时具有SOD和GST活力,证实我们构建与表达了正确的蛋白。
此外,本研究还对GST-SOD1-R9融合蛋白的温度和pH稳定性进行了研究,结果表明,在37-50 ℃的范围内,该蛋白的SOD活力残留91%-89%,GST活力残留86%-100%;在pH 6-7的范围内,该蛋白的SOD活力残留99%-100%,GST活力残留100%-88%,表明GST-SOD1-R9融合蛋白在生理条件下具有良好的活性。与GST-TAT-SOD1的稳定性[28]相比,二者pH稳定性相当,但当蛋白的处理温度大于50 ℃时,GST-SOD1-R9更容易丧失活性。最终的细胞跨膜实验结果表明,本研究构建的GST-SOD1-R9融合蛋白低剂量(0.125 mg/mL)下,跨膜能力是GST-TAT-SOD1融合蛋白的1.6倍以上(P < 0.05),高剂量(0.25 mg/mL)下,跨膜能力超过GST-TAT-SOD1融合蛋白2.5倍以上(P < 0.05)。由此可知,GST-SOD1-R9融合蛋白的跨膜能力已超过SOD1-TAT。
综上所述,重新构建的GST-SOD1-R9融合蛋白可取代GST-TAT-SOD1融合蛋白,更有效地发挥双效抗氧化能力,防治机体各种氧化损伤。
| [1] | Mikkelsen RB, Wardman P. Biological chemistry of reactive oxygen and nitrogen and radiation-induced signal transduction mechanisms. Oncogene, 2003, 22(37): 5734–5754. DOI: 10.1038/sj.onc.1206663 |
| [2] | Wu CG, Parrott AM, Fu CX, et al. Thioredoxin 1-mediated post-translational modifications: reduction, transnitrosylation, denitrosylation, and related proteomics methodologies. Antioxid Redox Signal, 2011, 15(9): 2565–2604. DOI: 10.1089/ars.2010.3831 |
| [3] | Formenti SC, Demaria S. Local control by radiotherapy: is that all there is?. Breast Cancer Res, 2008, 10(6): 215. DOI: 10.1186/bcr2160 |
| [4] | Robbins MEC, Zhao W. Chronic oxidative stress and radiation-induced late normal tissue injury: a review. Int J Radiat Biol, 2004, 80(4): 251–259. DOI: 10.1080/09553000410001692726 |
| [5] | Azzam EI, Jay-Gerin JP, Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury. Cancer Lett, 2012, 327(1/2): 48–60. |
| [6] | McCord JM, Fridovich I. Superoxide dismutase: an enzymic function for erythrocuprein (hemocuprein). J Biol Chem, 1969, 244(22): 6049–6055. |
| [7] | Eguchi A, Akuta T, Okuyama H, et al. Protein transduction domain of HIV-1 tat protein promotes efficient delivery of DNA into mammalian cells. J Biol Chem, 2001, 276(28): 26204–26210. DOI: 10.1074/jbc.M010625200 |
| [8] | Josephson L, Tung CH, Moore A, et al. High-efficiency intracellular magnetic labeling with novel superparamagnetic-tat peptide conjugates. Bioconjug Chem, 1999, 10(2): 186–191. DOI: 10.1021/bc980125h |
| [9] | Lewin M, Carlesso N, Tung CH, et al. Tat peptide-derivatized magnetic nanoparticles allow in vivo tracking and recovery of progenitor cells. Nat Biotechnol, 2000, 18(4): 410–414. DOI: 10.1038/74464 |
| [10] | Rothbard JB, Garlington S, Lin Q, et al. Conjugation of arginine oligomers to cyclosporin a facilitates topical delivery and inhibition of inflammation. Nat Med, 2000, 6(11): 1253–1257. DOI: 10.1038/81359 |
| [11] | Torchilin VP, Rammohan R, Weissig V, et al. TAT peptide on the surface of liposomes affords their efficient intracellular delivery even at low temperature and in the presence of metabolic inhibitors. Proc Natl Acad Sci USA, 2001, 98(15): 8786–8791. DOI: 10.1073/pnas.151247498 |
| [12] | Wadia JS, Dowdy SF. Protein transduction technology. Curr Opin Biotechnol, 2002, 13(1): 52–56. DOI: 10.1016/S0958-1669(02)00284-7 |
| [13] |
Pan JR, Zhou JH, Peng SM, et al. The preventing effects of recombinant protein PTD-SOD on guinea pigs damaged by Ultraviolet B.
J Radiat Res Radiat Process, 2009, 27(5): 297–302.
(in Chinese). 潘剑茹, 周静宏, 彭树美, 等. 融合蛋白PTD-SOD对豚鼠UVB损伤的预防效应. 辐射研究与辐射工艺学报, 2009, 27(5): 297-302. |
| [14] |
Pan JR, Peng SM, Zhou JH, et al. Protective effects of recombinant protein PTD-SOD on guinea pigs damaged by ultraviolet B.
Radiat Protect, 2010, 30(5): 284–288.
(in Chinese). 潘剑茹, 彭树美, 周静宏, 等. 融合蛋白PTD-SOD对受紫外线照射豚鼠皮肤损伤的保护作用. 辐射防护, 2010, 30(5): 284-288. |
| [15] | Pan JR, Zhou KJ, Zheng GJ, et al. Crystallization and preliminary X-ray diffraction analysis of the SOD-TAT fusion protein. Acta Crystallogr Sect F: Struct Biol Cryst Commun, 2012, 68(5): 543–546. DOI: 10.1107/S1744309112012031 |
| [16] | Pan JR, Su Y, Hou XJ, et al. Protective effect of recombinant protein SOD-TAT on radiation-induced lung injury in mice. Life Sci, 2012, 91(3/4): 89–93. |
| [17] | Douglas KT. Mechanism of action of glutathione-dependent enzymes. Adv Enzymol Relat Areas Mol Biol, 1987, 59: 103–167. |
| [18] | Leaver MJ, George SG. A piscine glutathione S-transferase which efficiently conjugates the end-products of lipid peroxidation. Mar Environ Res, 1998, 46(1/5): 71–74. |
| [19] | Pan JR, He HC, Su Y, et al. GST-TAT-SOD: cell permeable bifunctional antioxidant enzyme-a potential selective radioprotector. Oxid Med Cell Longev, 2016, 2016: 5935080. |
| [20] |
Pan JR. Radioprotective effect of intracellular free radical scavenger[D]. Fuzhou: Fuzhou University, 2012 (in Chinese). 潘剑茹. 细胞内自由基清除剂的放射防护效应[D]. 福州: 福州大学, 2012. |
| [21] | Wender PA, Mitchell DJ, Pattabiraman K, et al. The design, synthesis, and evaluation of molecules that enable or enhance cellular uptake: peptoid molecular transporters. Proc Natl Acad Sci USA, 2000, 97(24): 13003–13008. DOI: 10.1073/pnas.97.24.13003 |
| [22] | Li H, Tsui TY, Ma WX. Intracellular delivery of molecular cargo using cell-penetrating peptides and the combination strategies. Int J Mol Sci, 2015, 16(8): 19518–19536. DOI: 10.3390/ijms160819518 |
| [23] | Rothbard JB, Kreider E, Vandeusen CL, et al. Arginine-rich molecular transporters for drug delivery: role of backbone spacing in cellular uptake. J Med Chem, 2002, 45(17): 3612–3618. DOI: 10.1021/jm0105676 |
| [24] | Gammon ST, Villalobos VM, Prior JL, et al. Quantitative analysis of permeation peptide complexes labeled with technetium-99m: chiral and sequence-specific effects on net cell uptake. Bioconjug Chem, 2003, 14(2): 368–376. DOI: 10.1021/bc0256291 |
| [25] | Wright LR, Rothbard JB, Wender PA. Guanidinium rich peptide transporters and drug delivery. Curr Protein Pept Sci, 2003, 4(2): 105–124. DOI: 10.2174/1389203033487252 |
| [26] | Jin LH, Bahn JH, Eum WS, et al. Transduction of human catalase mediated by an HIV-1 tat protein basic domain and arginine-rich peptides into mammalian cells. Free Radic Biol Med, 2001, 31(11): 1509–1519. DOI: 10.1016/S0891-5849(01)00734-1 |
| [27] |
Chen J, Fu R, Liu ST, et al. Transmembrane activity of PTD of tat protein fused at carboxyl-terminus of heterologous protein.
Chin J Biochem Mol Biol, 2005, 21(4): 459–464.
(in Chinese). 陈菁, 傅蓉, 刘树滔, 等. Tat蛋白转导区域位于融合蛋白C端时的跨膜递送作用. 中国生物化学与分子生物学报, 2005, 21(4): 459-464. |
| [28] |
Pan JR, Zheng GJ, Huang WB, et al. Stability comparison of SOD from different sources.
J Fuzhou Univ: Nat Sci Ed, 2009, 37(5): 756–759.
(in Chinese). 潘剑茹, 郑光进, 黄文斌, 等. 不同来源SOD蛋白的稳定性比较. 福州大学学报:自然科学版, 2009, 37(5): 756-759. |
 2017, Vol. 33
2017, Vol. 33