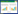中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李佳瑞, 王泽建, 郭美锦, 郭元昕, 黄帅, 宋云飞, 孙圳, 孙阳阳, 孔凡晶, 庄英萍
- Li Jiarui, Wang Zejian, Guo Meijin, Guo Yuanxin, Huang Shuai, Song Yunfei, Sun Zhen, Sun Yangyang, Kong Fanjing, Zhuang Yingping
- 基于电容测定的罗汉果细胞超低温保藏快速方法
- Rapid cryopreservation for Siraitia grosvenorii cells based on cells' capacitance detection
- 生物工程学报, 2017, 33(5): 817-827
- Chinese Journal of Biotechnology, 2017, 33(5): 817-827
- 10.13345/j.cjb.160490
-
文章历史
- Received: December 22, 2016
- Accepted: March 20, 2017
2 上海生物制造技术协同创新中心,上海 200237;
3 桂林莱茵生物科技股份有限公司,广西 桂林 541199
2 Shanghai Biological Manufacturing Technology Innovation Center, Shanghai 200237, China;
3 Guilin Layn Biotechnology Company, Guilin 541199, Guangxi, China
罗汉果Siraitia grosvenorii来源于葫芦科苦瓜属Momordica,为广西桂林特有的一种珍贵的药食两用植物,其中含有的主要有效成分罗汉果甜苷(Mogrosides)具有清热润肺、利咽开音、润肠通便的生物功能。最近有研究表明罗汉果还具有抗氧化、抗糖尿病和抗癌的功效,是肥胖症、高血压、糖尿病患者最好的甜味剂和保健品,具有广泛的应用价值[1]。罗汉果甜苷主要通过罗汉果果实提取得到,目前,随着市场需求量的大幅度增加,采用植物细胞愈伤组织悬浮培养技术生产罗汉果甜苷逐渐成为研究的热点[2-3],优良的罗汉果愈伤组织细胞的低温保藏在稳定生产效率方面非常关键,然而,关于罗汉果细胞悬浮培养以及其细胞系的低温保藏技术却鲜少报道。
现有的植物细胞系的保藏主要通过以下两种方式。一种是在生长培养基中进行继代保存(Subculture),另一种则是对细胞进行低温冷冻保藏(Cryopreservation)。冷冻保藏是将培养的愈伤组织细胞悬浮在加有冷冻保护剂的溶液中,以一定的冷冻速率降至特定温度[4] (一般是低于–70 ℃的超低温)。通过长期继代而保存细胞存在费时费力、成本昂贵,并且会出现植物细胞特性消失等缺点[5]。而细胞在超低温的条件下,会停止胞内的一系列代谢活动,并能够保持细胞自身的特性,大大降低细胞特性消失的风险。目前已有多种植物组织的器官和细胞培养物得到成功保存,例如新疆紫草Arnebia euchroma细胞[6],玫瑰茄Hibiscus sabdariffa[7]、三分三细胞Anisodus acutangulus[8]等。
植物细胞在冷冻保藏过程中会由于内部或者外部水结成冰晶而造成细胞破裂和细胞活力降低,不同种类的植物细胞由于细胞组成结构的不同,往往低温保藏的处理方法也大有不同。以往均是采用细胞线粒体活性测定(2, 3, 5-triphenyltetrazolium chloride,TTC)[9]或双醋酸荧光素(Fluorescein diacetate,FDA)[10]的方法来间接反映细胞在冷冻保藏后的活性情况,也可以采用冻存后将细胞在固体培养基上复苏培养[11]。一般植物细胞的生长周期都在3–4周,生长较慢的细胞则需要1–2个月,同时植物细胞复苏过程缓慢,因此在低温保藏方法的优化过程中,单次处理考察要耗费几个月甚至更长的时间,效率低。建立一种对处理过程中细胞存活率或者死亡率的快速检测方法,对于低温处理工艺条件的优化非常关键。
活细胞传感仪(Viable cell mass monitor)是利用电容法(Capacitance)测量溶液中活细胞浓度。其主要原理是:在一定频率的交变电场作用下,溶液中的离子发生迁移,而活细胞具有完整的绝缘性细胞膜,细胞中的离子受到束缚导致细胞膜极化,这使得细胞成为一个个微小的电容器,测量得到的电容值与溶液中的活细胞量存在良好的线性关系。其可以用于细菌[12]、霉菌[13]、酵母菌[14]、植物细胞[15]、动物细胞[16]培养过程中活细胞浓度的准确测定,是在生物过程监测分析中很有前途的工具。李兰等[17]在PHA发酵优化过程中发现采用活细胞传感仪在线采集的电容值比离线干重和OD值更能反映细胞的生长和活性。罗艳霞等[18]采用活细胞传感仪测定的活细胞数与平板活菌计数法测定的菌体浓度也有非常好的线性关系,基于电容值计算出的比生长速率比基于细胞氧代谢速率和二氧化碳释放速率计算出的比生长速率更可信。近年来,活细胞传感仪也广泛应用于植物细胞的液态悬浮培养过程中[19-20]。王泽建等在红豆杉细胞放大培养过程中,采用活细胞传感仪在线监测的细胞生物量与细胞干重在一定范围内也存在很好的线性关系[21]。在植物细胞红花细胞悬浮培养的研究结果中也表明采用活细胞传感仪能够对活细胞的浓度和细胞形态进行实时精确的监控[22]。
本文考察分析了利用活细胞传感仪进行罗汉果细胞冻存处理过程中活细胞电容值的快速测定,计算得到细胞存活率(Viability),并结合TTC法测定的细胞线粒体活性(Activity),对罗汉果细胞保藏工艺条件的预处理剂种类、预处理时间,以及冷冻保护剂的成分等方法进行评价和优化,建立了一种新的快速定量的罗汉果细胞超低温冷冻保藏的工艺方法。
1 材料与方法 1.1 主要仪器和设备活细胞传感仪(Biomass Monitor 220,Hamilton瑞士):四环式探头,测定范围为:0.2–150 pF/cm,测量精度:0.05–0.10g/L,超低温冰箱(Thermo Scientific),旋转式摇床(上海智诚仪器公司),紫外-可见光分光光度计(上海棱光),The EVOS® FL自动成像系统(Thermo Fisher)。
1.2 培养基及细胞系罗汉果悬浮细胞系是通过罗汉果种胚诱导出胚性松散的愈伤组织,并在液体培养基中经过分散、过滤培养得到。培养基为B5培养基添加6-苄氨基嘌呤(6-BA) 1.0 mg/L,萘乙酸(NAA) 0.5 mg/L,蔗糖30.0 g/L,肌醇100.0 mg/L,聚乙烯吡咯烷酮2.0 g/L。
1.3 方法 1.3.1 罗汉果细胞悬浮培养体系的建立将种子在无菌条件下进行消毒处理后剥掉外部硬种壳,接入到含有激素的培养基中诱导出胚性松散的愈伤组织,经过不断的继代筛选,选取生长均一的愈伤组织细胞接种至液体培养基中进行悬浮培养。
1.3.2 罗汉果悬浮细胞的超低温保存方法预处理:取一定量处于对数生长期的细胞,沉降后去除上清,加入等量的预处理剂,混匀后在110 r/min、25 ℃的条件下暗培养0–2 d,其目的在于诱导植物组织细胞进行保护性脱水,减少细胞内自由水含量,防止细胞在冰冻过程中结冰,避免细胞结构损伤及死亡。一般预处理剂为含有一定量浓度的渗透调节剂的糖溶液,例如蔗糖、甘露醇、海藻糖、山梨醇等[23-24]。
冷冻保存:将预处理后的细胞进行沉降处理,沉降后去除预处理剂,再加入等量的冷冻保护剂,在110 r/min、4 ℃的黑暗条件下孵育45 min。孵育后,先在–20 ℃冰箱内放置40 min后,再放到–80 ℃进行保存。
解冻复苏:将冻存后的细胞,置于39 ℃水浴锅中解冻,直至悬液中没有冰块,此过程一般2–3 min为宜,时间太久冷冻保护剂会对细胞产生一定的毒害作用。解冻后迅速将冷冻保护剂去掉,加入相应预处理剂清洗2–3次,逐步降低细胞中的DMSO浓度[25]。
1.3.3 罗汉果甜苷V的提取检测对照品溶液的制备:精确称取50 mg的对照品溶解至10 mL的容量瓶中,用流动相溶解成浓度为5 mg/mL的对照品原液,并分别稀释成0.1、0.25、0.5、1.0、2.0、3.0和5.0 mg/mL后,0.22 μm滤膜过滤,滤液用高效液相色谱仪测定。以峰面积y (mAU)为纵坐标,以罗汉果甜苷V浓度x (mg/mL)为横坐标进行线性回归,得到线性方程。
供试品溶液的制备:取烘干后的细胞用碾钵将其碾成粉末状,精密称取5 g的干重细胞粉末置于锥形瓶中,以1:10的固液比加入60%的乙醇超声破碎提取40 min后,在90 ℃的微沸状态下提取2 h。将提取液旋转蒸发浓缩至5 mL后,采用0.22 μm的滤膜过滤待用。
罗汉果甜苷V的检测:色谱柱:Unitary C18柱(5 μm,100A,4.6 mm×250 mm);流动相:水-乙腈(78:22);流速:l mL/min;柱温:30 ℃;检测波长为203 nm;进样量:20 μL。
1.4 过程参数测定 1.4.1 活细胞保存率的测定将活细胞传感仪的电极没入罗汉果细胞悬液中,进行全频扫描,确定活细胞传感仪的检测频率为473 kHz。在此频率下取对数生长期的细胞,离线测定细胞干重与电容值,发现在0.67–10.25 g/L细胞干重范围内,电容值与细胞干重具有良好的线性关系,此时活细胞电容值的测定范围在7.0–160 pF/cm,所以采用电容值可以更科学、更方便地定量表征培养体系中活细胞浓度。
在此频率下分别离线测定一定量预处理后的细胞悬液、解冻复苏后的细胞悬液,以及经过超声、煮沸处理后的细胞悬液,混匀后进行活细胞电容值的测定,分别记为Cap1、Cap2、Cap3。活细胞保存率(%)=(Cap2–Cap3)/ (Cap1–Cap3)×100。
|
| 图 1 离线测定干重与活细胞电容值的关系 Figure 1 Relationship between dry cell weight and capacitance value. |
| |
悬浮细胞经8 μm滤膜抽滤后,取100 mg新鲜细胞,分别加入2.5 mL 0.4%的2, 3, 4-氯化三苯基四氮唑(TTC)溶液和2.5 mL 0.05 mol/L的Na2HPO4-NaH2PO4的磷酸缓冲液(pH 7.5),混匀后25 ℃暗处理18 h。暗培养后离心去除上清液,细胞用蒸馏水洗涤3次,加入4 mL甲醇,置于60 ℃水浴50 min,期间振动摇晃细胞,使底部细胞充分接触甲醇,至细胞脱至无色。室温静置后,4 000 r/min离心5 min后取上清液,在485 nm下测定光密度(OD485),得到细胞活力[26]。
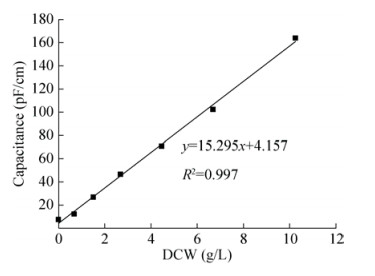
2 结果与分析 2.1 活细胞电容值与细胞浓度的线性关系取对数生长期不同浓度的细胞分别将细胞稀释1、2、4、6、10、20倍)测定其相应的电容值,结果显示在10–100 pF/cm测量值范围内与细胞浓度有良好的线性关系(图 2),其中对照空白(无植物细胞)或将细胞100 ℃高温杀死后,培养液中只有7 pF/cm电容值,因此,在测定过程中,对于活细胞浓度测定值的基础上进行对应空白培养基质电容值的校正后,得到的较正活细胞电容值能够很好地表征活细胞浓度。
|
| 图 2 细胞相对浓度与活细胞电容值的线性关系 Figure 2 Linear relationship between the biomass percentage and their capacitance values. |
| |
常被用作冷冻保护剂的有甘油、二甲基亚砜(DMSO)、蔗糖、山梨醇、聚乙二醇(PEG)等。其中,甘油和DMSO为渗透性冷冻保护剂,蔗糖和山梨醇是非渗透性冷冻保护剂,一些研究提出将渗透性和非渗透性冷冻保护剂组合使用的效果要优于采用一种冷冻保护剂[27]。但不同的植物细胞在冷冻保存方法上有非常大的差异。为此,将不同类型冷冻保护剂对罗汉果组织细胞的冻存条件进行优化。向培养基中添加不同浓度的DMSO (5%(W/V)、10%)、蔗糖(5%、10%)、山梨醇(5%、10%)考察冷冻保护剂对细胞冻存存活率的影响。将细胞用含有0.35 mol/L蔗糖的液体培养基预处理18 h后,进行低温冷冻处理,复苏后进行细胞活性的测定,结果见表 1。
| Group | Concentration of DMSO (%, W/V) | Concentration of sucrose (%, W/V) | Concentration of sorbitol (%, W/V) | Survival rate (%) | Mitochondrial viability/ 100 mg fresh cells |
| 1 | 5 | 5 | 0 | 30.06 | 0.339 |
| 2 | 5 | 10 | 0 | 44.92 | 0.835 |
| 3 | 10 | 5 | 0 | 32.23 | 0.672 |
| 4 | 10 | 10 | 0 | 41.04 | 0.859 |
| 5 | 5 | 0 | 5 | 29.07 | 0.612 |
| 6 | 5 | 0 | 10 | 39.53 | 0.746 |
| 7 | 10 | 0 | 5 | 33.33 | 0.691 |
| 8 | 10 | 0 | 10 | 41.77 | 0.945 |
| 9 | 0 | 0 | 0 | 12.65 | 0.187 |
结果表明:不论是活细胞电容值还是细胞线粒体活性,加入冷冻保护剂的细胞活性及存活率都远远高于不添加冷冻保护剂的细胞。说明冷冻保护剂在细胞冻存过程中起到了重要作用,大大提高了细胞的存活率。活细胞电容值(Cap)和TTC活性值也有较好的对应关系。因此,采用活细胞电容值可以用来较好地表征细胞在冷冻保藏后的存活率情况,从而快速地筛选出对细胞较好的冷冻保护剂组分及浓度。
将DMSO、蔗糖、山梨醇各个水平下活细胞电容值和TTC值进行统计分析,各水平冷冻保护剂对细胞低温保藏后存活率及活性的影响结果见图 3。从图 3结果可以看出,10%含量的DMSO对细胞低温保藏后的效果要优于5% DMSO。而对于山梨醇和蔗糖,不论是细胞存活率还是线粒体活力,10%的含量对于细胞低温保藏的效果都是最好的,且10%的蔗糖对于细胞保存的效果要优于10%的山梨醇。因此确定细胞低温保藏较好的冷冻保护剂成分为:细胞生长培养基+10% DMSO+10%蔗糖。与经过预处理但是不加冷冻保护剂的细胞相比,此条件下细胞的活力保存率和线粒体活性(TTC值)分别提高了224.43%和372.16%。

|
| 图 3 冷冻保护剂中不同组分对细胞存活率和线粒体活力的影响 Figure 3 Survival rates and MTT activities of S. grosvenorii cells treated by different cryoprotectants. |
| |
预处理能降低植物细胞内的含水量,减轻冻存过程中冰晶体形成及状态对膜系统的损伤。预处理剂的种类以及预处理剂的浓度不同,对于细胞低温保藏有很大影响。预处理剂浓度过高时,虽然脱水效果比较好,但有可能会对细胞活性产生不可逆的影响,对细胞结构及内部组织造成一定的损伤;但细胞若不进行脱水预处理,含水量太高则会在冷冻过程中形成大量冰晶刺破细胞。在前面实验的基础上,本实验选择蔗糖0.20、0.35、0.50 mol/L以及海藻糖0.20、0.35、0.50 mol/L进行考察,对照为不进行预处理、直接进行冻存的细胞。
在一定量的预处理剂进行处理时(蔗糖0.20 mol/L,海藻糖0.20、0.35 mol/L),可以提高预处理后细胞的存活率,但是随着蔗糖和海藻糖的浓度增加时(0.50 mol/L),细胞的存活率和细胞活力均出现显著降低。在预处理浓度为0.20 mol/L蔗糖时,细胞的冻存活力保持效果最好。与对照相比,细胞的活力保存率和线粒体活性(TTC值)均有大幅度提高,活力保存率和细胞活性分别提高了29.18.%、36.72%,因此,选择蔗糖0.20 mol/L作为预处理细胞的最佳条件。
2.4 不同预处理时间对细胞冷冻保存的影响预处理时间对细胞冷冻保藏后活性的影响与预处理剂的浓度原理相似,若细胞在具有一定渗透压的环境下处理时间过长时,有可能造成细胞的过度失水,这样就造成细胞在预处理阶段的活性大大降低,从而影响细胞冻存复苏后的活性。在前面实验的基础上,以蔗糖0.20 mol/L为预处理剂,冻存培养基为:液体培养基+10% DMSO+10%蔗糖,对预处理时间0、1、2、5、9、22、46 h进行考察。

|
| 图 4 不同预处理剂对细胞存活率和线粒体活力的影响 Figure 4 Survival rates and MTT activities of S. grosvenorii cells treated by different pretreatment agents. |
| |
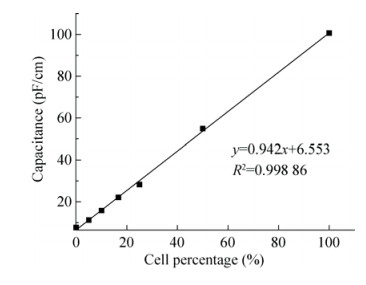
以细胞生长培养基(液体培养基) +10% DMSO+10%蔗糖作为冷冻保护剂,随着预处理时间的增加,细胞的存活率和细胞活力出现钟形变化曲线,细胞经过蔗糖0.2 mol/L预处理剂预处理9 h后进行超低温保藏,细胞保存效果最好,与对照(预处理0 h)相比,细胞的活力保存率和线粒体活性(TTC值)均有大幅度的提高(图 5)。
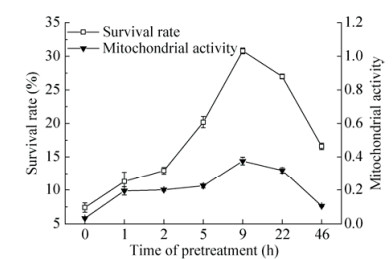
|
| 图 5 预处理时间对细胞存活率和线粒体活力的影响 Figure 5 Survival rates and MTT activities of S. grosvenorii cells treated by different pretreatment time. |
| |
为了考察基于活细胞以及细胞线粒体活性作为评价细胞保存效果的可靠性,在进行预处理时间考察的同时,选择预处理0、2、9、22、46 h对冻存后的细胞进行解冻复苏。将解冻复苏后的细胞重新接种到半固体生长培养基中,在25 ℃的条件下暗培养21 d后,统计相对正常细胞的细胞存活率,以公式进行计算:细胞存活率=W冻/W未冻,W冻:经过冻存的细胞复苏后的鲜重,W未冻:未经过冻存的细胞复苏后的鲜重。
从复苏结果(图 6)可以看出,预处理9 h后细胞计算得出的存活率为33.67%,与采用活细胞传感仪得出的结论相同。其中预处理22 h和46 h的细胞存活率相对较低,从复苏过程中细胞生长状态来看,可能是因为预处理时间过长的细胞脱水比较严重,细胞冻存过程中渗入到胞内的DMSO不易从细胞中被洗脱出来,从而对细胞造成了一定的毒害作用,导致细胞的存活率比较低。从图 7显微镜图上来看,经过冻存和没有经过冻存的细胞形态相同,表明此条件冻存效果最好。

|
| 图 6 不同预处理时间复苏后细胞存活率 Figure 6 Survival rates of S. grosvenorii cells pretreated by different periods. |
| |
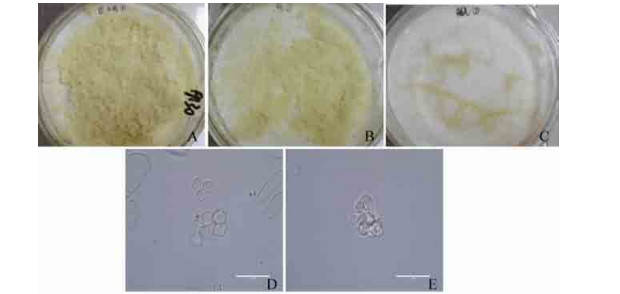
|
| 图 7 低温保藏罗汉果细胞复苏后生长图 Figure 7 Images of S. grosvenorii cells grown in suspension culture after cryopreservation at –80 ℃. (A) Cells without cryopreservation. (B) Cells after cryopreservation (treated with 0.2 mol/L sucrose for 9 h). (C) Cells after cryopreservation (treated with 0.2 mol/L sucrose for 46 h). (D) Cells without cryopreservation (40×). (E) Cells after cryopreservation (40×). |
| |
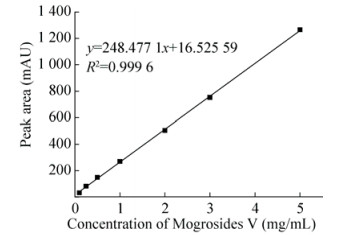
根据方法中所述的罗汉果甜苷V的检测方法,配置0.1、0.25、0.5、1.0、2.0、3.0、5.0 mg/mL的7种不同浓度的罗汉果甜苷V对照品溶液,根据所出峰面积以及相应的甜苷V浓度绘制得到标准曲线。采用此检测方法得到的峰面积与甜苷V的浓度具有较好的线性关系,y=248.28x+ 16.52。将冻存后的细胞在B5培养基上进行复苏,继代2次后,在第22天收获细胞进行甜苷V的提取和高效液相色谱检测(图 9)。结果显示冻存后的细胞经复苏培养后,罗汉果甜苷V的合成能力可达到2.19 mg/g干重细胞,与冻存之前细胞合成罗汉果甜苷V的能力相当。实验结果表明,经冻存后的细胞很好地保留了其合成甜苷V的特性,该冻存存活率快速测定方法能够很好地用于植物细胞的低温保藏过程评价。
|
| 图 8 罗汉果甜苷V对照品标准曲线 Figure 8 Standard curve of mogrosides V detected by HPLC. |
| |
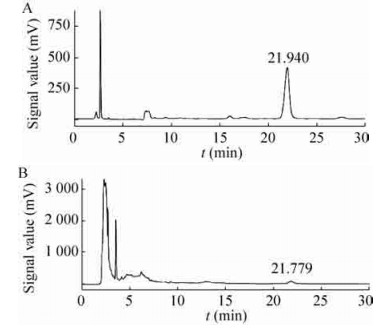
|
| 图 9 罗汉果甜苷V对照品(A)、样品(B)色谱图 Figure 9 HPLC profiles of standards (A) and samples (B). |
| |
本文通过采用活细胞传感仪建立了一种基于电容测定的罗汉果细胞超低温冷冻保藏及存活率的快速评价方法。以往细胞冻存后的评价方法主要采用的是测定细胞线粒体活力(TTC)或FDA方法来间接反映冻存方法对细胞冻存的效果,或者采用冻存后细胞复苏的方法。但是这两种方法都存在一定的缺陷,采用FDA法并不能完全表征细胞冻存后的存活率[28];TTC法则是TTC溶液进入细胞内部,与细胞线粒体上的酶发生反应而显色,通过颜色的深浅反应细胞生活力强弱,与细胞呼吸作用直接相关,呼吸作用容易受环境温度、空气、水分等的影响,造成结果误差较大。由于植物细胞具有生长周期长的特点,若采用细胞复苏的方法则会使得方法的建立需要较长周期,效率低。卞福花等曾采用中性红染色细胞统计存活率的方式优化细胞冻存的方法,但是由于植物细胞具有聚团生长的特性,使得细胞在计数时存在困难,需要对大量的细胞进行统计,工作量大,易于产生误差[29]。本文首次采用活细胞传感仪建立了量化的评价体系,对细胞冻存的方法进行了优化,快速地建立了适于罗汉果细胞冷冻保藏的方法。
本文结果表明向生长培养基中添加10%的蔗糖与10%的DMSO时,细胞经过冻存后的活率比较高,为较好的冷冻保护剂。在一定的预处理剂浓度(蔗糖0.20 mol/L)和预处理时间(9 h)下,细胞的存活率相对于不进行预处理细胞有大大提高,但是随着预处理剂浓度的升高以及预处理时间的延长,细胞的存活率和细胞活力均有大幅度的下降,说明一定的脱水处理对于细胞的保存有利,但是过度脱水的话则会对细胞造成损伤,降低冻存后的细胞存活率。
将预处理不同时间的细胞经过冻存复苏后,测定出来的细胞存活率与活细胞电容值测定的存活率相近,表明了此种评价方法的可靠性。采用优化后的条件对细胞进行复苏后,细胞存活率可以达到70%,且显微镜观察其形态与未经过冻存的细胞形态几乎相同,其有效代谢物甜苷V的合成特性也得以继续保存,说明此方法对细胞的保存效果较好,能够较好地保持冻存后细胞的特性。
| [1] |
Zeng XL. The research progress on a specialty plant Siraitia grosvenorii in Guangxi.
Guangxi Med J, 2009, 31(8): 1182–1186.
(in Chinese). 曾祥林. 广西特产植物罗汉果研究进展. 广西医学, 2009, 31(8): 1182-1186. |
| [2] |
Liu JH, Zhou H, Wu QW, et al. The influence of different hormone concentration on Siraitia grosvenorii callus induction and growth.
Anhui Agric Sci Bull, 2014, 20(7): 29–35.
(in Chinese). 刘健晖, 周欢, 伍琴文, 等. 不同激素浓度对罗汉果愈伤组织诱导的影响. 安徽农学通报, 2014, 20(7): 29-35. |
| [3] |
Wu QY, Li BL, Li JY. Micro-stem tip tissue culture and rapid propagation of Mornordica groswenori swingle.
Seed, 2013, 32(4): 116–117, 121.
(in Chinese). 吴群英, 李伯林, 李景云. 罗汉果微茎尖组织培养与快速繁殖. 种子, 2013, 32(4): 116-117, 121. |
| [4] |
Wu YF, Li Y.
Practical Medical Cell Culture Technique. Guangzhou: Zhongshan University Press, 2010(in Chinese).
吴燕峰, 黎阳. 实用医学细胞培养技术. 广州: 中山大学出版社, 2010. |
| [5] | Deus-Neumann B, Zenk MH. Instability of indole alkaloid production in Catharanthus roseus cell suspension cultures. Planta Med, 1984, 50(5): 427–431. DOI: 10.1055/s-2007-969755 |
| [6] |
Li GF, Ye HC, Dong JW, et al. Cryopreservation of calli of Arnebia euchroma.
Acta Bot Sin, 1992, 34(12): 962–964.
(in Chinese). 李国凤, 叶和春, 董教望, 等. 新疆紫草愈伤组织超低温保存. 植物学报, 1992, 34(12): 962-964. |
| [7] | Chen THH, Kartha KK, Leung NL, et al. Cryopreservation of alkaloid-producing cell cultures of periwinkle (Catharanthus roseus). Plant Physiol, 1984, 75(3): 726–731. DOI: 10.1104/pp.75.3.726 |
| [8] |
Zheng GZ, He JB, Wang SL. Cryopreservation of calli and their suspension culture cells of Anisodus acutangulus.
Acta Bot Sin, 1983, 25(6): 512–518.
(in Chinese). 郑光植, 何静波, 王世林. 三分三愈伤组织及其悬浮培养细胞的冰冻贮藏. 植物学报, 1983, 25(6): 512-518. |
| [9] | Verleysen H, Samyn G, Van Bockstaele E, et al. Evaluation of analytical techniques to predict viability after cryopreservation. Plant Cell Tissue Organ Cult, 2004, 77(1): 11–21. DOI: 10.1023/B:TICU.0000016483.00158.a9 |
| [10] | Widholm JM. The use of fluorescein diacetate and phenosafranine for determining viability of cultured plant cells. Stain Technol, 1972, 47(4): 189–194. DOI: 10.3109/10520297209116483 |
| [11] | Škrlep K, Bergant M, De Winter GM, et al. Cryopreservation of cell suspension cultures of Taxus x media and Taxus floridana. Biol Plant, 2008, 52(2): 329–333. DOI: 10.1007/s10535-008-0067-7 |
| [12] | Hoffmann F, Schmidt M, Rinas U. Simple technique for simultaneous on-line estimation of biomass and acetate from base consumption and conductivity measurements in high-cell density cultures of Escherichia coli. Biotechnol Bioeng, 2000, 70(3): 358–361. DOI: 10.1002/(ISSN)1097-0290 |
| [13] | Krairak S, Yamamura K, Nakajima M, et al. On-line monitoring of fungal cell concentration by dielectric spectroscopy. J Biotechnol, 1999, 69(2/3): 115–123. |
| [14] | Austin GD, Watson RWJ, D'Amore T. Studies of on-line viable yeast biomass with a capacitance biomass monitor. Biotechnol Bioeng, 1994, 43(4): 337. DOI: 10.1002/(ISSN)1097-0290 |
| [15] | Markx GH, Hoopen HT, Meijer JJ, et al. Dielectric spectroscopy as a novel and convenient tool for the study of the shear sensitivity of plant cells in suspension culture. J Biotechnol, 1991, 19(2/3): 145–157. |
| [16] | Cannizzaro C, Gügerli R, Marison I, et al. On-line biomass monitoring of CHO perfusion culture with scanning dielectric spectroscopy. Biotechnol Bioeng, 2003, 84(5): 597–610. DOI: 10.1002/bit.10809 |
| [17] | Li L, Wang ZJ, Chen XJ, et al. Optimization of polyhydroxyalkanoates fermentations with on-line capacitance measurement. Bioresource Technol, 2014, 156(2): 216–221. |
| [18] |
Luo YX, Huang MZ, Guo YX, et al. The application of viable cell mass monitoring in Lactobacillus acidophilus cultivation.
Sci Technol Food Ind, 2012, 33(21): 152–155, 159.
(in Chinese). 罗艳霞, 黄明志, 郭元昕, 等. 活细胞传感仪在嗜酸乳酸杆菌培养过程中的应用. 食品工业科技, 2012, 33(21): 152-155, 159. |
| [19] | Nosov AM. Application of cell technologies for production of plant-derived bioactive substances of plant origin. Appl Biochem Microbiol, 2012, 48(7): 609–624. DOI: 10.1134/S000368381107009X |
| [20] | Huang TK, Mcdonald KA. Bioreactor engineering for recombinant protein production in plant cell suspension cultures. Biochem Eng J, 2009, 45(3): 168–184. DOI: 10.1016/j.bej.2009.02.008 |
| [21] | Wang ZJ, Zhang W, Zhang JW, et al. Optimization of a broth conductivity controlling strategy directed by an online viable biomass sensor for enhancing Taxus cell growth rate and Taxol productivity. Rsc Adv, 2016, 6(47): 40631–40640. DOI: 10.1039/C5RA26540A |
| [22] | Liu Y, Wang ZJ, Li L, et al. On-line monitoring of the aggregate size distribution of Carthamus tinctorius L. cells with multi-frequency capacitance measurements. Rsc Adv, 2016, 6(92): 89764–89769. DOI: 10.1039/C6RA13527G |
| [23] | Ishikawa K, Harata K, Mii M, et al. Cryopreservation of zygotic embryos of a Japanese terrestrial orchid (Bletilla striata) by vitrification. Plant Cell Rep, 1997, 16(11): 754–757. DOI: 10.1007/s002990050314 |
| [24] | Towill LE, Jarret RL. Cryopreservation of sweet potato (Ipomoea batatas [L.] Lam.) shoot tips by vitrification. Plant Cell Rep, 1992, 11(4): 175–178. |
| [25] |
Shi R, Wang F, Wang J, et al. Research progress on cryopreservation technology by vitrification.
Northern Horticult, 2011(24): 231–235.
(in Chinese). 石茹, 王芳, 王舰, 等. 玻璃化法超低温保存技术及其研究进展. 北方园艺, 2011(24): 231-235. |
| [26] | Towill LE, Mazur P. Studies on the reduction of 2, 3, 5-triphenyltetrazolium chloride as a viability assay for plant tissue cultures. Can J Bot, 1975, 53(11): 1097–1102. DOI: 10.1139/b75-129 |
| [27] |
Chen HL. Cell culture and cryopreservation of Magnolia[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012 (in Chinese). 陈慧丽. 厚朴细胞培养与超低温保存的研究[D]. 福州: 福建农林大学, 2012. |
| [28] | Kim SI, Choi HK, Son JS, et al. Cryopreservation of Taxus chinensis suspension cell cultures. Cryo Lett, 2001, 22(1): 43–50. |
| [29] |
Bian FH, Gong XQ, You CR, et al. Cryopreservation of Cyclamen persicum Mill. callus.
Chin J Biotech, 2008, 24(3): 504–508.
(in Chinese). 卞福花, 龚雪琴, 由翠荣, 等. 仙客来愈伤组织的超低温保存. 生物工程学报, 2008, 24(3): 504-508. |
 2017, Vol. 33
2017, Vol. 33