中国科学院微生物研究所、中国微生物学会主办
文章信息
- 付婷婷, 胡玮, 陈勇, 魏欢, 杨光
- Fu Tingting, Hu Wei, Chen Yong, Wei Huan, Yang Guang
- 反刍兽月形单胞菌β-木糖苷酶基因在毕赤酵母中的高效表达及酶学性质
- High-level expression and characterization of Selenomonas ruminantium β-xylosidase in Pichia pastoris
- 生物工程学报, 2017, 33(5): 785-795
- Chinese Journal of Biotechnology, 2017, 33(5): 785-795
- 10.13345/j.cjb.160433
-
文章历史
- Received: November 8, 2016
- Accepted: February 7, 2017
β-木糖苷酶(β-xylosidase,酶编号为EC 3.2.1.37) 是木聚糖降解酶系中的一种,主要催化水解木糖苷和以外切方式作用于低聚合度木寡糖(木二糖和木三糖)的非还原性末端生成木糖[1],在造纸、生物能源、食品、饲料以及医药等多个领域具有潜在的应用价值[2]。
反刍兽月形单胞菌Selenomonas ruminantium是瘤胃中的优势菌,占瘤胃总细菌的21%-50%[3],是利用低聚木糖的重要微生物,其降解低聚木糖的能力与木糖苷酶和阿拉伯糖苷酶活性呈正相关[4]。由反刍兽月形单胞菌产生的β-木糖苷酶Sxa是具有β-木糖苷酶和α-阿拉伯呋喃糖苷酶活性的双功能酶[5]。与以往发现的β-木糖苷酶相比,Sxa的活性更高,其Kcat和Kcat/Km是目前发现的其他β-木糖苷酶的10倍[5]。由此可见,反刍兽月形单胞菌产生的木糖苷酶Sxa具有较好的商业价值。然而,反刍兽月形单胞菌为严格厌氧菌,直接利用其生产Sxa的成本较高。
本研究以Sxa为目的基因,根据宿主菌毕赤酵母Pichia pastoris密码子的偏爱性等对来源于反刍兽月形单胞菌的β-木糖苷酶Sxa基因进行密码子优化,通过全基因合成技术得到新的β-木糖苷酶基因mSxa,构建重组载体pPIC9K-mSxa,并在毕赤酵母中表达;同时,对重组β-木糖苷酶mSxa的酶学性质进行研究,为后续应用奠定基础。
1 材料与方法 1.1 菌株与试剂大肠杆菌Escherichia coli DH5α、宿主菌毕赤酵母GS115和表达载体pPIC9K为本实验室保存。Taq DNA聚合酶、限制性内切酶、DNA和蛋白质标准分子量购自宝生物工程(大连)有限公司;质粒小提试剂盒和DNA纯化试剂盒购自天根生化科技(北京)有限公司;地衣多糖、大麦β-葡聚糖、燕麦木聚糖购自Megazyme公司;其他试剂为国产分析纯。
1.2 反刍兽月形单胞菌β-木糖苷酶Sxa基因的优化与mSxa基因的合成在GenBank中检索反刍兽月形单胞菌β-木糖苷酶基因Sxa (GenBank Accession No. AF040720.1) DNA序列,经SignalP 4.1软件在线分析Sxa是否存在潜在的信号肽序列;在不改变原有Sxa氨基酸顺序的情况下,利用Optimum GeneTM根据毕赤酵母对密码子的偏爱性、mRNA二级结构、GC含量和稀有密码子进行优化。优化后的核苷酸序列送至南京金斯瑞生物科技有限公司合成获得优化后的β-木糖苷酶基因mSxa。合成的mSxa基因和酵母表达载体pPIC9K用限制性内切酶SnaBⅠ和AvrⅡ进行双酶切,酶切产物采用DNA纯化试剂盒进行纯化。经纯化后的mSxa基因和表达载体pPIC9K用T4 DNA连接酶进行连接,构建mSxa基因的酵母表达载体pPIC9K-mSxa。将pPIC9K-mSxa转化E. coli DH5α,经过菌落PCR和限制性内切酶鉴定后,由上海生工生物工程有限公司测序。
1.3 重组毕赤酵母表达系统的构建及筛选用限制性内切酶Bgl Ⅱ将重组质粒pPIC9K-mSxa线性化,并用DNA纯化试剂盒进行纯化回收后,使用BTX ECM399电转化仪转化毕赤酵母GS115感受态细胞。将细胞涂布于葡萄糖再生培养基(Regeneration dextrose base, RDB)平板上,29 ℃培养48 h。挑选生长良好的细胞在最小葡萄糖培养基(Minimal dextrose medium,MD)和最小甲醇培养基(Minimal methanol medium,MM)板上进行甲醇利用慢型(Muts)和甲醇利用正常型(Mut+)的表型筛选,再经不同浓度梯度遗传霉素G418 (Geneticin®)的抗性筛选以及PCR鉴定,得到高拷贝阳性转化子。
1.4 重组β-木糖苷酶mSxa的诱导表达选取表型为Muts、抗6 mg/mL G418的9个高拷贝转化子分别于试管和摇瓶中进行甲醇诱导表达,诱导表达时每24 h补加甲醇1次至终浓度为0.5%。采用试管表达时培养48 h后结束;采用摇瓶表达时培养144 h结束,同时每12 h取5 mL菌液用于测定β-木糖苷酶酶活性。
1.5 重组β-木糖苷酶mSxa的活性检测 1.5.1 刚果红平板染色法定性检测β-木糖苷酶活性分别取培养96 h的宿主菌GS115、转化pPIC9K空载体的重组菌以及pPIC9K-mSxa重组菌诱导表达0、60和96 h后的培养上清液80 μL,滴至含5 mmol/L对硝基苯基-β-D-木糖苷(p-Nitrophenyl β-D-xyloside,pNPX)琼脂平板的牛津杯中,将平板置于37 ℃恒温培养箱中培养16-18 h,取出牛津杯在平板上缓慢添加适量0.1%刚果红染液,静置30 min,用适量1 mol/L氯化钠溶液进行脱色30-60 min,再用适量0.5%乙酸固定平板。根据刚果红染色平板上透明圈的直径初步判断表达产物的酶活性。
1.5.2 β-木糖苷酶活性的定量测定参考胡玮的方法定量测定β-木糖苷酶酶活性[6]。1个木糖苷酶活性单位(IU)为:以5 mmol/L pNPX为底物,每分钟在pH 6.0和55 ℃条件下分解pNPX生成1 μmol对硝基苯酚所需的酶量。
1.6 重组β-木糖苷酶mSxa高密度诱导表达参考Hoggins等[7]的方法进行高密度发酵。在装有6 L发酵FM22/PMT4培养基的发酵罐中接种1%的种子液,甲醇诱导表达114 h,每12 h取10 mL样品,用于测定酶活性。
1.7 发酵上清的SDS-PAGE取1 mL发酵上清液加入0.1 mL的100%三氯乙酸(TCA),混匀后于-20 ℃放置30 min,离心20 min,弃上清后向沉淀加入0.2 mL冷丙酮洗去TCA,加入20 μL上样缓冲液混匀后进行SDS-PAGE。
1.8 重组β-木糖苷酶mSxa酶学性质的研究 1.8.1 表达产物的浓缩和纯化发酵产物经离心后,取6 mL发酵上清液经超滤浓缩至1 mL。以G-75葡聚糖凝胶对浓缩上清进行层析纯化,用部分收集器每30 s收集1管。取2.5 μL于280 nm处测定OD280,通过OD280初步判定蛋白质所在洗脱组分。
1.8.2 mSxa的最适反应温度及温度稳定性1) 取200 μL适当稀释的重组β-木糖苷酶溶液,分别在20 ℃、30 ℃、40 ℃、50 ℃、55 ℃、60 ℃、70 ℃、80 ℃、90 ℃和100 ℃条件下与5 mmol/L pNPX于pH 6.0条件下反应10 min,然后加入2 mol/L碳酸钠750 μL终止反应,测定酶活性。2) 取200 μL适当稀释的重组β-木糖苷酶液,分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃和100 ℃条件下保持30 min后,在55 ℃及pH 6.0条件下测定其剩余酶活性,以最适温度条件下的酶活性为100%计算各处理的相对酶活性。
1.8.3 mSxa的最适反应pH及pH稳定性1) 取200 μL适当稀释的重组β-木糖苷酶液溶,分别在pH 2、3、4、5、6、7、8、9、10和11及55 ℃条件下测定酶活性。2) 取200 μL适当稀释的重组β-木糖苷酶溶液,分别在pH 2、3、4、5、6、7、8、9、10和11及55 ℃条件下保持30 min后测定剩余酶活性,以最适pH条件下的酶活性为100%计算各处理的相对酶活性。
1.8.4 mSxa的底物特异性取200 μL适当稀释的重组β-木糖苷酶液,分别以大麦β-葡聚糖、地衣多糖、燕麦木聚糖、pNPX和羧甲基纤维素钠为底物在pH 6和55 ℃条件下测定酶活性,以最适底物的酶活性为100%计算各底物的相对酶活性。
1.8.5 金属离子、螯合剂和表面活性剂对mSxa酶活性的影响在最适反应体系中加入适当浓度的金属离子(FeCl3、MnSO4、CuSO4、CoCl2、CaSO4和MgSO4),螯合剂(EDTA)和表面活性剂(SDS),使金属离子、螯合剂和表面活性剂的浓度为5 mmol/L,在pH 6和55 ℃条件下测定酶活性,以加入等体积缓冲液的样品酶活性为100%计算各组相对酶活性。
2 结果与分析 2.1 反刍兽月形单胞菌β-木糖苷酶Sxa基因的优化与合成经DNA测序后确认,人工合成的mSxa基因全长1 617 bp,共编码538个氨基酸残基,与设计的优化序列(图 1)完全一致。与Sxa基因(GenBank Accession No. AF040720.1) 相比,优化核苷酸385个,涉及340个密码子,优化前后的序列的相似性为76.10%。通过Optimum GeneTM软件分析后发现,密码子优化指数由优化前的0.63提高到优化后的0.85,GC含量由优化前的53.68%降低至优化后的43.68%,Sxa基因含有6.00%的稀有密码子,优化后被全部消除。

|
| 图 1 反刍兽月形单胞菌β-木糖苷酶Sxa基因优化前和优化后序列的比较 Figure 1 Alignment of nucleotide sequences between the wild-type and optimized β-xylosidase Sxa gene of S. ruminantium. The regions with black background mean the nucleotides were not changed before and after optimization. |
| |
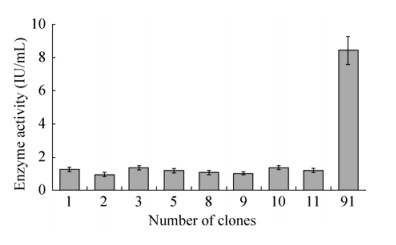
通过表型和抗遗传霉素筛选,累积获得9个抗6 mg/mL G418的Muts转化子。在试管中,木糖苷酶的平均活性为1.98 IU/mL,其中91号转化子酶活性明显高于其他转化子,其活性为8.56 IU/mL,是其他转化子平均活性的7.3倍(图 2)。后续研究均选取第91号转化子进行。
|
| 图 2 mSxa在试管表达水平下的酶活性 Figure 2 Enzymatic activity of mSxa of different clones expressed in test tube. |
| |
如图 3所示,毕赤酵母GS115和转化空表达载体pPIC9K的GS115诱导96 h后以及转化pPIC9K-mSxa的GS115诱导前的培养上清未产生透明圈,表明毕赤酵母GS115和转化空表达载体pPIC9K的GS115无木糖苷酶活性。转化pPIC9K-mSxa的GS115诱导60和96 h后的培养上清产生了明显的透明圈,诱导60 h后产生的透明圈直径为13 mm,诱导96 h后的透明圈直径为21 mm。这表明mSxa基因在毕赤酵母GS115中得到了表达,并且产生了明显的木糖苷酶活性。

|
| 图 3 平板刚果红法鉴定重组β-木糖苷酶活性 Figure 3 Activity staining of the secreted recombinant β-xylosidase on plate observed after induction. A: the host P. pastoris GS115 induced 96 h, did not produce a transparent circle; B: GS115-pPIC9K induced 96 h, did not produce a transparent circle; C: GS115-pPIC9K-mSxa before inducing, did not produce a transparent circle; D: GS115-pPIC9K-mSxa induced 60 h, produced a less transparent circle; E: GS115-pPIC9K-mSxa induced 96 h, produced a larger transparent circle. |
| |
如图 4所示,在摇瓶条件下,第91号转化子在诱导表达84 h之前,随着时间的增加,酶活性有缓慢上升;在84-96 h,酶活性迅速上升,并在96 h时活性达到最高值,为17.54 IU/mL。之后开始缓慢下降。在10 L发酵罐中,mSxa的活性变化规律与摇瓶中的变化相似,但整体活性显著提高,在诱导表达96 h时酶活性较高,为287.61 IU/mL。

|
| 图 4 mSxa在摇瓶和发酵罐条件下的酶活性 Figure 4 Enzymatic activity of mSxa expressed at flask and fermenter levels. |
| |
如图 5所示,发酵上清在66 kDa附近出现一条明显的蛋白质条带。反刍兽月形单胞菌Sxa酶由538个氨基酸残基组成,理论相对分子质量为59.18 kDa。所得到的蛋白分子量略大于理论计算值,这可能是由于蛋白质的糖基化和磷酸化的结果。

|
| 图 5 不同发酵时间发酵液上清的SDS-PAGE Figure 5 SDS-PAGE analysis of the culture supernatants at different time of fermentation. M: protein molecular weight standards; 1–8: before induction; 24 h, 36 h, 48 h, 60 h, 72 h, 84 h and 96 h after induction in a 10 L fermenter. |
| |
如图 6所示,当反应的温度低于55 ℃时,随着反应温度的升高酶活性逐步升高并在55 ℃时酶活性达到最高;之后随着反应温度的不断升高酶活性逐渐下降。因此,该重组β-木糖苷酶的最适温度为55 ℃。

|
| 图 6 mSxa的最适温度和温度稳定性 Figure 6 The optimal temperature and temperature stability of mSxa. |
| |
通过对剩余酶活性的测定发现,重组β-木糖苷酶在温度为40-60 ℃保持30 min后剩余酶活性均大于80%;但是当温度超过60 ℃后,剩余酶活性急剧下降。这表明,该重组β-木糖苷酶在40-60 ℃时有较好的热稳定性。
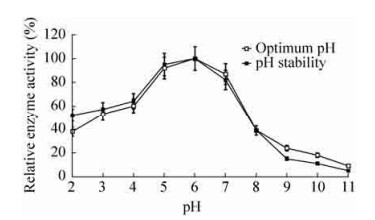
2.6.2 重组β-木糖苷酶最适反应pH及pH稳定性如图 7所示,在pH 2.0的条件下,该酶的相对酶活性为40%;在pH 5.0-7.0之间,该酶相对酶活性均在80%以上,且该重组β-木糖苷酶的最适反应pH为6.0;在pH 11.0时,该酶的相对酶活性仅为9.2%。
|
| 图 7 mSxa的最适pH和pH稳定性 Figure 7 The optimal pH and pH stability of mSxa. |
| |
通过测定剩余酶活性,在pH 2.0时该酶的剩余酶活性为53%;在pH 5.0-7.0时剩余酶活性均高于80.0%;当pH升高至9.0时,该酶的剩余酶活性仅有11.5%。由此可知,该重组β-木糖苷酶在pH 5.0-7.0的条件下较为稳定。
2.6.3 mSxa的底物特异性底物特异性试验结果显示,重组β-木糖苷酶对燕麦木聚糖(Oat spelt xylan,OSX)和pNPX具有水解作用,但不降解地衣多糖(Lichenin,Li)、大麦β-葡聚糖(Barley β-glucan, BG)以及羧甲基纤维素钠(Sodium carboxymethyl cellulose,SCMC) (图 8)。此外,该重组β-木糖苷酶对pNPX的降解效率远高于OSX。这表明重组β-木糖苷酶具有较高的底物特异性。

|
| 图 8 mSxa的底物特异性 Figure 8 Substrate specificity of mSxa. SCMC: sodium carboxymethyl cellulose; BG: barley β-glucan; pNPX: p-Nitrophenyl β-D-xyloside; OSX: oat spelt xylan; Li: Lichenin. |
| |
图 9显示,Mn2+和Ca2+对重组β-木糖苷酶的活性有激活作用,其中Ca2+使酶活性提高近50%,而Fe3+、Cu2+、Co2+、Mg2+、EDTA及SDS明显抑制酶的活性。

|
| 图 9 金属离子、螯合剂及表面活性剂对mSxa酶活性的影响 Figure 9 Influence of metal ions, chelating agent and surfactant on enzymatic activity of mSxa. C: control; EDTA: elhylene diamine tetraacetic acid; SDS: sodium dodecylsulphate. |
| |
木聚糖酶和β-木糖苷酶、α-葡萄糖醛酸酶、乙酰酯酶是降解木聚糖的主要酶类[8-9]。一些细菌、放线菌和真菌等微生物以及高等植物均可产生β-木糖苷酶。与木聚糖酶相比,有关β-木糖苷酶的研究及异源表达还鲜见报道。
根据氨基酸组成,β-木糖苷酶分布于糖苷水解酶的第3、30、39、43、51、52和54家族[10]。由于β-木糖苷酶和α-阿拉伯呋喃糖苷酶的活性中心高度保守,因此β-木糖苷酶和一些α-阿拉伯呋喃糖苷酶可以水解α-阿拉伯呋喃糖苷键和β-吡喃糖苷键[11]。由反刍兽月形单胞菌产生的β-木糖苷酶Sxa是糖苷水解酶第43家族成员[12],是具有β-木糖苷酶和α-阿拉伯呋喃糖苷酶活性的双功能酶[5]。这种双功能酶不仅具有从木聚糖和低聚木聚糖中释放木糖,也能够从阿拉伯聚糖、阿拉伯低聚糖和阿拉伯木聚糖中释放阿拉伯糖[13]。这表明Sxa在木聚糖的生物转化中具有潜在的应用价值。在本研究中,重组β-木糖苷酶mSxa具有降解燕麦木聚糖和pNPX的作用,而不降解其他非淀粉多糖,说明mSxa具有较强的专一性。受条件限制,本研究未对mSxa的α-阿拉伯呋喃糖苷酶活性进行研究。
瘤胃是降解纤维质效率最高的生物反应器,其中蕴含了大量非淀粉多糖酶基因资源。但是由于大部分瘤胃微生物为严格厌氧微生物,因此,直接利用瘤胃微生物生产工业用酶制剂受到极大限制。基因工程技术能很好地解决这一问题。目前,一些来源于瘤胃微生物的基因获得了异源表达[14-16]。
毕赤酵母是高效表达异源蛋白质的优良系统。利用该系统,一些来源于瘤胃细菌和真菌的葡聚糖酶和木聚糖酶获得了表达[16-18]。对目的基因进行优化常用于提高蛋白质的表达水平。优化时不仅需考虑替换宿主低利用率的密码子,同时还需注意mRNA的二级结构和自由能、顺式作用元件以及重复序列和GC含量。Dehnavi等[19]对Sxa基因进行优化后,在毕赤酵母GS115中的表达水平达到0.5 U/mL。在本试验中,重组β-木糖苷酶mSxa在10 L发酵罐中的表达水平达到287.61 IU/mL,远远高于之前的任何报道。这可能与以下因素有关:1) 优化核苷酸的位置。Dehnavi等[19]对编码Sxa的365个核苷酸进行了优化,涉及341个氨基酸,GC含量由52%下降至46%;本研究对385个核苷酸进行了优化,涉及340个密码子(339个氨基酸和终止密码子),GC含量由优化前的53.68%降低至优化后的43.68%。这表明,本研究中mSxa的核苷酸与Dehnavi等[19]合成的基因存在明显不同,mSxa的mRNA自由能可能更低,更易于表达。2) 异源表达系统。Dehnavi等[19]所采用的表达系统为pPinkα-HC/GS115,而本研究中采用的表达系统为pPIC9K/GS115。众所周知,表达载体的结构元件是影响外源蛋白质表达的因素之一。3) 甲醇利用表型。pPinkα-HC/GS115无需进行甲醇利用表型筛选,通过同源重组产生的转化子均为Mut+。而本研究中,利用Bgl Ⅱ线性化pPIC9K-mSxa后,获得的转化子是Muts。不同的甲醇利用表型是影响外源蛋白质表达水平的重要因素[20]。与Muts相比,Mut+的生长速度和甲醇摄入速度要快得多[21]。因此,目前大部分的研究均利用Mut+型菌株表达外源蛋白质。然而,研究发现尽管Muts菌株达到最高表达量的诱导时间较长,但其代谢甲醇较少,受氧的限制较小,有时外源蛋白质的表达量比Mut+菌株还要高[21-22]。
酶的热稳定性是影响工业应用的重要因素。由微生物产生的β-木糖苷酶最适反应温度一般介于40–60 ℃之间[8],而一些嗜热微生物产生的β-木糖苷酶有较高的热稳定性。Bachmann等[23]研究发现,褐色高温单孢菌Thermomonospora fusca的β-木糖苷酶最适反应温度为82 ℃,其活性在70 ℃可以保持1.5 h。在本研究中,重组β-木糖苷酶的最适反应温度为55 ℃;在40-60 ℃时保持30 min,剩余约80%的酶活性;当温度达到70 ℃时,酶活性基本丧失。这说明本研究中获得的mSxa耐热性能不强。要获得工业应用,还需通过蛋白质改造以提高其热稳定性。Jordan等[5]在大肠杆菌中表达了Sxa基因,将第145位的色氨酸替换为苯丙氨酸或亮氨酸可提高重组β-木糖苷酶的KiD-glucose和KiD-xylose,增加对pH和温度的稳定性。对氨基酸残基进行替换并不总能产生有益的结果。Jordan等[24]将Sxa第186位的谷氨酸替换为丙氨酸后,酶活性显著降低。
大部分β-木糖苷酶的最适pH在3.0-6.0之间,耐受弱酸性[8]。如来源于出芽短梗霉菌Aureobasidium pullulans的β-木糖苷酶,其最适pH为4.0[25]。然而,由嗜热脱氮芽孢杆菌Geobacillus thermodenitrificans产生的β-木糖苷酶具有耐热、耐碱和耐盐的特性,其最适pH为7.0[26]。这提示,该β-木糖苷酶可能具有更广阔的应用范围。本试验以pNPX为底物,在反应温度55 ℃时测得mSxa的最适pH为6.0,在pH 5.0-7.0都保持良好的稳定性,表明mSxa亦呈弱酸性。
不同金属离子、螯合剂和表面活性剂对重组β-木糖苷酶的影响有显著差异。有研究表明,金属离子Fe3+、Fe2+、Co2+、Ag+、Cu2+和Hg2+,SDS以及螯合剂EDTA抑制酶的活性;而金属离子Mg2+、Ni2+、Ca2+和K+对酶的活性起激活作用[17, 27]。在本研究中,5 mmol/L的Fe3+、Cu2+、Co2+、Mg2+、EDTA及SDS明显抑制酶的活性。而Ca2+和Mn2+对mSxa具有明显的激活作用,因此推测Ca2+和Mn2+可能是mSxa的辅因子。
4 结论通过密码子优化,反刍兽月形单胞菌β-木糖苷酶基因mSxa在毕赤酵母中实现了分泌表达。在发酵罐水平表达的酶活性达到了287.61 IU/mL。该酶在温度为40-60 ℃,pH为5.0-7.0时较稳定,其最适反应温度和pH分别为55 ℃和6.0。该酶对β-木糖苷键具有特异的切割作用,Mn2+和Ca2+激活其活性,而Fe3+、Cu2+、Co2+、Mg2+、EDTA及SDS抑制其活性。
| [1] | Rasmussen LE, Sørensen HR, Vind J, et al. Mode of action and properties of the β-xylosidases from Talaromyces emersonii and Trichoderma reesei. Biotechnol Bioeng, 2006, 94(5): 869–876. DOI: 10.1002/(ISSN)1097-0290 |
| [2] | Bosetto A, Justo PI, Zanardi B, et al. Research progress concerning fungal and bacterial β-xylosidases. Appl Biochem Biotechnol, 2016, 178(4): 766–795. DOI: 10.1007/s12010-015-1908-4 |
| [3] |
Wu XZ, Gao YX, Ou HL, et al. Isolation and characterization of Selenomonas ruminantium from the rumen of dairy cows.
Prog Vet Med, 2008, 29(10): 25–28.
(in Chinese). 武心镇, 高玉霞, 欧海龙, 等. 奶牛瘤胃中反刍兽月形单胞菌的分离鉴定. 动物医学进展, 2008, 29(10): 25-28. DOI:10.3969/j.issn.1007-5038.2008.10.007 |
| [4] | Whitehead TR, Cotta MA. Identification of a broad-specificity xylosidase/arabinosidase important for xylooligosaccharide fermentation by the ruminal anaerobe Selenomonas ruminantium GA192. Curr Microbiol, 2001, 43(4): 293–298. DOI: 10.1007/s002840010304 |
| [5] | Jordan DB, Wagschal K, Fan ZM, et al. Engineering lower inhibitor affinities in β-D-xylosidase of Selenomonas ruminantium by site-directed mutagenesis of Trp145. J Ind Microbiol Biotechnol, 2011, 38(11): 1821–1835. DOI: 10.1007/s10295-011-0971-2 |
| [6] |
Hu W. Expression of the Paecilomyces sp. FLH 30 endo β-1, 3(4) glucanase gene and Selenomonas ruminantium xylosidase gene in Pichia pastoris [D]. Urumqi: Xinjiang Agricultural University, 2016 (in Chinese). 胡玮. Paecilomyces sp. FLH 30内切β-1, 3(4) 葡聚糖酶基因和Selenomonas ruminantium木糖苷酶基因在毕赤酵母中的表达[D]. 乌鲁木齐: 新疆农业大学, 2016. |
| [7] | Higgins DR, Cregg JM. Pichia protocols // Methods in Molecular Biology. Totowa: Humana Press, 1998: 1-264. |
| [8] |
Fan YY, Li XT, Teng C. Research progress on β-xylosidases from microorganism.
Food Res Dev, 2013, 34(12): 116–121.
(in Chinese). 范园园, 李秀婷, 滕超. 微生物产β-木糖苷酶的研究进展. 食品研究与开发, 2013, 34(12): 116-121. DOI:10.3969/j.issn.1005-6521.2013.12.033 |
| [9] | Qing Q, Wyman CE. Supplementation with xylanase and β-xylosidase to reduce xylo-oligomer and xylan inhibition of enzymatic hydrolysis of cellulose and pretreated corn stover. Biotechnol Biofuels, 2011, 4(1): 18. DOI: 10.1186/1754-6834-4-18 |
| [10] | Jordan DB, Wagschal K. Properties and applications of microbial β-D-xylosidases featuring the catalytically efficient enzyme from Selenomonas ruminantium. Appl Microbiol Biotechnol, 2010, 86(6): 1647–1658. DOI: 10.1007/s00253-010-2538-y |
| [11] | McKee LS, Peña MJ, Rogowski A, et al. Introducing endo-xylanase activity into an exo-acting arabinofuranosidase that targets side chains. Proc Natl Acad Sci USA, 2012, 109(17): 6537–6542. DOI: 10.1073/pnas.1117686109 |
| [12] | Jordan DB, Li XL, Dunlap CA, et al. β-D-xylosidase from Selenomonas ruminantium of glycoside hydrolase family 43. Appl Biochem Biotechnol, 2007, 137-140(1/12): 93–104. |
| [13] | Lagaert S, Pollet A, Courtin CM, et al. β-xylosidases and α-L-arabinofuranosidases: accessory enzymes for arabinoxylan degradation. Biotechnol Adv, 2014, 32(2): 316–332. DOI: 10.1016/j.biotechadv.2013.11.005 |
| [14] | Kwon M, Song JY, Park HS, et al. Characterization of heterologously expressed acetyl xylan esterase1 isolated from the anaerobic rumen fungus neocallimastix frontalis PMA02. Asian-Australas J Anim Sci, 2016, 29(11): 1576–1584. DOI: 10.5713/ajas.16.0336 |
| [15] | Kobayashi Y, Okuda N, Matsumoto M, et al. Constitutive expression of a heterologous Eubacterium ruminantium xylanase gene (xynA) in Butyrivibrio fibrisolvens. FEMS Microbiol Lett, 1998, 163(1): 11–17. DOI: 10.1111/fml.1998.163.issue-1 |
| [16] |
Yang YX, Zhang HL, Wang Y, et al. Expression of Fibrobacter succinogenes 1, 3-1, 4-β-glucanase gene in Pichia pastoris.
J Nanjing Agric Univ, 2014, 37(4): 123–130.
(in Chinese). 杨玉霞, 张慧玲, 汪艳, 等. 产琥珀酸丝状杆菌1, 3-1, 4-β-葡聚糖酶基因在毕赤酵母中的表达. 南京农业大学学报, 2014, 37(4): 123-130. DOI:10.7685/j.issn.1000-2030.2014.04.018 |
| [17] |
Wang Y, Li X, Chen Y, et al. Expression of a xylanase gene originated from rumen anaerobic fungi Neocallimastix frontalis in Pichia pastoris.
Biotechnol Bull, 2015, 31(5): 186–193.
(in Chinese). 汪艳, 李晓, 陈勇, 等. 来源于瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶在毕赤酵母中的表达. 生物技术通报, 2015, 31(5): 186-193. |
| [18] |
Wang Y, Luo YL, Hu W, et al. High-level expression and characterization of xynA originated from anaerobic fungi Orpinomyces sp. PC-2 in Pichia pastoris.
J Agric Biotechnol, 2016, 24(5): 708–717.
(in Chinese). 汪艳, 罗艳丽, 胡玮, 等. 源于厌氧真菌Orpinomyces sp. PC-2的xynA在毕赤酵母中的高效表达及其酶学性质分析. 农业生物技术学报, 2016, 24(5): 708-717. |
| [19] | Dehnavi E, Siadat SOR, Roudsari MF, et al. Cloning and high-level expression of β-xylosidase from Selenomonas ruminantium in Pichia pastoris by optimizing of pH, methanol concentration and temperature conditions. Protein Expr Purif, 2016, 124: 55–61. DOI: 10.1016/j.pep.2016.05.001 |
| [20] | Pla IA, Damasceno LM, Vannelli T, et al. Evaluation of Mut+ and MutS Pichia pastoris phenotypes for high level extracellular scFv expression under feedback control of the methanol concentration. Biotechnol Prog, 2006, 22(3): 881–888. DOI: 10.1021/bp060012+ |
| [21] | Krainer FW, Dietzsch C, Hajek T, et al. Recombinant protein expression in Pichia pastoris strains with an engineered methanol utilization pathway. Microb Cell Fact, 2012, 11: 22. DOI: 10.1186/1475-2859-11-22 |
| [22] | Orman MA, Çalik P, Özdamar TH. The influence of carbon sources on recombinant-human-growth-hormone production by Pichia pastoris is dependent on phenotype: a comparison of Muts and Mut+ strains. Biotechnol Appl Biochem, 2009, 52(3): 245–255. DOI: 10.1042/BA20080057 |
| [23] | Bachmann SL, Mccarthy AJ. Purification and characterization of a thermostable β-xylosidase from Thermomonospora fusca. J Gen Micobiol, 1989, 135(2): 293–299. |
| [24] | Jordan DB, Braker JD. β-D-xylosidase from Selenomonas ruminantium: role of glutamate 186 in catalysis revealed by site-directed mutagenesis, alternate substrates, and active-site inhibitor. Appl Biochem Biotechnol, 2010, 161(1/8): 395–410. |
| [25] | Nasr S, Soudi MR, Salmanian AH, et al. Partial optimization of endo-1, 4-β-xylanase production by Aureobasidium pullulans using agro-industrial residues. Iran J Basic Med Sci, 2013, 16(12): 1245–1253. |
| [26] | Anand A, Kumar V, Satyanarayana T. Characteristics of thermostable endoxylanase and β-xylosidase of the extremely thermophilic bacterium Geobacillus thermodenitrificans TSAA1 and its applicability in generating xylooligosaccharides and xylose from agro-residues. Extremophiles, 2013, 17(3): 357–366. DOI: 10.1007/s00792-013-0524-x |
| [27] |
Liang YL, Li XY, Shin HD, et al. Expression and characterization of a xylosidase (Bxyl) from Bacillus halodurans C-125.
Chin J Biotech, 2009, 25(9): 1386–1393.
(in Chinese). 梁艳丽, 李兴玉, ShinHD, 等. 嗜碱芽孢杆菌C-125木糖苷酶基因的表达与酶特征鉴定. 生物工程学报, 2009, 25(9): 1386-1393. |
 2017, Vol. 33
2017, Vol. 33