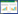中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李冠, 王霞, 尹秀波, 胡晓辉, 陈静, 乔利仙, 隋炯明, 王晶珊
- Li Guan, Wang Xia, Yin Xiubo, Hu Xiaohui, Chen Jing, Qiao Lixian, Sui Jiongming, Wang Jingshan
- 利用离体诱变培育花生新品种宇花4号
- Breeding of peanut variety Yuhua 4 by in vitro mutagenesis
- 生物工程学报, 2017, 33(5): 766-774
- Chinese Journal of Biotechnology, 2017, 33(5): 766-774
- 10.13345/j.cjb.160444
-
文章历史
- Received: November 14, 2016
- Accepted: January 6, 2017
2 山东省农业技术推广总站,山东 济南 250013;
3 山东省农业科学院花生研究所,山东 青岛 266110
2 The Agricultural Technology Extension Station of Shandong Province, Ji'nan 250013, Shandong, China;
3 Peanut Research Institute, Shandong Academy of Agricultural Sciences, Qingdao 266110, Shandong, China
创造花生高油新种质、培育高产高油新品种对提高花生产值、增加农民收益有着重要意义[1-2]。但目前花生品种中缺乏高油品种,杂交育种难以获得突破性进展。诱变能够产生自然界不存在的或极为罕见的新性状、新个体[3-5]。但突变是不定向的,诱变往往产生大量突变体,而突变体的后续鉴定需要大量人力、物力和财力[6]。诱变结合定向筛选可解决这一难题[7-9]。利用离体诱变结合离体定向筛选创造新种质已在多种植物上获得成功,罗静等[10]利用EMS诱变处理草莓愈伤组织并筛选得到抗灰霉病草莓植株。陈丽等[11]应用EMS处理杨树胚性愈伤组织,经盐胁迫定向筛选后获得了耐盐植株。李红等[12]采用NaN3处理苜蓿愈伤组织,对诱变处理的愈伤组织进行碱胁迫处理,获得了耐碱的变异植株。花生离体定向筛选研究也有报道,Venkatachalam等[13]以γ射线辐照处理花生愈伤组织,在培养基中添加黑斑病致病菌滤液进行定向筛选,后代中获得了对黑斑病抗性明显提高的植株。Zhao等[14]利用化学离体诱变结合NaCl定向筛选,获得了耐盐突变体。但利用离体诱变培育出花生新品种尚未见报道。
本研究报道了利用离体诱变和HYP离体定向筛选培育出高产、高油、早熟花生新品种宇花4号。
1 材料与方法 1.1 植物材料供试材料为花生品种花育20号的成熟种子,由山东省农业科学院花生研究所提供。
1.2 方法 1.2.1 离体诱变处理及HYP离体定向筛选2009年选取100粒花育20号成熟干种子,表面杀菌后,取胚小叶培养在添加4 mg/L PYM和10 mg/L 2, 4-二氯苯氧乙酸(2, 4-D)的培养基上进行诱变培养,同时诱导体胚的形成。每粒种子8个胚小叶,共计培养约800个外植体。培养4周后,将存活的外植体转移到添加4 mmol/L HYP和4 mg/L 6-苄氨基腺嘌呤(6-BA)的培养基上诱导体胚萌发,同时进行HYP定向筛选。筛选培养与恢复培养(培养基中不添加HYP)交替进行,直到体胚萌发长成小苗。
1.2.2 再生苗的嫁接和移栽将体胚萌发长成的小苗作为接穗,无菌萌发的花生实生苗作为砧木,采用插接法进行嫁接。嫁接苗继续在培养瓶中培养2 d后,移栽于育苗基质中,在驯化室培养3周后,移栽青岛农业大学试验田。成熟后按单株收获再生植株的种子。
1.2.3 再生植株后代选育过程及产量比较试验M2代开始按株行种植,单粒播种,采用系谱育种法进行选择。试验在青岛农业大学试验田进行,并结合海南加代加快育种进程。直到M5代株行基本稳定无明显分离,选择优良单株混收荚果,形成株系。
M6代对株系进行产量鉴定试验,选出产量高、抗逆强的优良株系形成品系。2013年对选出的高产品系在青岛农业大学试验田进行品比试验,起垄双粒播种,垄距90 cm,每垄播种2行,每行播种25穴,穴距16.7 cm,每个小区播种3垄。以诱变亲本花育20号(山东省区试花生小粒组对照)作为对照,设置3次重复。按常规进行田间管理,干旱时合理浇水,成熟后按小区混收荚果,晒干后称重产量。2014年继续进行品比试验,试验分别在青岛农业大学试验田和莱阳市团旺镇进行,青岛农业大学试验田干旱时合理浇水,莱阳市团旺镇整个生育期间不浇水。收获后进行农艺性状的田间和室内考种,并称重各小区荚果产量。
1.2.4 品质性状测定干种子送交农业部油料及制品质量监督检验测试中心(武汉)化验籽仁含油率,以诱变亲本花育20号作为对照。
1.2.5 安徽省非主要农作物品种鉴定登记试验试验为夏直播,起垄双粒播种,每垄播种2行,每个小区面积13.34 m2,重复3次,全省不同地域共设5个试验点。
2 结果与分析 2.1 离体诱变及HYP耐性体胚萌发成苗花育20号胚小叶外植体在添加PYM和2, 4-D的培养基上诱变培养4周后,800个外植体一半左右褐化,存活的外植体约75%形成了体胚。将存活的外植体转移到含有HYP和6-BA的体胚萌发和筛选培养基上培养4周后,观察发现大部分外植体褐化,仅有少数外植体存活。当存活的外植体转移到不添加HYP的恢复培养基上后,部分外植体上形成的体胚恢复生长。在筛选培养基和恢复培养基上交替培养,最终体胚萌发获得了15个再生苗。
2.2 育种过程及含油率测定结果将体胚萌发长成的小苗作为接穗进行无菌嫁接后,经驯化移栽于青岛农业大学试验田,成熟后按单株收获种子。次年将收获的单株种子按株行单粒播种,生育期及收获期观察发现,12个再生植株的M2代发生明显变异和分离。选择优良单株,利用系谱法结合海南加代进行选择和自交遗传稳定。M5代观察性状已基本稳定,同一株行的个体间无明显分离。将同一株行的优良单株荚果混收形成株系。
测定了所有30个株系含油率,结果见表 1。由表 1可以看出,再生植株不同其后代含油率有所差别,并且有的同一再生植株的后代含油率也不同。诱变亲本花育20号含油率为49.50%,12个原始再生植株的后代株系中只有12号植株后代含油率较低(50.00%–51.60%),其他11个植株后代株系中均有含油率在55.00%以上的高油株系,最高达到59.52%。3号、5号、9号和10号再生植株后代含油率均在55.00%–56.00%。2号、4号和13号再生植株后代株系含油率分别为56.36%–57.22%、55.26%–56.10%和56.20%,均未超过57.50%。1号再生植株后代株系含油率均在56.00%以上,有2个株系含油率高于58.00%,其中31-13-6-4达到59.52%,不同姊妹株系间含油率有所差别。6号植株后代株系含油率也均在56.00%以上,其中36-2-4-4达59.06%。7号再生植株后代含油率均达57.00%以上,但未超过59.00%。11号再生植株后代株系含油率(52.66%–59.38%)明显不同,5个株系中有4个株系含油率低于55.00%,41-23-17-1最低,为52.66%,而姊妹株系41-21-18-5含油率高达59.38%。
| Original plant number (or parent) | Lines | Oil content (%) |
| 1 | 31-3-1-1 | 56.66 |
| 31-5-4-1 | 58.06 | |
| 31-13-6-4 | 59.52 | |
| 2 | 32-1-3-1 | 57.22 |
| 32-2-9-1 | 56.36 | |
| 3 | 33-1-1-1 | 55.10 |
| 4 | 34-11-1-1 | 56.10 |
| 34-16-2-7 | 55.26 | |
| 5 | 35-8-1-1 | 55.70 |
| 35-12-2-1 | 55.00 | |
| 6 | 36-1-2-1 | 57.23 |
| 36-2-4-4 | 59.06 | |
| 36-3-2-1 | 56.47 | |
| 36-5-1-1 | 57.56 | |
| 36-6-4-5 | 57.43 | |
| 36-9-2-2 | 58.17 | |
| 36-11-5-1 | 57.06 | |
| 7 | 37-2-1-3 | 58.83 |
| 37-4-4-5 | 57.23 | |
| 9 | 39-3-1-1 | 55.25 |
| 10 | 40-12-1-1 | 55.80 |
| 11 | 41-2-4-4 | 54.28 |
| 41-11-8-1 | 54.56 | |
| 41-19-11-1 | 52.73 | |
| 41-21-18-5 | 59.38 | |
| 41-23-17-1 | 52.66 | |
| 12 | 42-13-1-1 | 50.00 |
| 42-17-1-1 | 50.40 | |
| 42-18-1-1 | 51.60 | |
| 13 | 43-5-1-1 | 56.20 |
| Parent | Huayu 20 | 49.50 |
对30个株系进行产量鉴定试验,9个株系获得较高产量,并形成品系。2013年对高产品系进行品比试验,品比结果见图 1,作为对照的诱变亲本花育20号平均小区荚果产量6.001 kg,参试的9个品系(来源于5个原始再生植株)中除6号再生植株后代的一个品系36-1-2-1平均小区产量(5.640 kg)低于对照外,其他品系均高于对照。6号植株后代的其他3个品系36-2-4-4、36-3-2-1和36-6-4-5平均小区产量为6.285–6.570 kg。1号再生植株后代品系31-3-1-1平均小区产量为6.015 kg,略高于对照。7号再生植株后代品系37-4-4-5平均小区产量为6.885 kg,显著高于对照,另一个品系37-2-1-3为6.255 kg。11号再生植株后代品系41-21-18-5平均小区产量为6.915 kg,也显著高于对照。4号再生植株后代品系34-11-1-1在参试的品系中产量最高,为7.020 kg,比对照高16.98%,达到了显著水平。

|
| 图 1 离体诱变及HYP定向筛选再生植株后代品系产量品比结果(2013年于青岛农大大学试验田) Figure 1 The difference of yield between mutant lines and parent Huayu 20 (2013, experiment field of Qingdao Agricultural University). |
| |
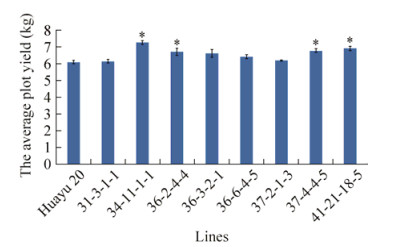
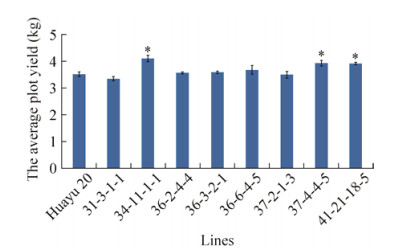
2014年分别在青岛农业大学试验田和莱阳市团旺镇对上述产量高于诱变亲本花育20号的8个品系进一步进行产量品比试验,以诱变亲本花育20号作为对照,结果与2013年试验结果基本吻合(图 2和图 3)。2013年产量显著增加的3个品系34-11-1-1、37-4-4-5和41-21-18-5,2014年在这2个试验点小区荚果产量仍均显著高于对照,其中34-11-1-1在2个试验点均表现第一位,小区荚果产量分别为7.17 kg和4.29 kg,分别比对照增产17.5%和21.8%。此外,36-2-4-4在青岛农业大学试验田小区荚果产量也显著高于对照,而在莱阳市团旺镇小区荚果产量与对照无显著差异。其他4个品系在青岛农业大学试验田小区荚果产量均高于亲本,但达不到显著水平,而在莱阳市团旺镇除31-3-1-1略低于对照外,其他3个品系略高于对照,但差异不显著。与青岛农业大学试验田小区荚果产量(5.91–7.17 kg)相比,莱阳市团旺镇各个品系及对照荚果产量(3.21–4.29 kg)均较低(图 2和图 3)。
|
| 图 2 离体诱变及HYP定向筛选再生植株后代品系产量品比结果(2014年于青岛农业大学试验田) Figure 2 The difference of yield between mutant ines and parent Huayu20 (2014, experiment field of Qingdao Agricultural University). |
| |
|
| 图 3 离体诱变及HYP定向筛选再生植株后代品系产量品比结果(2014年于莱阳市团旺镇) Figure 3 The difference of yield between mutant lines and parent Huayu20 (2014, Tuanwang town of Laiyang). |
| |
2014年收获期于青岛农业大学试验田每个品系取10株进行田间考种,结果列于表 2。参试的8个品系中37号原始再生植株后代的2个品系(37-2-1-3和37-4-4-5) 和41号原始再生植株后代品系(41-21-18-5),其主茎高和侧枝长均比诱变亲本花育20号高,而34-11-1-1和36-6-4-5与亲本相近,其他3个品系(31-3-1-1、36-2-4-4和36-3-2-1) 比亲本矮。由表 2还可以看出,这8个品系分枝数均变多,总分枝数变异范围10.1–15.0条,而亲本平均为9.5条;结果枝数变异范围8.5–14.0条,而亲本为7.1条。
| Lines | Main stem height (cm) | Lateral branch length (cm) | Number of lateral branch per plant | Number of podding branches per plant | Weight per 100 pod (g) | Weight per 100 seed kenels (g) | Milled rice rate (%) |
| Huayu 20 | 36.8 | 40.7 | 9.5 | 7.1 | 192.4 | 74.4 | 76.1 |
| 31-3-1-1 | 29.5 | 33.0 | 10.1 | 8.5 | 200.0 | 78.3 | 77.6 |
| 34-11-1-1 | 35.2 | 39.3 | 12.1 | 9.0 | 181.2 | 69.8 | 76.2 |
| 36-2-4-4 | 31.2 | 36.5 | 13.2 | 11.3 | 199.1 | 74.9 | 74.8 |
| 36-3-2-1 | 32.2 | 38.2 | 13.0 | 10.6 | 208.7 | 80.5 | 77.0 |
| 36-6-4-5 | 36.5 | 42.0 | 14.2 | 14.0 | 190.3 | 74.5 | 75.2 |
| 37-2-1-3 | 39.8 | 46.7 | 14.6 | 11.3 | 180.9 | 68.9 | 76.6 |
| 37-4-4-5 | 40.2 | 47.2 | 14.2 | 10.2 | 200.2 | 76.3 | 76.5 |
| 41-21-18-5 | 37.7 | 41.0 | 15.0 | 9.1 | 183.6 | 70.7 | 76.7 |
百果重、百仁重和出米率测定结果也列于表 2,亲本花育20号百果重和百仁重分别为192.4 g和74.4 g。8个品系百果重变异范围180.9–208.7 g,百仁重变异范围68.9–80.5 g,其中3个品系(34-11-1-1、37-2-1-3和41-21-18-5) 荚果稍变小,其百果重和百仁重均低于亲本。36-6-4-5与亲本相近,而另外4个品系(31-3-1-1、36-2-4-4、36-3-2-1和37-4-4-5) 荚果稍变大。8个品系的出米率(74.8%–77.6%)与亲本(76.1%)无明显区别。
2.4 宇花4号特征特性根据2年3个试验点产量品比试验结果,34-11-1-1、37-4-4-5和41-21-18-5荚果产量均显著高于诱变亲本花育20号,含油率分别为56.10%、57.23%和59.38%,均达到高油标准。其中34-11-1-1产量最高,2015年参加安徽省非主要农作物鉴定登记试验,并通过了试验,命名为宇花4号,审定编号为皖品鉴登字第1505006,在参试的品种中名列第一,平均亩产量260.50 kg,比对照白沙1016增产16.63%。
宇花4号为早熟高油小花生品种,株型直立、疏枝。春播全生育期125 d左右,夏播115 d左右。抗病、抗倒伏性、耐旱性较强。株茎高35.2 cm,侧枝长39.3 cm,总分枝数12条,有效分枝数9条。百果重181.2 g,百仁重69.8 g,出米率76.2%。荚果普通形,种皮浅粉红色,含油率56.10%,达到高油标准。和诱变亲本花育20号相比,宇花4号分枝数多2–3条(图 4),产量显著提高(图 1、2和3),含油率提高6.6个百分点(表 1)。

|
| 图 4 宇花4号(B)和诱变亲本花育20号(A)田间收获图 Figure 4 Harvested plants of Yuhua 4 (B) and parent Huayu 20 (A). |
| |
花育20号是山东省农业科学院花生研究所育成的高产小粒花生品种[15],是山东省花生区试小粒组对照品种。本研究以花育20号胚小叶作为外植体,PYM作为诱变剂进行离体诱变和HYP离体定向筛选,再生植株后代中,5个原始再生植株的8个品系产量高于诱变亲本,其中34-11-1-1、37-4-4-5和41-21-18-5等3个品系2013年和2014年在青岛农业大学试验田荚果产量均显著高于亲本,2014年在莱阳市团旺镇较干旱没有浇水的情况下产量仍显著高于诱变亲本花育20号,表现出较强的耐旱性。11个原始再生植株的23个品系含油率在55%以上,最高达59.52%,比花育20号(含油率为49.50%)高10.02个百分点。PYM是一种抗生素[16],作为诱变剂,与其他化学诱变剂相比具有安全、高效、诱变频率高、范围大等特点[17-18]。本研究结果进一步证实了PYM的诱变效果。
脯氨酸是最重要和有效的有机渗透调节物质[19],几乎所有的逆境(如干旱、低温、高温、冰冻、盐渍、低pH、营养不良、病害和大气污染等)都会造成植物体内脯氨酸的积累,尤其干旱胁迫时脯氨酸积累最多,因此脯氨酸含量常用作抗旱的生理指标,也可用于鉴定植物遭受干旱的程度[20]。HYP是脯氨酸的类似物, 能够与脯氨酸竞争性地反馈抑制脯氨酸合成途径中的谷氨酸激酶[21]。以HYP作为选择压力,通过组织培养手段,已先后在多种植物上获得耐HYP的变异细胞系,并表现出较强的抗逆性。李红等对紫花苜蓿进行离体诱变和HYP定向筛选,获得的变异体表现出较强的抗旱性和抗寒性[22]。胡博然等以枸杞胚性愈伤组织为辐照材料,经60Co辐照后进行HYP筛选,细胞变异系耐盐性明显提高[23]。张栋梁等利用无性系变异筛选茄子耐HYP突变体,再生植株表现出较强的耐冷性[24]。本研究经离体诱变的外植体在含有HYP的培养基上定向筛选,获得的耐性突变再生植株后代含油率明显提高,其突变位点及遗传机理有待进一步研究。突变体的耐盐性、耐冷性、抗旱性等也有待进一步鉴定。
花生是我国重要的油料作物之一,目前花生籽仁含油率在55%以上则定为高油品种[25]。据报道,含油率每提高1个百分点,纯利润可提高7%[26]。本研究培育出了高产高油花生新品种宇花4号,其他高油突变体也将为高产高油花生新品种培育以及遗传研究提供重要的材料。
4 结论本研究利用花生品种花育20号胚小叶作为外植体,PYM作为诱变剂和HYP作为筛选压进行离体诱变和离体定向筛选,再生植株后代中3个品系荚果产量显著高于诱变亲本花育20号,23个品系含油率达到高油标准(含油率55%以上)。育成的高产高油花生新品种宇花4号含油率为56.10%,达到高油标准,荚果产量比花育20号增产15%以上,比安徽省区试对照品种白沙1016提高16.63%。本研究证明离体诱变结合离体定向筛选是花生育种的一条有效途径。
| [1] |
Chen MN, Chi XY, Pan LJ, et al. The development progress and prospects of peanut breeding in China.
Chin Agric Sci Bull, 2014, 30(9): 1–6.
(in Chinese). 陈明娜, 迟晓元, 潘丽娟, 等. 中国花生育种的发展历程与展望. 中国农学通报, 2014, 30(9): 1-6. DOI:10.11924/j.issn.1000-6850.2013-1988 |
| [2] |
Chen SL. Identification and functional analysis of lipid biosynthesis related genes in peanut (Arachis hypogaea L.)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012 (in Chinese). 陈四龙. 花生油脂合成相关基因的鉴定与功能研究[D]. 北京: 中国农业科学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-82101-1013174694.htm |
| [3] |
Ao Y, Pan QH. Phenotypic variation of Euonymus fortunei branches treated by 60Co γ-rays irradiation.
J Nucl Agric Sci, 2008, 22(3): 271–275.
(in Chinese). 敖妍, 潘青华. 60Co γ射线辐照扶芳藤枝条的表型变异研究. 核农学报, 2008, 22(3): 271-275. |
| [4] |
Yu XL, Liu LX, Qiao LX, et al. Effects of mixed high energy particle field on embryonic leaflet culture and plant regeneration of peanut.
J Nucl Agric Sci, 2012, 26(3): 433–438.
(in Chinese). 于新玲, 刘录祥, 乔利仙, 等. 高能混合粒子场辐照对花生胚小叶组织培养及植株再生的影响. 核农学报, 2012, 26(3): 433-438. |
| [5] | Wang JS, Sui JM, Xie YD, et al. Generation of peanut mutants by fast neutron irradiation combined with in vitro culture. J Radia Res, 2015, 56(3): 437–445. DOI: 10.1093/jrr/rru121 |
| [6] |
Wang Y, Qiao LX, Wu XL, et al. Effect of in vitro mutagenesis with pingyangmycin and NaCl-directed screening on production and quality of offspring in peanut.
Acta Agric Boreali-Sin, 2015, 30(1): 202–206.
(in Chinese). 王亚, 乔利仙, 武秀玲, 等. 平阳霉素诱变与NaCl定向筛选对花生后代产量和品质性状的影响. 华北农学报, 2015, 30(1): 202-206. DOI:10.7668/hbnxb.2015.01.034 |
| [7] | Rai MK, Kalia RK, Singh R, et al. Developing stress tolerant plants through in vitro selection-an overview of the recent progress. Environ Exp Bot, 2011, 71(1): 89–98. DOI: 10.1016/j.envexpbot.2010.10.021 |
| [8] |
Wu WG, Liu GR, Yang XJ. Applications of the mutation in connection with in vitro culture for plant breeding.
Chin Agric Sci Bull, 2005, 21(11): 197–201.
(in Chinese). 吴伟刚, 刘桂茹, 杨学举. 诱变与组织培养相结合在植物育种中的应用. 中国农学通报, 2005, 21(11): 197-201. |
| [9] | Patade VY, Suprasanna P. An in vitro radiation induced mutagenesis-selection system for salinity tolerance in sugarcane. Sugar Tech, 2009, 11(3): 246–251. DOI: 10.1007/s12355-009-0042-4 |
| [10] |
Luo J, Zhou HC, Wang YQ, et al. EMS mutagenesis in vitro and screening of calli from strawberry leaves of resistance to Botrytis chinerea Pers.
J Nucl Agric Sci, 2009, 23(1): 90–94.
(in Chinese). 罗静, 周厚成, 王永清, 等. EMS离体诱变及抗草莓灰霉病愈伤组织的筛选. 核农学报, 2009, 23(1): 90-94. |
| [11] |
Chen L, Dong JW, Tang Y, et al. Selection of salt-tolerant mutants from ethyl methane sulfonate-mutagenized poplar embryonic calli.
Acta Agric Shanghai, 2007, 23(3): 86–91.
(in Chinese). 陈丽, 董举文, 唐寅, 等. EMS诱变处理定向筛选杨树耐盐突变体研究. 上海农业学报, 2007, 23(3): 86-91. |
| [12] |
Li H, Li B, Zhao HB, et al. Study on alkalinity resistance of alfalfa callus in mutagenic treatments.
Pratac Sci, 2009, 26(7): 32–35.
(in Chinese). 李红, 李波, 赵洪波, 等. 诱变处理苜蓿愈伤组织抗碱性的研究. 草业科学, 2009, 26(7): 32-35. |
| [13] | Venkatachalam P, Jayabalam N. Selection and regeneration of groundnut plants resistant to the pathotoxic culture filtrate of Cercosporidium personation through tissue culture technology. Appl Biochem Biotechnol, 1997, 61(3): 351–364. DOI: 10.1007/BF02787807 |
| [14] | Zhao MX, Sun HY, Ji RR, et al. In vitro mutagenesis and directed screening for salt-tolerant mutants in peanut. Euphytica, 2013, 193(1): 89–99. DOI: 10.1007/s10681-013-0956-5 |
| [15] | 崔凤高. 花生新品种介绍. 新农业, 2014(1): 25-28. |
| [16] |
Wu GT, Xia YW, Shu QY, et al. Biological effects of pingyangmycin on different rice varieties.
J Zhejiang Agric Univ, 1997, 23(1): 1–6.
(in Chinese). 吴关庭, 夏英武, 舒庆尧, 等. 平阳霉素对不同水稻品种的生物学效应. 浙江农业大学学报, 1997, 23(1): 1-6. |
| [17] |
Zhang DD, Wang WH, Li G, et al. Chemistry mutagenesis in vitro and characteristics of mutants in sweet potato.
J Plant Physio, 2016, 52(3): 343–348.
(in Chinese). 张丹丹, 王维华, 李冠, 等. 甘薯化学离体诱变及突变体的性状表现. 植物生理学报, 2016, 52(3): 343-348. |
| [18] |
Yan ZM, Feng YN, Han YL, et al. Effects of exogenous proline on proline metabolism of cucumis melo under salt stress.
Acta Bot Bor-Occid Sin, 2015, 35(10): 2035–2041.
(in Chinese). 颜志明, 冯英娜, 韩艳丽, 等. 外源脯氨酸对盐胁迫下甜瓜脯氨酸代谢的影响. 西北植物学报, 2015, 35(10): 2035-2041. |
| [19] |
Wang H, Chen FD, Zhao HB, et al. Mutagenic effect of pingyangmycin on Dendranthema grandiflorum 'Italy Red' with small inflorescence.
J Nanjing Agric Univ, 2007, 30(1): 39–43.
(in Chinese). 王红, 陈发棣, 赵宏波, 等. 平阳霉素对盆栽小菊意大利红的诱变效应. 南京农业大学学报, 2007, 30(1): 39-43. |
| [20] |
Wang Z.
Plant Physiology.2nd ed. Beijing: China Agriculture Press, 2009: 529-547(in Chinese).
王忠. 植物生理学.2版. 北京: 中国农业出版社, 2009: 529-547. |
| [21] | Adams E, Frank L. Metabolism of proline and the hydroxyprolines. Ann Rev Biochem, 1980, 49: 1005–1061. DOI: 10.1146/annurev.bi.49.070180.005041 |
| [22] |
Li H, Li B, Wang LL, et al. Screening and characterizing of L-hydroxyoroline resistant variants in Medicago sativa.
Pratac Sci, 2008, 25(10): 29–33.
(in Chinese). 李红, 李波, 王丽玲, 等. 紫花苜蓿耐羟脯氨酸变异体的筛选及抗性研究. 草业科学, 2008, 25(10): 29-33. |
| [23] |
Hu BR, Xu WB, Zhang SL, et al. Screening and characterizing of hydroxyproline-resistant variants in Lycium barbarum and analysis of its salt tolerance.
Acta Bot Bor-Occid Sin, 2003, 23(3): 422–427.
(in Chinese). 胡博然, 徐文彪, 张双灵, 等. 枸杞抗羟脯氨酸细胞变异系筛选及其耐盐特性的研究. 西北植物学报, 2003, 23(3): 422-427. |
| [24] |
Zhang DL, Xu YJ, Chen JJ. Primarily study on in vitro selection of hydroxyproline-resistant mutants of eggplant.
Hubei Agric Sci, 2008, 47(7): 805–809.
(in Chinese). 张栋梁, 徐跃进, 陈建军. 离体筛选茄子抗羟脯氨酸突变体的初步研究. 湖北农业科学, 2008, 47(7): 805-809. |
| [25] | 贾新旺. 高产高油大花生冀花5号高产配套栽培技术. 中国种业, 2010(S1): 90-92. |
| [26] | 制约花生产业发展的因素及对策[EB/OL]. [2016-11-10] http://news.idoican.com.cn/hbkejib/html/2009-11/26/content_46921150.htm. |
 2017, Vol. 33
2017, Vol. 33