中国科学院微生物研究所、中国微生物学会主办
文章信息
- 贾敬, 徐殿胜, 庄秀园, 张道敬, 陶黎明, 李元广
- Jia Jing, Xu Diansheng, Zhuang Xiuyuan, Zhang Daojing, Tao Liming, Li Yuanguang
- 小球藻热水提取物功能成分的活性跟踪分离
- Bioassay-guided isolation of functional components from hot water extract of Chlorella pyrenoidosa
- 生物工程学报, 2017, 33(5): 743-756
- Chinese Journal of Biotechnology, 2017, 33(5): 743-756
- 10.13345/j.cjb.160382
-
文章历史
- Received: October 15, 2016
- Accepted: January 16, 2017
2 华东理工大学药学院,上海 200237
2 School of Pharmacy, East China University of Science and Technology, Shanghai 200237, China
蛋白核小球藻Chlorella pyrenoidosa是一种食用历史悠久、营养丰富的健康食品[1],具有多种功效,近年来已成为畅销全球的功能性食品,2012年已被我国卫生部公布为新资源食品[2]。小球藻功能成分中最引人注目的是一种被称为“小球藻生长因子”的热水提取物(Hot water extract of C. pyrenoidosa,简称CPE)。据报道,CPE在调节免疫活性[3-4]、改善代谢综合征[5-6]、清除自由基[7-8]、清除体内重金属[9-10]等方面具有良好功效。由于CPE为非脂溶性物质,从小球藻中提取油脂后并不影响CPE的活性,因此,从提取油脂后的藻渣中获得CPE等高附加值产品,则可降低微藻开发生物能源的生产成本,推动微藻能源产业化的进程[11]。
活性氧(ROS)包括羟自由基、超氧阴离子、双氧水和NO等[12],是有机体进行代谢产生的。ROS能减弱生物体的正常代谢系统,造成各种畸形,如心肌缺氧、致癌、炎症和阿尔兹海默症等[13]。羟自由基是化学性质最活泼的活性氧,其反应速度快,是对机体危害最大的自由基[14]。ROS的平衡是保持机体氧化还原平衡的重要条件[15]。近年来关于抗氧化活性物质的研究报道很多,Seok等[16]从椭圆小球藻Chlorella ellipoidea中分离得到一种抗氧化多肽。Rafiquzzaman等[17]从裙带菜中分离得到的一种分子质量为10 000 Da的糖蛋白,具有清除自由基、免疫调节和保护DNA免受损伤的作用。然而,遗憾的是这些物质的抗氧化活性均不高,且质量浓度需在1−10 mg/mL时才能发挥作用。
Erick等[18]从C. pyrenoidosa中分离得到一种磷酸化多聚糖,能够调节巨噬细胞NO的分泌。Hsu等[19]对巨噬细胞的免疫刺激活性进行研究发现,小球藻多糖通过toll样受体4 (TLR4) 介导的蛋白激酶信号通路活化巨噬细胞。巨噬细胞作为抵抗病原微生物的第一道防线,具有清除机体损伤组织细胞、吞噬外源病菌并激活其他免疫细胞的作用,同时还可作为抗原提呈细胞与T细胞相互作用启动免疫反应[20]。因此常被作为研究免疫调节活性的靶标。
庄秀园等[11]指出不同原料来源、提取方法及活性跟踪筛选技术得到的CPE产物的活性存在差异。根据国内外文献报道,CPE的研究主要集中于抗肿瘤与免疫调节活性,而作为一种水溶性混合物,CPE中起关键作用的主要活性成分至今没有确切定论。前期研究中发现,利用高压热水萃取法制备的CPE在得率和生物活性方面具有明显优势[21],初步活性跟踪表明,经Sevag除蛋白、乙醇沉淀制备的多糖,在清除自由基及免疫调节活性方面更显著。本文以高产油脂的“异养-稀释-光诱导”串联培养新模式生产的C. pyrenoidosa藻粉为原料,以自由基清除作用和促巨噬细胞(Ana-1) 增殖作用为活性跟踪指标,对上述粗多糖进一步分离纯化,以期获得CPE中的主要功能成分。
1 材料与方法 1.1 材料与试剂蛋白核小球藻藻粉由嘉兴泽元生物制品有限责任公司提供;透析袋购于北京鼎国科技有限公司,截留分子量为3 500 Da;二乙基氨基乙基52 (DEAE52) 购于Whatman公司;葡聚糖凝胶(Sephadex G-100) 购于GE公司;羟自由基试剂盒和超氧阴离子自由基试剂盒购于南京建成生物有限公司;Ana-1购于中国科学院细胞库;RPMI1640培养基为Hyclone公司产品;胎牛血清(FBS)为Biosun产品;其他试剂均为化学纯或分析纯。
1.2 CPE粗多糖的制备510 g藻粉均匀悬浮于5 100 mL蒸馏水中,置于高压灭菌锅中,于121 ℃ (压力为0.1 MPa)萃取40 min。待冷却后10 000 r/min离心30 min,取上清。离心后的藻泥于等量蒸馏水中重悬,以相同条件进行提取处理,取上清。两次上清经减压抽滤浓缩后合并,冷冻干燥备用,得CPE粗组分。
CPE粗组分溶解于水后经Sevag法除蛋白,80%乙醇沉淀得到粗多糖组分PS。将PS组分溶于适量蒸馏水中,于10 000 Da超滤离心管中超滤离心,6 000 r/min离心40 min,分别收集两部分液体,80%乙醇溶液沉淀,60 ℃烘干。经超滤离心分离得到的高分子量(大于10 000 Da)的组分记为PS-1,低分子量(小于10 000 Da)的组分记为PS-2。
1.3 CPE粗多糖的分离纯化CPE粗多糖组分PS-1/PS-2高活性组分经DEAE52柱层析(5 cm×25 cm),以浓度为0、0.1、0.2、0.5、1.0、2.0 mol/L的NaCl溶液梯度洗脱,透析浓缩,冻干备用。
PS-1/PS-2经离子交换柱层析后产物中活性较高的组分上样至Sephadex G-100柱(1.9 cm× 10 cm),以3倍体积的蒸馏水洗脱,洗脱液以5 mL/管收集,根据苯酚硫酸法测总糖含量、280 nm检测蛋白质的吸收峰、合并糖吸收峰和蛋白质吸收峰,经减压浓缩,冷冻干燥,保存备用。
1.4 CPE多糖纯化组分分析采用苯酚-硫酸法测定样品的总糖含量,考马斯亮蓝法测定蛋白质含量。
纯化后的样品PS-1-4-2和PS-1-3-2采用高效液相色谱分析纯度和分子量,色谱条件为:美国Agilent1200series高效液相色谱仪(Agilent Chemstation控制系统及凝胶渗透色谱GPC数据处理软件),色谱柱Ultrahydrogel 2 000和500两根多糖专用凝胶色谱柱串联(柱长300 mm,内径7.8 mm,排阻限分别为7×106和4×105 Da),以0.1 mol/L NaNO3溶液为流动相,流速为0.5 mL/min,柱温度25 ℃,示差折光检测器,分子量标准物质为pullulan多糖。
纯化后的样品PS-2-3-3采用高效液相色谱分析纯度和分子量,色谱条件为:美国Agilent1200series高效液相色谱仪(Agilent Chemstation控制系统及凝胶渗透色谱GPC数据处理软件),色谱柱Shodex KS 802和804两根多糖专用凝胶色谱柱串联(柱长300 mm,内径8 mm,排阻极限分别为4×105和1×104 Da),以0.2 mol/L NaCl溶液为流动相,流速为0.8 mL/min,柱温度25 ℃,示差折光检测器,分子量标准物质为pullulan多糖。
1.5 CPE多糖组分抗氧化活性跟踪CPE多糖组分的清除自由基活性检测按照南京建成有限公司的羟自由基(·OH)试剂盒指示进行操作。样品的自由基清除能力根据下述公式进行计算,以样品对·OH的百分清除率表示。

|
CPE多糖组分促Ana-1增殖活性以Ana-1细胞存活率表示。采用MTT法检测CPE组分对Ana-1细胞存活率的影响。根据公式计算细胞存活率。
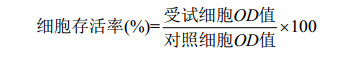
|
CPE粗分产物的得率及组分分析如表 1所示,PS-1和PS-2的得率分别为27.50 mg/g藻粉和20.90 mg/g藻粉。
| Sample | Yield (mg/g Chlorella) | Total sugar (mg/g sample) | Protein (mg/g sample) |
| CPE | – | 185.33±0.01 | 248.65±3.05 |
| PS | 31.55 | 221.54±0.01 | 77.78±0.01 |
| PS-1 | 27.50 | 410.95±0.02 | 219.44±0.02 |
| PS-2 | 20.90 | 126.43±0.00 | 267.78±0.01 |
表 1可知CPE中蛋白质组分的含量高于总糖含量,经Sevag试剂去除游离蛋白后的PS糖含量明显升高。经超滤离心后得到的组分中PS-1的糖含量明显升高,并且含有丰富的蛋白质。PS-2组分以蛋白质为主,并且含有较为丰富的糖。
2.2 CPE多糖分离纯化产物得率及组分分析表 2为PS-1离子交换产物得率及组分分析,PS-1经DEAE52离子交换层析分离得到的组分中得率最高为PS-1-1,PS-1-6的得率最低,仅为0.25 mg/g藻粉。总糖和蛋白质含量分析可知PS-1经离子交换层析分离后产物中含有较为丰富的总糖和蛋白质。
| Sample | Yield (mg/g Chlorella) | Total sugar (mg/g sample) | Protein (mg/g sample) |
| PS-1-1 | 23.26 | 136.0±0.04 | 106.67±0.01 |
| PS-1-2 | 3.63 | 71.40±0.01 | 54.47±0.03 |
| PS-1-3 | 4.52 | 87.19±0.02 | 111.67±0.01 |
| PS-1-4 | 2.17 | 51.40±0.02 | 76.67±0.01 |
| PS-1-5 | 0.45 | 81.80±0.02 | 52.78±0.01 |
| PS-1-6 | 0.25 | 0.00±0.01 | 66.12±0.01 |
PS-2离子交换产物得率及组分分析如表 3所示,PS-2经DEAE52离子交换层析分离得到的组分得率都很低,最高得率为PS-2-2,为3.56 mg/g藻粉。由总糖和蛋白质含量分析可知,PS-2经离子交换层析分离后产物中同样含有较为丰富的总糖和蛋白质,其中PS-2-1的蛋白质较为丰富,总糖相对其他组分为最高;PS-2-3的蛋白质含量最低,总糖含量较高;而PS-2-4的蛋白质含量却远远高于糖含量。
| Sample | Yield (mg/g Chlorella) | Total sugar (mg/g sample) | Protein (mg/g sample) |
| PS-2-1 | 1.79 | 104.51±0.01 | 963.89±0.04 |
| PS-2-2 | 3.56 | 40.90±0.02 | 180.56±0.03 |
| PS-2-3 | 1.57 | 40.24±0.00 | 15.00±0.01 |
| PS-2-4 | 2.21 | 25.00±0.00 | 107.22±0.01 |
| PS-2-5 | 0.21 | 27.99±0.00 | 73.89±0.01 |
| PS-2-6 | 0.22 | 24.58±0.00 | 25.98±0.02 |
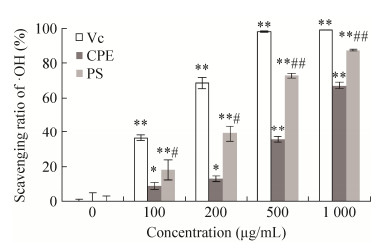
CPE和PS均具有自由基清除活性(图 1)。在质量浓度1 000 μg/mL时,PS对·OH的清除率为87.5% (P < 0.01,与空白对照相比),是Vc的89.3%。CPE和PS的清除活性均具有浓度依赖关系。与CPE相比,PS对·OH的清除活性明显升高,与前期研究中多糖的抗氧化活性优于蛋白质的活性一致[21]。
|
| 图 1 CPE粗多糖·OH清除能力(n=6) Figure 1 ·OH scavenging capacity of crude polysaccharides from CPE. *P < 0.05, **P < 0.01 compared with control; #P < 0.05, ##P < 0.01 compared with CPE. |
| |
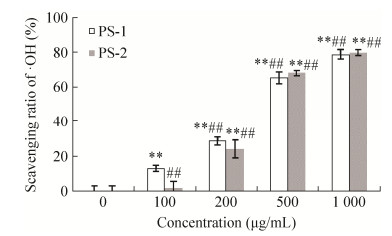
CPE多糖超滤分离组分·OH清除能力如图 2所示,PS-1和PS-2均具有较强的·OH清除能力,与空白对照相比,清除能力具有统计学意义(P < 0.01)。浓度为1 000 μg/mL时PS-1的清除率高达78.81%,PS-2的清除率高达79.94%。通过组间比较发现,PS-1和PS-2清除能力未达到显著性差异(P > 0.05),表明PS-1和PS-2的清除能力无明显差异,因此PS-1和PS-2均存在具有抗氧化能力的功能成分,需对两种组分分别进行活性跟踪。
|
| 图 2 CPE多糖超滤分离组分·OH清除能力(n=6) Figure 2 ·OH scavenging capacity of ultrafiltration components from PS. *P < 0.05, **P < 0.01 compared with control; #P < 0.05, ##P < 0.01 compared with PS. |
| |
PS-1离子交换产物·OH清除能力如图 3所示。图 3表明PS-1-2、PS-1-3、PS-1-4均具有一定程度的·OH清除能力,且具有浓度依赖关系。其中PS-1-4的清除率在1 000 μg/mL时高达81.73%,为Vc的82.50%。PS-1-3和PS-1-4的清除能力均明显高于PS-1-1、PS-1-2、PS-1-5和PS-1-6的活性,且PS-1-3和PS-1-4的组间数据具有统计学意义。PS-1主要为分子质量大于10 000 Da的CPE多糖成分,上述结果表明,CPE中大分子质量多糖的活性成分主要存在于PS-1-3或PS-1-4中,或者两者均有。
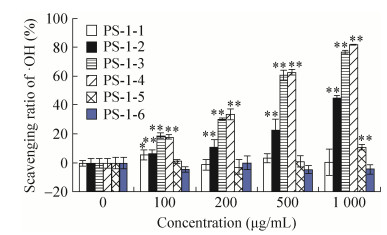
|
| 图 3 PS-1离子交换产物·OH清除能力(n=6) Figure 3 ·OH scavenging capacity of components isolated from PS-1 by ion exchange chromatography (n=6). *P < 0.05, **P < 0.01 compared with control. |
| |
PS-2离子交换产物·OH清除能力如图 4所示。PS-2-1、PS-2-2、PS-2-3和PS-2-4都具有一定程度的自由基清除能力,且具有浓度依赖关系。PS-2-3和PS-2-4在1 000 μg/mL的清除率明显高于其他组分。PS-2为分子质量小于10 000 Da的CPE多糖成分,研究表明分子质量较小的组分中的活性成分主要存在于PS-2-3或PS-2-4,或两者都有,但其他组分中也含有部分活性较弱的成分。
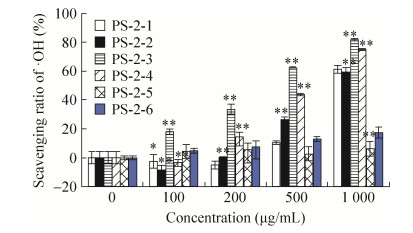
|
| 图 4 PS-2离子交换产物·OH清除能力(n=6) Figure 4 ·OH scavenging capacity of components isolated from PS-2 by ion exchange chromatography (n=6). *P < 0.05, **P < 0.01 compared with control. |
| |
PS-1和PS-2经过DEAE52分离得到的组分中,活性相对较高的为PS-1-3、PS-1-4、PS-2-3和PS-2-4。选取活性最高、分子质量较大的组分PS-1-4和分子量较低的组分PS-2-3,对其进行Sephadex G-100纯化,根据洗脱曲线收集组分,以自由基清除率为跟踪指标,对其组分进行活性评价。
PS-1-4纯化组分·OH自由基清除能力结果如图 5所示,PS-1-4纯化得到的2种组分都有一定程度的·OH清除能力。经活性比较,PS-1-4-2组分的清除能力优于PS-1-4-3,与空白对照相比,PS-1-4-2的清除率达到极其显著水平;与PS-1-4相比,PS-1-4-2和PS-1-4-3在1 000 μg/mL时具有显著的清除能力。

|
| 图 5 PS-1-4 Sephadex G-100产物·OH清除能力(n=6) Figure 5 ·OH scavenging capacity of components from PS-1-4 by Sephadex G-100. **P < 0.01 compared with control; ##P < 0.01 compared with PS-1-4. |
| |
PS-2-3纯化组分·OH清除能力结果如图 6所示。PS-2-3经Sephacryl S-100纯化得到5种组分,均能够有效清除反应体系内的·OH。通过活性比较,5种组分中清除自由基活性最高的组分为PS-2-3-2,1 000 μg/mL的清除率高达84.83%,且具有浓度依赖关系。PS-2-3-2的得率很低,不足以用于进一步纯化或结构鉴定。PS-2-3-3具有很高的清除·OH活性,清除能力仅次于PS-2-3-2,1 000 μg/mL的清除率高达78.86%,且具有浓度依赖关系。
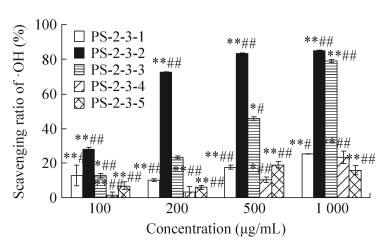
|
| 图 6 PS-2-3 Sephacryl S-100产物·OH自由基清除能力(n=6) Figure 6 ·OH scavenging capacity of components from PS-2-3 by Sephacryl S-100. *P < 0.05, **P < 0.01 compared with control; ##P < 0.01 compared with PS-2-3. |
| |
与CPE相比,PS的促细胞增殖活性显著增强(图 7)。在浓度为200 μg/mL时,PS作用下细胞的存活率高达168%,高于同浓度CPE作用下的细胞存活率(129%)。
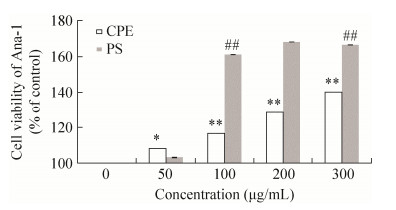
|
| 图 7 CPE粗多糖对Ana-1细胞存活率的影响(n=6) Figure 7 Ana-1 cell viability of crude polysacchride from CPE (n=6). *P < 0.05, **P < 0.01 compared with control; ##P < 0.01 compared with CPE. |
| |
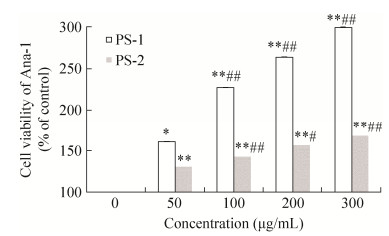
PS-1和PS-2都能够促进Ana-1细胞生长,其促增殖作用均具有浓度依赖关系(图 8)。其中PS-1的促增殖活性明显高于PS-2,在质量浓度为300 μg/mL时促增殖活性达到299%。由于Ana-1细胞是常见的免疫调节细胞,CPE及其分离组分能显著促进其生长,可能与Ana-1细胞的激活有关,进而通过调节机体的免疫系统发挥作用。
|
| 图 8 CPE多糖超滤组分对Ana-1细胞存活率的影响(n=6) Figure 8 Ana-1 cell viability of components from PS by ultrafiltration (n=6). *P < 0.05, **P < 0.01 compared with control; #P < 0.05, ##P < 0.01 compared with PS. |
| |
由于PS-1具有极强的促Ana-1细胞增殖能力,因此通过DEAE52分离得到PS-1的主要组分,对其进行活性评价,结果如图 9所示。PS-1-2、PS-1-3、PS-1-4组分都能够有效促进Ana-1细胞生长。其中PS-1-4具有明显的浓度依赖关系,在质量浓度为300 μg/mL时,促增殖能力达到60%。

|
| 图 9 PS-1离子交换层析产物对Ana-1细胞存活率的影响(n=6) Figure 9 Ana-1 cell viability of components from PS-1 by ion exchange chromatography (n=6). *P < 0.05, **P < 0.01 compared with control; #P < 0.05, ##P < 0.01 compared with PS-1. |
| |
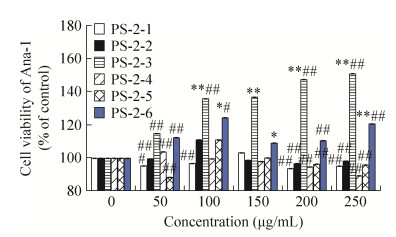
PS-2-3能够有效地促进Ana-1细胞生长,且具有浓度依赖关系,在质量浓度为300 μg/mL时,促增殖能力达到51% (图 10)。PS-2-1、PS-2-2、PS-2-4、PS-2-5和PS-2-6均能够不同程度地促进Ana-1细胞的生长,但促增殖率低于20%。
|
| 图 10 PS-2离子交换层析组分对Ana-1细胞存活率的影响(n=6) Figure 10 Ana-1 cell viability of components from PS-2 by ion exchange chromatography (n=6). *P < 0.05, **P < 0.01 compared with control; #P < 0.05, ##P < 0.01 compared with PS-2. |
| |
PS-1-4经Sephadex G-100纯化组分对Ana-1细胞存活率的影响如图 11所示。PS-1-4纯化组分中2种组分均能够促进细胞生长,其中PS-1-4-2的促增殖作用相对较高,200 μg/mL时促增殖率达到87%。PS-1-4-2和PS-1-4-3对Ana-1细胞存活率的影响与剂量存在一定的效应关系。

|
| 图 11 PS-1-4 Sephadex G-100组分对Ana-1细胞存活率的影响(n=6) Figure 11 Ana-1 cell viability of components from PS-1-4 by Sephadex G-100 (n=6). *P < 0.05, **P < 0.01 compared with control. |
| |
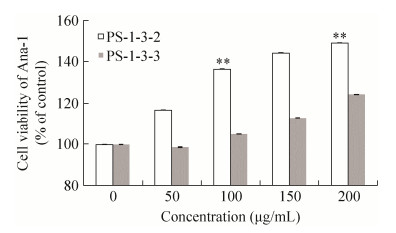
PS-1-3经Sephadex G-100纯化组分对Ana-1细胞存活率的影响如图 12所示。PS-1-3-2在200 μg/mL时促细胞增殖能力最高,促增殖率达到49%;PS-1-3-3在质量浓度为200 μg/mL时,促增殖率为24%。
|
| 图 12 PS-1-3 Sephadex G-100组分对Ana-1细胞存活率的影响(n=6) Figure 12 12 Ana-1 cell viability of components from PS-1-3 by Sephadex G-100 (n=6). *P < 0.05, **P < 0.01 compared with control; #P < 0.05, ##P < 0.01 compared with PS-1-3. |
| |
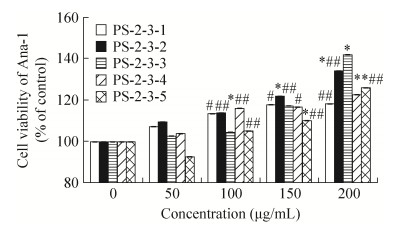
PS-2-3经Sephacryl S-100纯化组分对Ana-1细胞存活率的影响如图 13所示。图 13表明PS-2-3-3能够显著地促进Ana-1细胞生长,且具有浓度依赖关系,在质量浓度为200 μg/mL时,促增殖能力达到42%。与PS-2-3-3相比,PS-2-3-2具有同样的促进细胞生长的活性,并且在测试浓度范围内,促增殖率与浓度呈正相关。在浓度为200 μg/mL时,PS-2-3-2的促细胞增殖率为34%,略低于PS-2-3-3的活性。
|
| 图 13 PS-2-3 Sephacryl S-100组分对Ana-1细胞存活率的影响(n=6) Figure 13 Ana-1 cell viability of components from PS-2-3 by Sephacryl S-100 (n=6). *P < 0.05, **P < 0.01 compared with control; #P < 0.05, ##P < 0.01 compared with PS-2-3. |
| |
纯化组分PS-1-4-2和PS-1-3-2采用GPC检测,结果如图 14所示。图 14A中显示PS-1-4-2组分经GPC色谱分析,示差折光检测器和UV检测器信号(图 14B)表明,PS-1-4-2组分是一种复合多糖,可能为糖蛋白、糖肽或蛋白聚糖。由已知分子量的普鲁兰多糖制定校正曲线,根据多糖纯化产物的保留时间,由GPC软件分析得到PS-1-4-2的重均分子量Mw=3.97×104 Da,数均分子量Mn=1.12×103 Da。示差折光检测器信号显示,样品出峰时间为39.150 min。
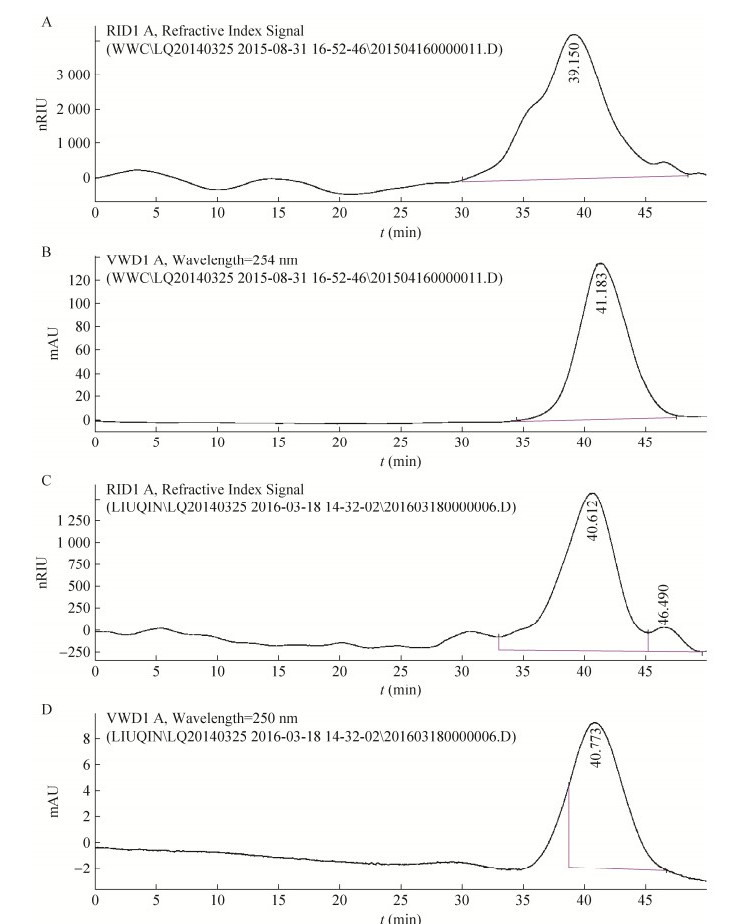
|
| 图 14 PS-1-4-2和PS-1-3-2的凝胶渗透色谱图 Figure 14 Gel permeation chromatogram of PS-1-4-2 and PS-1-3-2. (A, C) Results from refractive index test. (B, D) Results in 254 nm. |
| |
与PS-1-4-2相似,PS-1-3-2经GPC软件分析(图 14C和图 14D),其重均分子量Mw=2.28×104 Da,数均分子量Mn=5.92×103 Da,出峰时间为40.612 min。且PS-1-3-2在250 nm处有较强的洗脱峰信号,说明其为糖蛋白或糖肽。
与PS-1分级分离纯化的产物不同的是,PS-2分级纯化产物分子量较小,均低于10 000 Da,因此PS-2通过一系列分离纯化得到的产物PS-2-3-3通过Shodex KS 802和804分析结果如图 15所示。图 15A为PS-2-3-3产物经淋洗后的示差折光检测的信号,结果表明,该产物在20.354 min出峰,纯度为97.16%。根据标准多糖校正曲线,得知PS-2-3-3组分的Mw=4.10×103 Da,Mn=3.93×103 Da。图 15B表明PS-2-3-3组分在紫外检测区域254 nm处有窄且单一的洗脱峰,说明其含有蛋白或多肽侧链,可能为糖蛋白或糖肽等物质。
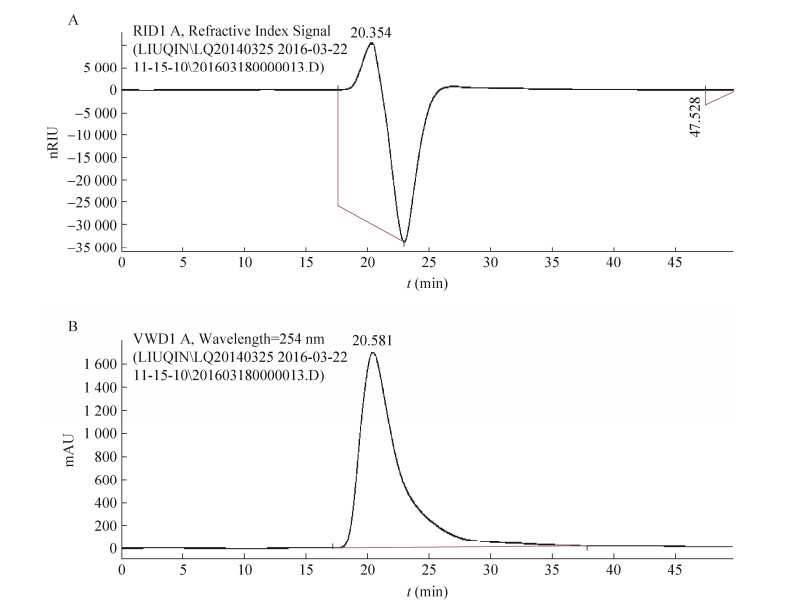
|
| 图 15 PS-2-3-3的凝胶渗透色谱图 Figure 15 Gel permeation chromatogram of PS-2-3-3. (A) Result from refractive index test. (B) Result in 254 nm. |
| |
笔者所在实验室近年来一直致力于微藻活性成分的研究,前期研究中建立了以“异养-稀释-光诱导”串联培养的新型微藻培养模式[22],实现了小球藻的大规模培养,藻粉来源稳定、营养成分丰富。
本研究分别以自由基清除作用和促巨噬细胞增殖作用作为活性指标,对CPE粗多糖进行分离纯化。以自由基清除作用作为活性跟踪指标的研究表明,CPE多糖粗组分具有较高的抗氧化能力,CPE多糖中的多种组分均能够清除自由基,活性成分主要集中于PS-1-3、PS-1-4、PS-2-3和PS-2-4组分中。在质量浓度为1 000 μg/mL时,PS-1-3、PS-1-4、PS-2-3和PS-2-4组分的清除率分别为76.61%、81.73%、80.03%和75.20%,其抗氧化活性高于文献所报道的相同质量浓度的其他物质的多糖组分[14-23]。
以促巨噬细胞增殖作用活性跟踪指标的研究表明,CPE多糖能够显著地促进巨噬细胞的生长,其中分子量较高的组分的促增殖作用高于低分子量组分,主要功能成分集中在PS-1-3、PS-1-4和PS-2-3中。质量浓度为300 μg/mL时,PS-1-3、PS-1-4的促增殖率分别为37%、60%;质量浓度为250 μg/mL时,PS-2-3的促增殖率为51%。CPE功能成分的促巨噬细胞增殖活性高于文献报道的相同浓度下的小球藻多糖[24]和海带多糖[25],并且其最高促增殖活性与经化学修饰后的银合欢多糖提取物相当[26]。
对纯化组分PS-1-4-2、PS-1-3-2和PS-2-3-3进行了结构分析,经GPC分析,其重均分子质量分别为3.97×104 Da、2.28×104 Da和4.10×103 Da,由于其在254 nm处有较强的吸收峰,推测其可能为新结构的糖蛋白。
本文以国内外首创的“异养-稀释-光诱导”培养模式生产的蛋白核小球藻藻粉为原料,对其热水提取物进行一系列的活性跟踪,确立了以抗氧化活性和促巨噬细胞增殖活性为主的跟踪手段,对其进行高压热水提取、Sevag除蛋白、乙醇沉淀、超滤等初步分离,采用离子交换层析以及体积排阻层析等纯化手段,最终得到3种CPE的主要功能成分。这一研究为小球藻作为高附加值产品的众多功效提供了科学依据,同时提高小球藻生物质的利用率,平衡高附加值产品与高油脂含量的不协调关系,从而进一步推动微藻能源的产业化进程,实现“高附加值微藻产品、微藻能源与微藻固碳”一体化的示范作用。
| [1] | Powell RC, Nevels EM, McDowell ME. Algae feeding in humans. J Nutr, 1961, 75(1): 7–12. |
| [2] | 关于批准蛋白核小球藻等4种新资源食品的公告(2012年第19号)[EB/OL]. http://www.nhfpc.gov.cn/sps/s7891/201212/5d4c82e89a9e4713aba8f782eca51e09.shtml. |
| [3] | An HJ, Rim HK, Jeong HJ, et al. Hot water extracts of Chlorella vulgaris improve immune function in protein-deficient weanling mice and immune cells. Immunopharmacol Immunotoxicol, 2010, 32(4): 585–592. DOI: 10.3109/08923971003604778 |
| [4] | Kojima M, Ino S, Takase N, et al. Extraction of an active polysaccharide from Chlorella cells and its stimulative effect on phagocytotic activity of rat roticuloendotholial system. Agric Chem Soc Jap J, 1972, 46(8): 373–380. |
| [5] | Hidaka S, Okamoto Y, Arita M. A hot water extract of Chlorella pyrenoidosa reduces body weight and serum lipids in ovariectomized rats. Phytother Res, 2004, 18(2): 164–168. DOI: 10.1002/(ISSN)1099-1573 |
| [6] |
Tan CY, Zhao Y, Wu D, et al. Study on the culture conditions of Chlorella spp. and its inhibitory activity on α-glucosidase.
Fine Spec Chem, 2011, 19(8): 30–33.
(in Chinese). 谭成玉, 赵莹, 吴迪, 等. 小球藻培养条件及其抑制α-葡萄糖苷酶活性的研究. 精细与专用化学品, 2011, 19(8): 30-33. |
| [7] | Kitada K, Machmudan S, Sasaki M, et al. Antioxidant and antibacterial activity of nutraceutical compounds from Chlorella vulgaris extracted in hydrothermal condition. Sep Sci Technol, 2009, 44(5): 1228–1239. DOI: 10.1080/01496390902729056 |
| [8] |
Wei WZ. The isolation, purification and screening of the tumor prevention in vitro of glycoprotein from Chlorella pyrenoidosa[D]. Wuxi: Jiangnan University, 2008 (in Chinese). 魏文志. 小球藻糖蛋白的分离纯化与体外预防肿瘤作用筛选的研究[D]. 无锡: 江南大学, 2008. |
| [9] | Queiroz MLS, Rodrigues APO, Bincoletto C, et al. Protective effects of Chlorella vulgaris in lead-exposed mice infected with Listeria monocytogenes. Int Immunopharmacol, 2003, 3(6): 889–900. DOI: 10.1016/S1567-5769(03)00082-1 |
| [10] | Hagino N, Ichimura S. Effect of Chlorella on fecal and urinary cadmium excretion in 'Itai-itai' disease. Nihon Eiseigaku Zasshi, 1975, 30(1): 77. |
| [11] |
Zhuang XY, Huang YM, Zhang DJ, et al. Research status and prospect on hot water extract of Chlorella: the high value-added bioactive substance from Chlorella.
Chin J Biotech, 2015, 31(1): 24–42.
(in Chinese). 庄秀园, 黄英明, 张道敬, 等. 小球藻高附加值生物活性物质"小球藻热水提取物"的研究现状与展望. 生物工程学报, 2015, 31(1): 24-42. |
| [12] | Busbee D, Barhoumi R, Burghardt RC, et al. Protection from glutathione depletion by a glyconutritional mixture of saccharides. Age, 1999, 22(4): 159–165. DOI: 10.1007/s11357-999-0018-z |
| [13] | Celino FT, Yamaguchi-Shimizu S, Miura C, et al. Proliferating spermatogonia are susceptible to reactive oxygen species attack in Japanese eel (Anguilla japonica). Biol Reprod, 2012, 87(3): 70. |
| [14] | Wang JH, Zhang YK, Yao YF, et al. Structure identification and antioxidant activity of a novel triple helical polysaccharide isolated from Dictyophora indusiata. J Chem Pharm Res, 2015, 7(1): 678–684. |
| [15] | Armeni T, Principato G, Quiles JL, et al. Mitochondrial dysfunctions during aging: vitamin E deficiency or caloric restriction-two different ways of modulating stress. J Bioenerg Biomembr, 2003, 35(2): 181–191. DOI: 10.1023/A:1023754305218 |
| [16] | Ko SC, Kim D, Jeon YJ. Protective effect of a novel antioxidative peptide purified from a marine Chlorella ellipsoidea protein against free radical-induced oxidative stress. Food Chem Toxicol, 2012, 50(7): 2294–2302. DOI: 10.1016/j.fct.2012.04.022 |
| [17] | Rafiquzzaman SM, Kim EY, Kim YR, et al. Antioxidant activity of glycoprotein purified from Undaria pinnatifida measured by an in vitro digestion model. Int J Biol Macromol, 2013, 62: 265–272. DOI: 10.1016/j.ijbiomac.2013.09.009 |
| [18] | Suárez ER, Kralovec JA, Grindley TB. Isolation of phosphorylated polysaccharides from algae: the immunostimulatory principle of Chlorella pyrenoidosa. Carbohydr Res, 2010, 345(9): 1190–1204. DOI: 10.1016/j.carres.2010.04.004 |
| [19] | Hsu HY, Jeyashoke N, Yeh CH, et al. Immunostimulatory bioactivity of algal polysaccharides from Chlorella pyrenoidosa activates macrophages via Toll-like receptor 4. J Agric Food Chem, 2010, 58(2): 927–936. DOI: 10.1021/jf902952z |
| [20] |
Zhang Q, Li XM, Li ZJ, et al. Immunomodulatory effects of sea cucumber fucoidan on macrophage and the signaling pathways.
Chin Pharmacol Bull, 2015, 31(1): 87–92.
(in Chinese). 张祺, 李学敏, 李兆杰, 等. 海参岩藻聚糖硫酸酯对巨噬细胞的调节作用及信号通路研究. 中国药理学通报, 2015, 31(1): 87-92. |
| [21] | Zhuang XY, Zhang DJ, Qin W, et al. A comparison on the preparation of hot water extracts from Chlorella pyrenoidosa (CPEs) and radical scavenging and macrophage activation effects of CPEs. Food Funct, 2014, 5(12): 3252–3260. DOI: 10.1039/C4FO00214H |
| [22] | Fan JH, Huang JK, Li YG, et al. Sequential heterotrophy-dilution-photoinduction cultivation for efficient microalgal biomass and lipid production. Bioresour Technol, 2012, 112: 206–211. DOI: 10.1016/j.biortech.2012.02.046 |
| [23] | You QH, Yin XL, Zhang SN, et al. Extraction, purification, and antioxidant activities of polysaccharides from Tricholoma mongolicum Imai. Carbohydr Polym, 2014, 99: 1–10. DOI: 10.1016/j.carbpol.2013.07.088 |
| [24] |
Wang L, Sun LQ, Zhou Y. Immunomodulation activities in vitro of polysaccharides from chlorella sp..
Food Res Dev, 2013, 34(7): 30–33.
(in Chinese). 王凌, 孙利芹, 周妍. 小球藻多糖体外免疫调节活性研究. 食品研究与开发, 2013, 34(7): 30-33. |
| [25] | Zha XQ, Lu CQ, Cui SH, et al. Structural identification and immunostimulating activity of a Laminaria japonica polysaccharide. Int J Biol Macromol, 2015, 78: 429–438. DOI: 10.1016/j.ijbiomac.2015.04.047 |
| [26] | Gamal-Eldeen AM, Amer H, Helmy WA, et al. Chemically-modified polysaccharide extract derived from Leucaena leucocephala alters Raw 264.7 murine macrophage functions. Int Immunopharmacol, 2007, 7(6): 871–878. DOI: 10.1016/j.intimp.2007.02.002 |
 2017, Vol. 33
2017, Vol. 33