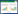中国科学院微生物研究所、中国微生物学会主办
文章信息
- 苏彩霞, 李逦, 金贞姬, 韩旭东, 赵平, 王琳, 江春虎, 王月丽, 王文雯, 徐德启, 朱乃硕
- Su Caixia, Li Li, Jin Zhenji, Han Xudong, Zhao Ping, Wang Lin, Jiang Chunhu, Wang Yueli, Wang Wenwen, Xu Deqi, Zhu Naishuo
- 戊型肝炎病毒样颗粒在重组汉逊酵母中的发酵表达、纯化及其免疫原性分析
- Fermentation, purification and immunogenicity evaluation of hepatitis E virus-like particles expressed inHansenula polymorpha
- 生物工程学报, 2017, 33(4): 653-663
- Chinese Journal of Biotechnology, 2017, 33(4): 653-663
- 10.13345/j.cjb.160387
-
文章历史
- Received: October 18, 2016
- Accepted: February 7, 2017
2 复旦大学 生命科学学院,上海 200433;
3 大连市血液中心,辽宁 大连 116001
2 College of Life Sciences, Fudan University, Shanghai 200433, China;
3 Dalian Blood Center, Dalian 116001, Liaoning, China
戊型肝炎 (Hepatitis E,HE) 是一种急性地方性流行肠道疾病,主要由粪-口途径传播,戊型肝炎多为急性发病,较少发展为慢性肝炎[1]。戊型肝炎作为一种肠道传染病在一些发展中国家可占到急性病毒性肝炎的50%[2]。戊型肝炎临床症状与甲型肝炎基本相同,患者主要表现为黄疸、厌食、肝肿大、腹部疼痛、恶心、呕吐以及发烧等症状,死亡率约为1%,高于甲型肝炎[3],尤其是孕妇的病死率可高达21%[4-5]。
戊型肝炎的第一次病原学鉴定是1983年Balayan等通过对1名志愿者的研究得到的,他们利用免疫电镜技术在病人的急性期粪便和康复期血清中发现1个直径为32 nm的无包膜病毒颗粒[6]。现有的戊型肝炎病毒细胞培养方法均存在细胞感染率低、病毒载量低以及病毒结构变化等严重问题,目前仍未找到可获得大量病毒的可行方法[7-9]。随着近年来人们对戊型肝炎病毒研究的不断深入与完善,对其基因组表达的认识也越来越明了,戊型肝炎的基因工程疫苗成为生物科学领域研究的重点之一。在基因工程疫苗中,病毒样颗粒 (Virus-like particles, VLPs) 与可溶性抗原相比,因其免疫原性与安全性更高,常作为制造疫苗的第一候选[10]。
目前全世界范围内研制成功上市的重组戊型肝炎疫苗采用大肠杆菌表达系统,表达的戊型肝炎病毒抗原通过体外合适的组装条件才能形成戊型肝炎病毒样颗粒,疫苗制造工艺复杂而且回收率低[11-12]。
本文成功构建了胞内表达重组戊型肝炎病毒样颗粒的重组汉逊酵母戊型肝炎疫苗工程菌株,在诱导表达的过程中直接形成完整的病毒样颗粒,不需要体外组装;并建立了此菌株的高密度发酵条件及发酵产物中重组汉逊酵母戊型肝炎病毒样颗粒 (HEV VLPs) 的纯化工艺,并对其进行了免疫原性评价。
1 材料与方法 1.1 质粒和菌株ATCC26012购自美国菌种保存中心,汉逊酵母ATCC26012 (Ura3-) 和重组汉逊酵母HEV 1、2、4和6拷贝的重组表达质粒pDGXHP1.0-HEV、pDGXHP2.0-2MOX-HEV、pDGXHP2.0-4MOX-HEV、pDGXHP2.0-6MOX-HEV及HEV原核大肠杆菌工程菌株[13],由本室构建并保存。
1.2 引物合成用于鉴定重组菌株的引物P1位于MOXP启动子,P2位于MOXT终止子,具体序列如下:P1 5′-CACGGTGTGACATCATCTAAAGT-3′,P2 5′-TCCTTCCACGTCTCCTTAGTCTG-3′,以上引物由宝生物工程 (大连) 有限公司合成。
1.3 试剂蛋白质分子量标准购于TaKaRa公司;ELISA抗原和抗体检测试剂盒购于北京万泰生物药业股份有限公司;羊抗HEV多克隆抗体由中国食品药品检定研究院王佑春研究员惠赠;HRP-兔抗羊IgG购于北京博奥森生物技术有限公司;PVDF膜购于Pall公司;色谱介质Sepharose 4FF及DEAE Sepharose FF购于GE公司;TSK-GEL G5000PW XL色谱柱购于东曹公司。
1.4 实验动物SPF级BALB/c小鼠,体重14-16 g,4-5周龄,由辽宁长生生物技术有限公司提供,生产许可证编号:SCXK (辽) 2015-0001。
1.5 培养基MDL培养基:0.14% YNB、0.5%硫酸铵、2%葡萄糖;MM培养基:1%甲醇、0.67% YNB、0.5%硫酸铵;酵母氮源培养基:0.67% YNB,0.5% (NH4)2SO4,2.5%甘油;甘油培养基:0.3% MgSO4·7H2O,0.4% KCl,0.04% NaCl,1.3% NH4H2PO4,3.4%甘油。
1.6 工程菌株的构建和筛选将重组表达质粒1、2、4和6拷贝的重组表达质粒pDGXHP1.0-HEV、pDGXHP2.0-2MOX-HEV、pDGXHP2.0-4MOX-HEV和pDGXHP2.0-6MOX-HEV以电转化方法转化ATCC26012 (Ura3-) 宿主菌,转化细胞涂于MDL平皿上,33 ℃孵箱培养1周,将长出的转化菌落转接入10 mL MDL液体培养基中,33 ℃摇床传代培养。传代过程中运用PCR的方法筛选重组菌株,引物为P1和P2,选择生长性能较稳定的重组菌株进行MDL培养,33 ℃摇床培养大约24 h,OD值达15-18,将其离心转接到含有1%甲醇的MM培养基中,经甲醇诱导72 h后对表达产物进行检测。对重组菌株表达产物采用SDS-PAGE、ELISA和电子显微镜检查病毒样颗粒大小的方法进行鉴定。最后将所鉴定的理想的原始菌株稳定传代培养70-80代,并且经PCR筛选为稳定整合有外源基因的重组菌株,接入YPD培养基中33 ℃摇床培养,加入冻存液制成主种子批于-70 ℃保存菌种。
1.7 工程菌株的高密度发酵工艺优化 1.7.1 一级菌种制备将筛选的工程菌株以1%接种量接种于酵母氮源培养基,30-33 ℃、200 r/min培养约20 h,当用紫外-可见分光光度法检测一级培养物吸光度值A600为10-20时,培养物可用于制备二级菌种。
1.7.2 二级菌种制备以10%的接种量将一级菌种接种于酵母氮源培养基,30-33 ℃、200 r/min培养约20 h,当用紫外-可见分光光度法检测二级培养物吸光度值A600为10-20时,培养物可用于发酵。
1.7.3 发酵工艺优化以10%的接种量将二级菌种接种于甘油培养基,控制除温度外的其他条件相同,分别于28 ℃、30 ℃、32 ℃及34 ℃培养4批,其中30 ℃条件下菌种生长最快。在30 ℃条件下分别培养4批,13-15 h后开始诱导。控制除甲醇流加速度外其他条件相同,分别匀速流加终浓度为0.5%、1%、1.5%及2%的甲醇,诱导75-80 h,其中甲醇添加终浓度为1%时目的物表达量最高。
1.8 HEV VLPs的分离与纯化 1.8.1 菌体破碎将发酵液离心收集菌体,充分混悬于PBS缓冲液 (50 mmol/L PBS,pH 8.0),使菌体浓度为50%,再离心收集菌体,如此清洗菌体3次。将清洗后的菌体充分混悬于细胞破碎液 (50 mmol/L PBS,100 mmol/L NaCl,1% Tween-80),使菌体浓度为30%,采用玻璃珠研磨法破碎。在破碎液中加入终浓度为0.04%的PMSF,用1 mol/L的NaOH溶液调节pH至8.0,离心收集上清。
1.8.2 澄清过滤将上清液通过0.65 µm中空纤维柱进行澄清去掉细胞碎片,用PBS缓冲液 (50 mmol/L PBS,pH 8.0) 冲洗9-10倍上清液体积,收集膜下透过液,相同条件下将透过液分别通过500 kDa、750 kDa及0.2 µm规格的中空纤维柱进行超滤浓缩,经比较发现750 kDa中空纤维柱能在完全保留目的蛋白的前提下去除较多的杂质,且目的蛋白收率最高。浓缩后用PBS缓冲液冲洗5-6倍透过液体积,收集膜上液。
1.8.3 硅胶吸附和解吸附于膜上液中加入7.5%硅胶溶液,2-8 ℃搅拌吸附10-16 h,离心去除上清液;沉淀充分重悬于与原上清液等体积的生理盐水中洗涤,离心去除洗涤上清液,如此洗涤2次;在沉淀中加入原上清液体积40%-50%的硅胶解吸附液 (3.814 g/L Na2B4O7·10H2O,0.742 g/L EDTA,2.5 g/L脱氧胆酸钠),于57 ℃搅拌90 min,离心去除沉淀,上清液中加入4 mol/L的NaCl溶液,使NaCl终浓度为0.33 mol/L,混匀,2-8 ℃静置30 min,离心去除沉淀,收集上清液。
1.8.4 过滤浓缩将经硅胶吸附和解吸附操作后得到的上清液经750 kDa中空纤维柱过滤,PBS缓冲液清洗5-6倍上清液体积,膜上保留溶液浓缩至蛋白浓度为2-3 mg/mL,收集保留浓缩溶液。
1.8.5 层析工艺优化尝试使用Q Sepharose FF及DEAE Sepharose FF两种阴离子交换色谱介质纯化保留浓缩液,其中Q Sepharose FF在各种条件下均对保留浓缩液中的目的蛋白和杂质同时保持较高吸附率,纯化效果不理想;DEAE Sepharose FF纯化效果较好,对其进一步摸索,分别采用不同pH值 (pH 7.0-8.5) 的平衡液 (3 mmol/L PBS) 平衡系统后上样,检测穿透峰,确定在pH 8.0条件下目的蛋白完全吸附且杂质吸附最少。在pH 8.0条件下上样,穿透峰完全穿出后尝试不同NaCl浓度的洗脱液 (50 mmol/L PBS,0.2-1.5 mol/L NaCl范围,pH 8.0) 洗脱,比较洗脱峰形,检测洗脱峰,确定NaCl浓度为0.5 mol/L时纯化结果最好。在NaCl浓度为0.5 mol/L条件下洗脱,监测波长280 nm,收集A280第1个洗脱峰;继续考察此洗脱峰经色谱介质Sepharose 4FF及Sepharose 6FF纯化的效果,二者都出现2个穿透峰,其中经Sepharose 4FF纯化时含有目的蛋白的1峰纯度更好。则采用Sepharose 4FF对上述洗脱峰进行进一步纯化,平衡液 (3 mmol/L PBS,pH 8.0) 平衡系统后上样,监测波长280 nm,收集A280第1个穿透峰。
1.9 HEV VLPs检测 1.9.1 电子显微镜检查取50 μL HEV VLPs纯化样品滴于铜网,2%磷钨酸负染3 min,室温下干燥4 min,样品置于透射电子显微镜 (H-7000FA) 下观察,本实验在大连医科大学完成,仪器和试剂由该实验室提供。
1.9.2 ELISA检测采用双抗体夹心ELISA试剂盒进行检测,具体步骤如下:在已包被戊型肝炎病毒多克隆抗体的酶标板孔中加入梯度稀释的细胞破碎上清液 (设HEV抗原阳性血清作为阳性对照、HEV抗原阴性血清作为阴性对照、稀释样品所用的缓冲液作为空白对照)。37 ℃孵育l h;然后加入HRP标记的HEV特异性单克隆抗体,37 ℃孵育l h;加入1% TMB显色液显色10 min,加终止液终止反应,在酶标分析仪上测定ELISA反应各孔OD450值,P/N≥2.1,判断为阳性,且A450≥0.1,抗原的最高稀释度为目的蛋白的效价。
1.9.3 SDS-PAGE检测配制12%分离胶、6%浓缩胶,菌体样品经NaOH、SDS缓冲液处理;破碎上清样品经SDS缓冲液处理;加样量均为4 μL,同时点样HEV原核表达菌阳性对照及无HEV基因原核和酵母菌阴性对照,小摇瓶和发酵罐样品进行表达量的对比并确定细胞破碎效果。先12 mA恒流电泳20 min,再24 mA恒流继续电泳1.5 h,电泳完毕,取下胶,考马斯亮蓝染色,凝胶成像系统扫描分析目的蛋白HEV VLPs的分子量和表达量。
1.9.4 HPLC分析采用TSK-GEL G5000PW XL色谱柱分析HEV VLPs纯化样品的纯度,平衡液 (3 mmol/L PBS,pH 8.0) 平衡系统至少30 min,进样,监测波长280 nm,记录图谱。
1.10 HEV VLPs抗原性和免疫原性分析 1.10.1 Western blotting鉴定纯化样品SDS-PAGE胶电转移至PVDF膜,以160 mA的恒定电流转移2 h;封闭:将转移后的PVDF膜置封闭液PBST中37 ℃封闭过夜;结合:加入羊抗HEV多克隆抗体 (1:500) 作为第一抗体,与PVDF膜37 ℃结合2 h,然后加入HRP-兔抗羊IgG (1:1 000) 第二抗体,37 ℃作用l h;OPD显色直至出现清晰条带,去离子水终止反应。
1.10.2 疫苗效力ED50 (免疫原性) 检测戊型肝炎病毒样颗粒与铝佐剂配制成疫苗,用铝佐剂分别稀释成HEV VLPs浓度为2.5 μg/mL、0.625 μg/mL和0.156 μg/mL的3个样品,采用SPF级BALB/c小鼠进行腹腔注射免疫,每个样品各注射10只小鼠,每只小鼠注射1.0 mL,28 d取血,小鼠血室温放置1 h,8 000 r/min离心1 min,即得免疫血清。采用戊型肝炎病毒IgG抗体ELISA试剂盒检测血清抗体,统计抗体阳转率,根据Reed-Muench法计算小鼠效力ED50 (半数有效剂量),确定其免疫原性。
2 结果与分析 2.1 重组菌株的PCR筛选结果PCR引物P1和P2位于外源基因两端启动子和终止子上,扩增目的基因片段大约为1 600 bp,部分HEV工程菌PCR结果如图 1所示。

|
| 图 1 HEV ORF2重组工程菌PCR鉴定结果 Figure 1 Identification of HEV ORF2 recombinant strains by PCR. 1: DNA marker DL 2 000; 2-7: HEV recombinant strains. |
| |
对重组菌株采用MM培养基诱导表达后,产物采用SDS-PAGE和电子显微镜检查病毒样颗粒大小的方法进行鉴定,实验中发现外源基因拷贝数越高的重组菌株外源蛋白表达量越高,但高拷贝表达量过高的菌株病毒样颗粒形成大小不理想,最后筛选到了外源基因两拷贝的高表达工程菌株,命名为HP/HEV2.3,其表达量高并能组装形成与天然病毒颗粒大小一致的病毒样颗粒。结果见图 5和图 6。
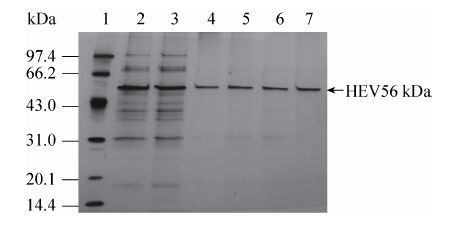
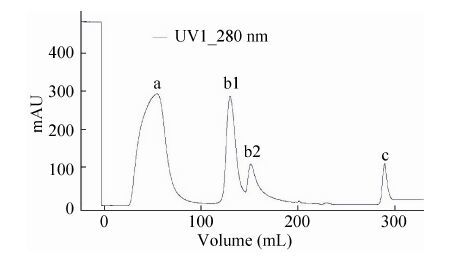
2.3 层析工艺优化结果保留浓缩溶液经色谱介质DEAE Sepharose FF进行纯化的纯化图谱见图 2,HEV VLPs存在于A280第1个洗脱峰 (图 2中的b1峰);此洗脱峰再经过色谱介质Sepharose 4FF进行纯化的纯化图谱见图 3,A280第1个穿透峰 (图 3中的a峰) 为目的蛋白峰HEV VLPs SDS-PAGE分析见图 4。
|
| 图 2 DEAE Sepharose FF介质纯化280 nm吸收光谱图 Figure 2 DEAE Sepharose FF chromatography curve (280 nm). |
| |

|
| 图 3 Sepharose 4FF介质纯化280 nm吸收光谱图 Figure 3 Sepharose 4FF chromatography curve (280 nm). |
| |
电镜检查HEV VLPs大小为32 nm左右,与天然病毒颗粒理论大小一致,结果见图 5。

|
| 图 5 HEV VLPs电子显微镜检查结果 Figure 5 Electron micrograph of HEV VLPs. |
| |
抗原的最高稀释度为目的蛋白的效价,检测效价为1:10 000,结果见表 1。
| A450 | P/N | Dilution | |
| HP/HEV2.3 | 1.03 | 8.5 | 1:10 000 |
| 1.54 | 12.8 | 1:5 000 | |
| 2.12 | 17.7 | 1:2 000 |
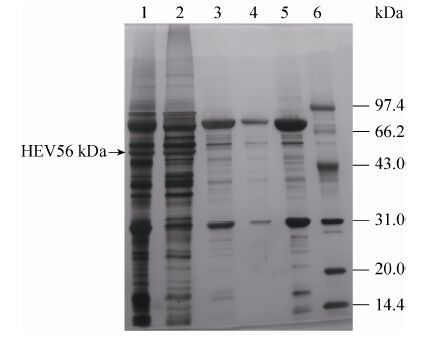
SDS-PAGE检测结果见图 4、图 6和图 7,结果确定分子量大小约为56 kDa;凝胶成像系统扫描分析表达量结果见图 6第6泳道和表 2,分析可知表达量占细胞总蛋白的26%,发酵液总的表达量为1.0 g/L,通过对整体纯化收率估算,收率为33%,估算见表 3。

|
| 图 6 细胞破碎上清蛋白电泳分析结果 Figure 6 SDS-PAGE analysis of the cell lysate. 1: HP/HEV 2.3 cells before inducing; 2: HP/HEV 2.3 cells collected from the 30 L fermenter; 3: positive control (HEV prokaryotic expression); 4: negative control (prokaryotic cell without HEV gene); 5: induced HP/HEV 2.3 cells collected from 20 mL shaking flask; 6: homogenate of the HP/HEV 2.3 cells collected from the 30-L fermenter; 7: negative control (Hansenula polymorpha without HEV gene); 8: molecular weight marker. |
| |
| Bands | Molecular weight (kDa) | Intensity | Percentage (%) |
| 1 | 108.33 | 66 | 1.79 |
| 2 | 98.23 | 100 | 3.58 |
| 3 | 92.55 | 85 | 0.62 |
| 4 | 86.66 | 120 | 2.60 |
| 5 | 82.84 | 131 | 2.31 |
| 6 | 75.55 | 146 | 20.83 |
| 7 | 60.61 | 127 | 3.37 |
| 8 (HEV) | 55.73 | 163 | 26.18 |
| 9 | 49.57 | 141 | 2.56 |
| 10 | 43.17 | 138 | 2.90 |
| 11 | 39.37 | 122 | 2.18 |
| 12 | 31.90 | 150 | 2.96 |
| 13 | 27.98 | 132 | 2.24 |
| 14 | 26.28 | 138 | 6.78 |
| 15 | 18.77 | 165 | 19.10 |
|
| 图 7 细胞破碎上清的初步纯化蛋白电泳结果 Figure 7 SDS-PAGE analysis of the preliminary purification of the cell lysate. 1: silica gel desorbed supernatant concentrated by ultrafiltration; 2: silica gel desorbed supernatant; 3, 4: washing supernatant of silica gel adsorbed precipitate; 5: silica gel adsorbed supernatant; 6: molecular weight marker. |
| |
| Step | Quantity of HEV VLPs from 600 mL fermentation products (mg) |
Purity (%) | Percentage yield (%) | Total percentage yield (%) |
| Crush | 602.85 | 26 | - | - |
| Clarify | 525.10 | 31 | 87 | 87 |
| Silica gel adsorb and desorb | 309.45 | 46 | 59 | 51 |
| Purified by DEAE Sepharose FF | 252.96 | 67 | 82 | 42 |
| Purified by Sepharose 4FF |
199.24 | 99 | 79 | 33 |
Western blotting鉴定见图 8,可见为特异性的56 kDa的单一条带。
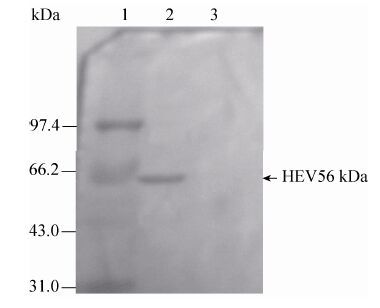
|
| 图 8 HEV VLPs最终纯化样品的Western blotting鉴定结果 Figure 8 Western blotting analysis of the final purification of the HEV VLPs. 1: molecular weight marker; 2: purified HEV VLPs; 3: negative control (Hansenula polymorpha without HEV gene). |
| |
最终纯化样品经HPLC分析显示,HEV VLPs纯度为99%;结果见图 9。

|
| 图 9 HEV VLPs最终纯化样品的HPLC图谱 Figure 9 HPLC result of the final purification of the HEV VLPs. |
| |
将HEV VLPs浓度为2.5、0.625和0.156 μg/mL的3个样品分别腹腔注射3组各10只小鼠,小鼠编号1-10,小组编号分别为Group 1、2、3;免疫小鼠采血检测抗体,结果见表 4。
| A450 | Seroconversion rate (%) |
||||||||||
| Group | Mouse 1 | Mouse 2 | Mouse 3 | Mouse 4 | Mouse 5 | Mouse 6 | Mouse 7 | Mouse 8 | Mouse 9 | Mouse 10 | |
| 1 | 2.371 | 1.506 | 2.460 | 1.166 | 1.445 | 1.564 | 1.127 | 1.906 | 2.390 | 1.166 | 100.00 |
| 2 | 0.268 | 0.507 | 0.024 | 1.363 | 0.575 | 1.145 | 0.794 | 0.893 | 0.993 | 2.306 | 91.67 |
| 3 | 0.006 | 0.004 | 0.001 | 0.001 | 0.402 | 0.013 | 0.008 | 0.186 | 0.066 | 0.098 | 18.18 |
| Negative control | 0.001 | -0.002 | -0.002 | - | - | - | - | - | - | - | - |
| Positive control | 2.971 | 3.165 | - | - | - | - | - | - | - | - | - |
距离比例=(高于50%阳转率-50%)/(高于50%阳转率-低于50%阳转率)=(91.67%-50%)/(91.67%-18.18%)=0.57
50%阳转率终点对数=高于50%阳转率含量对数+距离比×稀释系数的对数=lg0.625+0.57×lg0.25=-0.55
ED50值 (μg)=10(50%阳转率终点对数)=10-0.55=0.3
计算结果ED50值为0.3 μg,表明其具有很好的免疫原性。
3 讨论基因工程疫苗实现产业化的基本条件是目的蛋白表达量足够高,并能够从宿主杂蛋白中纯化出纯度足够高和免疫原性足够好的目的蛋白,满足这3个条件之后才有可能实现产业化。本室多年在汉逊酵母平台上研发戊型肝炎疫苗,前期构建了一系列单和多拷贝HEV重组表达质粒,本文通过一些检测手段筛选到了表达量足够高并能形成理想VLPs的HEV汉逊工程菌株HP/HEV2.3,实验中我们发现外源基因拷贝数越多外源蛋白的表达量越高,这一点与文献报道相一致[14-15],但表达量过高又会影响理想VLPs的形成[16-17]。然后通过并对此菌株的发酵条件的摸索及其发酵产物的纯化方法的研究,建立了酵母菌胞内直接组装成完整的重组戊型肝炎病毒样颗粒的制备工艺路线,经检测,表达量占细胞总蛋白的26%,发酵液表达量为1.0 g/L;经纯化后所得样品纯度可高达99%,收率达33%,具备了产业化的可能性;ELISA效价为1:10 000,疫苗效力ED50值为0.3 μg,结果表明制备的HEV VLPs纯度高免疫原性良好,能够用来制备新型重组戊型肝炎疫苗,为戊型肝炎的防治工作提供了新的方法。本研究采用多形汉逊酵母作为表达系统,多形汉逊酵母是一种有很大潜力的外源基因表达系统,已在科研和工业化生产上广泛应用,用它生产来源于真核生物的外源基因有诸多优势,如遗传稳定、能进行正确的翻译后加工和修饰、表达量高等[18-21],而且病毒样颗粒的装配和加工也更适用于大规模工业化生产[22-25]。
致谢: 本课题的研究工作得到了中国食品药品检定研究院王佑春研究员及其实验室老师们的大力支持,在此深表感谢!| [1] |
Liu CB, Yang DH, Dong W, et al. Recent advances in treatment of chronic hepatitis E.
Chem Life, 2016, 36(4): 477–481.
(in Chinese). 刘承波, 杨德红, 董薇, 等. 慢性戊型肝炎治疗的新进展. 生命的化学, 2016, 36(4): 477-481. |
| [2] | Worm HC, van der Poel WHM, Brandstätter G. Hepatitis E: an overview. Microbes Infect, 2002, 4(6): 657–666. DOI: 10.1016/S1286-4579(02)01584-8 |
| [3] | Purcell RH, Emerson SU. Hepatitis E virus//Knipe DM, Howley PM, Eds. Fields Virology, Vol. 2. 4th ed. Philadelphia, PA, USA: Lippincott Williams & Wilkins, 2001: 3051-3061. |
| [4] |
Zhuang H, Bi SL, Wang YC, et al. Studies on hepatitis E in China.
J Peking Univ (Health Sci), 2002, 34(5): 434–439.
(in Chinese). 庄辉, 毕胜利, 王佑春, 等. 我国戊型肝炎研究. 北京大学学报 (医学版), 2002, 34(5): 434-439. |
| [5] | Kamar N, Dalton HR, Abravanel F, et al. Hepatitis E virus infection. Clin Microbiol Rev, 2014, 27(1): 116–138. DOI: 10.1128/CMR.00057-13 |
| [6] | Balayan MS, Andjaparidze AG, Savinskaya SS, et al. Evidence for a virus in non-A, non-B hepatitis transmitted via the fecal-oral route. Intervirology, 1983, 20(1): 23–31. DOI: 10.1159/000149370 |
| [7] | Okamoto H. Culture systems for hepatitis E virus. J Gastroenterol, 2013, 48(2): 147–158. DOI: 10.1007/s00535-012-0682-0 |
| [8] | Qi Y, Zhang F, Zhang L, et al. Hepatitis E virus produced from cell culture has a lipid envelope. PLoS ONE, 2015, 10(7): e0132503. DOI: 10.1371/journal.pone.0132503 |
| [9] |
Zhang YL, Wang L, Zhuang H. Progress on cell culture models for hepatitis E virus.
Prog Microbiol Immunol, 2013, 41(5): 42–46.
(in Chinese). 张玉林, 王玲, 庄辉. 戊型肝炎病毒细胞培养模型的研究进展. 微生物学免疫学进展, 2013, 41(5): 42-46. |
| [10] | Li SW, Zhang J, Xia NS. Lessons from hepatitis E vaccine design. Curr Opin Virol, 2015, 11: 130–136. DOI: 10.1016/j.coviro.2015.04.003 |
| [11] | Li SW, Zhao QJ, Wu T, et al. The development of a recombinant hepatitis E vaccine HEV 239. Hum Vaccin Immunother, 2015, 11(4): 908–914. DOI: 10.1080/21645515.2015.1008870 |
| [12] | Zhang X, Mei MX, Pan HR, et al. Robust manufacturing and comprehensive characterization of recombinant hepatitis E virus-like particles in Hecolin (®). Vaccine, 2014, 32(32): 4039–4050. DOI: 10.1016/j.vaccine.2014.05.064 |
| [13] |
Su CX, Gu MR, Zhang P, et al. Expression of ORF2 protein of HEV genotype Ⅳ in Hansenula polymorpha.
Chin J Biotech, 2007, 23(1): 73–78.
(in Chinese). 苏彩霞, 顾美荣, 张萍, 等. 戊型肝炎病毒Ⅳ型ORF2蛋白在汉逊酵母中的表达. 生物工程学报, 2007, 23(1): 73-78. |
| [14] |
Yang JS, Dong X, Pan QJ. Determination of exogenous gene copy number and protein expression in antithrombin Ⅲ transgenic goat.
Lett Biotechnol, 2010, 21(3): 393–396.
(in Chinese). 杨继山, 董晓, 潘庆杰. 抗凝血酶Ⅲ转基因山羊外源基因拷贝数及其蛋白表达量的测定. 生物技术通讯, 2010, 21(3): 393-396. |
| [15] |
Lin FL. The effect of gene dosage and culture temperature on the expression of β-mannanase in Pichia pastoris [D]. Changsha: Central South University, 2012 (in Chinese). 林福来. 基因剂量及培养温度对β-甘露聚糖酶在毕赤酵母中表达的影响[D]. 长沙: 中南大学, 2012. http://cn.bing.com/academic/profile?id=c1350b458b19381929b26c9a25c6d249&encoded=0&v=paper_preview&mkt=zh-cn |
| [16] | Arevalo MT, Wong TM, Ross TM. Expression and purification of virus-like particles for vaccination. J Vis Exp, 2016(112). DOI: 10.3791/54041 |
| [17] | Steppert P, Burgstaller D, Klausberger M, et al. Purification of HIV-1 gag virus-like particles and separation of other extracellular particles. J Chromatogr A, 2016, 1455: 93–101. DOI: 10.1016/j.chroma.2016.05.053 |
| [18] | Kata I, Semkiv MV, Ruchala J, et al. Overexpression of the genes PDC1 and ADH1 activates glycerol conversion to ethanol in the thermotolerant yeast Ogataea (Hansenula) polymorpha. Yeast, 2016, 33(8): 471–478. DOI: 10.1002/yea.v33.8 |
| [19] | Earnest-Silveira L, Christiansen D, Herrmann S, et al. Large scale production of a mammalian cell derived quadrivalent hepatitis C virus like particle vaccine. J Virol Methods, 2016, 236: 87–92. DOI: 10.1016/j.jviromet.2016.06.012 |
| [20] | Xie JF, Huang RQ, Lai YX. Prokaryotic production of virus-like particle vaccine of betanodavirus// Thomas S, Ed. Vaccine Design. New York: Springer, 2016: 211-223. |
| [21] |
Dong QH, Shen YY. Research progress and prospects on yeast expression systems.
J Beijing Univ Agric, 2008, 23(2): 72–75.
(in Chinese). 董清华, 沈元月. 酵母表达系统研究进展与展望. 北京农学院学报, 2008, 23(2): 72-75. |
| [22] | Kim HJ, Kim HJ. Yeast as an expression system for producing virus-like particles: what factors do we need to consider? Lett Appl Microbiol, 2016: doi: 10.1111/lam.12695. https://www.ncbi.nlm.nih.gov/pubmed/27859400 |
| [23] | Pushko P, Tretyakova I, Hidajat R, et al. Virus-like particles displaying H5, H7, H9 hemagglutinins and N1 neuraminidase elicit protective immunity to heterologous avian influenza viruses in chickens. Virology, 2017, 501: 176–182. DOI: 10.1016/j.virol.2016.12.001 |
| [24] | Qi Y, Fan JP, Huang WJ, et al. Expression and characterization of hepatitis E virus-like particles and non-virus-like particles from insect cells. Biotechnol Appl Biochem, 2016, 63(3): 362–370. DOI: 10.1002/bab.2016.63.issue-3 |
| [25] |
Qi H, Liu XL. Research progress of expression systems of Escherichia coli and yeast.
J Anhui Agric Sci, 2016, 44(17): 4–6.
(in Chinese). 祁浩, 刘新利. 大肠杆菌表达系统和酵母表达系统的研究进展. 安徽农业科学, 2016, 44(17): 4-6. |
 2017, Vol. 33
2017, Vol. 33