中国科学院微生物研究所、中国微生物学会主办
文章信息
- 易凡琪, 郑军平, 李琼瑜, 焦思明, 杜昱光, 叶云, 刘洪涛
- Yi Fanqi, Zheng Junping, Li Qiongyu, Jiao Siming, Du Yuguang, Ye Yun, Liu Hongtao
- 几丁寡糖对脂肪酸代谢紊乱的抑制作用及分子机制
- Inhibition of chitin oligosaccharide on dyslipidemia and the potential molecular mechanism exploration
- 生物工程学报, 2017, 33(4): 630-641
- Chinese Journal of Biotechnology, 2017, 33(4): 630-641
- 10.13345/j.cjb.160482
-
文章历史
- Received: December 16, 2016
- Accepted: January 23, 2017
2 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190
2 State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
几丁质 (Chitin) 又名壳多糖、甲壳质,广泛存在于昆虫和甲壳类动物 (虾、蟹等) 的外骨骼、多种植物和真菌的细胞壁及一些绿藻中,是海洋环境中碳、氮及能量存在的主要形式之一,其在自然界中的含量仅次于纤维素[1]。几丁质是由N-乙酰氨基葡萄糖 (GlcNAc) 通过β-1,4-糖苷键连接而成的多糖,分子式为 (C8H13NO5)n。几丁质具有良好的组织相容性和生物降解性,安全无毒,无刺激性,无抗原性[2]。几丁质不溶于水、有机溶剂及碱液,在酸中不稳定,易发生糖苷键的断裂,形成聚合度不等的水溶性片段,采用适当的方法将其降解,可得到不同聚合度和乙酰度的水溶性几丁寡糖 (Chitin oligosaccharides,NACOS)。研究表明,小分子几丁寡糖的聚合度、乙酰度及乙酰化位点不同时,将表现出不同甚至完全相反的生物学活性。文献证实,不同结构的几丁寡糖亦表现出多种药理活性,如抗氧化、抗菌、抗肿瘤及增强机体免疫功能等[3-6]。
过多的脂肪聚集不但会扰乱机体内糖和脂肪的代谢,还会引起代谢与免疫调节通路的整合[7]。伴随着脂肪组织及肝脏的脂肪酸蓄集,上述组织和/或器官中炎症细胞的浸润及炎性反应标记物的增高亦将随之出现。文献报道,肥胖机体内存在一种慢性、低度的炎症状态,学者称之为代谢性炎症[8]。代谢性炎症可影响机体的主要代谢器官如肝脏、脂肪、骨骼肌等,导致胰岛素抵抗、血脂升高和肝脂肪沉积等系统性代谢紊乱。肝脏也是肥胖机体炎症通路激活的主要器官,其炎症反应同样可通过器官的交互作用引起系统性炎症和代谢紊乱[9]。本研究使用棕榈酸刺激肝细胞产生过量脂滴积累,及高脂饮食诱导小鼠产生脂肪肝,旨在研究NACOS预处理对肝细胞及小鼠肝脏组织脂代谢紊乱的保护作用和潜在的分子机制。
1 材料与方法 1.1 试剂与材料人肝癌细胞系购于中国科学院细胞库;壳寡糖购自大连格莱克生物科技有限公司;棕榈酸 (Palmitic acid,PA) 购自美国OCROS公司;MEM培养基及青霉素/链霉素购自Gibco公司;胎牛血清 (FBS) 购自北京康源世纪有限公司;BCA蛋白定量试剂盒及油红O染液购自西安赫特生物科技有限公司;RNA抽提试剂盒及Ultra SYBR Green试剂盒购自Promega公司。
几丁寡糖 (NACOS) 由实验室制备,主要流程如下:1) 取5.0 g壳寡糖 (分子量为300-1 700 Da,脱乙酰度为90%),溶于50 mL水中,分别加入3 mL甲醇及0.1 g 4-二甲氨基吡啶,再加入乙酸酐4.37 mL,于60 ℃下反应4 h;2) 在反应液中加入5倍体积的丙酮,得到灰白色沉淀,过滤后用丙酮洗涤2-3遍,置于真空干燥箱中干燥2 h,得到灰白色NACOS;3) 经LC-MS及核磁共振分析,确定NACOS的乙酰度为97%,聚合度为3-10。
1.2 方法 1.2.1 细胞培养及药物处理HepG2细胞用MEM常规培养基培养 (含10% FBS胎牛血清、100 U/mL青霉素、100 U/mL链霉素及1%非必需氨基酸),培养温度37 ℃,5% CO2浓度。细胞融合度达80%后,以0.125%胰酶消化传代 (含0.02% EDTA)。
药物处理如下:1) 待细胞融合度为80%左右时,以不同浓度的NACOS预处理12 h;2) 弃上清,以无血清培养基洗涤2次;3) 加入含PA (100 μmol/L) 的新鲜培养基 (1%或10% FBS),根据实验设定时间进行培养;4) 处理完毕,弃上清,收集细胞并进行后续相关实验。
1.2.2 细胞活性实验1) 收集对数生长期HepG2细胞,调整细胞悬液的浓度为104/mL,接种于96孔培养板,每孔150 μL;2) 细胞融合度达到80%左右时,弃上清,以无血清培养基洗涤2次;3) 加入不同浓度的NACOS和/或PA,进行药物处理;4) 处理完毕,弃上清,以无血清培养基洗涤2次;5) 加入100 μL含MTT (5 mg/mL) 的新鲜培养基,继续培养3 h;5) 弃上清,每孔加入100 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶充分溶解;6) 使用酶联免疫检测仪,于490 nm处测量各孔的光吸收值;7) 计算细胞活力,活力%=(给药OD-空白OD)/(对照OD-空白OD)×100%。
1.2.3 油红O染色1) HepG2细胞接种于六孔培养板中,待细胞融合度为80%左右时,进行药物处理;2) 药物处理完毕,弃上清,以预冷PBS清洗2次;3) 4%多聚甲醛固定30 min;4) PBS漂洗1 min后,60 %异丙醇冲洗15 s;5) 油红O工作液染细胞1 min后,PBS漂洗3次,每次3 min。
1.2.4 动物实验本研究所用实验动物由北京维通利华科技有限公司提供,系4周龄清洁级雄性C57BL/6小鼠,体重18-20 g。高脂饲料 (蛋白:碳水化合物:脂=20:35:45,Kcal%) 及基础饲料 (蛋白:碳水化合物:脂=20:70:10,Kcal%) 均购自北京维通利华科技有限公司。饲养条件控制在20-25 ℃,自然照明,自由饮水和摄食。
小鼠随机分为4组 (n=5),具体分组及药物处理如下:1) 正常对照组 (Normal chow diet,NCD),饲以基础饲料+正常饮水;2) 高脂模型组 (High fat diet,HFD),饲以高脂饲料+正常饮水;3) NACOS组:饲以基础饲料+NACOS (1 mg/mL) 水溶液;4) NACOS+高脂模型组:饲以高脂饲料,以浓度为1 g/L的NACOS替代正常饮水。饲养20周后,麻醉后杀死小鼠,分别提取肝脏组织中的mRNA和蛋白质进行实验检测。
1.2.5 样品RNA提取及RT-PCR反应RNA提取流程如下:1) 称取40 mg新鲜肝脏组织,加入800 μL Trizol,放入1.5 mL离心管中,研磨均匀;2) 每毫升匀浆液加入0.2 mL氯仿,剧烈振荡15 s,室温放置3 min;3) 4 ℃、12 000 r/min离心15 min,将上层无色水相转移至一新的离心管中;4) 加入等体积异丙醇,颠倒均匀,室温放置10 min;5) 离心10 min,条件同上;6) 弃上清,加入75 %乙醇800 μL,洗涤沉淀,涡旋3 s;7) 离心3 min,条件同上;8) 弃上清,室温放置2-3 min,加入50 μL DEPC水溶解;9) 确定各样品RNA浓度,并使用cDNA逆转录试剂盒合成cDNA。细胞样品RNA提取及逆转录步骤同上。
RT-PCR反应使用UltraSYBR试剂盒,反应体系为25 μL,组成如下:1 μL cDNA,10 μL SYBR Green,1 μL上、下游引物 (上海生工公司合成,引物序列见表 1),13 μL去离子水。反应参数设置为:50 ℃ 1 min;95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min;上述反应条件下,共40个循环。
| Primers | Forward primer (5′-3′) | Reverse primer (5′-3′) |
| hPGC1α | TCTGAGTCTGTATGGAGTGACAT | CCAAGTCGTTCACATCTAGTTCA |
| mPGC1α | CCCTGCCATTGTTAAGACC | TGCTGCTGTTCCTGTTTTC |
| hIL-1β | AAA AGCTTGGTGATGTCTGG | TTTCAACACGCAGGACAGG |
| mIL-1β | CGACAA AATACCTGTGGCCT | TTCTTTGGGTATTGCTTGGG |
| hACC1 | ATGTCTGGCTTGCACCTAGTA | CCCCAAAGCGAGTAACAAATTCT |
| mACC1 | CTGCCATCCCATGTGCTAAT | AGCAGTCGTTCCCCTTCATT |
| hCOX5b | ATGGCTTCAAGGTTACTTCGC | CCCTTTGGGGCCAGTACATT |
| mCOX5b | GCTGCATCTGTGAAGAGGACAAC | CAGCTTGTAATGGGTTCCACAGT |
| hMCAD | TGGATAACCAACGGAGGAAAAG | CTGGGGTATCTGCTTCCACA |
| mMCAD | TAAAGCCCTTTTCCCCTGAA | CCCTGTGGAGAAGCTGATGA |
| hβ-Actin | ACGGCATCGTCACCAACTG | GAGCCACACGCAGCTCATT |
| mβ-Actin | AGGTGACAGCATTGCTTCTG | GCTGCCTCAACACCTCAAC |
1) HepG2细胞种于六孔培养板中,经不同浓度的药物处理后,预冷PBS清洗1次;2) 加入RIPA裂解液,用细胞刮刀轻轻刮下细胞,收集到1.5 mL离心管中;3) 4 ℃条件下离心15 min (12 000×g),收集离心上清液;4) 经BCA法定量各组蛋白样品后,加入适量上样缓冲液,混匀后95 ℃变性;5) 样品经SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 分离目的条带,以湿转法将目的条带转移至PVDF膜上;6) 经5%脱脂牛奶室温封闭1 h后,加入p-p38、p38、p-ERK1/2、ERK1/2、p-Akt、Akt及β-actin一抗,4 ℃孵育过夜;7) TBST漂洗3次,每次5 min;8) 加入辣根过氧化物酶标记的相应二抗,室温孵育1 h;9) TBST漂洗3次,每次5 min;10) 免疫反应复合物用ECL化学发光试剂盒检测。
1.2.7 统计学分析实验数据应用SPSS软件进行统计学处理,资料以均数±标准差 (x±s) 表示。
2 结果与分析 2.1 PA和NACOS处理对HepG2细胞活力的影响MTT细胞活性实验表明,PA在25-200 μmol/L范围内对HepG2细胞的活力没有明显的抑制作用 (图 1A),表明PA在该浓度下没有细胞毒性。另外,NACOS (100 μmol/L) 可略微增加HepG2的活力,但没有统计学差异,且NACOS与PA联合进行药物处理时亦没有表现出细胞毒作用 (图 1B)。
|
| 图 1 PA及NACOS处理对HepG2细胞活力的影响 (A:PA对HepG2细胞活力的影响;B:NACOS与PA共处理对HepG2细胞活力的影响) Figure 1 Effects of PA and NACOS on the viability of HepG2 cells. (A) Effect of PA treatment on the viability of HepG2 cells. (B) Effect of NACOS plus PA treatment on the viability of HepG2 cells. |
| |
RT-PCR实验结果表明,HepG2细胞经PA (100 μmol/L) 处理3-12 h后,过氧化物酶体增殖体受体共激活因子-1α (PGC1α)、炎症因子IL-1β、乙酰辅酶A1 (ACC1)、细胞色素氧化酶亚单位-5b (Cox5b)、中链酰基辅酶A脱氧酶 (Mcad) 均表现出不同程度的升高 (P<0.05或0.01),并在作用6 h后达峰值 (图 2A)。与PA单处理组相比,HepG2细胞经NACOS预处理15 h后可明显抑制PA诱导的前述因子的转录激活 (P<0.01) (图 2B),而NACOS单处理则对各因子的转录水平没有明显的影响。上述结果表明,NACOS可抑制PA刺激引起的HepG2细胞脂代谢的紊乱及相关炎症因子的过表达。

|
| 图 2 PA及NACOS对HepG2细胞脂代谢调控分子及炎症因子在转录水平的影响 (A:PA对HepG2细胞脂代谢调控分子及炎症因子转录表达的影响;B:NACOS对PA诱导的HepG2细胞脂代谢调控分子及炎症因子过表达的抑制作用。*P<0.05或**P<0.01,VS对照组;#P<0.05或##P<0.01,VS PA单处理组) Figure 2 Effects of PA and NACOS on the expression of lipid metabolism-related regulators and inflammatory cytokines in HepG2 cells at mRNA level. (A) Effect of PA on the expression of lipid metabolism-related regulators and inflammatory cytokines in HepG2 cells at mRNA level. (B) Inhibitory effect of NACOS on PA-induced over-expression of lipid metabolism-related regulators and inflammatory cytokines in HepG2 cells at mRNA level. *P < 0.05 or **P < 0.01, compared to the control group; #P < 0.05 or ##P < 0.01, compared to the group treated with PA alone. |
| |
Western blotting结果显示,HepG2细胞经PA (100 μmol/L) 刺激后,丝裂原活化蛋白激酶 (Mitogen activated protein kinases,MAPKs) 及磷脂酰肌醇3-激酶/蛋白激酶B (Phosphoinositide 3-kinase,PI3K;Protein kinase B,Akt) 通路中的p38、ERK1/2、Akt激酶迅速激活,其磷酸化水平在0-1 h内呈时间依赖性增加。其中,p-ERK1/2及p-Akt在0.5 h时达峰值 (P<0.05,vs对照组),而p-p38则在1 h时达最高水平 (P<0.01,vs对照组) (图 3A、3B)。

|
| 图 3 PA及NACOS处理对HepG2细胞MAPKs及PI3K/Akt通路的影响 (A、B:PA处理对HepG2细胞MAPKs及PI3K/Akt通路的作用;C、D:NACOS预处理对PA诱导的MAPKs及PI3K/Akt通路激活的抑制作用。*P<0.05或**P<0.01,vs对照组;#P<0.05,vs PA单处理组) Figure 3 Effects of PA and NACOS on the activation of MAPKs and PI3K/Akt pathways in HepG2 cells. (A, B) Effect of PA on the activation of MAPKs and PI3K/Akt pathways in HepG2 cells; (C, D) Inhibitory effects of NACOS pre-treatment on the PA-induced activation of MAPKs and PI3K/Akt pathways. *P < 0.05 or **P < 0.01, compared to the control group; #P < 0.05, compared to the group treated with PA alone. |
| |
为研究NACOS对PA诱导的MAPKs及PI3K/Akt通路激活的抑制作用,HepG2经NACOS (50-100 μg/mL) 预处理15 h后,再由PA (100 μmol/L) 作用0.5 h。结果表明,NACOS预处理可显著抑制p-p38、p-ERK1/2及p-Akt的表达水平 (P<0.05,vs对照组),提示NACOS可能通过阻断MAPKs及PI3K/Akt通路达到抑制HepG2细胞脂代谢紊乱的作用 (图 3C、3D)。
2.4 NACOS对HepG2细胞脂滴形成的抑制作用为探讨NACOS对肝细胞中脂滴形成的抑制作用,HepG2细胞经NACOS预处理15 h后,再用PA (100 μmol/L) 刺激24 h。待处理完毕,细胞采用油红O染色,然后显微镜观察细胞浆中油红脂滴形成的变化。结果显示,对照组在光学显微镜下可见肝细胞轮廓清晰,细胞内呈现的红色脂肪颗粒极少,而PA处理后则细胞浆中的红色脂肪颗粒呈显著聚集趋势。与PA单处理相比,NACOS预处理可明显抑制PA诱导所致的HepG2细胞中脂滴的形成 (图 4)。

|
| 图 4 NACOS预处理对PA诱导所致的HepG2细胞中脂滴形成的抑制作用 Figure 4 Inhibitory effect of NACOS pre-treatment on PA-induced formation of lipid droplet in HepG2 cells. |
| |
为进一步确定NACOS对机体脂代谢紊乱的预防作用,我们考察了高脂模型C57BL/6小鼠在给予NACOS后各项生理指标的的变化 (图 5)。结果表明,与给予基础饲料的正常对照组 (NCD) 小鼠比较,高脂模型组 (HFD) 小鼠的平均体重显著增加 (P<0.01)。相反,当脂代谢紊乱小鼠同时给予NACOS (1 mg/mL,溶于日常饮水中) 处理时,可显著抑制其体重的增加 (P<0.05或0.01)。此外,无论高脂饲料抑或NACOS均对小鼠的采食量及饮水量没有明显影响。
|
| 图 5 NACOS处理对脂代谢紊乱小鼠体重及饮食的影响 (A:NACOS对脂代谢紊乱小鼠体重增加的抑制作用;B:NACOS对脂代谢紊乱小鼠采食量的影响;C:NACOS对脂代谢紊乱小鼠饮水量的影响。**P<0.01,vs NCD组;#P<0.05或##P<0.01,vs HFD组) Figure 5 Effects of NACOS on body weight, diet and drinking water of mice with HFD feeding. (A) Effect of NACOS on the body weight of mice with HFD feeding. (B) Effect of NACOS on the diet of mice with HFD feeding. (C) Effect of NACOS on drinking water of mice with HFD feeding. |
| |
我们检测了NACOS处理对脂代谢紊乱小鼠肝脏组织脂代谢调控相关分子及炎症因子转录表达的影响 (图 6)。RT-PCR实验结果表明,HFD组小鼠较NCD组小鼠肝脏组织中PGC1α、ACC1及Mcad显著升高 (P<0.05或0.01),炎症因子IL-1β亦增加明显 (P<0.05),但HFD处理对Cox5b的转录表达无显著影响。与HFD组比较,脂代谢紊乱小鼠经NACOS处理后,其肝脏组织中脂代谢调控因子PGC1α、Mcad及ACC1的转录水平均不同程度地受到抑制,炎症因子IL-1β亦显著降低,Cox5b转录表达水平变化不明显。上述结果表明,NACOS处理可有效逆转高脂饮食喂养所致的小鼠肝脏脂代谢紊乱。
|
| 图 6 NACOS处理对脂代谢紊乱小鼠肝脏组织中相关调控分子及炎症因子转录表达的影响 (*P<0.05或**P<0.01,vs NCD组;#P<0.05或##P<0.01,vs HFD组) Figure 6 Effect of NACOS on the mRNA expression of lipid metabolism-related regulators and inflammatory cytokine in liver tissues from HFD-fed mice. *P < 0.05 or **P < 0.01, compared to the NCD group; #P < 0.05 or ##P < 0.01, compared to the HFD group. |
| |
为进一步探讨NACOS抑制小鼠脂代谢紊乱的分子机制,我们检测了各实验组小鼠肝脏组织中MAPKs及PI3K/Akt通路的表达变化 (图 7)。Western blotting结果显示,与NCD组小鼠相比,HFD组小鼠肝脏的p-p38、p-Akt蛋白的表达水平显著增高 (P<0.05),而p-ERK1/2则无明显差别 (图 7A、7B)。与HFD组相比,MACOS可显著抑制高脂饮食喂养所致p-p38及p-Akt的激活 (P<0.01或0.05)。此外,NACOS亦可降低p-ERK1/2的蛋白表达水平 (P<0.05)。
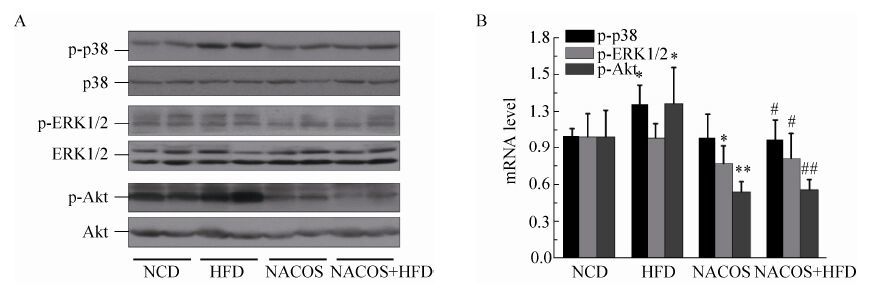
|
| 图 7 NACOS处理对脂代谢紊乱小鼠肝脏组织MAPKs及PI3K/Akt通路的影响 (*P<0.05或P<0.01,vs NCD组;#P<0.05或##P<0.01,vs HFD组) Figure 7 Effects of NACOS on the activation of MAPKs and PI3K/Akt pathway in liver tissues from HFD-fed mice. *P < 0.05 or **P < 0.01, compared to the NCD group; #P < 0.05 or ##P < 0.01, compared to the HFD group. |
| |
肝脏是人体代谢最活跃的合成和分解代谢器官之一,肝脏对糖、脂、蛋白的代谢均有直接的影响。以往研究表明,高脂喂养后可致使小鼠肝脏内脂质沉积和肝脏胰岛素抵抗的发生,同时伴有各种肝细胞内事件的发生,如线粒体脂肪酸氧化功能障碍[10]、脂质从头合成增加[11]、内质网应激[12-13]和炎症通路激活[14]等,但脂肪肝发生的始动机制、各种肝内细胞事件的发生顺序及其与脂肪肝发生的关系均尚未阐明。本文通过PA刺激肝细胞产生过量脂滴,采用高脂饮食诱导小鼠产生脂肪肝,检测NACOS处理与否时小鼠机体及其肝脏的生理、病理学改变,全面评价了NACOS对早期脂肪肝形成的抑制作用及潜在的分子作用机制。
不健康的饮食习惯可导致脂肪肝的发生,其中脂类的过量摄入是饮食因素中导致脂肪肝的最常见原因[15]。临床和动物研究已证明,过量饱和脂肪酸摄入将引起肝内的脂质沉积[15-16]。本研究通过体外构建肝细胞脂肪变性模型,以PA刺激模拟高脂饮食下脂肪蓄积对肝细胞的损伤作用,以NACOS作为干预因素,考察NACOS对肝脂代谢紊乱的预防作用。通过油红染色,从形态学上观察到,在PA诱导损伤的HepG2细胞中,有大量脂滴产生,而NACOS预处理则可有效降低细胞内脂滴的聚集程度。体内实验进一步发现,NACOS处理可抑制高脂饮食所致的C57BL/6小鼠的体重增加及脂代谢紊乱的发生。
肝脏的一个重要功能是维持正常机体血浆葡萄糖浓度的稳态,当机体摄入能量过剩时,过多的葡萄糖可通过脂质从头合成途径转化为脂肪贮存在肝脏,内源性糖异生形成的葡萄糖或外源的果糖等在肝细胞中首先转化为乙酰辅酶A羧化酶ACC1,后者是肝脏脂质从头合成的关键酶。生理状态下肝内脂质仅有5%来源于内源性脂质从头合成途径[13],然而在病理状态下肝内源性脂质从头合成途径将成为肝内脂质沉积的重要来源。另外,ACC1基因敲除或表达减少均可减少高脂饮食诱导的肝脏脂质沉积[17]。本实验中,在HepG2细胞及小鼠肝脏内,PA及高脂饮食均能导致脂质合成酶ACC1的显著增高 (P<0.05),而NACOS处理则可不同程度地下调ACC1在转录水平的增加。
线粒体是真核细胞能量代谢的中心,也是脂肪酸氧化的细胞场所,肝内线粒体脂肪酸氧化的改变以及功能的异常与肥胖等代谢疾病的发生发展相关,如线粒体脂肪酸氧化的减少,可出现脂质堆积[18]。PGC-1α表达于骨骼肌、心肌、肝脏、棕色脂肪组织等能量代谢活跃的组织[19],可调节线粒体生物发生、调控适应性产热、调控骨骼肌细胞内脂肪氧化累积等生理过程[20]。研究发现,PGC-1α基因敲除后,小鼠的脂肪酸氧化基因表达下调[21]。此外,MCAD是中链脂肪酸β氧化第一步的关键酶,在脂肪酸氧化中起着重要作用,而PGC-1α可以调控MCAD的表达水平[22]。本实验从转录水平检测了线粒体生成和代谢等相关因子,包括PGC1α、MCAD及Cox5b,以对脂肪肝发生早期时的线粒体功能改变进行评估。本实验中,体外与体内实验均表明,脂肪酸的过量摄入将导致线粒体合成的上游因子PGC1α及细胞色素氧化酶Cox5b的转录表达水平上调 (P<0.01),而NACOS处理则可显著抑制其上调 (P<0.01)。上述结果提示,在脂肪肝发生的早期存在肝脏线粒体功能障碍和脂肪酸氧化功能障碍,而NAC OS则可能通过逆转线粒体氧化功能损伤,进而增加脂肪酸分解代谢,以阻断肝细胞脂质的沉积。
过多的脂肪在体内聚集不但会干扰体内脂肪的代谢,还会引起代谢和免疫反应通路的异常[7]。伴随肝脏脂肪组织的聚集,炎症细胞的浸润及炎性反应的发生亦随之出现。多项研究表明,肥胖机体内存在一种慢性、低度的炎症状态,学者称之为代谢性炎症[8]。慢性炎症反应在脂肪肝的形成和发展过程中起到了关键作用,但其发生的分子机制至今尚不明了。最近有观点认为,肝脏也是肥胖机体炎症通路激活的重要器官,肝脏的炎症反应同样可通过器官的交互作用引起系统性炎症和代谢紊乱[9]。因此,本研究重点检测了炎症相关因子IL-1β在HepG2细胞及小鼠肝脏内的表达变化,结果表明,PA及高脂饮食均能导致IL-1β转录的显著增加 (P<0.01或0.05),而NACOS共处理则能明显降低其表达水平 (P<0.01或0.05)。
研究证明,脂肪肝与炎症通路相关。MAPKs信号通路存在于大多数细胞内,是细胞膜表面受体与决定性基因表达间起连接作用的重要调节酶,可以将细胞外刺激信号传递给细胞核,是细胞应激及损伤反应的主要信号通路之一,能被多种炎性刺激激活,在炎症的发生、发展过程中起到重要的调控作用。其中主要有p38分裂原激活蛋白激酶 (p38 MAPK)、c-Jun氨基末端激酶 (c-jun-N-terminal kinases,JNK) 和细胞外信号调节蛋白激酶 (Extracellular signal-regulated protein kinase,ERK) 三条途径。其中,p38 MAPK通路和JNK通路主要对炎性细胞因子和多种类型的细胞应激信号进行转导,而ERK通路主要对细胞的生长、分裂和分化信号进行转导。本实验表明,PA及高脂饮食可明显增加p38或/和ERK1/2的磷酸化水平 (P<0.05),而NACOS能显著抑制两种激酶的磷酸化发生 (P<0.05),提示NACOS可能通过抑制MAPKs通路的激活而下调了炎症反应的发生。
机体内葡萄糖的代谢主要通过胰岛素依赖的PI3K/AKT信号通路进行。胰岛素受体通过酪氨酸的磷酸化激活其受体激酶,与胰岛素受体底物 (IRS) 发生作用。磷酸化的IRS与PI3K发生作用,促进其活化和Akt的磷酸化,随后通过激活葡萄糖转运载体-4 (GLUT4) 的跨膜转运,完成对葡萄糖的吸收和利用。当出现胰岛素抵抗时,此通路受到抑制,胰岛素作用出现障碍,使其无法发挥正常生物学功能。本实验表明,无论PA诱导所致的HepG2细胞抑或发生脂代谢紊乱的小鼠肝脏组织,其增加的Akt磷酸化均可被NACOS有效地抑制 (P<0.05或0.01),提示NACOS将可能通过PI3K/AKT信号通路抑制胰岛素抵抗的发生。
与本研究结果相似,研究表明NACOS的去乙酰化产物壳寡糖对高血脂的形成也具有明显抑制效果。动物实验发现,壳寡糖 (分子量为1-10 kDa) 可显著降低大/小鼠血浆的低密度脂蛋白、胆固醇及甘油三酯,并能增加高密度脂蛋白的血浆水平,且壳寡糖的降脂效果与其聚合度呈负相关[23-24]。因此,聚合度可能是影响甲壳类寡糖抑制脂代谢紊乱的重要因素之一。此外,乙酰度的高低对该类寡糖的生物学活性是否也有较大影响,即相同聚合度的NACOS与壳寡糖之间的活性是否有差别,尚需要在将来的研究中进一步阐释。
综上所述,本实验从生理功能和分子生物学机制两方面评价了NACOS在早期脂肪肝形成时对肝内线粒体脂肪酸氧化、脂质合成途径及线粒体相关途径的抑制作用,并通过抑制MAPKs炎症信号通路和胰岛素依赖的PI3K/AKT信号通路,达到调控脂代谢紊乱及炎症激活的作用。
| [1] |
Yao WS, Wang X, Hou HR, et al. Advances in preparation of chitooligosaccharides.
Shandong Sci, 2006, 19(3): 27–31.
(in Chinese). 姚婉生, 王雪, 侯海荣, 等. 几丁寡糖制备的研究进展. 山东科学, 2006, 19(3): 27-31. |
| [2] |
Wu QJ, Wu HC. Chitin fibers-decomposable material of the 21th century.
J Donghua Univ Nat Sci Ed, 2004, 30(1): 133–138.
(in Chinese). 吴清基, 吴鸿昌. 甲壳素——21世纪的绿色材料. 东华大学学报:自然科学版, 2004, 30(1): 133-138. |
| [3] | Ngo DN, Lee SH, Kim MM, et al. Production of chitin oligosaccharides with different molecular weights and their antioxidant effect in RAW 264.7 cells. J Funct Foo, 2009, 1(2): 188–198. DOI: 10.1016/j.jff.2009.01.008 |
| [4] | Ngo DN, Kim MM, Kim SK. Chitin oligosaccharides inhibit oxidative stress in live cells. Carbohydr Polymer, 2008, 74(2): 228–234. DOI: 10.1016/j.carbpol.2008.02.005 |
| [5] | Wang SL, Lin HT, Liang TW, et al. Reclamation of chitinous materials by bromelain for the preparation of antitumor and antifungal materials. Bioresour Technol, 2008, 99(10): 4386–4393. DOI: 10.1016/j.biortech.2007.08.035 |
| [6] | Suzuki K, Tokoro A, Okawa Y, et al. Effect of N-acetylchito-oligosaccharides on activation of phagocytes. Microbiol Immunol, 1986, 30(8): 777–787. DOI: 10.1111/mim.1986.30.issue-8 |
| [7] | Ferrante AJ Jr. Obesity-induced inflammation: a metabolic dialogue in the language of inflammation. J Intern Med, 2007, 262(4): 408–414. DOI: 10.1111/jim.2007.262.issue-4 |
| [8] | Hotamisligil GS. Inflammation and metabolic disorders. Nature, 2006, 444(7121): 860–867. DOI: 10.1038/nature05485 |
| [9] | Kerner A, Avizohar O, Sella R, et al. Association between elevated liver enzymes and C-reactive protein: possible hepatic contribution to systemic inflammation in the metabolic syndrome. Arterioscler Thromb Vasc Biol, 2005, 25(1): 193–197. |
| [10] | Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest, 2004, 114(2): 147–152. DOI: 10.1172/JCI200422422 |
| [11] | ÖzcanU, YilmazE, ÖzcanL, 等. Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes. Science, 2006, 313(5790): 1137-1140. |
| [12] | Puri P, Mirshahi F, Cheung O, et al. Activation and dysregulation of the unfolded protein response in nonalcoholic fatty liver disease. Gastroenterology, 2008, 134(2): 568–576. DOI: 10.1053/j.gastro.2007.10.039 |
| [13] | Byrne CD, Olufadi R, Bruce KD, et al. Metabolic disturbances in non-alcoholic fatty liver disease. Clin Sci (Lond), 2009, 116(7): 539–564. DOI: 10.1042/CS20080253 |
| [14] | Singh R, Wang YJ, Xiang YQ, et al. Differential effects of JNK1 and JNK2 inhibition on murine steatohepatitis and insulin resistance. Hepatology, 2009, 49(1): 87–96. DOI: 10.1002/hep.22578 |
| [15] | Moore JB. Non-alcoholic fatty liver disease: the hepatic consequence of obesity and the metabolic syndrome. Proc Nutr Soc, 2010, 69(2): 211–220. DOI: 10.1017/S0029665110000030 |
| [16] | Westerbacka J, Lammi K, H kkinen AM, et al. Dietary fat content modifies liver fat in overweight nondiabetic subjects. J Clin Endocrinol Metab, 2005, 90(5): 2804–2809. DOI: 10.1210/jc.2004-1983 |
| [17] | Mao JQ, DeMayo FJ, Li H, et al. Liver-specific deletion of acetyl-CoA carboxylase 1 reduces hepatic triglyceride accumulation without affecting glucose homeostasis. Proc Natl Acad Sci USA, 2006, 103(22): 8552–8557. DOI: 10.1073/pnas.0603115103 |
| [18] | Begriche K, Igoudjil A, Pessayre D, et al. Mitochondrial dysfunction in NASH: causes, consequences and possible means to prevent it. Mitochondrion, 2006, 6(1): 1–28. DOI: 10.1016/j.mito.2005.10.004 |
| [19] | Ruas JL, White JP, Raor RR, et al. A PGC-1 α isoform induced by resistance training regulates skeletal muscle hypertrophy. Cell, 2012, 151(6): 1319–1331. DOI: 10.1016/j.cell.2012.10.050 |
| [20] | Finck BN, Kelly DP. PGC-1 coactivators: inducible regulators of energy metabolism in health and disease. J Clin Invest, 2006, 116(3): 615–622. DOI: 10.1172/JCI27794 |
| [21] | Koos H, Satoh H, Herzig S, et al. PGC-1 promotes insulin resistance in liver through PPAR-α-dependent induction of TRB-3. Nat Med, 2004, 10(5): 530–534. DOI: 10.1038/nm1044 |
| [22] | Summermatter S, Troxler H, Santos G, et al. Coordinated balancing of muscle oxidative metabolism through PGC-1α increases metabolic flexibility and preserves insulin sensitivity. Biochem Biophys Res Commun, 2011, 408(1): 180–185. DOI: 10.1016/j.bbrc.2011.04.012 |
| [23] | Wang DX, Han JJ, Yu Y, et al. Chitosan oligosaccharide decreases very-low-density lipoprotein triglyceride and increases high-density lipoprotein cholesterol in high-fat-diet-fed rats. Exp Biol Med (Maywood), 2011, 236(9): 1064–1069. DOI: 10.1258/ebm.2011.011032 |
| [24] | Huang LL, Chen J, Cao PQ, et al. Anti-obese effect of glucosamine and chitosan oligosaccharide in high-fat diet-induced obese rats. Mar Drugs, 2015, 13(5): 2732–2756. DOI: 10.3390/md13052732 |
 2017, Vol. 33
2017, Vol. 33