中国科学院微生物研究所、中国微生物学会主办
文章信息
- 游婷, 刘季华, 梁如冰, 刘建华
- You Ting, Liu Jihua, Liang Rubing, Liu Jianhua
- 铜绿假单胞菌存活时间延长可提高生物燃料电池的产电量
- Survival elongation of Pseudomonas aeruginosa improves power output of microbial fuel cells
- 生物工程学报, 2017, 33(4): 601-608
- Chinese Journal of Biotechnology, 2017, 33(4): 601-608
- 10.13345/j.cjb.160372
-
文章历史
- Received: October 8, 2016
- Accepted: January 20, 2017
2 上海工程技术大学 材料工程学院,上海 201620
2 School of Material Engineering, Shanghai University of Engineering Sciences, Shanghai 201620, China
微生物燃料电池是利用电化学活菌的作用,通过其催化一系列氧化反应,将消耗能量产生的电子传递到阳极,产生电流并将化学能转化为电能的技术[1-7]。微生物燃料电池可应用到环境污染物处理、生物能产生与高价值附加材料的合成等过程,提供了一种有利于环境的可持续性发展方案,实现了在污染物去除或低附加值物质转化的同时产生电能的目标[8-11]。尽管微生物电池具有广泛应用潜能,但因微生物和电极间极缓慢电子传递所致的低功率密度直接限制了微生物燃料电池的实际应用[6, 12-13]。因此,如何通过改进生物燃料电池性能来提高微生物燃料电池的产电量一直是研究的热点。
研究人员已从电极材料改造、电池结构改造及能量消耗等多个方面对生物燃料电池进行改造来改善生物燃料电池的性能[14-17]。也有研究者从电化学活菌入手,试图通过提升电子传递体含量和改进电子传递介质等方法来提高生物燃料电池产电量[18-21]。由于铜绿假单胞菌生长适应性强,可利用多种碳源并可产生多种次生代谢产物,这其中包括许多可作为电子介质进行电子传递的化合物,如吩嗪类化合物,因此可被用于搭建微生物燃料电池进行产电。研究发现假单胞菌产生的吩嗪类化合物中的绿脓菌素 (pyocyanin,PYO) 或吩嗪-1-羧酸 (phenazine-1-acid,PCA) 等可介导该菌搭建的微生物燃料电池中阳极胞外电子的传递过程[19-20]。通过基因改造提升绿脓菌素的产量可提高细胞外电子传递效率和电流的输出功率,实现产电量增加的目的[2]。在以假单胞菌MBR为催化剂构建的双室微生物燃料电池中,研究者发现由假单胞菌产生的吩嗪-1-羧酸在燃料电池中可作为一个循环的电子穿梭载体,促进有机物和阳极棒之间的电子传递,提高微生物燃料电池的利用率[21]。尽管电化学活菌产生电子传递体的量可影响微生物燃料电池的产电量,但是微生物有多重途径来搭建细胞表面与电极间的电子传递通道,其他因素的影响依旧不明确。
研究发现,铜绿假单胞菌的全局调控因子MvaT参与了其群体感应系统、次生代谢途径和生物膜的形成等过程的调控,其敲除菌株产生的绿脓菌素是野生菌株的2倍以上[22]。这提示这一基因的敲除突变株可能用于高产电量生物燃料电池的构建。本文以高产吩嗪化合物的铜绿假单胞菌SJTD-1和其敲除突变株SJTD-1 (Δ mvaT) 为研究对象,研究了以其搭建的微生物燃料电池的放电过程,分析了影响其放电量的主要因素。结果显示吩嗪-1-羧酸的含量和细胞活性对微生物燃料电池的放电量均有重要影响,突变菌株可在微生物燃料电池的发酵液中存活更长的时间,产电量比野生型菌株增加了77.9%。这为后续利用工程菌株来优化微生物燃料电池的性能提供了思路。
1 材料与方法 1.1 菌株、培养基与试剂本实验所用的细菌及质粒见表 1。Luria-Bertani (LB) 液体培养基 (蛋白胨10.0 g/L,酵母提取物5.0 g/L,NaCl 10.0 g/L) 和无机盐基础培养基 (MM) (KH2PO4 4.5 g/L;K2HPO4·3H2O 13.75 g/L;(NH4)2SO4 2.0 g/L;MgSO4·7H2O 0.16 g/L;0.5% FeSO4·7H2O 1.0 mL/L;1.1% CaCl2·2H2O 1.0 mL/L;0.2% MnCl2·4H2O 1.0 mL/L;2.0%葡萄糖) 用于微生物培养。LB固体培养基含有8.0 g/L的琼脂粉。电极缓冲液 (K3Fe (CN)6 16.45 g/L;Na2HPO4·12H2O 17.91 g/L;KH2PO4 6.80 g/L) 用于搭建微生物燃料电池。所有化学试剂均为分析纯,购自生工生物工程有限公司 (上海,中国)。限制性内切酶与T4 DNA连接酶均购自Thermo Fisher Scientific公司 (MA,US)。质粒小量提取试剂盒与PCR产物柱回收试剂盒等购自天根生物科技有限公司 (北京,中国)。
| Strains/plasmids | Characteristics | Sources/references |
| DH5α | E. coli cloning host | Qiagen |
| SM10 | thi-1 thr leu tonA lacY supE recA::RP4-2-Tc :: Mu | Qiagen |
| SJTD-1 | P. aeruginosa strain, CGMCC No. 6584 | [23] |
| SJTD-1 (Δ mvaT) | mvaT-knockout mutant of P. aeruginosa SJTD-1 | This study |
| pEX18Gm | GmR; oriT + sacB +, gene replacement vector with MCS from pUC18 | [24] |
| pEX18Gm-mvaT-HR | pEX18Gm inserted with the 700 bp upstream and 500 bp downstream fragments of mvaT. | This study |
利用二步法同源重组方法敲除铜绿假单胞菌SJTD-1中的mvaT基因,方法参考文献[24]。以引物mvaT-F1/R1和mvaT-F2/R2扩增mvaT基因上游700 bp同源臂片段和下游500 bp同源臂片段 (F1:5′-GGGGGGGAGCTCATCGAAGG CCGGCTGCTTG-3′,R1:5′-GGGGGGGGATCC CGTGGCGCGATATTCGTTGAT-3′;F2:5′-GGGG GGGGATCCACCCTGCTCGGCTAAACCAG-3′,R2:5′-GGGGGGCTGCAGTTCTCCGCCAGCGA CGACC-3′)。电泳检测后纯化PCR产物。分别用限制性内切酶Sac Ⅰ/ Bam H Ⅰ和Bam H Ⅰ/ Pst Ⅰ对上游同源片段和下游同源片段进行双酶切,酶切后产物检测后回收。利用T4 DNA连接酶将酶切后的片段与Sac Ⅰ/ Pst Ⅰ双酶切的pEX18Gm质粒进行连接后转化大肠杆菌DH5α。鉴定的阳性克隆命名为pEX18Gm-mvaT - HR。将该质粒转化大肠杆菌SM10中获得转化子SM10 (pEX18Gm-mvaT - HR)。混合该转化子与铜绿假单胞菌SJTD-1使其进行接合,之后利用含有庆大霉素的LB固体平板和含有10%蔗糖的固体平板筛选获得二次重组的敲除菌株,阳性克隆经PCR验证等确定为mvaT敲除突变株,命名为SJTD-1 (Δ mvaT)。
1.3 微生物燃料电池搭建生物燃料电池包含2个由玻璃制成的圆形部分,每部分的容积是400 mL。本文中每部分工作体积为360 mL。在阳极室和阴极室之间由一张离子交换膜来隔离阳极和阴极;在双室生物燃料电池中,每部分各有一根碳棒作为电极棒。在使用之前,碳棒用水清洗几次除去杂质。离子交换膜用稀释的HCl浸泡过夜后,用去离子水清洗数次。挑取铜绿假单胞菌SJTD-1或SJTD-1 (Δ mvaT) 单克隆至3 mL LB小管,37 ℃、200 r/min摇培过夜。次日,接种1 mL过夜培养物到100 mL LB中,37 ℃、200 r/min摇培至OD 600=1.2-1.6。4 ℃、4 000 r/min离心15 min收菌。用灭菌的超纯水重悬菌体,4 ℃、4 000 r/min离心8 min收菌,重复清洗2次。用无机盐培养基悬浮菌体后备用。阳极室灌入360 mL无机盐培养基并接种菌体使其起始OD 600为0.01。阴极室装入360 mL电极缓冲液。用铜线将阳极棒、阴极棒和电阻器连成闭合回路,外电阻设为1 980 Ω。该生物燃料电池系统在37 ℃培养箱中连续运行180 h。每隔1 min用数据采集器测量流过固定外电阻 (1 980 Ω) 的电流和电压。利用USB接口将数据采集器和电脑连接,取每小时测得电压的平均值,绘制电压的时间变化曲线。所有结果均为3次独立实验的平均值。
1.4 菌株生长曲线测定与吩嗪含量测定每2 h从铜绿假单胞菌SJTD-1或SJTD-1 (Δ mvaT) 搭建的生物燃料电池的阳极室取出2 mL发酵液,其中1 mL用于测OD 600,取3次实验的平均值绘制菌株的生长曲线。另1 mL菌液用于吩嗪含量测定,步骤如下。将1 mL菌液离心 (室温,10 000 r/min、5 min) 后,取900 μL上清加入等体积氯仿,振荡混匀后离心 (室温,10 000 r/min、5 min);吸取下层有机相,加入等体积的0.2 mol/L盐酸振荡混匀后离心 (室温,10 000 r/min、5 min),取下层有机相测OD 251[25-26]。取3次实验的平均值绘制吩嗪含量随时间变化曲线。
2 结果与分析 2.1 吩嗪-1-羧酸主要介导了铜绿假单胞菌SJTD-1的微生物燃料电池放电过程有研究显示铜绿假单胞菌的次生代谢产物吩嗪-1-羧酸 (PCA) 可介导微生物燃料电池的电子传递,降低MFCs的内阻,提高MFCs的利用率[21]。为了探讨PCA在本文用铜绿假单胞菌SJTD-1搭建的MFCs中的作用,我们测定了在整个放电过程中,发酵液中PCA的含量与电压的时间变化曲线。结果显示,假单胞菌SJTD-1产生的PCA的含量随着放电时间的延长而逐渐增高,与此同时微生物燃料电池产生的电压也逐渐增加;当发酵液中的PCA含量达到峰值时,微生物燃料电池产生的电压也达到了最大值 (图 1)。类似现象也在突变菌株SJTD-1 (Δ mvaT) 的MFCs系统的放电过程中被观察到。在SJTD-1 (Δ mvaT) 的MFCs系统的初始放电阶段,发酵液中PCA含量很低,微生物燃料电池产生的电压也很低;随着发酵时间延长,发酵液中PCA含量不断增加到最大值,与之对应的微生物燃料电池产生的电压也不断增大,直至达到最高值 (图 2)。因此,在铜绿假单胞菌SJTD-1和SJTD-1 (Δ mvaT) 的微生物燃料电池中,次生代谢产物吩嗪-1-羧酸 (PCA) 是介导放电过程中的一个主要因素。进一步分析发现,尽管突变菌株SJTD-1 (Δ mvaT) 的PCA产量最大可达20 μg/mL,高于野生型菌株SJTD-1的13 μg/mL的PCA产量;但是野生型菌株SJTD-1在放电过程中可产生最大440 mV的电压,远高于突变菌株SJTD-1 (Δ mvaT) 产生的130 mV最大电压。此外,虽然2个菌株在MFCs系统中的吩嗪含量随时间变化的曲线类似,但两者的电压时间曲线差异较大,突变菌株SJTD-1 (Δ mvaT) 的电压可在130 mV持续约40 h后出现下降,但是野生型菌株SJTD-1在出现电压的峰值后其电压迅速发生了下降 (图 1和图 2)。这些说明尽管吩嗪-1-羧酸作为电子传递体是微生物燃料电池放电过程中的主要因素,但不是唯一决定因素,还有其他因素影响了两个微生物燃料电池的产电性质。

|
| 图 1 SJTD-1生物燃料电池电极电压与PCA含量随时间变化曲线 (黑色三角形代表PCA含量,灰色圆点代表电极电压) Figure 1 Time course of electrode voltage and PCA concentration in SJTD-1 MFCs. The black triangles represent the contents of PCA, and the gray dots represent the electrode potential. |
| |

|
| 图 2 SJTD-1 (Δ mvaT) 生物燃料电池电极电压与PCA含量随时间变化曲线 (黑色三角形代表PCA含量,灰色圆点代表电极电压) Figure 2 Time course of electrode voltage and PCA concentration in SJTD-1 (Δ mvaT) MFCs. The black triangles represent the contents of PCA, and the gray dots represent the electrode potential. |
| |
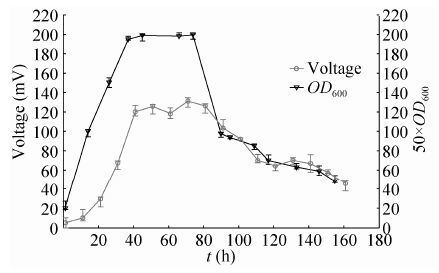
在生物燃料电池放电过程中,铜绿假单胞菌产生的吩嗪-1-羧酸作为电子传递体可循环使用,其含量不会因电子传递而降低。铜绿假单胞菌的活菌似乎仅在产电起始阶段起重要作用,用于产生大量电子传递体;当吩嗪-1-羧酸达到最大值后,活菌似乎没有了明显作用。对比野生型菌株SJTD-1和突变株SJTD-1 (Δ mvaT) 的MFCs系统中的吩嗪含量与电压随时间变化曲线的异同,我们思考是否用于产生电子传递体吩嗪的细菌活性与活菌数量在整个MFCs发酵过程中都存在重要作用?为此,我们测定并绘制了野生型菌株SJTD-1和突变株SJTD-1 (Δ mvaT) 的MFCs在整个放电过程中其发酵液中细菌的生长曲线与电压随时间变化的曲线。结果显示,在初始放电阶段,发酵液中的野生型菌株SJTD-1处于对数期,活菌数目不断增加,生物燃料电池中产生的电压也不断增大。当细菌进入稳定期,发酵液中的细胞活性最高,活菌数目达到一个最大值;与此同时在MFCs中,电压也在这个时期达到了最高值。最后当细菌进入衰亡期时,细胞活性下降,活菌数量逐渐减少,MFCs产生的电压也随之减小 (图 3)。类似现象也见于突变菌株SJTD-1 (Δ mvaT) 的MFCs系统:处于对数期和稳定期时,即细胞活性最高和活菌数目最多时,生物燃料电池产生的电压增大到最大;反之,发酵液中活菌数目减少,生物燃料电池产生的电压也随之减小 (图 4)。因此,在铜绿假单胞菌生物燃料电池放电过程中,其发酵液中的细菌活性与活菌数目对于整个放电过程十分关键,会直接影响生物燃料电池产生的电压值。
2.3 铜绿假单胞菌SJTD-1 (Δ mvaT) 的存活时间延长可提高生物燃料电池的总产电量从图 3和图 4可见,在两个MFCs放电过程中,野生型菌株SJTD-1在到达稳定期后,迅速进入衰亡期,大量细胞破裂,活菌数目下降,同时其产生的电压也随之立刻降低;而突变菌株SJTD-1 (Δ mvaT) 可在稳定期持续约50 h后才进入衰亡期,其产生的电压也会在其最高值处保持一段时间后才会随着细胞进入衰亡期而缓慢下降。因此,尽管突变菌株SJTD-1 (Δ mvaT) 的最高产电电压低于野生型菌株,但是其放电时间可持续超过160 h,产生的总电量达到了2.32 J;而野生型菌株SJTD-1只能持续90 h的放电时间,产生1.30 J的总电量。相比于野生型菌株,突变菌株SJTD-1 (Δ mvaT) 产生的总电量增加了77.9%。这说明,由于铜绿假单胞菌SJTD-1 (Δ mvaT) 的存活时间延长,其放电时间更持久,故其生物燃料电池的总产电量得到了显著提高。

|
| 图 3 SJTD-1生物燃料电池电极电压与活菌数目随时间变化的曲线 (黑色三角形代表活菌数目,灰色圆点代表电极电压) Figure 3 Time course of the electrode voltage and the viable cells number in the SJTD-1 MFCs. The black triangles represent number of the viable cells, and the gray dots represent the electrode potential. |
| |
|
| 图 4 SJTD-1 (Δ mvaT) 生物燃料电池电极电压与活菌数目随时间变化的曲线 (黑色三角形代表活菌数目,灰色圆点代表电极电压) Figure 4 Time course of the electrode voltage and the viable cells number in the SJTD-1 (Δ mvaT) MFCs. The black triangles represent number of the viable cells, and the gray dots represent the electrode potential. |
| |
本研究对以单一菌株铜绿假单胞菌SJTD-1及其突变菌株SJTD-1 (Δ mvaT) 搭建的生物燃料电池的放电过程进行了研究,并分析了影响其产电效能的关键因素。结果显示吩嗪-1-羧酸是介导该铜绿假单胞菌SJTD-1搭建的MFCs中的主要电子传递体;无论是在MFCs的产电初期还是在放电过程中,发酵液中假单胞菌的细菌活性与活菌数目均是影响此MFCs产电量的关键因素。虽然发酵系统中阳极表面始终保持适当规模的活性生物量,但发酵液中的活性细胞数量增加与存活时间延长可改善系统的电子传递效率,提升整个微生物燃料电池系统的产电量。因此,这一发现为通过改进菌株性质或构建工程菌株来优化以单一菌株构建的微生物燃料电池效能的研究提供了思路,有利于推进相关微生物燃料电池的实际应用。
微生物燃料电池是由具有电化学活性的微生物菌群、阴阳极与极室、外电路共同构建的完整系统,其产电过程会受到包括电极材料、电池结构及微生物自身性质及产生的电子供体性质等多种因素影响。本文以铜绿假单胞菌作为催化菌株的双室微生物燃料电池,研究其放电过程的主要影响因素,认为其电子传递途径主要利用其产生的吩嗪类化合物作为电子穿梭载体,在微生物和电极之间实现电子的传递从而产生电流。在阳极阴极与外电路条件等其他因素相同的条件下,敲除铜绿假单胞菌SJTD-1的调控因子MvaT可使细菌存活时间与放电时间延长,产生更多的电量。由于MvaT参与了铜绿假单胞菌的群体感应系统、次生代谢途径和生物膜的形成等多个过程的负调控,敲除MvaT的突变株,其吩嗪化合物产量较野生型有所提升;同时,突变菌株SJTD-1 (Δ mvaT) 具有较厚的生物膜,在其保护下,其环境耐受能力更强,使其可在生物燃料电池系统中存活更长时间。由于吩嗪化合物的产生主要是在假单胞菌的对数生长期后期和稳定期,具有较长稳定期的突变菌株也可持续产生电子传递体,提升MFCs的总产电量。另一方面,较厚的生物膜也会降低阳极电子与阳极棒之间的传递速率,导致产生的电压最高峰值降低。因此,如何在增加电子传递体与活菌数目的情况下提升电子的传递速度,仍需进一步研究。
| [1] | Wang HM, Park JD, Ren ZJ. Practical energy harvesting for microbial fuel cells: a review. Environ Sci Technol, 2015, 49(6): 3267–3277. DOI: 10.1021/es5047765 |
| [2] | Yong XY, Shi DY, Chen YL, et al. Enhancement of bioelectricity generation by manipulation of the electron shuttles synthesis pathway in microbial fuel cells. Bioresour Technol, 2014, 152: 220–224. DOI: 10.1016/j.biortech.2013.10.086 |
| [3] | Lewis NS, Nocera DG. Powering the planet: chemical challenges in solar energy utilization. Proc Natl Acad Sci USA, 2006, 103(43): 15729–15735. DOI: 10.1073/pnas.0603395103 |
| [4] | Logan BE. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol, 2009, 7(5): 375–381. DOI: 10.1038/nrmicro2113 |
| [5] | Lovley DR. The microbe electric: conversion of organic matter to electricity. Curr Opin Biotechnol, 2008, 19(6): 564–571. DOI: 10.1016/j.copbio.2008.10.005 |
| [6] | Rabaey K, Verstraete W. Microbial fuel cells: novel biotechnology for energy generation. Trends Biotechnol, 2005, 23(6): 291–298. DOI: 10.1016/j.tibtech.2005.04.008 |
| [7] | Logan BE, Regan JM. Microbial fuel cells-challenges and applications. Environ Sci Technol, 2006, 40(17): 5172–5180. DOI: 10.1021/es0627592 |
| [8] | Sun HS, Xu SJ, Zhuang GQ, et al. Performance and recent improvement in microbial fuel cells for simultaneous carbon and nitrogen removal: a review. J Environ Sci, 2016, 39: 242–248. DOI: 10.1016/j.jes.2015.12.006 |
| [9] | ElMekawy A, Srikanth S, Bajracharya S, et al. Food and agricultural wastes as substrates for bioelectrochemical system (BES): the synchronized recovery of sustainable energy and waste treatment. Food Res Int, 2015, 73: 213–225. DOI: 10.1016/j.foodres.2014.11.045 |
| [10] | Ryu JH, Lee HL, Lee YP, et al. Simultaneous carbon and nitrogen removal from piggery wastewater using loop configuration microbial fuel cell. Process Biochem, 2013, 48(7): 1080–1085. DOI: 10.1016/j.procbio.2013.05.016 |
| [11] | Zhang F, Li J, He Z. A new method for nutrients removal and recovery from wastewater using a bioelectrochemical system. Bioresour Technol, 2014, 166: 630–634. DOI: 10.1016/j.biortech.2014.05.105 |
| [12] | Qiao Y, Qiao YJ, Zou L, et al. Real-time monitoring of phenazines excretion in Pseudomona s aeruginosa microbial fuel cell anode using cavity microelectrodes. Bioresour Technol, 2015, 198: 1–6. DOI: 10.1016/j.biortech.2015.09.002 |
| [13] | Qiao Y, Bao SJ, Li CM, et al. Nanostructured polyaniline/titanium dioxide composite anode for microbial fuel cells. ACS Nano, 2008, 2(1): 113–119. DOI: 10.1021/nn700102s |
| [14] | Yuan HY, He Z. Graphene-modified electrodes for enhancing the performance of microbial fuel cells. Nanoscale, 2015, 7(16): 7022–7029. DOI: 10.1039/C4NR05637J |
| [15] | Mason JA, Sumida K, Herm ZR, et al. Evaluating metal-organic frameworks for post-combustion carbon dioxide capture via temperature swing adsorption. Energy Environ Sci, 2011, 4(8): 3030–3040. DOI: 10.1039/c1ee01720a |
| [16] | Perry JJ, Perman JA, Zaworotko MJ. Design and synthesis of metal-organic frameworks using metal-organic polyhedra as supermolecular building blocks. Chem Soc Rev, 2009, 38(5): 1400–1417. DOI: 10.1039/b807086p |
| [17] | Zhou MH, Chi ML, Luo JM, et al. An overview of electrode materials in microbial fuel cells. J Power Sources, 2011, 196(10): 4427–4435. DOI: 10.1016/j.jpowsour.2011.01.012 |
| [18] | Rabaey K, Boon N, HÖfte M, et al. Microbial phenazine production enhances electron transfer in biofuel cells. Environ Sci Technol, 2005, 39(9): 3401–3408. DOI: 10.1021/es048563o |
| [19] | Rabaey K, Boon N, Siciliano SD, et al. Biofuel cells select for microbial consortia that self-mediate electron transfer. Appl Environ Microbiol, 2004, 70(9): 5373–5382. DOI: 10.1128/AEM.70.9.5373-5382.2004 |
| [20] | Pham TH, Boon N, Aelterman P, et al. Metabolites produced by Pseudomonas sp. enable a Gram-positive bacterium to achieve extracellular electron transfer. Appl Microbiol Biotechnol, 2008, 77(5): 1119–1129. DOI: 10.1007/s00253-007-1248-6 |
| [21] | Zhang TT, Zhang LX, Su WT, et al. The direct electrocatalysis of phenazine-1-carboxylic acid excreted by Pseudomonas alcaliphila under alkaline condition in microbial fuel cells. Bioresour Technol, 2011, 102(14): 7099–7102. DOI: 10.1016/j.biortech.2011.04.093 |
| [22] | Li CR, Wally H, Miller SJ, et al. The multifaceted proteins MvaT and MvaU, members of the H-NS family, control arginine metabolism, pyocyanin synthesis, and prophage activation in Pseudomonas aeruginosa PAO1. J Bacteriol, 2009, 191(20): 6211–6218. DOI: 10.1128/JB.00888-09 |
| [23] | Liu H, Liang RB, Tao F, et al. Genome sequence of Pseudomonas aeruginosa strain SJTD-1, a bacterium capable of degrading long-chain alkanes and crude oil. J Bacteriol, 2012, 194(17): 4783–4784. DOI: 10.1128/JB.01061-12 |
| [24] | Hoang TT, Karkhoff-Schweizer RR, Kutchma AJ, et al. A broad-host-range Flp-FRT recombination system for site-specific excision of chromosomally-located DNA sequences: application for isolation of unmarked Pseudomonas aeruginosa mutants. Gene, 1998, 212(1): 77–86. DOI: 10.1016/S0378-1119(98)00130-9 |
| [25] | Cui Q, Lv H, Qi Z, et al. Cross-regulation between the phz1 and phz2 operons maintain a balanced level of phenazine biosynthesis in Pseudomonas aeruginosa PAO1. PLos ONE, 2016, 11(1): e0144447. DOI: 10.1371/journal.pone.0144447 |
| [26] | Kim KJ. Phenazine 1-carboxylic acid resistance in phenazine 1-carboxylic acid producing Bacillus sp. B-6. Korean Soc Biochem Mol Biol, 2000, 33(4): 332–336. |
 2017, Vol. 33
2017, Vol. 33