中国科学院微生物研究所、中国微生物学会主办
文章信息
- 彭曙光, 谢震
- Peng Shuguang, Xie Zhen
- 基于合成基因线路的智能药物
- Smart therapeutics based on synthetic gene circuits
- 生物工程学报, 2017, 33(3): 456-466
- Chin J Biotech, 2017, 33(3): 456-466
- 10.13345/j.cjb.160425
-
文章历史
- Received: November 3, 2016
- Accepted: January 5, 2017
合成基因线路是由不同功能的生物分子和基因元件组成的自动控制装置,通过在活细胞中感受、整合和处理分子信号,行使特定生物功能。具体而言,合成基因线路可以分为3个模块:1) 输入,感知细胞内信号,比如利用肿瘤细胞特异性启动子,仅在相应的肿瘤细胞内表达其调控的基因;2) 运算,对输入进行计算与处理,比如利用肿瘤细胞的两个特异性启动子分别表达某种转录调控因子的N端和C端,则只有两个特异性启动子同时表达进行“逻辑与”运算时,才能形成完整的调控因子;3) 输出,释放生物信号以实现预期的调控目标,比如利用肿瘤细胞的两个特异性启动子拆分表达的调控因子作用于下游基因元件从而表达自杀蛋白等完成靶向杀伤肿瘤细胞。合成基因线路发展从最简单的小型模块开始,包括双稳态开关 (Toggle switch)[1-2]、振荡器 (Oscillators)[3-4]和细胞通讯[5-6]等,利用这些模块化功能单元,研究人员根据目标重新组合,设计能够执行复杂逻辑功能的新颖的基因线路,以应对复杂的生物环境。
合成基因线路最主要的应用之一便是生物医学研究,即疾病诊断与治疗 (基因治疗、细胞治疗)。这些基于合成基因线路、能够随着外界环境的变化做出及时的响应智能药物不仅根植于哺乳动物细胞,细菌也是重要的设计底盘之一,而后者则更加简单,也更加可控。过去研究中已经证明利用合成基因线路可以处理多个输入,识别和干扰RNA以杀死特定肿瘤细胞[7-8]。本综述重点介绍近几年基于哺乳动物细胞和细菌的、针对细胞表面抗原或者细胞内标志物所设计的具有治疗作用的基因线路,其中也包括新的基因元件、细胞内实现预期逻辑运算与存储的线路设计。
1 适用于哺乳动物细胞的合成基因线路利用并改造一些经典的细胞感知、响应信号通路对于开发工程化治疗性细胞是非常有用的,这些工程化的细胞可以自动检测所在部位的疾病或者损伤信号并精确地部署治疗或修复功能。疾病或者损伤信号可能出现在细胞表面,如由抗原呈递细胞表达的抗原,也可能在细胞内部,如肿瘤特异性miRNA。
1.1 以细胞表面抗原为靶点以细胞表面抗原为靶点的智能药物近年来取得很大的进展。嵌合抗原受体 (Chimeric antigen receptor,CAR) T细胞 (CAR-T) 便是其中比较具有代表性的工作[9]。CAR-T是人为将特异性的抗原结合区即单链抗体 (Single-chain variable fragment,scFv) 与跨膜区域和胞内信号转导区结合起来并组装到患者的T细胞中去,使改造后的T细胞可以表达肿瘤抗原受体,不依赖于天然的抗原提呈机制,对特定的肿瘤抗原具有高度亲和性,并能够进行特异性地杀伤[10]。
目前CAR-T的发展已历经3代 (图 1A),区别主要在于胞内信号转导区,第一代的CAR-T胞内信号转导区主要是免疫受体酪氨酸活化基序 (Immunoreceptor tyrosine-based activation motifs,ITAM,通常为CD3ζ或FcεRIγ),第二代在此基础上增加了共刺激分子CD28,第三代则是继续增加了CD137 (4-1BB) 等共刺激分子,其目的在于增强T细胞的活化能力和杀伤性能,并延长T细胞的存活时间[11-13]。
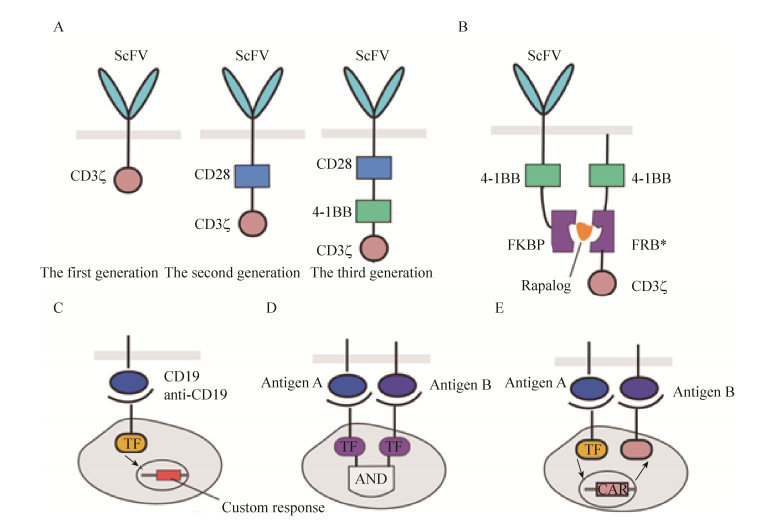
|
| 图 1 靶向细胞表面抗原的哺乳动物细胞疗法 (A:三代CAR-T技术之间的区别;B:利用小分子控制CAR-T的活性[16];C:可定制响应的synNotch[19];D:具有“逻辑与”运算功能的synNotch线路[19];E:synNotch与CAR-T联用,提高CAR-T安全性[20]) Figure 1 Mammalian cell therapy target at cell surface antigen. (A) The difference among three generations of CAR-T technology. (B) Control the activity of CAR-T by small molecules[16]. (C) Customize synNotch response to specific antigen[19]. (D) Logic AND computation based on synNotch circuit[19]. (E) Promote the CAR-T safety by combination with synNotch[20]. |
| |
尽管CAR-T在临床上已经取得了良好的治疗效果,但是其一旦失控极易引发细胞因子风暴 (Cytokine storm),从而引起患者的高烧等一系列不良反应,导致患者多器官的衰竭;另外CAR-T在靶向杀伤肿瘤细胞的同时,由于多数抗原也会在正常组织中低水平表达,继而带来脱靶问题,从而对非肿瘤细胞组织造成损伤;以及CAR-T在实体瘤治疗领域效果依然较差,一进入实体瘤内,很快进入失能状态[14-15]。为了能够人为干预调控CAR-T的活性,Wu等将嵌合抗原受体进行了拆分 (图 1B),其中一部分由scFv和共刺激分子组成以及FK506结合蛋白 (FKBP) 结构域组成,另一部分由共刺激分子和FKBP-雷帕霉素结合域的T2089L突变体 (FRB*) 以及CD3ζ构成,仅在雷帕霉素的作用下,FKBP和FRB*才会融合在一起,拆分的两部分才能重新结合,进而开启T细胞的活化与特异性的杀伤功能[16]。这种利用小分子控制的CAR-T,可以帮助医生精确地控制T细胞作用的时间、地点和强度,从而缓解毒性。此外,Wei等曾在T细胞中利用细菌效应蛋白作为反馈调节器调节T细胞响应振幅,或者构建可诱导的暂停开关短暂关闭T细胞的激活[17],这也为调节T细胞响应以及免疫风暴提供了一种新的策略。
与嵌合抗原受体类似,Notch是另外一种简单、直接的细胞通讯使用的信号转导工具。Notch受体与其配体Delta家族蛋白表达在伴侣细胞的表面,Notch与Delta的结合导致膜蛋白的水解从而释放Notch的胞内信号转录调节结构域[18]。这些转录调节信号进入细胞核以激活发育过程中起关键作用的靶基因。并且Notch的胞内信号转导调节结构域和胞外的配体都可以进行替换,仅保留核心的跨膜区域,这为定制具有特异性功能的人工信号通路提供了良好的平台。基于上述内容,Morsut等设计了人工合成Notch (synNotch),其胞外区域变成了单链抗体,保留了天然Notch的跨膜自剪切区域,胞内区域则可以替换成转录激活结构域Gal4-VP64以及tTA等[19]。这种人工改造后的Notch在细胞内表达之后,可以特异性地识别与其配对的抗原细胞,释放预先定制的转录调节信号,转录激活下游基因,行使设计好的功能 (图 1C)。而且synNotch具有良好的正交性,同一细胞表达两种定制的Notch通路不会互相影响,进而可以设计具有“逻辑与”运算功能的信号通路,可以提高细胞通讯的特异性,使细胞决策更加准确 (图 1D)。同时,该研究组将synNotch与CAR-T联用 (图 1E),提高了对肿瘤识别的特异性[20]。具体而言,肿瘤表达的特异性抗原A可以与synNotch上对应的抗体相结合,释放synNotch胞内转录激活信号tTA,tTA入核激活CAR,表达的CAR识别肿瘤另一种特异性抗原B,促进T细胞的活化与增殖,并对肿瘤进行特异性地杀伤。
最近,Roybal等利用synNotch改造T细胞,使之成为药物递送的工具[21]。改造后的T细胞在肿瘤抗原的刺激下可以诱导产生预设的细胞因子或者对T细胞分化具有决定性作用的转录调节因子从而控制分化的T细胞的种类,也可以释放肿瘤坏死因子相关的凋亡诱导配体。除此之外,该研究还尝试了用synNotch信号通路诱导产生PD-1、CTLA-4抗体增强免疫系统的功能,以及双特异性单链抗体去激活T细胞杀伤肿瘤细胞。这种响应可定制的智能药物进一步为疾病诊断和治疗带来更多可能。目前该设计仅仅是凭借简单的转录调控,下一步引入多功能的基因线路将会继续扩展其潜能和使用场景。
1.2 以细胞内标志物为靶点除了利用细胞表面抗原来特异性区分靶向对象并在天然的细胞信号通路基础上做改造,使工程化的哺乳动物细胞可以靶向递送药物之外,利用细胞内标志物如肿瘤特异性启动子、miRNA设计构建基因线路进行特异性治疗也是目前重要的研究方向。
活细胞的复杂控制需要借助能够感知、测量多种内源分子信号的合成基因线路。RNA干扰提供了一个通用的界面,允许合成基因线路模块感测和整合哺乳动物细胞中的内源性分子输入。Li等利用模块化的转录激活抑制子 (TALER) 构建双稳态开关,并且利用细胞内源miRNA来控制该开关,从而可以特异性区分开肿瘤细胞和正常细胞,提高对Hela细胞分类的精确度,该研究同时实现了哺乳动物合成生物学领域的重要目标,工程化合成转录激活因子和抑制子来支持可扩展的线路设计[22]。Haefliger等利用合成基因线路检测、评估药物对靶向miRNA的作用,该基因线路可以评估药物的靶向效果以及是否具有脱靶副作用,比如干预基因表达或者其他RNA发挥作用,为精准药物研发评估提供了新的方法与平台[23]。
近年来迅猛发展的CRISPR/Cas9系统具有灵活强大的基因编辑和基因表达调控能力[24-25],为生物学各分支方向的研究提供了强有力的工具,当然也为合成基因线路的构建提供了良好的元件,推动了基因治疗和细胞治疗领域的发展。Moore等利用Cas9靶向自剪切递送基因为更加可控地对哺乳动物细胞进行基因治疗提供了新的策略[26](图 2A)。虽然Cas9系统存在一定的脱靶和失控问题,但已有相关研究者对此进行改进,除了对蛋白本身进行突变,降低其与错配碱基的亲和度[27-28],从而降低脱靶效应,也有研究者改造Cas9蛋白使之成为化学物质诱导型[29],或者利用光诱导型二聚体CRY2和C1B1蛋白结合dCas9 (deactiveCas9) 蛋白使之仅在光照条件下才会激活靶基因[30],可以进行体外控制Cas9蛋白的活性。为了能够让细胞自动控制Cas9是否行使功能,Liu等利用特异性启动子设计逻辑与基因线路进行膀胱癌检测[31]。两个特异性启动子仅在膀胱癌细胞中才会同时具有活性,表达Cas9蛋白和guide RNA (gRNA),最终使报告基因荧光素酶或者毒性蛋白表达 (图 2B)。最近该研究组还结合核糖体开关 (Riboswitch) 来控制gRNA序列是否裸露,进一步来控制Cas9是否发挥功能[32]。除了用于感知小分子来控制Cas9的活性,他们还利用感知癌症细胞高表达的NF-κB和β-catenin蛋白,来控制是否释放gRNA序列,并最终诱导癌细胞凋亡。为了更加灵活地操控CRISPR-Cas9系统,对细胞进行重编程,为细胞治疗铺平道路。Zalatan等构建模块化支架RNA,结合dCas9,实现预设的多基因转录程序,其中一些基因被激活而同时其他基因被抑制[33]。CRISPR相关的RNA支架提供了一个强大的方法来构建合成基因表达程序,包括重新布线细胞命运,定制工程化细胞响应。Kiani等则通过控制表达不同长度的gRNA决定融合了转录激活因子VPR的Cas9蛋白是剪切还是激活或是抑制目的基因,为研究者灵活运用Cas9功能提供了有力的工具[34]。除了直接控制Cas9蛋白或者gRNA序列,Ma等利用miRNA控制由TALE转录抑制子构建的双稳态开关从而表达不同类型的dCas9,最终在癌细胞激活靶向基因但在正常细胞中则关闭该基因,实现特异性治疗的目标[35](图 2C)。该工作在上述Li等工作的基础上更进一步,使双稳态开关在miRNA控制范围下可操控的基因种类更多,但是随着多一级的转录调控增加,该基因线路的噪声也伴随着被放大,Ma等也提出了解决策略,如利用miRNA进行前馈调节[22, 35]。近期,Gao等设计实现了一个灵活的基于dCas9的化学诱导的复杂基因调控平台。他们利用两个有效的化学诱导剂,与正交dCas9组合,在哺乳动物细胞中介导有效的基因激活和抑制,独立地控制同一细胞内不同基因的表达。使用这个平台,他们进一步设计了基于dCas9的AND、OR、NAND和NOR逻辑运算单元[36]。这项工作提供了一个强大的基于CRISPR-dCas9的平台,适用于大规模转录组工程的复杂转录调控,为以哺乳动物细胞为底盘的细胞治疗方法的开发提供了有力的工具。
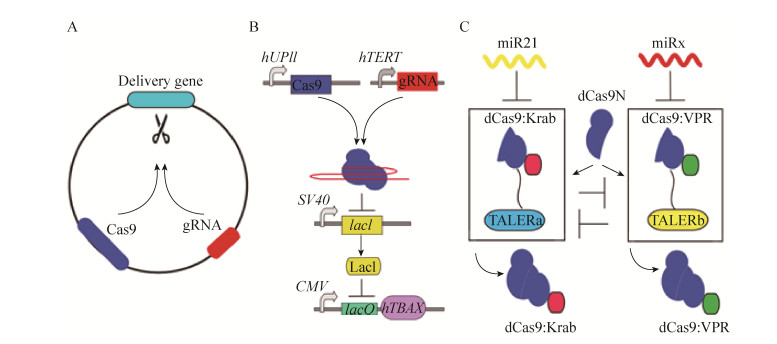
|
| 图 2 基于Cas9元件的的哺乳动物细胞疗法 (A:利用Cas9靶向自剪切递送基因[26];B:利用特异性启动子控制Cas9系统实现膀胱癌识别[31];C:利用miRNA控制TALER构建的双稳态开关表达不同dCas9进行多功能基因转录调控[35]) Figure 2 Mammalian cell therapy based on Cas9 system. (A) Self-cleaving gene delivery mechanism based on Cas9 system[26]. (B) Identify bladder cancer by specific promoter driving Cas9 and gRNA individually[31]. (C) Use toggle switch to control dCas9 transcription function by miRNA[35]. |
| |
合成基因线路在对哺乳动物细胞的改造中取得显著效果,而其在以细菌为底盘的改造过程中同样发挥重要作用,使改造后细菌可以靶向杀灭病菌或者靶向摧毁癌细胞以及检测肿瘤发生。目前基于细菌的基因线路大都依赖群体感应机制 (Quorum sensing)。即细菌通过感知其周围环境中的特定小分子,比如酰基高丝氨酸内酯 (Acyl-homoserine lactone,AHL),当这种特定的小分子达到一定浓度/阈值之后,会打开邻近细胞中启动子,激活相应的基因,细菌便是利用这种机制来交流沟通,感知群体的大小,并作出相应的决策。
2.1 靶向病菌的细菌疗法Gupta等利用改造后的大肠杆菌Escherichiacoli靶向杀灭绿脓杆菌Pseudomonas aeruginosa[37]。研究者利用绿脓杆菌分泌AHL,当AHL达到一定浓度便会启动大肠杆菌表达对绿脓杆菌具有特异性杀伤作用的CoPy蛋白,从而达到抑制绿脓杆菌生长的目的 (图 3A)。Hwang等则更近一步,他们同时在大肠杆菌内部添加了动力马达,当被改造后的大肠杆菌感知到AHL时,便会开启CheZ蛋白表达,使大肠杆菌游向绿脓杆菌,同时分泌抗生物膜蛋白与抗菌多肽杀灭绿脓杆菌[38](图 3B)。这种基于群体感应机制改造后的细菌仅在特定条件下快速繁殖,一定程度上能够限制其给正常组织带来的伤害。
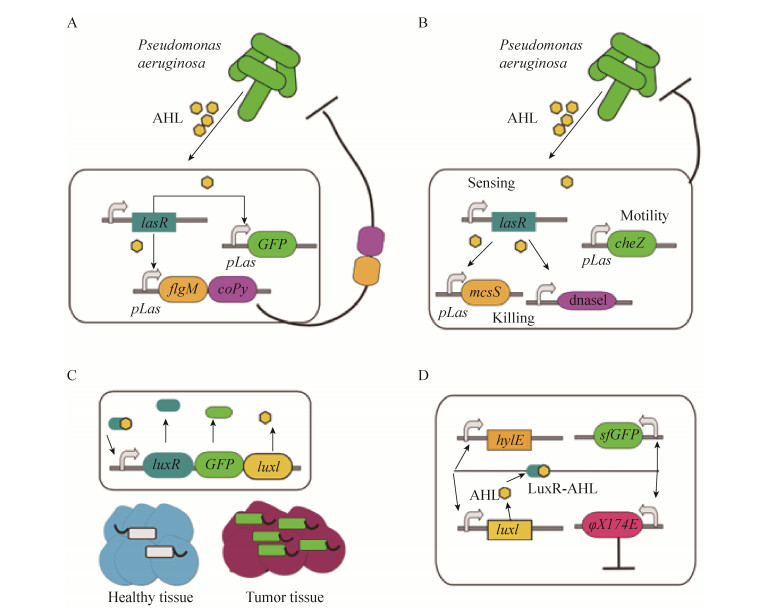
|
| 图 3 基于群体感应的细菌疗法 (A:利用改造后的大肠杆菌在群体感应机制的控制下靶向杀灭绿脓杆菌[37];B:改造后的大肠杆菌感知到AHL达到阈值后表达CheZ蛋白,游向绿脓杆菌同时分泌抗生物膜蛋白与抗菌多肽杀灭绿脓杆菌[38];C:沙门氏菌优先在肿瘤组织中累积并表达抗肿瘤蛋白抑制肿瘤[43];D:大肠杆菌在群体感应机制的控制下周期性裂解并释放携带药物[44]) Figure 3 Bacterial therapy based on quorum sensing. (A) Engineer Escherichiacolito target and destroy Pseudomonas aeruginosa[37]. (B) Engineered Escherichiacoliinduced by AHL moves to Pseudomonas aeruginosa through expressing CheZ protein and kills them[38]. (C) Engineered Salmonella selectively reproduces in tumor tissue and kill cancer cells[43]. (D) Engineered Escherichiacoliundergoes periodic lysis and release of the drug under the control of quorum sensing mechanism[44]. |
| |
改造后的细菌不仅可以用来靶向杀灭病菌,也可以特异性裂解肿瘤,使用细菌作为抗实体瘤的治疗策略正在作为癌症治疗中具有巨大潜力的领域出现。已有研究表明厌氧菌可以侵润实体瘤区域从而降低其生长速率抑制肿瘤生长,然而未经改造的兼性厌氧菌也会对正常组织造成损伤,限制了其使用场景和治疗效果。针对这一问题,Yu等将鼠伤寒沙门氏菌Salmonella typhimurium工程化改造得到了YB1菌株,使其必需基因置于缺氧条件的启动子下游,确保其仅在厌氧条件下存活,避免对正常组织的损伤[39]。在乳腺肿瘤携带的小鼠中,YB1在肿瘤内繁殖,抑制肿瘤生长,同时也能在正常组织中迅速消除。Guo等在此基础上,利用这种工程化的沙门氏菌 (Sal-YB1) 靶向神经母细胞瘤,期望解决其不良的预后问题[40]。经Sal-YB1处理的小鼠中,肿瘤组织具有更多的Sal-YB1浸润、坏死和收缩。Shi等为解决癌症和感染性疾病的细菌治疗方法缺乏安全和有效的载体的问题,开发了沙门氏菌菌株,以保持和安全地递送质粒载体到目标组织。该载体被设计为允许治疗因子 (例如细胞毒性蛋白质,短发夹RNA或组合) 在真核细胞的细胞核或细胞质中双重转录,其中这种表达由自催化正反馈回路维持,还提供了引发系统和在细菌中保持质粒的机制。这种持续的递送和高基因表达水平对于治疗功效是至关重要的[41]。最近,Shi等设计了一种名为ST8的鼠伤寒沙门氏菌菌株,其在肿瘤中积累的水平比亲本专性厌氧菌株ST4高至少100倍[42]。此外,改造后的ST8递送Ⅲ型分泌蛋白SopA融合的内皮抑素,靶向肿瘤周围的血管,通过Ⅲ型分泌系统 (T3SS) 释放血管生成抑制剂,以干扰生长因子在肿瘤中的促血管生成作用。具有结肠癌的小鼠在注射ST8后,通过诱导肿瘤坏死并抑制肿瘤内的血管内皮细胞密度,显示出有效的肿瘤抑制效果。
与Yu等策略不同,Swofford等利用群体感应线路结合非致病性的沙门氏菌来治疗癌症[43]。沙门氏菌分泌抗肿瘤蛋白可以帮助清除肿瘤,然而其在正常的组织中也会表达进而带来副作用。不过因为沙门氏菌优先在肿瘤组织中累积,这些研究人员将群体感应线路应用到沙门氏菌的改造中,仅当在沙门氏菌达到一定密度之后才会开启抗肿瘤蛋白的表达,实现了治疗蛋白在肿瘤组织中选择性表达的目标 (图 3C)。Din等为了更好地控制细菌种群的数量以及释放细菌所携带药物,他们在群体感应的基础上,增添了正负反馈机制,使细菌种群数量具有非常鲁棒的振荡的动力学特征[44]。改造后的大肠杆菌可以分泌并感知小分子AHL,这些小分子结合细菌产生的LuxR进一步促进AHL的合成,当AHL达到一定阈值便会开启噬菌体裂解基因 (φX174E) 合成,引起细菌死亡,并释放所携带的基因编码的药物,菌群数量急剧下降,AHL浓度也达到最低点,一个振荡周期至此结束,细菌开启下一轮快速繁殖 (图 3D)。这种振荡性的给药方式将会减轻细胞负担,如果下一步能够做到振荡性供给多种药物,将有可能解决肿瘤的耐药性问题。
2.3 基于细菌线路的疾病、病菌检测除了利用细菌来作为靶向给药的运载工具,Danino等将改造后的大肠杆菌口服给药,并通过尿液来无创地检测肝癌是否发生转移[45]。这些改造后的细菌会特异地在转移瘤中扩增,表达LacZ并裂解荧光素,释放到泌尿系统中,最终可以通过尿液进行检测。在Borrero等的工作中,乳酸乳球菌被工程化以检测和抑制万古霉素抗性粪肠球菌的生长。一旦检测到由粪肠球菌产生的性信息素cCF10,工程改造的乳酸乳杆菌产生enterocinA、hiracin JM79和enterocin P,从而抑制粪肠球菌生长[46]。
3 结论和展望合成生物学旨在使生物元件标准化,并将其开发为可用于各种应用场景和基础科学中即插即用的模块。合成生物学的发展将有助于人们开发针对肿瘤、糖尿病、单基因遗传病等疾病的新型治疗方法。在基础科学方面,合成生物学允许开发可量化的模型,其概括自然界中的一些复杂现象,通过这些模型使我们能够更好地了解类似的过程,如昼夜节律和发育开关是怎样被监管的。合成生物学还为我们提供了各种各样的工具,可以被模块化地重组以检测感兴趣的触发并且给出响应报告。
基于哺乳动物细胞或者细菌的智能药物有很多的潜力。正如上述讨论的以合成基因线路为基础的设计平台,在疾病诊断与治疗中有很大的潜能。当然,目前基于合成基因线路的治疗手段并非完美无缺,依旧存在一些问题。比如工程化细胞的功能,在面对时间和环境的变化下,是否可以一直鲁棒地工作是一个重大挑战,这是因为目前设计的合成基因线路通常在最佳的体外生长环境下进行测试和响应,对于预期复杂环境可能无法精确复现。另外,细胞异质性带来的噪声也会在一定程度上影响基因线路的预期效果[47],模块化的基因线路下游元件也会向上游模块施加负载从而负面影响基因线路功能[48],从而导致了哺乳动物细胞中组装基因线路的功能预测不准确。这些都是以合成基因线路为基础的智能药物开发所需要考虑和解决的问题。随着合成生物学研究在动物模型和临床中的应用,新的、有效的体外系统应该尽快开发,以更好地模拟改造后细胞所面临的错综复杂的情况,从而加速智能药物的研发与评估。
| [1] | Gardner TS, Cantor CR, Collins JJ. Construction of a genetic toggle switch in Escherichia coli. Nature, 2000, 403(6767): 339–342. DOI: 10.1038/35002131 |
| [2] | Atkinson MR, Savageau MA, Myers JT, et al. Development of genetic circuitry exhibiting toggle switch or oscillatory behavior in Escherichia coli. Cell, 2003, 113(5): 597–607. DOI: 10.1016/S0092-8674(03)00346-5 |
| [3] | Elowitz MB, Leibler S. A synthetic oscillatory network of transcriptional regulators. Nature, 2000, 403(6767): 335–338. DOI: 10.1038/35002125 |
| [4] | Tigges M, Marquez-Lago TT, Stelling J, et al. A tunable synthetic mammalian oscillator. Nature, 2009, 457(7227): 309–312. DOI: 10.1038/nature07616 |
| [5] | Basu S, Gerchman Y, Collins CH, et al. A synthetic multicellular system for programmed pattern formation. Nature, 2005, 434(7037): 1130–1134. DOI: 10.1038/nature03461 |
| [6] | Liu CL, Fu XF, Liu LZ, et al. Sequential establishment of stripe patterns in an expanding cell population. Science, 2011, 334(6053): 238–241. DOI: 10.1126/science.1209042 |
| [7] | Xie Z, Wroblewska L, Prochazka L, et al. Multi-input RNAi-based logic circuit for identification of specific cancer cells. Science, 2011, 333(6047): 1307–1311. DOI: 10.1126/science.1205527 |
| [8] | Benenson Y. RNA-based computation in live cells. Curr Opin Biotechnol, 2009, 20(4): 471–478. DOI: 10.1016/j.copbio.2009.08.002 |
| [9] | Davila ML, Riviere I, Wang XY, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med, 2014, 6(224): 224–225. |
| [10] | Sadelain M, Rivière I, Brentjens R. Targeting tumours with genetically enhanced T lymphocytes. Nat Rev Cancer, 2003, 3(1): 35–45. DOI: 10.1038/nrc971 |
| [11] | Song DG, Ye QR, Carpenito C, et al. In vivo persistence, tumor localization, and antitumor activity of CAR-engineered T cells is enhanced by costimulatory signaling through CD137 (4-1BB). Cancer Res, 2011, 71(13): 4617–4627. DOI: 10.1158/0008-5472.CAN-11-0422 |
| [12] | Savoldo B, Ramos CA, Liu EL, et al. CD28 costimulation improves expansion and persistence of chimeric antigen receptor-modified T cells in lymphoma patients. J Clin Invest, 2011, 121(5): 1822–1826. DOI: 10.1172/JCI46110 |
| [13] | Gandhi M, Jones K. Optimizing tumor-targeting chimeric antigen receptor T cells in B-cell lymphoma patients. Immunotherapy, 2011, 3(12): 1441–1443. DOI: 10.2217/imt.11.135 |
| [14] | Morgan RA, Yang JC, Kitano M, et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol Ther, 2010, 18(4): 843–851. DOI: 10.1038/mt.2010.24 |
| [15] | De Francesco L. CAR-T cell therapy seeks strategies to harness cytokine storm. Nat Biotechnol, 2014, 32(7): 604. DOI: 10.1038/nbt0714-604 |
| [16] | Wu CY, Roybal KT, Puchner EM, et al. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science, 2015, 350(6258): aab4077. DOI: 10.1126/science.aab4077 |
| [17] | Wei P, Wong WW, Park JS, et al. Bacterial virulence proteins as tools to rewire kinase pathways in yeast and immune cells. Nature, 2012, 488(7411): 384–388. DOI: 10.1038/nature11259 |
| [18] | Bray SJ. Notch signalling: a simple pathway becomes complex. Nat Rev Mol Cell Biol, 2006, 7(9): 678–689. DOI: 10.1038/nrm2009 |
| [19] | Morsut L, Roybal KT, Xiong X, et al. Engineering customized cell sensing and response behaviors using synthetic notch receptors. Cell, 2016, 164(4): 780–791. DOI: 10.1016/j.cell.2016.01.012 |
| [20] | Roybal KT, Rupp LJ, Morsut L, et al. Precision tumor recognition by T cells with combinatorial antigen-sensing circuits. Cell, 2016, 164(4): 770–779. DOI: 10.1016/j.cell.2016.01.011 |
| [21] | Roybal KT, Williams JZ, Morsut L, et al. Engineering T cells with customized therapeutic response programs using synthetic notch receptors. Cell, 2016, 167(2): 419–432.e16. DOI: 10.1016/j.cell.2016.09.011 |
| [22] | Li YQ, Jiang Y, Chen H, et al. Modular construction of mammalian gene circuits using TALE transcriptional repressors. Nat Chem Biol, 2015, 11(3): 207–213. DOI: 10.1038/nchembio.1736 |
| [23] | Haefliger B, Prochazka L, Angelici B, et al. Precision multidimensional assay for high-throughput microRNA drug discovery. Nat Commun, 2016, 7: 10709. DOI: 10.1038/ncomms10709 |
| [24] | Mali P, Yang LH, Esvelt KM, et al. RNA-guided human genome engineering via Cas9. Science, 2013, 339(6121): 823–826. DOI: 10.1126/science.1232033 |
| [25] | Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems. Science, 2013, 339(6121): 819–823. DOI: 10.1126/science.1231143 |
| [26] | Moore R, Spinhirne A, Lai MJ, et al. CRISPR-based self-cleaving mechanism for controllable gene delivery in human cells. Nucleic Acids Res, 2015, 43(2): 1297–1303. DOI: 10.1093/nar/gku1326 |
| [27] | Slaymaker IM, Gao LY, Zetsche B, et al. Rationally engineered Cas9 nucleases with improved specificity. Science, 2016, 351(6268): 84–88. DOI: 10.1126/science.aad5227 |
| [28] | Kleinstiver BP, Pattanayak V, Prew MS, et al. High-fidelity CRISPR-Cas9 nucleases with no detectable genome-wide off-target effects. Nature, 2016, 529(7587): 490–495. DOI: 10.1038/nature16526 |
| [29] | Davis KM, Pattanayak V, Thompson DB, et al. Small molecule-triggered Cas9 protein with improved genome-editing specificity. Nat Chem Biol, 2015, 11(5): 316–318. DOI: 10.1038/nchembio.1793 |
| [30] | Polstein LR, Gersbach CA. A light-inducible CRISPR-Cas9 system for control of endogenous gene activation. Nat Chem Biol, 2015, 11(3): 198–200. DOI: 10.1038/nchembio.1753 |
| [31] | Liu YC, Zeng YY, Liu L, et al. Synthesizing AND gate genetic circuits based on CRISPR-Cas9 for identification of bladder cancer cells. Nat Commun, 2014, 5: 5393. DOI: 10.1038/ncomms6393 |
| [32] | Liu YC, Zhan YH, Chen ZC, et al. Directing cellular information flow via CRISPR signal conductors. Nat Methods, 2016, 13(11): 938–944. DOI: 10.1038/nmeth.3994 |
| [33] | Zalatan JG, Lee ME, Almeida R, et al. Engineering complex synthetic transcriptional programs with CRISPR RNA scaffolds. Cell, 2015, 160(1/2): 339–350. |
| [34] | Kiani S, Chavez A, Tuttle M, et al. Cas9 gRNA engineering for genome editing, activation and repression. Nat Methods, 2015, 12(11): 1051–1054. DOI: 10.1038/nmeth.3580 |
| [35] | Ma DC, Peng SG, Xie Z. Integration and exchange of split dCas9 domains for transcriptional controls in mammalian cells. Nat Commun, 2016, 7: 13056. DOI: 10.1038/ncomms13056 |
| [36] | Gao YC, Xiong X, Wong S, et al. Complex transcriptional modulation with orthogonal and inducible dCas9 regulators. Nat Methods, 2016, 13(12): 1043–1049. DOI: 10.1038/nmeth.4042 |
| [37] | Gupta S, Bram EE, Weiss R. Genetically programmable pathogen sense and destroy. ACS Synth Biol, 2013, 2(12): 715–723. DOI: 10.1021/sb4000417 |
| [38] | Hwang IY, Tan MH, Koh E, et al. Reprogramming microbes to be pathogen-seeking killers. ACS Synth Biol, 2013, 3(4): 228–237. |
| [39] | Yu B, Yang M, Shi L, et al. Explicit hypoxia targeting with tumor suppression by creating an "obligate" anaerobic Salmonella Typhimuriumstrain. Sci Rep, 2012, 2: 436. |
| [40] | Guo ZL, Yu B, Ning BT, et al. Genetically modified "obligate" anaerobic Salmonella typhimurium as a therapeutic strategy for neuroblastoma. J Hematol Oncol, 2015, 8: 99. DOI: 10.1186/s13045-015-0196-3 |
| [41] | Shi L, Yu B, Cai CH, et al. Combined prokaryotic-eukaryotic delivery and expression of therapeutic factors through a primed autocatalytic positive-feedback loop. J Controlled Release, 2016, 222: 130–140. DOI: 10.1016/j.jconrel.2015.12.005 |
| [42] | Shi L, Yu B, Cai CH, et al. Angiogenic inhibitors delivered by the type Ⅲ secretion system of tumor-targeting Salmonella typhimurium safely shrink tumors in mice. AMB Express, 2016, 6(1): 56. DOI: 10.1186/s13568-016-0226-8 |
| [43] | Swofford CA, Van Dessel N, Forbes NS. Quorum-sensing Salmonella selectively trigger protein expression within tumors. Proc Natl Acad Sci USA, 2015, 112(11): 3457–3462. DOI: 10.1073/pnas.1414558112 |
| [44] | Din MO, Danino T, Prindle A, et al. Synchronized cycles of bacterial lysis for in vivo delivery. Nature, 2016, 536(7614): 81–85. DOI: 10.1038/nature18930 |
| [45] | Danino T, Prindle A, Kwong GA, et al. Programmable probiotics for detection of cancer in urine. Sci Transl Med, 2015, 7(289): 289ra84. DOI: 10.1126/scitranslmed.aaa3519 |
| [46] | Borrero J, Chen YQ, Dunny GM, et al. Modified lactic acid bacteria detect and inhibit multiresistantenterococci. ACS Synth Biol, 2015, 4(3): 299–306. DOI: 10.1021/sb500090b |
| [47] | Morel M, Shtrahman R, Rotter V, et al. Cellular heterogeneity mediates inherent sensitivity-specificity tradeoff in cancer targeting by synthetic circuits. Proc Natl Acad Sci USA, 2016, 113(29): 8133–8138. DOI: 10.1073/pnas.1604391113 |
| [48] | Mishra D, Rivera PM, Lin A, et al. A load driver device for engineering modularity in biological networks. Nat Biotechnol, 2014, 32(12): 1268–1275. DOI: 10.1038/nbt.3044 |
 2017, Vol. 33
2017, Vol. 33




