中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李峰, 门冬, 王殿冰, 张先恩
- Feng Li, Dong Men, Dianbing Wang, Xian-En Zhang
- 生物大分子自组装合成多维纳米生物结构与器件
- Synthesis of multi-dimensional nano biostructures and biodevices through self-assembly of biomacromolecules
- 生物工程学报, 2017, 33(3): 404-421
- Chin J Biotech, 2017, 33(3): 404-421
- 10.13345/j.cjb.160468
-
文章历史
- Received: December 5, 2016
- Accepted: February 15, 2017
2 中国科学院生物物理研究所 生物大分子国家重点实验室 中国科学院生物大分子科教融合卓越中心,北京 100101
2 CAS Center for Excellence in Biomacromolecules, National Laboratory of Biomacromolecules, Institute of Biophysics, Chinese Academy of Sciences, Beijing 100101, China
生物体系含有无以计数的纳米生物机器或结构,它们行使着各种功能,维持生命过程。这些精巧的结构和分子机器,都是通过自组装形成的。学习和了解其自组装,一方面可以加深对生命本质的理解,另一方面可以利用其原理,合成新颖的功能纳米生物结构,这是制备合成纳米生物器件的有效途径。本研究团队从事相关研究多年,分别构建了一维、二维、三维和多层级的纳米生物结构并赋予功能。现将国内外有关进展综述如下。
1 一维纳米生物结构一维纳米生物结构,也称为生物纳米线,一般直径小于100 nm,纵向无限制,具有较大的纵横比 (长径比大于1 000)。
生物纳米线通常是由生物大分子自组装形成的,具有几个明显的特点:首先,具有非常大的比表面积和高度有序的表面分子排布;其次,很多生物分子本身就具有生物学功能,可直接赋予纳米线生物学活性,如荧光、催化功能或特异性识别能力等;第三,相对于其他材料的纳米线,生物分子更容易修饰,从而使生物纳米线可根据需要而多功能化;最后,通过理性设计 (Rational design),可以控制生物分子自组装并在生物纳米线的表面进行选择性功能化,最终获得具有复杂功能的纳米结构。
因此,生物纳米线是一种理想的一维生物纳米技术平台。在过去十多年间,人们设计并制备了种类众多的一维纳米生物结构和器件。这些结构和器件在催化、生物传感、电信号传导和细胞培养支架等研究领域受到广泛的关注[1]。
1.1 生物纳米线的合成人们在学习和借鉴天然生物大分子自组装的基础上[2],利用生物分子间特异性相互作用,通过遗传、化学修饰等手段,制备了具有不同特性的生物纳米线。这些生物纳米线主要由核酸、多肽、蛋白或丝状病毒等生物大分子构成。本文主要讨论由多肽和蛋白构成的生物纳米线。
1.1.1 多肽纳米线多肽由于其稳定的化学性质、良好的生物相容性和组装行为易预测等性质,成为合成生物纳米线的重要材料[3]。用于合成纳米线的多肽根据来源主要分两种。一种是天然自组装线状结构蛋白的组装结构域,一般来源于淀粉样纤维蛋白的自组装结构域或类似结构,又称为淀粉样结构 (Amyloid like structure);另一种是从头设计 (De novo design) 的人工自组装多肽,包含两类,一是基于α螺旋的多肽设计 (α-Helical assemblies),该研究主要以布里斯托尔大学的Derek Woolfson为代表[4],其主要原理是利用氨基酸分子间的疏水作用和氢键,人为设计疏水氨基酸和极性氨基酸循环排列,最终得到相互结合形成线状纳米结构的多肽;二是双亲性多肽[5](Amphiphilic peptide,PAs),是将多肽设计为一端亲水、一端疏水的结构,在疏水作用力的作用下,于溶液中自组装形成线性纳米结构。
1.1.2 蛋白纳米线蛋白纳米线,也可分为两类:一类主要是利用天然线状蛋白质聚合物自组装的性质,如淀粉样蛋白 (如酵母朊蛋白Sup35、Ure2等)、胶原蛋白和丝蛋白等[1],通过遗传修饰功能性蛋白 (如荧光蛋白、酶和特异性亲和分子等) 来制备功能化的纳米线。其特点是能够容纳较大的外源功能蛋白,从而易于实现纳米线的多功能化;另一类蛋白纳米线[2],主要来源于人工设计,利用蛋白-蛋白相互作用、蛋白-核酸相互作用或蛋白-小分子相互作用,通过循环排列将蛋白头尾相连形成线状纳米结构。
1.2 生物纳米线的功能化生物纳米线的功能化是一维纳米生物器件制备的关键[6],主要通过两种方式实现:一种是发生在组装前,另一种发生在组装后。
前者是对自组装基元 (Building blocks) 进行修饰,进而组装成为功能化的纳米线,我们称之为功能配体的共组装。例如,对于一些对组装影响较小的小分子,可以直接修饰在自组装基元上,而后随自组装的过程展示在纳米线表面 (图 1A)。对于一些较大的外源功能蛋白,则可以通过基因融合的方式实现共组装 (图 1B)。第二种方式是在生物分子发生自组装后,利用生物分子的活性基团进行共价、非共价的化学修饰,引入功能配体。例如,通过对生物分子的氨基、羧基、巯基等基团进行化学交联功能分子 (图 1C),或者利用纳米线结构的特殊性质 (如局部疏水区域),进行插入式的修饰,最终得到功能化的纳米线,我们称之为组装后修饰 (图 1D)。

|
| 图 1 生物纳米线的功能化 (A:对自组装基元进行功能小分子修饰,共组装形成功能化纳米线;B:自组装基元进行功能配体的遗传修饰,共组装形成功能化纳米线;C:对自组装纳米线进行功能配体的化学修饰,获得功能化纳米线;D:利用生物纳米线的疏水性进行功能化修饰) Figure 1 Functionalization of biological nanowires. (A) Construction of functional nanowires through co-assembly of the self-assembling building blocks that are modified with functional small molecules. (B) Construction of functional nanowires through co-assembly of the self-assembling building blocks that are genetically modified with functional ligands. (C) Construction of functional nanowires through chemical modification of the self-assembling nanowire with functional ligands. (D) Functionalization of nanowires through hydrophobic interaction |
| |
功能配体沿纳米线轴向排列后,通常会表现出与其在宏观材料中不同的物理、化学性质。同时,这种一维的功能配体排布方式也提供了特殊的空间效应。因此,生物纳米线被广泛应用于生物催化、生物传感、细胞定向培养以及指导其他材料纳米线合成等领域。
1.3.1 催化纳米线自组装生物纳米线,其表面分子排布整齐有序,且具有明确的分子取向。通过理性设计和遗传修饰,可以高密度、阵列化地展示酶分子,获得具有催化能力的纳米线。这种酶分子固定的方法能够大幅度降低修饰过程中所带来的功能损伤,甚至能够提高酶分子的活性。早在2000年,Baxa等首先利用酵母朊蛋白构建了多种催化纳米线,并测定了酶活,用来研究侧链基团对酵母朊蛋白自组装的影响[7]。而后,中国科学院生物物理研究所的Zhou等利用酵母Ure2蛋白融合展示了碱性磷酸酶 (Alkaline phosphatase,AP),并借助微流控技术,制备了一种由酶纳米线组成的囊泡状催化凝胶[8]。吉林大学的Hou等在烟草花叶病毒 (Tobacco mosaic virus,TMV) 衣壳蛋白上引入谷胱甘肽过氧化物酶 (Glutathione peroxidase,GPx) 的活性位点,通过TMV衣壳蛋白自组装获得了GPx催化纳米线,这种酶分子的固定方法大幅提高了催化活性[9]。在纳米线中引入多个功能相关的酶,可以在体外或体内模拟一些成束状的天然多酶催化体系。该课题组的后续工作在热稳定蛋白SP1蛋白纳米线上同时引入超氧化物歧化酶 (Superoxide dismutase,SOD) 以及GPx酶活位点,制备了有抗氧化性质的生物纳米线 (如图 2A)[10]。Kim等则在纳米线上引入多酶体系来模拟光合作用,他们在苯丙氨酸二肽纳米线引入THPP (Tetra (p-hydroxyphe-nyl) porphyrin) 来实现光收集和酶反应,模拟光合作用中光系统Ⅰ的作用[11]。
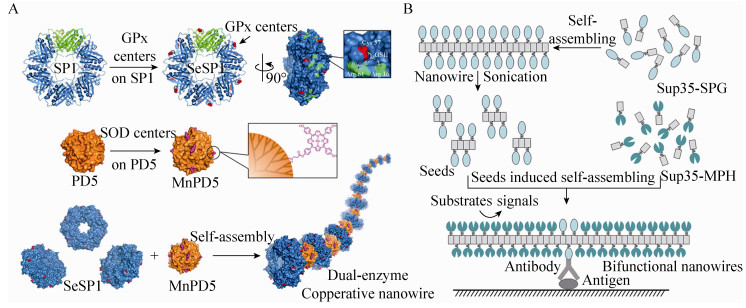
|
| 图 2 生物纳米线用于生物催化和生物传感 (A:多酶催化纳米线,摘自文献[10]);B:“种子诱导”的多功能纳米线用于超灵敏免疫分析,摘自文献[14]) Figure 2 Biological nanowires for bio-catalysis and bio-sensing. (A) Multi-enzyme-based catalytic nanowire (adapted from Ref. [10]). (B) Seed-induced multifunctional nanowire for ultrasensitive immunoassay (adapted from Ref. [14]) |
| |
生物纳米线本身由生物分子组成,很容易引入诸如具有特异性结合能力或者信号产生能力 (如荧光和酶分子等) 的功能配体,两种功能的组合可用于对目标分子的识别和信号输出。由于生物纳米线具有大的比表面积,可展示大量的功能配体,体外操控自组装过程,可以实现高信号-结合分子比的功能配体展示,从而获得一维的信号放大纳米器件。这种特性使生物纳米线在生物传感领域受到广泛关注。
中国科学院武汉病毒研究所的Men等利用酵母朊蛋白Sup35天然组装中的成种子事件,建立了一种名为“种子诱导”的多功能蛋白纳米线体外可控自组装制备方法,并获得了一系列由少量的特异性结合分子与大量信号分子组成的强信号扩增的双功能纳米线,用于多种形式的危险病原免疫分析,大幅提高了检测灵敏度 (图 2B) [12-14]。在该方法的基础上,将一种对甲基对硫磷敏感的分子传感器展示在纳米线表面,使其灵敏度提高了10 000倍[15]。
而Sasso等的工作则体现了生物纳米线用于生物传感的简便性,他们通过亲和素-生物素相互作用,在乳清蛋白纳米线上展示葡萄糖氧化酶 (Glucose oxidase,GOx),同时利用蛋白表面的巯基修饰纳米金颗粒,实现了灵敏的葡萄糖电化学检测[16]。Adler-Abramovich等则利用气相沉积法使多肽纳米线在基底上自组装,形成由纳米线结构组成的三维“纳米森林”,这种纳米线阵列可以用于开发高比表面积的电极材料,高疏水自洁表面和微流控芯片等[17]。
1.3.3 无机纳米线/纳米导线合成模板与电子在传统的宏观材料中会形成连续的能级或能带不同,纳米线中的电子被横向量子限制,具有特殊的能量水平和很多特殊的性质,因而受到人们广泛关注。生物纳米线可以非常容易地与金属结合或反应,在其表面形成连续的金属线状纳米结构,可用来制备纳米导线。
2002年,特拉维夫大学的Reches和Gazit巧妙地利用苯丙氨酸二肽纳米线的结构制备获得了形貌均一的银纳米线[18]。随后,Scheibel等通过在酵母朊蛋白纳米线羧基末端修饰半胱氨酸来结合金纳米颗粒 (Gold nanoparticle,AuNP),最终形成具有良好电学性质的导电纳米线 (图 3A)[19]。而Tan等则对天然导电蛋白纳米线进行了研究,他们将产电微生物硫还原地杆菌Geobacter sulfurreducens导电菌毛的组分PiLA蛋白羧基端的苯丙氨酸和酪氨酸替代为色氨酸,组装成的纳米线导电性能相比于野生型提高了2 000倍[20]。这些工作展现了生物纳米线作为纳米导线的优势和应用潜力。
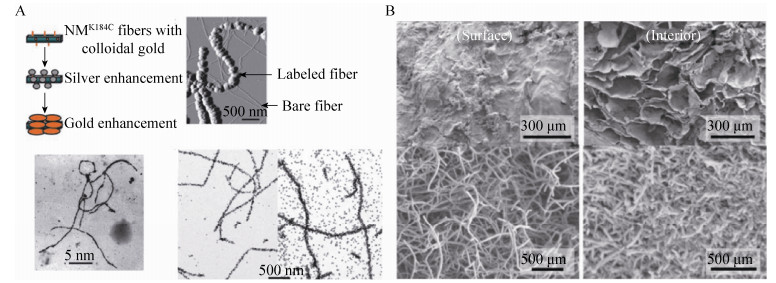
|
| 图 3 生物纳米线用于合成无机纳米线和细胞培养骨架材料 (A:蛋白纳米线为模板构建纳米导线,摘自文献[19];B:生物纳米线用于骨组织再生,摘自文献[25]) Figure 3 Biological nanowires for inorganic nanowire synthesis and cell culture scaffolds. (A) Construction of conducting nanowires using protein nanowires as templates (adapted from Ref. [19]). (B) Biological nanowire-based bone regeneration (adapted from Ref. [25]) |
| |
生物纳米线具有良好的生物相容性,对其表面进行细胞粘附分子或细胞因子的修饰后,细胞能够沿着纳米线的轴向进行定向生长和分化。而在特定部位修饰不同的诱导分子,可空间选择性地诱导细胞定向生长和分化,最终形成有功能的再生组织的生物骨架。因此,生物纳米线在3D细胞培养、组织模拟和再生等方面也有独特的研究价值。
2008年,Gras等利用细胞粘附性RGD (Arg-Gly-Asp) 短肽序列,将其与自组装结构域融合在一起,形成了具有细胞粘附性的纳米线细胞培养支架,实现了细胞粘附和定向生长[21]。Horii等通过对蛋白纳米线进行修饰,制备了可诱导细胞分化的组织培养支架。他们使用RADA16-1来组装形成支架,并通过在肽段上融合成骨因子、细胞粘附肽以及细胞粘附肽结合序列,在提供细胞粘附性能的同时,可诱导细胞分化[22-23]。Shah等则利用自组装两亲性肽,整合羟基磷灰石、细胞粘附肽和转化生长因子 (Transforming growth factor,TGF),制备了可诱导软骨再生的纳米纤维,并在随后工作中通过引入骨形态发生蛋白 (Bone morphogenetic protein,BMP),利用胶原蛋白制备了细胞支架 (图 3B),实现了类似细胞间质的多孔结构,通过在支架中加入生长因子,可用于骨组织的粘附生长、诱导分化及再生[24-25]。
综上,基于生物纳米线的一维纳米生物结构与器件,展现了非常优异的性质,如均一性好、易功能化、生物相容性和可操控性等,在纳米催化、生物传感、一维无机纳米材料制备及细胞培养骨架等方面具有广泛的应用前景和潜在价值。然而,在生物纳米线自组装过程控制、纳米线长度控制和精确空间特异性修饰上仍然存在很多挑战。
2 基于细菌S-层蛋白的二维生物纳米结构与器件 2.1 S-层 (Surface-layer)S-层是广泛存在于古菌和细菌菌体表面,具有规则晶体结构的单分子层。S-层与位于其下方的细胞膜或者细胞壁以非共价形式连接,完整地包裹着菌体,构成了生物体与外界环境之间一道天然屏障。大部分S-层由单一蛋白质组成,形成P1、P2、P3、P4和P6多种结构 (亚结构单元数目为1、2、3、4、6),其亚单位的排列可呈现斜形 (P1、P2)、正方形 (P4) 和六边形 (P3、P6) 对称。细菌的S-层厚度约为5-20 nm,各形态单位的中心间距为3-35 nm,占据70% S-层表面的孔洞直径为2-8 nm[26-27]。在具有S层的生物体中,被用于合成S-层的蛋白通常占细胞总蛋白的10%-20%。对于一个中等大小的杆状细菌而言,其完整的S-层需要5×105个单体组成[28]。在代时约为20-30 min的细菌生长过程中,S-层的形成体现了完美的超分子结构组装的动力学过程。
2.2 细菌S-层的体外合成及其应用在过去的30年里,S-层在结构、化学、遗传、形态发生和功能上蕴含的丰富信息充分体现了其潜在的应用价值。重要的是,不管是分离自菌体表面还是体外重组表达的S-层蛋白都能够在悬浮液、固相支持物、脂质膜等多种界面或者表面上重新自组装成与天然结构相同或者相似的二维纳米晶格结构[29-33]。这种体外自组装性质奠定了细菌S-层在纳米技术和仿生学领域的应用基础,也为二维纳米生物器件的开发提供了无限灵感。目前,已有应用大致如下。
2.2.1 用作超滤膜和分子筛S-层是由单一蛋白组装而成的规则、有序的二维晶格结构,其表面具有相同大小和形态的孔洞,每个分子单位小到亚纳米级。利用此特性,研究者将S-层通过戊二醛固定、在硼氢化钠的条件下降压,制备了均匀孔径、多种规格的超滤膜,可用于筛选不同尺寸的纳米颗粒[34-36]。
2.2.2 结合功能分子并用作固定化分子的支持结构在生物传感、分子电子学、非线性光学等诸多纳米技术领域中,实现功能分子的定向固定至关重要。S-层晶格和表面孔洞规则、有序、高密度的排列多种官能基团 (羧基、氨基和羟基),其中每平方微米的羧基基团达1.6×106之多。因此,S-层在形成单分子层二维晶格结构的同时,也可通过共价键/非共价键固定功能分子。对于共价键连接而言,主要利用S-层羧基与功能分子的氨基通过化学交联来实现,非共价键连接则主要依赖于电荷之间的相互作用。固定后的复合物不仅具有功能分子的活性,而且依然能在多种固相支持物表面进行重结晶,目前为止,酶、抗体、抗原等多种功能分子及细胞已成功定向固定于S-层表面,并作为高灵敏传感器件用于血糖等分析物的检测[37-39]。
2.2.3 稳定脂膜或者脂质体S-层蛋白可在人工脂膜如:朗缪尔单层脂膜 (Langmuir lipid monolayers) 和平面脂膜 (Planar lipid membranes)、乳化小体和脂质体等表面自组装成S-层晶格结构[40]。S-层可通过非共价键与脂分子结合,长时间保持各种脂膜、脂质体的稳定性,同时不改变其他特性[29]。用S层修饰的脂膜包被金电极,一周以后仍然性能优良[34]。目前,尽管固体支持的功能化脂膜已运用于新一代高度灵敏、特异的生物传感器,然而脂膜在操作及存储时依然极易受到污染与损坏,被称为“药物小车”的脂质体在包装药物时也因此频发渗漏现象。由此可见,S-层稳定脂膜、脂质体的特性对药物靶向输送、基因治疗、诊断试剂和疫苗的开发等均具有重要意义。
2.2.4 用于合成具有超晶格结构的金属纳米粒子通过对细菌在自然环境中矿化的研究,研究者发现当S-层置于含有金属离子的溶液时,在还原剂的作用下,金属离子可被还原并沉淀在S-层表面的孔洞中。由此形成的金属纳米粒子结构取决于S-层自身的空间晶格及其对称类型。因此,以S-层作为模板,可以合成广范围粒径 (直径3-15 nm)、不同粒子间距 (大于30 nm) 以及多种对称类型 (六边形、正方形等) 的超晶格金属纳米粒子。利用该策略,研究者已经成功制备CdS、Au、Pt、Pd等高质量纳米粒子[41-44]。与理化方法相比,S-层为新型纳米制备和加工提供了一条更加温和、易行的重要路径。
2.2.5 通过基因改造构建多功能S-层纳米器件当今,生物大分子的自组装性质已广泛应用于多个领域。S-层蛋白结构与功能的研究表明,将S-层蛋白基因与外源片段重组表达后,其融合蛋白仍然具有自组装成单分子晶格结构的能力。因此,为了获取更多理想的生物纳米材料,可以通过基因操纵改变S-层的自然属性来获得更多功能的S-层。现在已有嗜热芽孢杆菌S层蛋白SbsB与链霉亲和素、SgsE与葡萄糖-1-磷酸胸苷酰基转移酶 (Glucose-1-phosphate thymidylyltransferase,RmlA) 融合表达并体外自组装人工S-层的报道[45-46]。利用球形芽孢杆菌S-层蛋白SbpA,研究者们也成功构建了分别带有绿色荧光蛋白、骆驼抗体、IgG结合结构域的S-层[47-49]。遗憾的是,这些S-层纳米材料均未实现应用。
2.3 炭疽芽孢杆菌S-层蛋白与纳米生物传感目前已经证实,自然界有400多种细菌和古菌具有S-层结构。由于S-层蛋白的基因多样性,不同来源的S-层晶格结构和生物学特性千差万别。当今针对S-层的体外自组装研究仅围绕少数细菌展开,主要以嗜热芽孢杆菌、球形芽孢杆菌为主。我们团队在从事炭疽芽孢杆菌侦检研究时发现,炭疽芽孢杆菌S-层蛋白EA1 (非毒力蛋白) 作为炭疽芽孢杆菌S-层主要蛋白广泛存在于炭疽芽孢杆菌营养体及其孢子表面,是炭疽芽孢杆菌潜在的蛋白质标志物[50]。除此之外,其他研究者也已证实,该蛋白作为炭疽芽孢杆菌主要抗原,可诱发机体血清学反应,产生大量特异性抗体,这些抗体因此可以作为炭疽病血清学诊断的依据[51-52]。鉴于以上特征,我们团队在深入研究该蛋白体外自组装性质的同时,构筑了一种双功能二维纳米酶阵列[53]。该阵列呈现经典S-层纳米膜晶格结构,即:P1对称,晶格参数为a=73 Å,b=83 Å, γ=112°,孔洞直径约2-3 nm (图 4)。基于甲基对硫磷水解酶 (Methyl parathion hydrolase,MPH) 与S-层蛋白的融合及共组装,S-层表面载荷高密度酶分子,进而构建成既能稳定、高效降解有机磷农药,又能通过酶促放大反应高灵敏识别炭疽血清抗体的双功能生物传感元件。该研究不仅提供了一种新颖的纳米生物传感模式,同时为利用细菌S-层发展多功能纳米生物器件提供了新思路,被Small杂志评为“very important and very urgent paper”。
生物体中存在种类繁多的蛋白笼形结构。它们是由一种或几种蛋白质亚基自组装形成的空心笼状结构,一般具有正四面体、正八面体、正二十面体等对称性。蛋白笼形结构因其适当的纳米尺度 (10-200 nm)、高度均质、易于通过生物合成途径规模化制备、易于化学和基因工程修饰、生物相容性好、生物可降解、内腔和外表面均可利用、组装-解聚状态转换可人为调控等特性,已成为一类重要的生物纳米元件,可用于构建多功能纳米结构与器件,并成功用于肿瘤热疗、生物成像、生物传感、药物递送、组织工程、催化和电池等领域[54]。
常见的蛋白笼形结构包括病毒纳米颗粒 (Virus-based nanoparticle,VNP)、铁蛋白 (Ferritin)、源自饥饿细胞的DNA结合蛋白 (DNA-binding proteins from starve cells,Dps)、热休克蛋白 (Heat shock proteins,Hsp) 等 (示例见图 5)。VNP由一种或几种病毒衣壳蛋白自组装形成,不含病毒核酸、不能自主复制,因而无感染性。VNP通常具有与天然病毒衣壳相似的结构,大小在几十到几百纳米,具有正二十面体对称性[55-57]。很多病毒的衣壳蛋白可自组装形成VNP,例如,植物病毒:雀麦花叶病毒 (Brome mosaic virus,BMV)、豇豆褪绿斑驳病毒 (Cowpea chlorotic mottle virus,CCMV)、豇豆花叶病毒 (Cowpea mosaic virus,CPMV)、红三叶草坏死花叶病毒 (Red clover necrotic mosaic virus,RCNMV)、芜菁黄花叶病毒 (Turnip yellow mosaic virus,TYMV);动物病毒:猴病毒40 (Simian virus 40,SV40)、人乳头瘤病毒 (Human papilloma virus,HPV)、乙肝病毒 (Hepatitis B virus,HBV);噬菌体:P22、MS2、Qβ等[58]。铁蛋白是由24个相同或同源的亚基自组装形成的正八面体对称的蛋白笼形结构,外径约12 nm,内径约8 nm [59]。Dps属于铁蛋白超家族,又称为迷你铁蛋白,具有与铁蛋白类似的正八面体对称结构,不同的是它们由12个单体自组装而成,外径约9 nm,内径约4.5 nm[60]。Hsp是一类广泛存在于各种细胞中的热应急蛋白,是细胞在应激源 (尤其是环境高温) 诱导下产生的,例如,来自詹氏甲烷球菌Methanococcus jannaschii的小分子Hsp (Mj Hsp16.5) 是由24个相同亚基组装而成的正八面体对称多窗、空心蛋白笼形结构,外径12 nm,内径6.5 nm,其上有8个直径3 nm的三角形窗口和6个直径1.7 nm的方形窗口[61]。
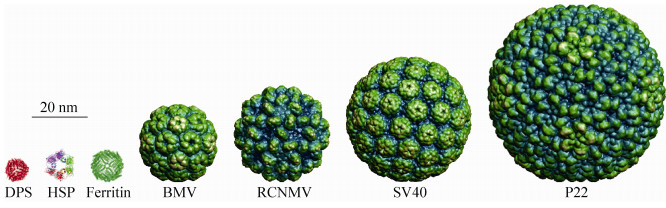
|
| 图 5 蛋白笼形结构举例 Figure 5 Examples of caged protein nanostructures |
| |
由于具有明确的结构信息,蛋白笼形结构通常作为构建多功能纳米结构的模板。其内腔和外表面均可用来装载功能元件,而同时利用内腔和外表面,则能获得更加复杂、元件间互相协调的多功能杂化纳米结构[62]。在蛋白笼形结构上装载功能元件,可采用如下几种途径:1) 利用蛋白笼上的亲和基团 (可通过基因工程或化学修饰的手段插入) 使原料或反应试剂在兴趣部位聚集,原位合成相关材料/元件;2) 通过共价或非共价作用,将功能元件与蛋白笼形结构的内壁或外表面相连;3) 通过控制蛋白笼的“解聚-组装”过程,将功能元件包装在蛋白笼的内腔。
1998年,Douglas等利用CCMV VNP pH依赖的闸门机制,装载前体物质,在VNP内部矿化获得了仲钨酸盐和十钒酸盐纳米颗粒,开创了用蛋白笼形结构限制性合成无机纳米材料的方法[63]。随后多种无机纳米材料均在蛋白纳米笼中成功合成,如β-TiO2、Fe2O3、CdS、CuS、Au等[64-66]。同时,包装预先合成的纳米颗粒是在蛋白笼形结构内腔装载纳米材料的另一类方法,在多种病毒的VNP自组装体系上得到了实现,如BMV、CCMV、alphavirus、RCNMV、MS2和SV40等;被包装的纳米材料包括不同粒径和表面修饰的AuNP、CdSe量子点 (Quantum dot,QD)、Fe3O4、CoFe2O4等[56, 67-76]。自2005年以来,本研究团队发展了SV40 VNP (由SV40主要衣壳蛋白VP1五聚体构成) 自组装体系,开展了一系列包装纳米材料的研究。SV40天然衣壳为直径45 nm左右T=7的正二十面体,但在有QD存在时倾向于形成T=1的正二十面体VNP[57, 77-78]。SV40 VNP可以包装多种不同表面修饰的CdSe@ZnS QD (巯基丙酸、DNA、带甲氧基末端的PEG、带氨基末端的PEG)[79]、Ag2S QD[80-81]、AuNP[82]。我们还发现QD对VNP组装有诱导作用[83],且VP1第9和104位半胱氨酸对稳定VNP-NP杂合结构起关键作用。除了包装纳米材料,外源蛋白质也可以通过理性设计包装入蛋白笼形结构,如荧光蛋白、AP等[84-85]。
类似的,在蛋白笼形结构的外表面,也可以进行纳米材料的可控合成和预先合成的纳米材料的组装。如,Evans团队在CPMV VNP的外表面成功地矿化了Co、Ni、Fe、Pt、Co-Pt和Ni-Fe等多种纳米材料[86-87]。再如,Johnson和Finn等在CPMV表面有序排布了AuNP,提出了把VNP作为可寻址的纳米材料有序组装模板的概念[88-91]。
同时利用蛋白笼形结构的内腔和外表面,可以构建更复杂的纳米结构,为纳米尺度的功能耦合提供了更大的空间。2011年起,本团队报道了一系列以SV40 VNP为模板、协同利用其内外空间指导纳米粒子有序组装的研究,通过基因工程和化学修饰理性调节蛋白-纳米粒子界面作用,实现了粒子组成、数目、间距等参数的精确调控,为纳米光子学研究提供了重要的实体模型 (图 6)[78, 81, 92]。2015年,Zhou等利用P22 VNP构建了一种整合CdS QD与AuNP的等离子体光催化纳米材料[93]。

|
| 图 6 以VNP为模板、自组装构建杂合纳米结构 (通过调节蛋白-无机NP间的界面相互作用,对杂合组装体的结构参数进行调控) Figure 6 VNP-templated fabrication of hybrid nanoarchitechtures through self-assembly. The structural parameters can be controlled by tuning the interfacial interactions between protein and inorganic NPs |
| |
从较为传统的靶向递送到前沿的纳米光子学研究,蛋白笼形结构在各个领域均受到了特别关注,或用于基础问题研究,或用于纳米生物技术创新研发。
3.3.1 生物成像与传感蛋白笼形结构与荧光探针共组装可用于发展新型荧光成像策略。2009年,本团队报道了通过在VNP中包装可见荧光QD进行活细胞中动态监测SV40 VNP侵染行为的研究,发现QD-VNP可以模拟SV40侵染的早期步骤。这种包装策略,从根本上避免了QD对VNP-宿主细胞相互作用的干扰 (图 7A)[77]。2015年,通过在SV40 VNP中包装发射近红外二区 (The second near-infrared window,NIR-Ⅱ) 荧光的Ag2S QD,借助该QD NIR-Ⅱ成像穿透深、时空分辨率高的优势,首次实现了蛋白笼形结构活体行为的实时动态NIR-Ⅱ荧光成像 (图 7B)[80]。最近,我们构建了“荧光-靶向-药物”的多功能VNP纳米器件,在小鼠活体内实现了动脉粥样斑块早、中、晚不同时期的荧光成像和药物靶向运送 (图 7C)[94]。2013年,王汉中等报道了一种对包膜病毒进行荧光标记的方法,通过在QD上修饰一段与HIV假病毒基因组RNA互补的序列,在细胞内进行假病毒包装时,把QD包装在病毒衣壳内部,追踪了带有VSV-G包膜,HIV衣壳的包膜假病毒的细胞侵染行为[95]。另外,在CPMV VNP上高密度的装载有机荧光分子[96]及在BMV VNP内腔包装近红外荧光染料[97]也被用于活体荧光成像。
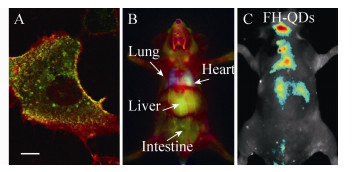
|
| 图 7 SV40 VNP包装QD用于生物成像与传感 (A:活细胞“侵染”行为示踪,摘自文献[77];B:活体动态分布实时NIR-Ⅱ成像,摘自文献[80];C:“荧光-靶向-药物”三功能VNP纳米器件用于动脉粥样硬化的检测和靶向药物递送,摘自文献[94]) Figure 7 QD encapsulation by SV40 VNP for bioimaging and biosensing. (A) Tracking of viral behaviors in living cells (adapted from Ref. [77]). (B) Real-time imaging of dynamic distribution of protein cages in vivo (adapted from Ref. [80]). (C) Fluorescence-targeting-drug tri-functional VNP nanodevices for detection of atherosclerosis and targeted drug delivery (adapted from Ref. [94]) |
| |
基于Gd3+的核磁共振成像 (Magnetic resonance imaging,MRI) 造影剂近年来吸引了大量的研究兴趣。多种多样的大分子 (聚合物、树枝状分子、脂质体等) 被用来装载Gd3+,期望在单个分子中装载尽可能多的Gd3+,增加成像的弛豫率[98]。蛋白笼形结构由于其可控的自组装、庞大的载物内腔、修饰位点空间可寻址性等,成为装载Gd3+的理想载体。2005年,Douglas等利用CCMV VNP内腔装载Gd3+,利用CCMV VNP内腔固有的Cd2+结合位点捕获Gd3+[99]。后来,他们又利用P22的“威浮球” (Wiffleball,WB) 颗粒,装载Gd3+。P22 WB VNP上有10 nm左右的孔,有利于VNP内外进行物质交换,且整个颗粒直径达64 nm,每个P22 VNP内腔可装载高达9 100个Gd3+,在298 K 0.65 T下,弛豫率达41 300 (mmol/L) -1s-1[100]。另外,他们在P22 VNP内腔引发原子转移自由基聚合反应 (Atom transfer radical polymerization,ATRP),限制性的合成聚合物,并在聚合物上高密度装载Gd3+,用于血管炎症的成像[101-102]。
3.3.2 生物活性分子及纳米材料的递送蛋白笼形结构被广泛用作疫苗、核酸、多肽、小分子药物等生物活性分子的递送载体。如HPV主要衣壳蛋白VP1自组装形成的病毒样颗粒可作为HPV的疫苗[103]。Lim等在木槿褪绿环斑病毒 (Hibiscus chlorotic ringspot virus,HCRSV) VNP内腔同时封装多元酸和抗癌药物阿霉素,增加阿霉素的装载效率,在VNP外表面结合叶酸,特异性靶向肿瘤细胞,大大增加了卵巢癌细胞对阿霉素的摄取能力,增加了阿霉素对癌细胞的杀伤能力[104]。Chen等用SV40 VNP包装质粒作为基因治疗的载体,表现出了很高的转染效率[105]。Curiel和Everts等用腺病毒载体递送AuNP进入细胞,通过共价键或范德华力在腺病毒载体上装载AuNP,保持腺病毒载体的感染及靶向肿瘤相关抗原的能力,用于肿瘤部位的热疗[106-107]。生物活性分子递送是蛋白笼形结构的重要应用领域,颇受关注,由于篇幅限制,更详细的介绍可参考文献[108]。
3.3.3 纳米反应容器将酶分子装入蛋白纳米笼,可以为其提供一个有限的反应空间,控制底物与产物的进出,从而实现对其催化反应的调控。Cornelissen等在CCMV VNP内腔分别包装单个辣根过氧化物酶及精确控制数量的脂肪酶B,显示被包装后酶活性显著增强,且跟每个VNP中包装的酶分子数量关系不大[109-110]。Douglas等在P22支架蛋白上融合表达3种催化相关反应的酶,全部包裹在P22 VNP内腔中,在蛋白笼形结构中建立了一个级联反应代谢反应器[111]。实际上,CO2固定相关的羧酶体 (Carboxysome) 就是生物体中天然存在的一种纳米反应器,其对CO2和O2迥异的选择通透性对其高效的固碳功能至关重要。
3.3.4 纳米光子学许多纳米材料拥有独特的光学性质,当把它们可控地装配到一起时,常常由于相互作用会产生全新的性质或功能。蛋白笼形结构由于合适的介观尺度、结构可寻址等特点,是一类理想的定向组装光学纳米结构的模板。2006年,Wang和Charbonniere等用TYMV VNP建立起一种用于时间分辨免疫荧光分析的生物纳米颗粒原型,采用荧光共振能量转移 (Fluorescence resonance energy transfer,FRET) 原理,可发展基于多价修饰蛋白笼形结构的传感器[112]。2011年,本团队利用一系列SV40 VNP指导的QD-AuNP杂化结构模型,定量研究了QD-Au间的能量转移[78]。实验数据与理论预测数据一致显示,SV40 VNP表面连接的4 nm左右的小AuNP之间表面等离子体共振 (Surface plasmon resonance,SPR) 耦合效应微弱,而AuNP对QD荧光具有强烈的累积淬灭效应[78]。2013年,Francis等在MS2 VNP内部包装一个AuNP,外表面连接荧光染料,通过使用不同长度的DNA调节染料分子与蛋白笼内腔AuNP之间的距离,发现了距离依赖的荧光增强效应[112]。
4 结论与展望基于生物大分子的纳米生物结构与器件,一个重要特征是其自组装可控,也是其独特优势,主要体现在两个层面:一是纳米结构基元与组装体之间的状态转换可控,这可以通过改变溶液条件或对结构基元之间的界面作用进行理性设计实现。二是生物大分子组装体具有明确的几何学结构,以之为模板或支架,与其他纳米材料共组装,可实现对复合纳米结构参数的控制。这两个层面的可控性,为纳米生物结构与器件的可重复制备带来了方便,更为功能的有机整合提供了很大的空间。
上述纳米生物结构与器件源于生物体系合成,具有一系列优异性质,在诸多领域的成功应用凸显了其重要的研究价值和应用潜力。发展自组装生物纳米结构与器件,涉及生物、物理、化学、纳米技术和信息技术等多学科交叉,合成生物学的研究思路,将为自组装生物纳米结构与器件的设计、结构控制和功能化等研究提供更加广阔的空间。
| [1] | Vo-Dinh T. Protein Nanotechnology: Protocols, Instrumentation, and Applications. New York: Humana Press, 2013. |
| [2] | Luo Q, Hou CX, Bai YS, et al. Protein assembly: versatile approaches to construct highly ordered nanostructures. Chem Rev, 2016, 116(22): 13571–13632. DOI: 10.1021/acs.chemrev.6b00228 |
| [3] | Ekiz MS, Cinar G, Khalily MA, et al. Self-assembled peptide nanostructures for functional materials. Nanotechnology, 2016, 27(40): 402002. DOI: 10.1088/0957-4484/27/40/402002 |
| [4] | Pandya MJ, Spooner GM, Sunde M, et al. Sticky-end assembly of a designed peptide fiber provides insight into protein fibrillogenesis. Biochemistry, 2000, 39(30): 8728–8734. DOI: 10.1021/bi000246g |
| [5] | Cui HG, Webber MJ, Stupp SI. Self-assembly of peptide amphiphiles: from molecules to nanostructures to biomaterials. Biopolymers, 2010, 94(1): 1–18. DOI: 10.1002/bip.21328 |
| [6] | Woolfson DN, Mahmoud ZN. More than just bare scaffolds: towards multi-component and decorated fibrous biomaterials. Chem Soc Rev, 2010, 39(9): 3464–3479. DOI: 10.1039/c0cs00032a |
| [7] | Baxa U, Speransky V, Steven AC, et al. Mechanism of inactivation on prion conversion of the Saccharomyces cerevisiae Ure2 protein. Proc Natl Acad Sci USA, 2002, 99(8): 5253–5260. DOI: 10.1073/pnas.082097899 |
| [8] | Zhou XM, Shimanovich U, Herling TW, et al. Enzymatically active microgels from self-assembling protein nanofibrils for microflow chemistry. ACS Nano, 2015, 9(6): 5772–5781. DOI: 10.1021/acsnano.5b00061 |
| [9] | Hou CX, Luo Q, Liu JL, et al. Construction of gpx active centers on natural protein nanodisk/nanotube: a new way to develop artificial nanoenzyme. ACS Nano, 2012, 6(10): 8692–8701. DOI: 10.1021/nn302270b |
| [10] | Sun HC, Miao L, Li JX, et al. Self-assembly of cricoid proteins induced by "soft nanoparticles": an approach to design multienzyme-cooperative antioxidative systems. ACS Nano, 2015, 9(5): 5461–5469. DOI: 10.1021/acsnano.5b01311 |
| [11] | Kim JH, Nam DH, Park CB. Nanobiocatalytic assemblies for artificial photosynthesis. Curr Opin Biotechnol, 2014, 28: 1–9. |
| [12] | Men D, Zhang ZP, Guo YC, et al. An auto-biotinylated bifunctional protein nanowire for ultra-sensitive molecular biosensing. Biosens Bioelectron, 2010, 26(4): 1137–1141. DOI: 10.1016/j.bios.2010.07.103 |
| [13] | Men D, Zhou J, Li W, et al. Fluorescent protein nanowire-mediated protein microarrays for multiplexed and highly sensitive pathogen detection. ACS Appl Mater Interfaces, 2016, 8(27): 17472–17477. DOI: 10.1021/acsami.6b04786 |
| [14] | Men D, Guo YC, Zhang ZP, et al. Seeding-induced self-assembling protein nanowires dramatically increase the sensitivity of immunoassays. Nano Lett, 2009, 9(6): 2246–2250. DOI: 10.1021/nl9003464 |
| [15] | Leng Y, Wei HP, Zhang ZP, et al. Integration of a fluorescent molecular biosensor into self-assembled protein nanowires: a large sensitivity enhancement. Angew Chem Int Ed, 2010, 49(40): 7243–7246. DOI: 10.1002/anie.v49:40 |
| [16] | Sasso L, Suei S, Domigan L, et al. Versatile multi-functionalization of protein nanofibrils for biosensor applications. Nanoscale, 2014, 6(3): 1629–1634. DOI: 10.1039/C3NR05752F |
| [17] | Adler-Abramovich L, Aronov D, Beker P, et al. Self-assembled arrays of peptide nanotubes by vapour deposition. Nat Nanotechnol, 2009, 4(12): 849–854. DOI: 10.1038/nnano.2009.298 |
| [18] | Reches M, Gazit E. Casting metal nanowires within discrete self-assembled peptide nanotubes. Science, 2003, 300(5619): 625–627. DOI: 10.1126/science.1082387 |
| [19] | Scheibel T, Parthasarathy R, Sawicki G, et al. Conducting nanowires built by controlled self-assembly of amyloid fibers and selective metal deposition. Proc Natl Acad Sci USA, 2003, 100(8): 4527–4532. DOI: 10.1073/pnas.0431081100 |
| [20] | Tan Y, Adhikari RY, Malvankar NS, et al. Synthetic biological protein nanowires with high conductivity. Small, 2016, 12(33): 4481–4485. DOI: 10.1002/smll.v12.33 |
| [21] | Gras SL, Tickler AK, Squires AM, et al. Functionalised amyloid fibrils for roles in cell adhesion. Biomaterials, 2008, 29(11): 1553–1562. DOI: 10.1016/j.biomaterials.2007.11.028 |
| [22] | Horii A, Wang XM, Gelain F, et al. Biological designer self-assembling peptide nanofiber scaffolds significantly enhance osteoblast proliferation, differentiation and 3-D migration. PLoS ONE, 2007, 2(2): e190. DOI: 10.1371/journal.pone.0000190 |
| [23] | Kumada Y, Zhang SG. Significant type Ⅰ and type Ⅲ collagen production from human periodontal ligament fibroblasts in 3D peptide scaffolds without extra growth factors. PLoS ONE, 2010, 5(4): e10305. DOI: 10.1371/journal.pone.0010305 |
| [24] | Shah RN, Shah NA, Del Rosario Lim MM, et al. Supramolecular design of self-assembling nanofibers for cartilage regeneration. Proc Natl Acad Sci USA, 2010, 107(8): 3293–3298. DOI: 10.1073/pnas.0906501107 |
| [25] | Lee SS, Huang BJ, Kaltz SR, et al. Bone regeneration with low dose BMP-2 amplified by biomimetic supramolecular nanofibers within collagen scaffolds. Biomaterials, 2013, 34(2): 452–459. DOI: 10.1016/j.biomaterials.2012.10.005 |
| [26] | Sleytr UB, Sára M. Bacterial and archaeal S-layer proteins: structure-function relationships and their biotechnological applications. Trends Biotechnol, 1997, 15(1): 20–26. DOI: 10.1016/S0167-7799(96)10063-9 |
| [27] | Sleytr UB, Sára M, Messner P, et al. Two-dimensional protein crystals (S-layers): fundamentals and applications. J Cell Biochem, 1994, 56(2): 171–176. DOI: 10.1002/(ISSN)1097-4644 |
| [28] | Sára M, Sleytr UB. S-layer proteins. J Bacteriol, 2000, 182(4): 859–868. DOI: 10.1128/JB.182.4.859-868.2000 |
| [29] | Ucisik MH, Küpcü S, Debreczeny M, et al. S-layer coated emulsomes as potential nanocarriers. Small, 2013, 9(17): 2895–2904. DOI: 10.1002/smll.v9.17 |
| [30] | Ferner-Ortner-Bleckmann J, Gelbmann N, Tesarz M, et al. Surface-layer lattices as patterning element for multimeric extremozymes. Small, 2013, 9(22): 3887–3894. DOI: 10.1002/smll.v9.22 |
| [31] | Toca-Herrera JL, Krastev R, Bosio V, et al. Recrystallization of bacterial S-layers on flat polyelectrolyte surfaces and hollow polyelectrolyte capsules. Small, 2005, 1(3): 339–348. DOI: 10.1002/smll.v1:3 |
| [32] | Pum D, Sleytr UB. Reassembly of S-layer proteins. Nanotechnology, 2014, 25(31): 312001. DOI: 10.1088/0957-4484/25/31/312001 |
| [33] | Lopez AE, Moreno-Flores S, Pum D, et al. Surface dependence of protein nanocrystal formation. Small, 2010, 6(3): 396–403. DOI: 10.1002/smll.v6:3 |
| [34] | Schuster B, Pum D, Sára M, et al. S-layer ultrafiltration membranes: a new support for stabilizing functionalized lipid membranes. Langmuir, 2001, 17(2): 499–503. DOI: 10.1021/la0008784 |
| [35] | Weigert S, Sára M. Surface modification of an ultrafiltration membrane with crystalline structure and studies on interactions with selected protein molecules. J Membrane Sci, 1995, 106(1/2): 147–159. |
| [36] | Sára M, Sleytr UB. Production and characteristics of ultrafiltration membranes with uniform pores from two-dimensional arrays of proteins. J Membrane Sci, 1987, 33(1): 27–49. DOI: 10.1016/S0376-7388(00)80050-2 |
| [37] | Picher MM, Küpcü S, Huang CJ, et al. Nanobiotechnology advanced antifouling surfaces for the continuous electrochemical monitoring of glucose in whole blood using a lab-on-a-chip. Lab Chip, 2013, 13(9): 1780–1789. DOI: 10.1039/c3lc41308j |
| [38] | Rothbauer M, Küpcü S, Sticker D, et al. Exploitation of S-layer anisotropy: pH-dependent nanolayer orientation for cellular micropatterning. ACS Nano, 2013, 7(9): 8020–8030. DOI: 10.1021/nn403198a |
| [39] | Scheicher SR, Kainz B, Köstler S, et al. 2D crystalline protein layers as immobilization matrices for the development of DNA microarrays. Biosens Bioelectron, 2013, 40(1): 32–37. DOI: 10.1016/j.bios.2012.05.037 |
| [40] | Schuster B, Gufler PC, Pum D, et al. S-layer proteins as supporting scaffoldings for functional lipid membranes. IEEE Trans Nanobioscience, 2004, 3(1): 16–21. DOI: 10.1109/TNB.2004.824267 |
| [41] | Mark SS, Bergkvist M, Yang X, et al. Bionanofabrication of metallic and semiconductor nanoparticle arrays using S-layer protein lattices with different lateral spacings and geometries. Langmuir, 2006, 22(8): 3763–3774. DOI: 10.1021/la053115v |
| [42] | Shenton W, Pum D, Sleytr UB, et al. Synthesis of cadmium sulphide superlattices using self-assembled bacterial S-layers. Nature, 1997, 389(6651): 585–587. DOI: 10.1038/39287 |
| [43] | Tang JL, Badelt-Lichtblau H, Ebner A, et al. Fabrication of highly ordered gold nanoparticle arrays templated by crystalline lattices of bacterial S-layer protein. Chemphyschem, 2008, 9(16): 2317–2320. DOI: 10.1002/cphc.v9:16 |
| [44] | Liu JR, Mao YB, Lan E, et al. Generation of oxide nanopatterns by combining self-assembly of S-layer proteins and area-selective atomic layer deposition. J Am Chem Soc, 2008, 130(50): 16908–16913. DOI: 10.1021/ja803186e |
| [45] | Schäffer C, Novotny R, Küpcü S, et al. Novel biocatalysts based on S-layer self-assembly of Geobacillus stearothermophilus NRS 2004/3a: a nanobiotechnological approach. Small, 2007, 3(9): 1549–1559. DOI: 10.1002/(ISSN)1613-6829 |
| [46] | Moll D, Huber C, Schlegel B, et al. S-layer-streptavidin fusion proteins as template for nanopatterned molecular arrays. Proc Natl Acad Sci USA, 2002, 99(23): 14646–14651. DOI: 10.1073/pnas.232299399 |
| [47] | Pleschberger M, Saerens D, Weigert S, et al. An S-layer heavy chain camel antibody fusion protein for generation of a nanopatterned sensing layer to detect the prostate-specific antigen by surface plasmon resonance technology. Bioconjugate Chem, 2004, 15(3): 664–671. DOI: 10.1021/bc049964w |
| [48] | Ilk N, Küpcü S, Moncayo G, et al. A functional chimaeric S-layer-enhanced green fluorescent protein to follow the uptake of S-layer-coated liposomes into eukaryotic cells. Biochem J, 2004, 379(2): 441–448. DOI: 10.1042/bj20031900 |
| [49] | Völlenkle C, Weigert S, Ilk N, et al. Construction of a functional S-layer fusion protein comprising an immunoglobulin G-binding domain for development of specific adsorbents for extracorporeal blood purification. Appl Environ Microbiol, 2004, 70(3): 1514–1521. DOI: 10.1128/AEM.70.3.1514-1521.2004 |
| [50] | Wang DB, Yang RF, Zhang ZP, et al. Detection of B. anthracis spores and vegetative cells with the same monoclonal antibodies. PLoS ONE, 2009, 4(11): e7810. DOI: 10.1371/journal.pone.0007810 |
| [51] | Makam SS, Kingston JJ, Harischandra MS, et al. Protective antigen and extractable antigen 1 based chimeric protein confers protection against Bacillus anthracis in mouse model. Mol Immunol, 2014, 59(1): 91–99. DOI: 10.1016/j.molimm.2014.01.012 |
| [52] | Shlyakhov E, Shoenfeld Y, Gilburd B, et al. Evaluation of Bacillus anthracis extractable antigen for testing anthrax immunity. Clin Microbiol Infect, 2004, 10(5): 421–424. DOI: 10.1111/j.1469-0691.2004.00852.x |
| [53] | Wang XY, Wang DB, Zhang ZP, et al. A S-layer protein of Bacillus anthracis as a building block for functional protein arrays by in vitro self-assembly. Small, 2015, 11(43): 5826–5832. DOI: 10.1002/smll.201501413 |
| [54] | Flenniken ML, Uchida M, Liepold LO, et al. A library of protein cage architectures as nanomaterials// Manchester M, Steinmetz NF. Viruses and Nanotechnology. Berlin Heidelberg: Springer-Verlag, 2009: 71-93. |
| [55] | Pokorski JK, Steinmetz NF. The art of engineering viral nanoparticles. Mol Pharmaceutics, 2011, 8(1): 29–43. DOI: 10.1021/mp100225y |
| [56] | Sun JC, DuFort C, Daniel MC, et al. Core-controlled polymorphism in virus-like particles. Proc Natl Acad Sci USA, 2007, 104(4): 1354–1359. DOI: 10.1073/pnas.0610542104 |
| [57] | Salunke DM, Caspar DL, Garcea RL. Polymorphism in the assembly of polyomavirus capsid protein VP1. Biophys J, 1989, 56(5): 887–900. DOI: 10.1016/S0006-3495(89)82735-3 |
| [58] | Li F, Wang QB. Fabrication of nanoarchitectures templated by virus-based nanoparticles: Strategies and applications. Small, 2014, 10(2): 230–245. DOI: 10.1002/smll.v10.2 |
| [59] | Arosio P, Levi S. Ferritin, iron homeostasis, and oxidative damage. Free Radic Biol Med, 2002, 33(4): 457–463. DOI: 10.1016/S0891-5849(02)00842-0 |
| [60] | Almirón M, Link AJ, Furlong D, et al. A novel DNA-binding protein with regulatory and protective roles in starved Escherichia coli. Genes Dev, 1992, 6(12b): 2646–2654. DOI: 10.1101/gad.6.12b.2646 |
| [61] | Kim R, Lai LH, Lee HH, et al. On the mechanism of chaperone activity of the small heat-shock protein of Methanococcus jannaschii. Proc Natl Acad Sci USA, 2003, 100(14): 8151–8155. DOI: 10.1073/pnas.1032940100 |
| [62] | Douglas T, Young M. Viruses: making friends with old foes. Science, 2006, 312(5775): 873–875. DOI: 10.1126/science.1123223 |
| [63] | Douglas T, Young M. Host-guest encapsulation of materials by assembled virus protein cages. Nature, 1998, 393(6681): 152–155. DOI: 10.1038/30211 |
| [64] | Klem MT, Young M, Douglas T. Biomimetic synthesis of β-TiO2 inside a viral capsid. J Mater Chem, 2008, 18(32): 3821–3823. DOI: 10.1039/b805778h |
| [65] | Reichhardt C, Uchida M, O'Neil A, et al. Templated assembly of organic-inorganic materials using the core shell structure of the P22 bacteriophage. Chem Commum, 2011, 47(22): 6326–6328. DOI: 10.1039/c1cc11215e |
| [66] | Zhou ZY, Bedwell GJ, Li R, et al. Formation mechanism of chalcogenide nanocrystals confined inside genetically engineered virus-like particles. Sci Rep, 2014, 4: 3832. |
| [67] | Aniagyei SE, Kennedy CJ, Stein B, et al. Synergistic effects of mutations and nanoparticle templating in the self-assembly of cowpea chlorotic mottle virus capsids. Nano Lett, 2009, 9(1): 393–398. DOI: 10.1021/nl8032476 |
| [68] | Goicochea NL, De M, Rotello VM, et al. Core-like particles of an enveloped animal virus can self-assemble efficiently on artificial templates. Nano Lett, 2007, 7(8): 2281–2290. DOI: 10.1021/nl070860e |
| [69] | Dragnea B, Chen C, Kwak ES, et al. Gold nanoparticles as spectroscopic enhancers for in vitro studies on single viruses. J Am Chem Soc, 2003, 125(21): 6374–6375. DOI: 10.1021/ja0343609 |
| [70] | Chen C, Daniel MC, Quinkert ZT, et al. Nanoparticle-templated assembly of viral protein cages. Nano Lett, 2006, 6(4): 611–615. DOI: 10.1021/nl0600878 |
| [71] | Dixit SK, Goicochea NL, Daniel MC, et al. Quantum dot encapsulation in viral capsids. Nano Lett, 2006, 6(9): 1993–1999. DOI: 10.1021/nl061165u |
| [72] | Huang XL, Bronstein LM, Retrum J, et al. Self-assembled virus-like particles with magnetic cores. Nano Lett, 2007, 7(8): 2407–2416. DOI: 10.1021/nl071083l |
| [73] | Daniel MC, Tsvetkova IB, Quinkert ZT, et al. Role of surface charge density in nanoparticle-templated assembly of bromovirus protein cages. ACS Nano, 2010, 4(7): 3853–3860. DOI: 10.1021/nn1005073 |
| [74] | Tsvetkova I, Chen C, Rana S, et al. Pathway switching in templated virus-like particle assembly. Soft Matter, 2012, 8(17): 4571–4577. DOI: 10.1039/c2sm00024e |
| [75] | Loo L, Guenther RH, Basnayake VR, et al. Controlled encapsidation of gold nanoparticles by a viral protein shell. J Am Chem Soc, 2006, 128(14): 4502–4503. DOI: 10.1021/ja057332u |
| [76] | Loo L, Guenther RH, Lommel SA, et al. Encapsidation of nanoparticles by red clover necrotic mosaic virus. J Am Chem Soc, 2007, 129(36): 11111–11117. DOI: 10.1021/ja071896b |
| [77] | Li F, Zhang ZP, Peng J, et al. Imaging viral behavior in mammalian cells with self-assembled capsid-quantum-dot hybrid particles. Small, 2009, 5(6): 718–726. DOI: 10.1002/smll.v5:6 |
| [78] | Li F, Gao D, Zhai XM, et al. Tunable, discrete, three-dimensional hybrid nanoarchitectures. Angew Chem Int Ed, 2011, 50(18): 4202–4205. DOI: 10.1002/anie.v50.18 |
| [79] | Li F, Li K, Cui ZQ, et al. Viral coat proteins as flexible nano-building-blocks for nanoparticle encapsulation. Small, 2010, 6(20): 2301–2308. DOI: 10.1002/smll.v6:20 |
| [80] | Li CY, Li F, Zhang YJ, et al. Real-time monitoring surface chemistry-dependent in vivo behaviors of protein nanocages via encapsulating an NIR-Ag2S quantum dot. ACS Nano, 2015, 9(12): 12255–12263. DOI: 10.1021/acsnano.5b05503 |
| [81] | Li F, Chen HL, Zhang YJ, et al. Three-dimensional gold nanoparticle clusters with tunable cores templated by a viral protein scaffold. Small, 2012, 8(24): 3832–3838. DOI: 10.1002/smll.v8.24 |
| [82] | Wang TJ, Zhang ZP, Gao D, et al. Encapsulation of gold nanoparticles by simian virus 40 capsids. Nanoscale, 2011, 3(10): 4275–4282. DOI: 10.1039/c1nr10568j |
| [83] | Gao D, Zhang ZP, Li F, et al. Quantum dot-induced viral capsid assembling in dissociation buffer. Int J Nanomed, 2013, 8(1): 2119–2128. |
| [84] | Minten IJ, Hendriks LJA, Nolte RJM, et al. Controlled encapsulation of multiple proteins in virus capsids. J Am Chem Soc, 2009, 131(49): 17771–17773. DOI: 10.1021/ja907843s |
| [85] | Glasgow JE, Capehart SL, Francis MB, et al. Osmolyte-mediated encapsulation of proteins inside MS2 viral capsids. ACS Nano, 2012, 6(10): 8658–8664. DOI: 10.1021/nn302183h |
| [86] | Aljabali AA, Barclay JE, Lomonossoff GP, et al. Virus templated metallic nanoparticles. Nanoscale, 2010, 2(12): 2596–2600. DOI: 10.1039/c0nr00525h |
| [87] | Aljabali AAA, Barclay JE, Cespedes O, et al. Charge modified cowpea mosaic virus particles for templated mineralization. Adv Func Mater, 2011, 21(21): 4137–4142. DOI: 10.1002/adfm.v21.21 |
| [88] | Wang Q, Lin TW, Tang L, et al. Icosahedral virus particles as addressable nanoscale building blocks. Angew Chem Int Ed, 2002, 41(3): 459–462. DOI: 10.1002/1521-3773(20020201)41:3<>1.0.CO;2-9 |
| [89] | Blum AS, Soto CM, Wilson CD, et al. Cowpea mosaic virus as a scaffold for 3-D patterning of gold nanoparticles. Nano Lett, 2004, 4(5): 867–870. DOI: 10.1021/nl0497474 |
| [90] | Chatterji A, Ochoa WF, Ueno T, et al. A virus-based nanoblock with tunable electrostatic properties. Nano Lett, 2005, 5(4): 597–602. DOI: 10.1021/nl048007s |
| [91] | Blum AS, Soto CM, Wilson CD, et al. An engineered virus as a scaffold for three-dimensional self-assembly on the nanoscale. Small, 2005, 1(7): 702–706. DOI: 10.1002/(ISSN)1613-6829 |
| [92] | Li F, Chen YH, Chen HL, et al. Monofunctionalization of protein nanocages. J Am Chem Soc, 2011, 133(50): 20040–20043. DOI: 10.1021/ja207276g |
| [93] | Zhou ZY, Bedwell GJ, Li R, et al. P22 virus-like particles constructed Au/CdS plasmonic photocatalytic nanostructures for enhanced photoactivity. Chem Commun, 2015, 51(6): 1062–1065. DOI: 10.1039/C4CC08057B |
| [94] | Sun XX, Li W, Zhang XW, et al. In vivo targeting and imaging of atherosclerosis using multifunctional virus-like particles of simian virus 40. Nano Lett, 2016, 16(10): 6164–6171. DOI: 10.1021/acs.nanolett.6b02386 |
| [95] | Zhang Y, Ke XL, Zheng ZH, et al. Encapsulating quantum dots into enveloped virus in living cells for tracking virus infection. ACS Nano, 2013, 7(5): 3896–3904. DOI: 10.1021/nn305189n |
| [96] | Lewis JD, Destito G, Zijlstra A, et al. Viral nanoparticles as tools for intravital vascular imaging. Nat Med, 2006, 12(3): 354–360. DOI: 10.1038/nm1368 |
| [97] | Gupta S, Chatni MR, Rao ALN, et al. Virus-mimicking nano-constructs as a contrast agent for near infrared photoacoustic imaging. Nanoscale, 2013, 5(5): 1772–1776. DOI: 10.1039/c3nr34124k |
| [98] | Hooker JM, Datta A, Botta M, et al. Magnetic resonance contrast agents from viral capsid shells: a comparison of exterior and interior cargo strategies. Nano Lett, 2007, 7(8): 2207–2210. DOI: 10.1021/nl070512c |
| [99] | Allen M, Bulte JW, Liepold L, et al. Paramagnetic viral nanoparticles as potential high-relaxivity magnetic resonance contrast agents. Magn Reson Med, 2005, 54(4): 807–812. DOI: 10.1002/(ISSN)1522-2594 |
| [100] | Qazi S, Liepold LO, Abedin MJ, et al. P22 viral capsids as nanocomposite high-relaxivity MRI contrast agents. Mol Pharmaceutics, 2013, 10(1): 11–17. DOI: 10.1021/mp300208g |
| [101] | Lucon J, Qazi S, Uchida M, et al. Use of the interior cavity of the P22 capsid for site-specific initiation of atom-transfer radical polymerization with high-density cargo loading. Nat Chem, 2012, 4(10): 781–788. DOI: 10.1038/nchem.1442 |
| [102] | Kosuge H, Uchida M, Lucon J, et al. High-Gd-Payload P22 protein cage nanoparticles for imaging vascular inflammation. J Cardiovasc Magn Reson, 2013, 15(S1): O66. |
| [103] | Paavonen J, Jenkins D, Bosch F, et al. Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women: an interim analysis of a phase Ⅲ double-blind, randomised controlled trial. Lancet, 2007, 369(9580): 2161–2170. DOI: 10.1016/S0140-6736(07)60946-5 |
| [104] | Ren YP, Wong SM, Lim LY. Folic acid-conjugated protein cages of a plant virus: a novel delivery platform for doxorubicin. Bioconjugate Chem, 2007, 18(3): 836–843. DOI: 10.1021/bc060361p |
| [105] | Chen XS, Stehle T, Harrison SC. Interaction of polyomavirus internal protein VP2 with the major capsid protein VP1 and implications for participation of VP2 in viral entry. EMBO J, 1998, 17(12): 3233–3240. DOI: 10.1093/emboj/17.12.3233 |
| [106] | Everts M, Saini V, Leddon JL, et al. Covalently linked au nanoparticles to a viral vector: potential for combined photothermal and gene cancer therapy. Nano Lett, 2006, 6(4): 587–591. DOI: 10.1021/nl0500555 |
| [107] | Saini V, Martyshkin DV, Mirov SB, et al. An adenoviral platform for selective self-assembly and targeted delivery of nanoparticles. Small, 2008, 4(2): 262–269. DOI: 10.1002/(ISSN)1613-6829 |
| [108] | Molino NM, Wang SW. Caged protein nanoparticles for drug delivery. Curr Opin Biotechnol, 2014, 28: 75–82. DOI: 10.1016/j.copbio.2013.12.007 |
| [109] | Comellas-Aragonès M, Engelkamp H, Claessen VI, et al. A virus-based single-enzyme nanoreactor. Nat Nanotechnol, 2007, 2(10): 635–639. DOI: 10.1038/nnano.2007.299 |
| [110] | Minten IJ, Claessen VI, Blank K, et al. Catalytic capsids: the art of confinement. Chem Sci, 2011, 2(2): 358–362. DOI: 10.1039/C0SC00407C |
| [111] | Patterson DP, Schwarz B, Waters RS, et al. Encapsulation of an enzyme cascade within the bacteriophage P22 virus-like particle. ACS Chem Biol, 2014, 9(2): 359–365. DOI: 10.1021/cb4006529 |
| [112] | Capehart SL, Coyle MP, Glasgow JE, et al. Controlled integration of gold nanoparticles and organic fluorophores using synthetically modified MS2 viral capsids. J Am Chem Soc, 2013, 135(8): 3011–3016. DOI: 10.1021/ja3078472 |
 2017, Vol. 33
2017, Vol. 33





