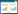中国科学院微生物研究所、中国微生物学会主办
文章信息
- 巩旭, 刘叶, 王毳, 李江华, 康振
- Gong Xu, Liu Ye, Wang Cui, Li Jianghua, Kang Zhen
- 代谢工程改造酿酒酵母合成葡萄糖二酸
- Metabolic engineering of Saccharomyces cerevisiae for production of glucaric acid
- 生物工程学报, 2017, 33(2): 228-236
- Chin J Biotech, 2017, 33(2): 228-236
- 10.13345/j.cjb.160287
-
文章历史
- Received: July 28, 2016
- Accepted: September 13, 2016
2 江南大学 生物工程学院,江苏 无锡 214122
2 School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
葡萄糖二酸(Glucaric acid,GA) 是一种天然有机酸,广泛存在于水果、蔬菜和哺乳动物中,可应用于降低胆固醇[1]、治疗肥胖[2]和癌症[3]等。此外,葡萄糖二酸作为聚合物的合成成分,被大量用于新型羟基化尼龙材料的制造,又因其具备可与金属螯合的特性,葡萄糖二酸催化法为合成染料的生物降解提供了新思路[4-5]。众多附加应用使得葡萄糖二酸在2004年被美国能源部确定为“最具价值的生物炼制产品”[6]。
葡萄糖二酸主要通过化学氧化葡萄糖的方法制备,包括硝酸氧化法及2, 2, 6, 6-四甲基哌啶氧自由基(TEMPO) 氧化法等[7]。但因其存在试剂耗费量大、环境污染等问题,使得化学法应用受到限制。生物法制备葡萄糖二酸因其长足的发展空间,逐渐受到研究者的重视。哺乳动物体内,葡萄糖到葡萄糖二酸至少需要10步酶催化反应[8]。Prather团队通过组合表达不同来源的途径酶,在大肠杆菌和酿酒酵母中成功构建了葡萄糖二酸合成途径,实现了微生物合成葡萄糖二酸[9-10];Liu等以肌醇为底物,在毕赤酵母中生产葡萄糖二酸,产量达到目前最高值(6.61±0.30) g/L[11];Lee等通过多步酶法降解半纤维素,同时将水解产物进行转化,成功获得葡萄糖二酸[12]。
目前,关于微生物法生产葡萄糖二酸的研究,多依赖于其前体肌醇的添加,造成生产成本较高;酶法降解虽然以生物质原料为底物,但产量较低,只达到微摩尔每升级别。为进一步获得葡萄糖二酸的高产菌株,同时使产品获得更广泛的应用,本研究对食品安全菌株酿酒酵母进行代谢工程改造,实现以葡萄糖为唯一前体合成葡萄糖二酸。首先在酿酒酵母Saccharomyces cerevisiae CEN.PK2-1C中共表达小鼠来源的肌醇加氧酶(MIOX) 及恶臭假单胞菌来源的醛酸脱氢酶(Udh),成功构建葡萄糖二酸合成途径,在此基础上,通过过量表达肌醇-1-磷酸合成酶(INO1),强化其前体肌醇的合成。最后,通过敲除磷酸果糖激酶(PFK1) 弱化竞争支路--糖酵解途径,进一步提高葡萄糖二酸的产量,重组菌在摇瓶中产量达到(230.22±10.75) mg/L。
1 材料与方法 1.1 材料 1.1.1 菌种和质粒本研究所用菌株和质粒均为作者所在实验室购买和保存,详见表 1。
| Name | Description | Source |
| Plasmids | ||
| pUC57-mM | pUC57 carrying codon-optimized MIOX from mouse, Apr | [11] |
| pY26-GPD-TEF | E.coli/S.cerevisiae shuttle vector, ScURA3, 2 μm, Apr | This study |
| pY26 -MIOX-Udh | PGPD-MIOX-TCYC1 andPTEF-Udh-TADH1 in pY26-GPD-TEF | This study |
| pFA6a-HIS3MX6 | Gene deletion vector, HIS3, Apr | [13] |
| pFA6a-INM1 | PTEF-INM1-TTEF in pFA6a-HIS3MX6 | This study |
| pFA6a-INM2 | PTEF-INM2-TTEF in pFA6a-HIS3MX6 | This study |
| pFA6a-INO1 | PTEF-INO1-TTEF in pFA6a-HIS3MX6 | This study |
| YEp351 | E.coli/S.cerevisiae shuttle vector, ScLEU2, 2 μm, Apr | [14] |
| YEp351-INM1 | PTEF-INM1-TTEF in YEp351 | This study |
| YEp351-INM2 | PTEF-INM2-TTEF in YEp351 | This study |
| YEp351-INO1 | PTEF-INO1-TTEF in YEp351 | This study |
| YEp351-INM1-INO1 | PTEF-INM1-TTEF andPTEF-INO1-TTEF in YEp351 | This study |
| Strains | ||
| S.cerevisiae CEN.PK2-1C | MATa; ura3-52; trp1-289; leu2-3, 112; his3Δ 1; MAL2-8C; SUC2 | Lab stock |
| S-UM | S.cerevisiae CEN.PK2-1C/pY26-MIOX-Udh | This study |
| S | S.cerevisiae CEN.PK2-1C/YEp351 | This study |
| S-INM1 | S.cerevisiae CEN.PK2-1C/YEp351-INM1 | This study |
| S-INM2 | S.cerevisiae CEN.PK2-1C/YEp351-INM2 | This study |
| S-INO1 | S.cerevisiae CEN.PK2-1C/YEp351-INO1 | This study |
| S-INM1+INO1 | S.cerevisiaeCEN.PK2-1C/YEp351-INM1-INO1 | This study |
| S0 | S.cerevisiae CEN.PK2-1C/YEp351, pY26-MIOX-Udh | This study |
| S-INM1-UM | S.cerevisiae CEN.PK2-1C/YEp351-INM1, pY26-MIOX-Udh | This study |
| S-INM2-UM | S.cerevisiae CEN.PK2-1C/YEp351-INM2, pY26-MIOX-Udh | This study |
| S-INO1-UM | S.cerevisiae CEN.PK2-1C/YEp351-INO1, pY26-MIOX-Udh | This study |
| S-INM1+INO1-UM | S.cerevisiaeCEN.PK2-1C/YEp351-INM1-INO1, pY26-MIOX-Udh | This study |
| S1 | S-INO1-UM derivate, △PFK1 | This study |
| S2 | S-INO1-UM derivate, △PFK2 | This study |
Primer STAR DNA聚合酶、DNA marker、T4 DNA连接酶和大肠杆菌感受态细胞制备试剂盒均购自TaKaRa (大连);各种限制性内切酶购自Thermo公司;PCR引物(表 2) 由生工生物(上海) 有限公司合成;质粒小量抽提试剂盒和细菌总DNA提取试剂盒均购自生工生物(上海) 有限公司;酵母基因组提取试剂盒购自天根生化科技(北京) 有限公司;葡萄糖二酸钾色谱级标准品购自Sigma-Aldrich公司。
| Primers | Sequences (5'-3') |
| GPD-MIOX-F | CCGGAATTCATGAAGGTCGACGTAGGTCCAGATC |
| GPD-MIOX-R | CCCAAGCTTTTACCAGGACAGAGTGCCAGGG |
| TEF-Udh-F | ATAAGAATGCGGCCGCATGACCACTACCCCCTTCAATCG |
| TEF-Udh-R | GGAAGATCTTTAGTTGAACGGGCCGGCCACG |
| pFA6a-His-F | GCATGCTAGCGAGTACTGACAATAAAAAGATTCTTG |
| pFA6a-His-R | GTACCTCGAGGGTTGTTTATGTTCGGATGTG |
| INM1-6a-F | CCGCTCGAGATGACCATTGATCTAGCTTCTATCG |
| INM1-6a-R | GCATGCTAGCTCAGTCATATTTCAAATGGCC |
| INM2-6a-F | CCGCTCGAGATGGTATTAACGAGGCAAGTAC |
| INM2-6a-R | GCATGCTAGCTTAGTATTCTAACTCACCCGC |
| INO1-6a-F | CCGCTCGAGATGACAGAAGATAATATTGCTCCA |
| INO1-6a-R | GCATGCTAGCTTACAACAATCTCTCTTCGAATCT |
| TEF-INM1(BamHⅠ) F | CGGGATCCCGCCAGATCTGTTTAGCTTG |
| TEF-INM1(BamHⅠ) R | TCGGATCCCTGGATGGCGGCGTTAGTATC |
| TEF-INM2(HindⅢ) F | CGCAAGCTTCGCCAGATCTGTTTAGCTTG |
| TEF-INM2(HindⅢ) R | CCCAAGCTTCTGGATGGCGGCGTTAGTATC |
| TEF-INO1(SamⅠ) F | TCCCCCGGGCGCCAGATCTGTTTAGCTTG |
| TEF-INO1(SamⅠ) R | GTACCCGGGCTGGATGGCGGCGTTAGTATC |
| Pfk1-disrup-F | ATGCAATCTCAAGATTCATGCTACGGTGTTGCATTCAGATCTATCATCACGACATGGAGGCCCAGAATACCCTC |
| Pfk1-disrup-R | TCATTTGTTTTCAGCGGCTAAAGCGGCTACCTCAGCTCTCAACTTTAATCTGGATGGCGGCGTTAGTATCG |
| Pfk2-disrup-F | ATGACTGTTACTACTCCTTTTGTGAATGGTACTTCTTATTGTACCGTCACGACATGGAGGCCCAGAATACCCTC |
| Pfk2-disrup-R | TTAATCAACTCTCTTTCTTCCAACCAAATGGTCAGCAATGAGTCTGGTAGTGGATGGCGGCGTTAGTATCG |
| Underlined letters are restriction enzyme cut sites. | |
蛋白胨10,氯化钠10,酵母粉5,自然pH。制备固体培养基时添加2%的琼脂。
1.2.2 YPD培养基(g/L)葡萄糖40,蛋白胨20,酵母粉10,自然pH。
1.2.3 SD筛选培养基(g/L)Yeast Nitrigon Base 6.7,葡萄糖20,根据需要添加亮氨酸、组氨酸、色氨酸及尿嘧啶,使其在培养基中终浓度为50 μg/mL,自然pH。制备固体培养基时添加2%的琼脂。
1.3 培养方法 1.3.1 种子培养挑取生长良好的单菌落接种于含25 mL的YPD液体培养基的250 mL三角瓶中,30 ℃、220 r/min培养24 h。
1.3.2 摇瓶培养将种子培养液按1%接种量转接至50 mL (摇瓶容量为500 mL) 的发酵培养基YPD中,培养96 h。
1.4 方法 1.4.1 基因的扩增与质粒的构建以从S.cerevisiae CEN.PK2-1C中提取的基因组DNA为模板,利用引物对INM1-6a-F/R、INM2-6a-F/R和INO1-6a-F/R分别扩增INM1、INM2和INO1基因;以从恶臭假单胞菌Pseudomonas putida KT2440中提取的基因组DNA为模板,利用引物对TEF-Udh-F/R扩增Udh基因;以pUC57-mmol/L质粒为模板,利用引物对GPD-MIOX-F/R扩增小鼠来源的MIOX基因。pFA6a-His-F/R引物对用于扩增pFA6a质粒。
将扩增得到的MIOX基因用EcoRⅠ和Hind Ⅲ双酶切,连接至相应切口的质粒pY26-GPD-TEF中,转化验证后再将该质粒用NotⅠ和BglⅡ双酶切,与经相同限制性内切酶酶切后的Udh基因连接,转化验证后得到质粒pY26-MIOX-Udh。
将扩增得到的INM1、INM2和INO1基因用NheⅠ和XhoⅠ双酶切,与扩增得到并用相同内切酶酶切后的pFA6a质粒连接,转化验证后分别得到pFA6a-INM1、pFA6a-INM2及pFA6a-INO1质粒。再分别以pFA6a-INM1、pFA6a-INM2及pFA6a-INO1质粒为模板,TEF-INM1(BamHⅠ) F/R、TEF-INM2(Hind Ⅲ) F/R、TEF-INO1(SamⅠ) F为引物,分别扩增INM1、INM2和INO1表达框。得到的表达框分别经BamHⅠ、Hind Ⅲ及SamⅠ单酶切后,连接至相应单酶切后的YEp351质粒上,转化验证后分别得到YEp351-INM1、YEp351-INM2及YEp351-INO1质粒。
将单酶切后的INM1表达框连接至BamHⅠ酶切后的YEp351-INO1质粒上,得到质粒YEp351-INM1-INO1。
以pFA6a-HIS3MX6为模板,分别以Pfk1-disrup-F/R及Pfk2-disrup-F/R引物对扩增PFK1及PFK2敲除框。
引物见表 2。
1.4.2 酵母的转化和重组子的筛选酿酒酵母的转化采用LiAc/SSDNA/PEG法[15]。转化后涂布于相应氨基酸缺陷的SD筛选平板,挑选转化子,提取基因组或质粒进行PCR验证。
1.4.3 葡萄糖二酸的定量检测采用HPLC定量检测葡萄糖二酸,具体参见文献[10]。HPLC分析条件:流动相为5 mmol/L稀硫酸,色谱柱为Aminex HPX-87H (Bio-Rad,USA),流速0.5 mL/min,柱温55 ℃,进样量10 μL,检测器为紫外检测器,检测波长为210 nm。
2 结果与分析 2.1 酿酒酵母中葡萄糖二酸合成途径的构建为实现酿酒酵母中葡萄糖二酸的从头合成,首先需要在菌株中构建1条由葡萄糖到葡萄糖二酸的通路。如图 1所示,在酿酒酵母中存在从葡萄糖到肌醇完整的合成途径,包含3个途径酶INO1、INM1和INM2,因此只需要异源表达肌醇加氧酶(MIOX) 和醛酸脱氢酶(Udh)。
|
| 图 1 酿酒酵母中葡萄糖二酸合成途径 Figure 1 The biosynthetic pathway of GA in S.cerevisiae. The native pathways are in black while the heterologous GA biosynthetic pathway is in red. |
| |
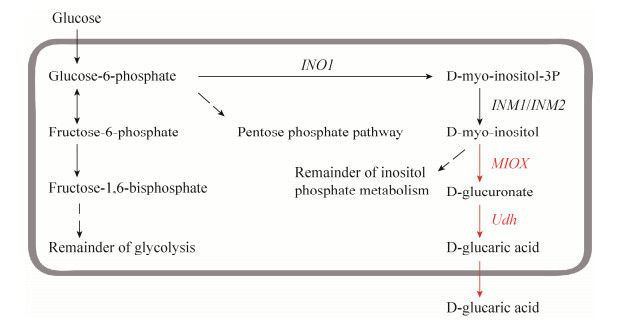
质粒pY26-MIOX-Udh同时含有MIOX表达框和Udh表达框,通过将该质粒转化S.cerevisiae CEN.PK2-1C得到产葡萄糖二酸的菌株S-UM,在S.cerevisiae中成功构建了从葡萄糖到葡萄糖二酸的合成途径。将该重组菌株培养96 h后,取发酵液进行HPLC检测产物,HPLC检测结果如图 2B所示。
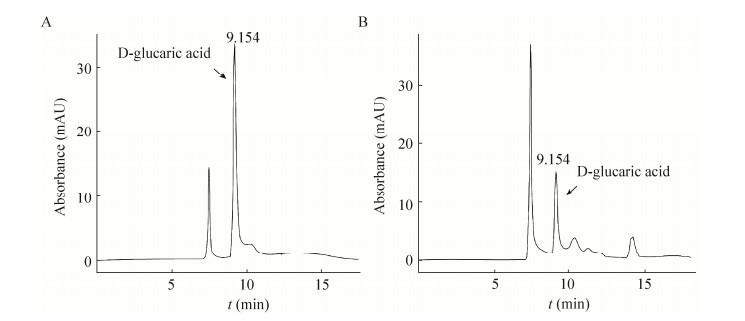
|
| 图 2 葡萄糖二酸标准品和重组菌发酵液的HPLC图 Figure 2 HPLC chromatogram of the standard sample and the product from recombinant S.cerevisiae. (A) GA. (B) The product from S-UM. |
| |
通过对不同浓度的葡萄糖二酸标准品的HPLC (图 2A) 分析,确定其保留时间约为9.154 min,并确定其标准曲线为C=1.761 6S+7.954 9(C代表GA浓度,单位:mg/L;S代表峰面积),相关系数R=0.995。据此,确定菌株S-UM葡萄糖二酸的产量为(28.28±3.15) mg/L。
2.2 过量表达肌醇合成途径关键酶强化葡萄糖二酸的合成肌醇不仅是合成葡萄糖二酸的重要前体,而且胞内肌醇的含量在一定范围内的提升能增强MIOX的活性[16]。因此,在一定程度上,肌醇的含量与葡萄糖二酸的产量存在正相关性。但是,在酿酒酵母细胞内,有限的肌醇不仅要生产目标产物,还要合成众多磷脂酰化合物和胆碱等[17-18],严重制约了利用微生物作为生产平台合成葡萄糖二酸。因此,为进一步提高葡萄糖二酸产量,过量表达肌醇合成途径不同基因,强化葡萄糖二酸代谢流。
如图 1所示,在肌醇合成途径中,首先由INO1将6-磷酸葡萄糖转化为3-磷酸肌醇,再由INM1或其同工酶INM2将3-磷酸肌醇转化为肌醇。本研究通过分别过量表达INO1、INM1及INM2,分析对葡萄糖二酸合成的影响。分别将含有INO1、INM1及INM2基因的重组菌株S-INO1-UM、S-INM1-UM、S-INM2-UM及对照菌株S0在摇瓶中培养,葡萄糖二酸产量如图 3所示。
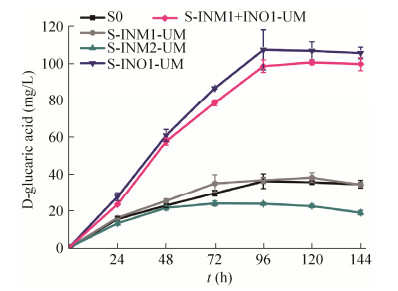
|
| 图 3 过表达肌醇合成途径不同基因对葡萄糖二酸产量的影响 Figure 3 Effect of overexpression of inositol biosynthetic pathway genes on GA production. |
| |
从图 3中可以看出,与对照菌株S0相比,S-INO1-UM的葡萄糖二酸产量有明显提升,96 h产量达到(107.51±10.87) mg/L,是对照菌S0的3.8倍,说明过量表达INO1有利于葡萄糖二酸的生成。而重组菌株S-INM1-UM及S-INM2-UM中葡萄糖二酸的产量没有明显变化。上述结果说明INO1编码的是葡萄糖二酸合成途径中的一个限速酶,而INM1和INM2虽然也是肌醇合成途径的必需基因,但酿酒酵母自身含有的肌醇单磷酸酶(INM1/INM2) 已足够催化3-磷酸肌醇到肌醇的反应。
为进一步验证以上推论,将过量表达INM1和INO1的重组菌株S-INO1+INM1-UM培养,该重组菌葡萄糖二酸产量与S-INO1-UM相近(图 3)。由此可以进一步证明,过量表达INO1可以强化葡萄糖二酸的上游代谢流,进而提高其产量。这与大肠杆菌合成葡萄糖二酸的相关研究一致[16]。
另外,有研究表明INO1是肌醇合成途径的限速酶[18]。为验证过量表达INO1是通过增加胞内肌醇含量,进而提升葡萄糖二酸含量,本研究用HPLC法[19]分别检测菌株S、S-INM1、S-INM2、S-INO1和S-INM1+INO1胞内肌醇含量,但均因含量较低无法量化。可能是因为肌醇作为酿酒酵母的代谢中间产物,多流向磷脂酰肌醇代谢途径中,很少积累,故未获得相应的有效数据。
2.3 敲除PFK1/PFK2基因强化葡萄糖二酸的合成在酿酒酵母中,6-磷酸葡萄糖作为葡萄糖二酸的前体是一个重要的分支点,除了参与肌醇磷酸代谢途径,还参与其竞争支路--糖酵解及磷酸戊糖途径(图 1)。为进一步提高重组菌中葡萄糖二酸的产量,需要更多的6-磷酸葡萄糖进入肌醇磷酸代谢途径中。因此,通过弱化其竞争途径
的关键酶--磷酸果糖激酶的活性抑制糖酵解途径,是减少6-磷酸葡萄糖消耗的一个重要策略。有研究表明,PFK1和PFK2分别编码磷酸果糖激酶的α亚基和β亚基,两者中任一亚基突变失活后,另一亚基也能单独完成该酶的功能,同时使胞内6-磷酸葡萄糖含量上升[20-21]。本研究分别敲除重组菌中PFK1和PFK2基因,即将PFK1敲除框和PFK2敲除框分别转化到S-INO1-UM中,验证正确后得到重组菌S1和S2。图 4为S1和S2缺陷菌株的PCR鉴定凝胶电泳图。
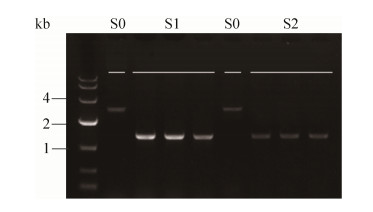
|
| 图 4 PFK1/PFK2基因敲除菌株的鉴定 Figure 4 Identification of PFK1/PFK2 mutant S.cerevisiae. |
| |
S1及S2重组菌摇瓶培养96 h后葡萄糖二酸产量如图 5所示。敲除PFK1或PFK2基因后,重组菌葡萄糖二酸产量均有明显提高,分别为(230.22±10.75) mg/L及(178.99±9.21) mg/L。该结果表明,弱化糖酵解途径能有效促进葡萄糖二酸的合成。
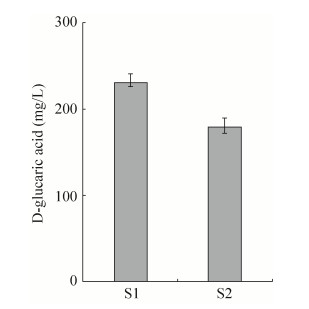
|
| 图 5 敲除PFK1/PFK2对葡萄糖二酸产量的影响 Figure 5 Effect of PFK1/PFK2 deletion on the GA production. |
| |
其中,S1比S2产量更高,故敲除PFK1对葡萄糖二酸的合成有更好的促进作用。在磷酸果糖激酶中,α亚基主要作用为调节功能,而β亚基行使催化功能[20]。因此推测重组菌S1和S2葡萄糖二酸产量存在差异可能是由两亚基功能不同,失活后对磷酸果糖激酶活性的抑制效果不同而造成的。
3 结语葡萄糖二酸作为一种自然界存在的高附加值有机酸,具有重要的生理功能。通过共表达小鼠来源的肌醇加氧酶(MIOX) 及恶臭假单胞菌来源的醛酸脱氢酶(Udh),在酿酒酵母中成功构建了葡萄糖二酸合成途径。通过调控其前体肌醇合成途径,发现肌醇-1-磷酸合成酶(INO1) 是葡萄糖二酸合成途径的限速酶。在此基础上,通过使PFK1酶失活,弱化竞争支路,使产量达到(230.22±10.75) mg/L,是相同条件下原始菌株产量的8.14倍。为进一步提高葡萄糖二酸的产量,通过抑制磷酸戊糖支路、磷脂酰肌醇支路以及改造葡萄糖二酸途径限速酶,成为后续研究的重点。
| [1] | Walaszek Z, Szemraj J, Hanausek M, et al. D-Glucaric acid content of various fruits and vegetables and cholesterol-lowering effects of dietary D-glucarate in the rat. Nutr Res, 1996, 16(4): 673–681. DOI: 10.1016/0271-5317(96)00045-0 |
| [2] | Bhattacharya S, Manna P, Gachhui R, et al. D-Saccharic acid 1, 4-lactone protects diabetic rat kidney by ameliorating hyperglycemia-mediated oxidative stress and renal inflammatory cytokines via NF-κB and PKC signaling. Toxicol Appl Pharmacol, 2013, 267(1): 16–29. DOI: 10.1016/j.taap.2012.12.005 |
| [3] | Gupta KP, Singh J. Modulation of carcinogen metabolism and DNA interaction by calcium glucarate in mouse skin. Toxicol Sci, 2004, 79(1): 47–55. DOI: 10.1093/toxsci/kfh098 |
| [4] | Kiely DE, Chen L, Lin TH. Simple preparation of hydroxylated nylons-polyamides derived from aldaric acids//Fishman ML, Friedman RB, Huang SJ, Eds. Polymers from Agricultural Coproducts. Washington: American Chemical Society, 1994: 149-158. |
| [5] | Polen T, Spelberg M, Bott M. Toward biotechnological production of adipic acid and precursors from biorenewables. J Biotechnol, 2013, 167(2): 75–84. DOI: 10.1016/j.jbiotec.2012.07.008 |
| [6] | Werpy T, Petersen G, Aden A, et al. Top value added chemicals from biomass, volume 1: results of screening for potential candidates from sugars and synthesis gas. Washington, DC: US Department of Energy, 2004. |
| [7] | Kochkar H, Lassalle L, Morawietz M, et al. Regioselective oxidation of hydroxyl groups of sugar and its derivatives using silver catalysts mediated by TEMPO and peroxodisulfate in water. J Catal, 2000, 194(2): 343–351. DOI: 10.1006/jcat.2000.2927 |
| [8] | Linster CL, Van Schaftingen E. Glucuronate, the precursor of vitamin C, is directly formed from UDP-glucuronate in liver. FEBS J, 2006, 273(7): 1516–1527. DOI: 10.1111/ejb.2006.273.issue-7 |
| [9] | Gupta A, Hicks MA, Manchester SP, et al. Porting the synthetic D-glucaric acid pathway from Escherichia coli to Saccharomyces cerevisiae. Biotechnol J, 2016, 11(9): 1201–1208. DOI: 10.1002/biot.201500563 |
| [10] | Moon TS, Yoon SH, Lanza AM, et al. Production of glucaric acid from a synthetic pathway in recombinant Escherichia coli. Appl Environ Microbiol, 2009, 75(3): 589–595. DOI: 10.1128/AEM.00973-08 |
| [11] | Liu Y, Gong X, Wang C, et al. Production of glucaric acid from myo-inositol in engineered Pichia pastoris. Enzyme Microb Technol, 2016, 91: 8–16. DOI: 10.1016/j.enzmictec.2016.05.009 |
| [12] | Lee CC, Kibblewhite RE, Paavola CD, et al. Production of glucaric acid from hemicellulose substrate by rosettasome enzyme assemblies. Mol Biotechnol, 2016, 58(7): 489–496. DOI: 10.1007/s12033-016-9945-y |
| [13] | Wach A, Brachat A, Alberti-Segui C, et al. Heterologous HIS3 marker and GFP reporter modules for PCR-targeting in Saccharomyces cerevisiae. Yeast, 1997, 13(11): 1065–1075. DOI: 10.1002/(ISSN)1097-0061 |
| [14] | Hill JE, Myers AF, Koerner TJ, et al. Yeast/E. colishuttle vectors with multiple unique restriction sites.. Yeast, 1986, 2(3): 163–167. DOI: 10.1002/(ISSN)1097-0061 |
| [15] | Gietz RD, Schiestl RH. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nat Protoc, 2007, 2(1): 31–34. DOI: 10.1038/nprot.2007.13 |
| [16] | Moon TS, Dueber JE, Shiue E, et al. Use of modular, synthetic scaffolds for improved production of glucaric acid in engineered E. coli. Metab Eng, 2010, 12(3): 298–305. DOI: 10.1016/j.ymben.2010.01.003 |
| [17] | Henry SA, Gaspar ML, Jesch SA. The response to inositol: regulation of glycerolipid metabolism and stress response signaling in yeast. Chem Phys Lipids, 2014, 180: 23–43. DOI: 10.1016/j.chemphyslip.2013.12.013 |
| [18] | Majumder AL, Johnson MD, Henry SA. 1L-myo-inositol-1-phosphate synthase. Biochim Biophys Acta, 1997, 1348(1/2): 245–256. |
| [19] | Shiue E, Brockman IM, Prather KLJ. Improving product yields on D-glucose in Escherichia coli via knockout of pgi and zwfand feeding of supplemental carbon sources. Biotechnol Bioeng, 2015, 112(3): 579–587. DOI: 10.1002/bit.v112.3 |
| [20] | Heinisch J. Construction and physiological characterization of mutants disrupted in the phosphofructokinase genes of Saccharomyces cerevisiae. Curr Genet, 1986, 11(3): 227–234. DOI: 10.1007/BF00420611 |
| [21] | Nishino S, Okahashi N, Matsuda F, et al. Absolute quantitation of glycolytic intermediates reveals thermodynamic shifts in Saccharomyces cerevisiae strains lacking PFK1 or ZWF1 genes. J Biosci Bioeng, 2015, 120(3): 280–286. DOI: 10.1016/j.jbiosc.2015.01.012 |
 2017, Vol. 33
2017, Vol. 33