中国科学院微生物研究所、中国微生物学会主办
文章信息
- 方荣锋, 李浩浩, 张培及, 曹让, 杨淑慎
- Fang Rongfeng, Li Haohao, Zhang Peiji, Cao Rang, Yang Shushen
- 产紫杉醇内生真菌TMS-26的分离和鉴定
- Identification and characterization of a taxol-producing endophytic fungus from Taxus media
- 生物工程学报, 2017, 33(12): 1945-1954
- Chinese Journal of Biotechnology, 2017, 33(12): 1945-1954
- 10.13345/j.cjb.170061
-
文章历史
- Received: February 21, 2017
- Accepted: June 15, 2017
紫杉醇(Paclitaxel,商品名Taxol)是一种具有天然抗肿瘤活性的二萜类物质。1971年美国化学家Wani等[1]首先从短叶红豆杉Taxus breuifolia树皮中分离得到,并命名为紫杉醇,即Paclitaxel。随后Schiff等[2]发现了紫杉醇独特的抗癌机理,它能抑制微管的解聚,影响纺锤丝的形成,从而阻断癌细胞的有丝分裂而达到治疗肿瘤的目的。自从紫杉醇问世以来,由于其良好、广谱的抗癌效果,被誉为是近半个世纪以来最好的抗癌药物之一[3]。《世界癌症报告》指出在今后的近20年,全球癌症病例将呈现迅猛增长的态势[4],由此对紫杉醇的需求也会陡然增长。然而,目前紫杉醇主要从红豆杉的树皮中提取,其含量仅为0.01%-0.05%[5],造成了紫杉醇来源的严重匮乏,导致其市场价格居高不下,限制了其在临床上的广泛应用。因此探索其他方法生产紫杉醇十分迫切。
1993年Stierle等[6]首次从短叶红豆杉Taxus brevifolia中分离出1株产紫杉醇的内生真菌Taxomyces andreanae,这一发现为紫杉醇生产开辟了新的途径。因此从红豆杉属等植物中分离内生真菌,无疑能缓解紫杉醇生产原料危机[7]。到目前为止,已报道有40多个属的200多种菌株可以产生紫杉醇[8],表现出丰富的物种多样性。但由于大部分菌株发酵性能较低,初始产量尚未达到1 mg/L的工业化生产的盈亏平衡点[9]。
本研究以生长在陕西关中地区的9年生曼地亚红豆杉Taxus media为材料,从中分离出1株产紫杉醇的内生真菌TMS-26,通过高效液相色谱法(High performance liquid chromatography,HPLC)和质谱法(Mass spectrum,MS)对其所提取得到的疑似紫杉醇物质进行了分析,同时通过传统形态学分类鉴定方法和18S rDNA序列分析、Internal-transcribed spacer (ITS)序列分析,对内生真菌TMS-26进行了鉴定。
1 材料与方法 1.1 材料菌株:分离自曼地亚红豆杉外植体,已保存于中国典型培养物保藏中心(CCTCC No:M 2014258)。
红豆杉:9年生曼地亚红豆杉Taxus media栽培于西北农林科技大学博览园。根据植物内生真菌在植物组织和器官中的分布特点及其在植物中的生活习性,选用曼地亚红豆杉的根、茎、叶以及树皮作为内生真菌分离的主要部位。
研究材料采集方法如下:
根:使用园艺铲沿所选曼地亚红豆杉植株根部向下挖,取地表以下15 cm处的曼地亚红豆杉多年生根,用园艺剪剪下装入无菌袋备用。
茎:取所选曼地亚红豆杉植株多年生、健康且粗壮的茎,使用园艺剪剪下装入无菌袋备用。
叶:取所选曼地亚红豆杉多年生、健康且较大的叶片,连同枝条用园艺剪剪下装入无菌袋备用。
树皮:取所选曼地亚红豆杉多年生的茎,用园艺剪剪下,在超净工作台上用无菌手术刀和镊子将皮剥下备用。
主要仪器和试剂:Waters 1525-2424型高效液相色谱仪(美国Waters);AB Sciex API 2000型三重四级杆液质联用仪(美国AB Sciex);JSM-6360LV型扫描电子显微镜(日本电子仪器公司)。工具酶、IPTG购自TaKaRa公司;DNA片段凝胶回收试剂盒购于TIANGEN BIOTECH (北京)公司;紫杉醇标准品购自Sigma公司;其他试剂均为国产色谱纯或分析纯。
1.2 方法 1.2.1 内生真菌的分离与纯化将采集的曼地亚红豆杉的外植体放入自来水中冲洗30 min,再用无菌水冲洗3次。转移至洁净工作台内,先用75%的乙醇浸泡30 s,然后用无菌水冲洗3-5次,接着用0.1%的升汞溶液浸泡10 min,完成后用无菌水冲洗3-5次,将最后一次的洗液涂布于PDA固体培养基上,作为对照组以检验是否消毒彻底。然后将外植体用无菌的解剖剪和解剖刀剪切成0.5 cm×0.5 cm左右的小块,按外植体部位分别接种于已经准备好的PDA固体培养基上。倒置于28 ℃培养箱中黑暗培养3-7 d,观察记录菌丝生长情况。
当观察对照组的平板无菌落长出,而实验组平板上长出菌丝后,根据所长出的菌落颜色、形态以及分泌物的不同,挑取不同菌落菌丝的尖端接种于新的PDA固体培养基上,28 ℃倒置于培养箱中黑暗培养3-7 d,每天观察记录菌丝生长情况。当有不同颜色或形态的菌落生长出来以后,继续以菌丝顶端纯化法进行纯化操作直至各个菌落为单一纯培养为止,然后将纯化后的单一菌株分别编号记录并保存到4 ℃冰箱备用[10]。
1.2.2 发酵液中紫杉醇的提取与分析将保藏于4 ℃冰箱中的26株菌种取出,以划线接种法接种于PDA平板上,倒置于28 ℃培养箱中黑暗培养3-4 d,待菌丝均匀长出后,在洁净工作台中用无菌手术刀片切取0.5 cm×0.5 cm大小生长均匀的带培养基菌块儿,然后分别接入装有50 mL PDA液体培养基的250 mL三角瓶中,28 ℃、180 r/min暗培养12-15 d。
将发酵培养液进行过滤,滤液用等体积的二氯甲烷120 r/min振荡萃取3次,分液,合并收集二氯甲烷相。将二氯甲烷相于旋转蒸发仪中40 ℃减压蒸干,用色谱级甲醇溶解蒸干后所得的固体残留物,定容至4 mL,然后再用0.22 μm的微孔过滤器进行过滤后于4 ℃冰箱中黑暗保存备用。
采用薄层色谱法对曼地亚红豆杉产紫杉醇内生真菌进行初步筛选,将菌株发酵提取物的甲醇溶液及标准品溶液点样于GF254硅胶板上,以三氯甲烷:乙腈(V:V)=9:1为展开剂,甲醇:浓硫酸:香草醛(V:V:M)=90 mL:10 mL:1 g为显色剂,根据提取物与标准品的显色情况,以初步判定菌株发酵液中是否含有紫杉醇[11]。对于经薄层色谱法检测后得出的疑似产紫杉醇的菌株,进一步通过高效液相色谱法检测,来确认这些菌株是否能够产紫杉醇。本次高效液相色谱法检测条件为:色谱柱为C18反向柱(4.5 mm×150 mm,5 μm),紫外检测波长为227 nm,进样量为5 μL,流动相为甲醇:水(V:V)=68:32,流速为1 mL/min,柱温为室温。根据高效液相色谱法检测结果得到疑似紫杉醇高产菌株,为了进一步确认菌株所产紫杉醇的结构,采用液质联用色谱法(LC/MS/MS)对高产菌株发酵提取物进行检测,检测条件如下:在紫杉醇的二级质谱检测中,紫杉醇加钠峰所产生质荷比为308.10的碎片子离子和紫杉醇加氢峰所产生质荷比为286.30的碎片子离子的检测灵敏度最高,故在此后的检测中,选择m/z=876.60/308.10和m/z=854.70/286.30的两对子母离子对为特征检测对象,使用电喷雾(ESI)离子源,正离子多反应监测(MRM)扫描模式。气帘气流速(CUR)为20 L/min,碰撞气流速(CAD)为5 L/min,离子源电压(IS)为5 000 V,离子源温度(TEM)为500 ℃,离子源气流速1 (GS1)为50 L/min,离子源气流速2 (GS2)为60 L/min,去簇电压(DP)为37 V,调焦电压(FP)为400 V,入口电压(EP)为10 V,碰撞电池出口电压(CXP)为4 V。
1.2.3 分离菌株的形态学特征本研究中采用单点法将26#菌株接种于PDA培养基上进行培养。对其培养6 d的菌落基本特征、光学显微镜下菌丝形态以及扫描电子显微镜下菌丝孢子形态等进行观测和鉴定。
1.2.4 分离菌株的分子系统学分析采用CTAB法提取26#菌株总基因组DNA[12],用于随后的18S rDNA和ITS序列的扩增[13]。
菌株18S rDNA的扩增与序列分析:
PCR扩增体系(50 μL):30–150 ng基因组DNA模板,引物18S-NS1 (5'-GTAGTCATATG CTTGTCTC-3')和18S-NS8 (5'-TCCGCAGGTT CACCTACGGA-3')[14]各1 μL,2×Taq MasterMix 25 μL,无菌双蒸水补足50 μL。
PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸2 min,共35个循环;72 ℃后延伸10 min,4 ℃保存。
PCR扩增完成后,DNA目的片段经过电泳检测,然后进行切胶回收DNA片段。纯化后的18S rDNA目的片段送交给英潍捷基(上海)生物技术有限公司完成双向测序。将所得序列上传至GenBank数据库,并获得序列登录号。而后将所得序列输入GenBank数据库中进行BLAST检索比对,利用MEGA5.2软件分析,自展数据集为1 000,其他为默认参数,采用邻位相连(Neighbor-joining)算法构建系统发育树[15-16]。
PCR扩增体系(20 μL):10–50 ng基因组DNA模板,引物ITS1和ITS4[14]各0.5 μL,10×Taq 缓冲液2 μL,MgCl2 1.5 μL,dNTPs 1 μL,Taq DNA polymerase 0.2 μL,无菌双蒸水补足20 μL。
PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,54 ℃退火45 s,72 ℃延伸1 min,共35个循环;72 ℃后延伸7 min,4 ℃保存。
序列比对及构建系统发育树方法与18S rDNA构建方法相同。
2 结果与分析 2.1 曼地亚红豆杉内生真菌的分离与筛选 2.1.1 薄层色谱法检测在本研究所用检测体系中,紫杉醇标准品经过薄层层析检测后显靛蓝色,Rf(点样斑点中心至斑点中心的距离∕点样斑点中心至展开剂前沿的距离)值为0.56。通过对所分离出来的26株曼地亚红豆杉内生真菌的发酵提取物进行薄层色谱法点样检测,结果显示其中的1#、3#、6#、11#、15#、17#、21#、26#这8株内生真菌的发酵提取物斑点颜色接近靛蓝色,并且它们的Rf值也接近于0.56 (图 1)。

|
| 图 1 疑似产紫杉醇菌株发酵提取物TLC图(其中右侧R为紫杉醇标品,左侧编号为样品) Figure 1 TLC analysis on the fermentation extract of the suspected taxol-producing endophytic (R which on the right represents authentic taxol and samples are on the left). |
| |
通过在相同色谱条件下对8株疑似产紫杉醇菌株的发酵提取物进行高效液相色谱法检测,检测结果发现26#、17#以及11#菌株的发酵提取物能够产生保留时间分别为4.486、4.502和4.630 min的色谱峰(图 2B–2D),这与紫杉醇标准品在相同色谱条件下检测所得特征峰的保留时间4.545 min (图 2A)极其接近(△≤0.2 min),这说明26#、17#、11#菌株在发酵培养过程中能够产生紫杉醇。

|
| 图 2 紫杉醇标准溶液及发酵提取物HPLC图 Figure 2 HPLC chromatograms of authentic taxol and the sample extracted from three strains. (A) An HPLC chromatograms of authentic taxol (Arrow indicates the taxol-specific peaks). (B) An HPLC chromatogram of the sample extracted from strain 26#. (C) An HPLC chromatogram of the sample extracted from strain 17#. (D) An HPLC chromatogram of the sample extracted from strain 11#. |
| |
由高效液相色谱法测得,26#菌株的紫杉醇产量相对较高,为了进一步确认26#菌株发酵提取物中紫杉醇的结构,本研究采用三重四级杆液质联用仪进行正离子模式多反应监测(MRM)扫描检测,对26#菌株发酵提取物中的紫杉醇进行结构确认分析。通过对紫杉醇标准品和26#菌株发酵提取物中的紫杉醇进行正离子模式多反应监测(MRM)扫描检测,发现在提取离子流图中,样品与标品的加钠峰和加氢峰保留时间极其接近(△≤0.2 min),且在二级质谱图,样品产生了和标品相同且对应的离子对峰,从而证明样品中的紫杉醇结构与标品相同(图 3)。
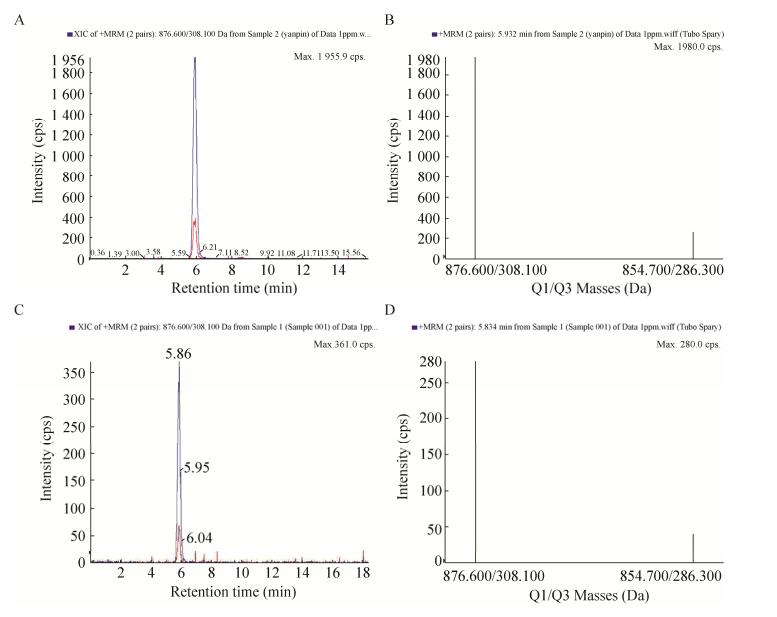
|
| 图 3 紫杉醇标准品(A)和26#菌株发酵提取物(C)的质谱提取粒子流图以及紫杉醇标准品(B)和26#菌株发酵提取物(D)的二级质谱离子峰图 Figure 3 Extracted ion chromatograms of LC/MS/MS of the authentic taxol (A) and the fungal taxol produced by strain 26# (C), and the mass spectrum figures of the authentic taxol (B) and the fungal taxol produced by strain 26# (D). |
| |
在PDA培养基上于28 ℃培养6 d后,26#菌株的菌落呈规则的椭圆形,直径75 mm,厚度约为1 mm,表面呈绒毛辐射状(图 4A)。菌落均一平坦无隆起,不透明,正面中心为蓝绿色,边缘灰白色,背面中心为黄绿色,向外依次变浅,整体较为干燥,与培养基结合较为紧密,无明显气味,生长较快且较为旺盛。
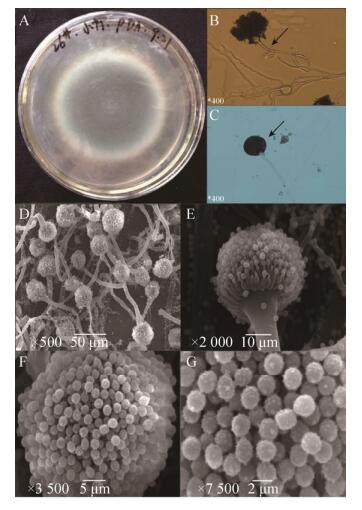
|
| 图 4 26#菌株形态结构特征 Figure 4 Morphological structure characteristics of strain 26#. (A) Colony of strain 26# after cultured on PDA medium at 28 ℃ for 6 days. (B, C) Mycelial morphology and sporangium morphology of strain 26#. (D–G) Conidia of strain 26# under a scanning electron microscope. |
| |
在TFM-850型倒置荧光显微镜白光模式下观测发现,26#菌株菌丝呈树枝状,有明显隔膜(图 4B);分生孢子梗较长,无分枝,无色;分生孢子囊呈椭圆形(图 4C),分生孢子呈圆形,蓝绿色。
在JSM-6360LV型扫描电子显微镜下,菌株菌丝有隔,多分枝,较粗,直径3.0–6.0 μm,分生孢子梗是从膨大的足细胞垂直生出,无色,光滑,无分枝,顶端膨大形成近似球形的顶囊,顶囊表面形成小梗,小梗平行簇生于顶囊顶部。小梗单层,分生孢子自小梗顶端相继形成。分生孢子为蓝绿色,近圆球形,形状均匀,表面有不规则块状突起,分生孢子直径1.8–2.2 μm。
以上形态学观测结果与《真菌鉴定手册》[17]进行对比,发现26#菌株的形态学特征与曲霉属真菌(Aspergillus sp.)相似。
2.3 分子生物学方法鉴定用CTAB法获得菌株总基因组DNA,通过1%的琼脂糖凝胶电泳检测后,PCR扩增,获得26#菌株18S rDNA序列,测序后片段大小为1 687 bp,所得序列提交至GenBank数据库并获得序列登录号KJ746594。对菌株18S rDNA序列进行聚类分析,得到菌株系统发育树(图 5A),显示26#菌株与烟曲霉菌Aspergillus fumigatus的18S rDNA序列同源性极高,序列相似度达到99%,证明依据菌株18S rDNA序列分析结果可以将26#菌株分类鉴定为烟曲霉菌。
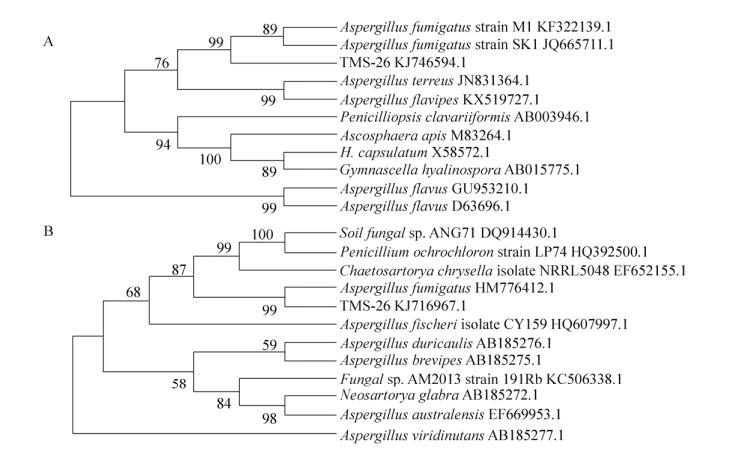
|
| 图 5 26#菌株系统发育树 Figure 5 Phylogenetic tree of strain 26#. (A) Phylogenetic trees showing relationship of strain 26# with other related fungal species retrieved from GenBank based on their sequence homologies of 18S rDNA sequence. (B) Phylogenetic trees showing relationship of strain 26# with other related fungal species retrieved from GenBank based on their sequence homologies of ITS sequence. |
| |
26#菌株ITS序列测序后,片段大小为555 bp,所得序列提交至GenBank数据库并获得序列登录号KJ716967。对菌株ITS序列进行聚类分析,得到菌株系统发育树(图 5B),显示26#菌株与烟曲霉菌Aspergillus fumigatus的ITS序列同源性极高,序列相似度也达到了99%,证明依据菌株ITS序列分析结果可以将26#菌株分类鉴定为烟曲霉菌,与26#菌株18S rDNA序列分析结果一致。
综合传统分类学方法鉴定结果和现代分子系统学分析的方法,26#菌株被鉴定为曲霉属烟曲霉Aspergillus fumigatus,将其命名为:烟曲霉TMS-26。
3 讨论与直接从红豆杉属植物的树皮中提取紫杉醇相比,内生真菌生产紫杉醇具有更大的发展潜力。真菌不仅能在简单的培养基上良好生长,产生大量的发酵产物,发酵周期短,还可以在生物反应器中人为控制各种参数,并可通过诱变育种等传统育种和基因工程手段来提高菌种性能以提高紫杉醇产量,如赵凯等对紫杉醇产生菌NCEU-1的原生质体进行UV和LiCl复合诱变,紫杉醇产量提高了33.17%[18];同时随着对紫杉醇合成途径中关键酶研究的不断深入,使构建紫杉醇高产基因工程菌株成为可能[19]。通过内生真菌发酵法生产对于植物来源的天然药物的开发及濒危药用植物的保护具有十分重要的经济及生态效益,并为生产紫杉醇药物开辟了新的途径[20]。
研究者们关注的焦点主要集中在太平洋短叶红豆杉、欧洲红豆杉、东北红豆杉、西藏红豆杉以及云南红豆杉等品种红豆杉中产紫杉醇内生真菌的分离和筛选[21],对于杂交种曼地亚红豆杉中产紫杉醇内生真菌的分离和筛选研究报道较少。本研究从生长在关中地区的曼地亚红豆杉中分离出26株内生真菌,筛选获得3株产紫杉醇菌株,通过HPLC对其发酵提取物进行分析(图 2B–2D)并对26#菌株的发酵产物进行了MS分析(图 3)。并对26#菌株菌落、菌丝体和孢子形态特征分析(图 4A–4G)和18S rDNA和ITS序列分析(图 5A、5B)将其鉴定为曲霉属烟曲霉真菌,并命名为“烟曲霉TMS-26”。
烟曲霉是自然界普遍存在的丝状腐生真菌,也是条件致病菌和重要的变应原[22]。TMS-26菌株分类为曲霉属烟曲霉,目前产紫杉醇内生真菌已有20多个属,如拟盘多毛孢属Pestalotiopsis microspora、树状多节孢Noduzisporium sylviforme、链格孢菌Alternaria、茎点霉属Phomopsis、曲霉属Aspergillus niger var等,但关于产紫杉醇的曲霉属烟曲霉菌株只有一例,编号EPTP-1[23]。与本研究分离得到的烟曲霉TMS-26菌株相比,菌株EPTP-1在形态特征和ITS序列上存在一定差异:在形态特征上,PDA培养基28 ℃暗培养5 d后,菌株EPTP-1产生黑灰色分生孢子,且菌落有黄色渗出液产生;在菌株ITS序列比较上,经过DNAMAN V6.0软件比对后发现,菌株EPTP-1的ITS序列(GenBank序列登录号为
EU256469)与烟曲霉TMS-26菌株的ITS序列拥有91%的序列同源性。综合两个菌株形态特征和ITS序列比较结果可知,本研究分离得到的烟曲霉TMS-26菌株和菌株EPTP-1属于两个不同的菌株。本研究首次报道了从曼地亚红豆杉中分离出产紫杉醇的曲霉属烟曲霉菌株,这丰富了产紫杉醇内生真菌的种群资源,为寻找适合人工修饰的产紫杉醇原始出发菌株奠定了基础[24-25]。但Aspergillus fumigatus TMS-26的发酵潜能以及发酵产物的生物学活性尚未明确,有待进一步研究。
| [1] | Wani MC, Taylor HL, Wall ME, et al. Plant antitumor agents. Ⅵ. Isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia. J Am Chem Soc, 1971, 93(9): 2325–2327. DOI: 10.1021/ja00738a045 |
| [2] | Schiff PB, Fant J, Horwitz SB. Promotion of microtubule assembly in vitro by taxol. Nature, 1979, 277(5698): 665–667. DOI: 10.1038/277665a0 |
| [3] | Li W, Tang YX, Wan L, et al. Effects of combining taxol and cyclooxygenase inhibitors on the angiogenesis and apoptosis in human ovarian cancer xenografts. Oncol Lett, 2013, 5(3): 923–928. |
| [4] | Bray F, Znaor A, Cueva P, et al. Planning and developing population-based cancer registration in low-and middle-income settings. IARC Technical, 2015: 1–31. |
| [5] | Wheeler NC, Jech K, Masters S, et al. Effects of genetic, epigenetic, and environmental factors on taxol content in Taxus brevifolia and related species. J Nat Prod, 1992, 55(4): 432–440. DOI: 10.1021/np50082a005 |
| [6] | Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew. Science, 1993, 260(5105): 214–216. DOI: 10.1126/science.8097061 |
| [7] | Gond SK, Kharwar RN, White Jr JFW. Will fungi be the new source of the blockbuster drug taxol?. Fungal Biol Rev, 2014, 28(4): 77–84. DOI: 10.1016/j.fbr.2014.10.001 |
| [8] | Kusari S, Singh S, Jayabaskaran C. Rethinking production of Taxol® (paclitaxel) using endophyte biotechnology. Trends Biotechnol, 2014, 32(6): 304–311. DOI: 10.1016/j.tibtech.2014.03.011 |
| [9] |
Jin R, Kang JC, Wen TC, et al. A study on optimal fermentation of an endophytic fungus producing taxol.
Mycosystema, 2011, 30(2): 235–241.
(in Chinese). 靳瑞, 康冀川, 文庭池, 等. 一株产紫杉醇内生真菌液体发酵工艺的优化. 菌物学报, 2011, 30(2): 235-241. |
| [10] | Strobel G, Yang X, Sears J, et al. Taxol from Pestalotiopsis microspora, an endophytic fungus of Taxus wallachiana. Microbiology, 1996, 142(Pt2): 435–440. |
| [11] |
Zhuang XL, Yu SH, Wang RW, et al. Detection of taxol by TLC-UV spectrophotography.
Biotechnology, 2001, 11(1): 45–47.
(in Chinese). 庄晓蕾, 于树宏, 王人为, 等. TLC-紫外分光光度法定量检测紫杉醇. 生物技术, 2001, 11(1): 45-47. |
| [12] | Zhang D, Yang Y, Castlebury LA, et al. A method for the large scale isolation of high transformation efficiency fungal genomic DNA. FEMS Microbiol Lett, 1996, 145(2): 261–265. DOI: 10.1111/fml.1996.145.issue-2 |
| [13] | Garyali S, Kumar A, Reddy MS. Diversity and antimitotic activity of taxol-producing endophytic fungi isolated from Himalayan yew. Ann Microbiol, 2014, 64(3): 1413–1422. DOI: 10.1007/s13213-013-0786-7 |
| [14] | Zhu D, Wang J, Zeng Q, et al. A novel endophytic Huperzine A-producing fungus, Shiraia sp. Slf14, isolated from Huperzia serrata. J Appl Microbiol, 2010, 109(4): 1469–1478. DOI: 10.1111/jam.2010.109.issue-4 |
| [15] | Gu Y, Wang YL, Ma XP, et al. Greater taxol yield of fungus Pestalotiopsis hainanensis from dermatitic scurf of the giant panda (Ailuropoda melanoleuca). Appl Biochem Biotechnol, 2015, 175(1): 155–165. DOI: 10.1007/s12010-014-1254-y |
| [16] | Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol, 2011, 28(10): 2731–2739. DOI: 10.1093/molbev/msr121 |
| [17] |
Wei JC.
A Manual for Fungi Identification. Shanghai: Shanghai Science and Technology Press, 1979: 560-733(in Chinese).
魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979: 560-733. |
| [18] |
Zhao K, Zhou DP, Ping WX, et al. Study on breeding up high-yield strain of taxol by protoplast mutagensis.
Chin J Biotech, 2005, 21(5): 848–851.
(in Chinese). 赵凯, 周东坡, 平文祥, 等. 产紫杉醇菌株原生质体诱变育种的研究. 生物工程学报, 2005, 21(5): 848-851. |
| [19] |
Zhao K, Yu L, Jin YY, et al. Advances and prospects of taxol biosynthesis by endophytic fungi.
Chin J Biotech, 2016, 32(8): 1038–1051.
(in Chinese). 赵凯, 宇璐, 金昱言, 等. 内生真菌紫杉醇生物合成的研究现状与展望. 生物工程学报, 2016, 32(8): 1038-1051. |
| [20] | Zhou XW, Zhu HF, Liu L, et al. A review: recent advances and future prospects of taxol-producing endophytic fungi. Appl Microbiol Biotechnol, 2010, 86(6): 1707–1717. DOI: 10.1007/s00253-010-2546-y |
| [21] |
Ren N. Genetic diversity analysis and biotransformation research among endophytic fungi from Taxus[D]. Hunan: Central South University, 2011 (in Chinese). 任娜. 红豆杉内生真菌遗传多样性分析及生物转化研究[D]. 湖南: 中南大学, 2011. |
| [22] |
Wang Q, Li RY, Liu W. The progress in antifungal resistance of pathogenic Aspergillus spp.
J Microbes Infect, 2015, 10(2): 116–121.
(in Chinese). 王千, 李若瑜, 刘伟. 致病性曲霉的耐药性研究进展. 微生物与感染, 2015, 10(2): 116-121. |
| [23] |
Sun RF, Ran XQ, Wang JF. Isolation and identification of a taxol-producing endophytic fungus from Podocrapus.
Acta Microbiol Sin, 2008, 48(5): 589–595.
(in Chinese). 孙端方, 冉雪琴, 王嘉福. 一株产紫杉醇罗汉松内生真菌的分离和鉴定. 微生物学报, 2008, 48(5): 589-595. |
| [24] | Ashkezari SJ, Fotouhifar KB. Diversity of endophytic fungi of common yew (Taxus baccata, L.) in Iran. Mycol Prog, 2017, 16(3): 247–256. DOI: 10.1007/s11557-017-1274-4 |
| [25] | Li Y, Zhang G, Pfeifer BA. Current and emerging options for taxol production. Adv Biochem Eng Biotechnol, 2015, 148: 405–425. |
 2017, Vol. 33
2017, Vol. 33




