中国科学院微生物研究所、中国微生物学会主办
文章信息
- 刘倩妮, 徐美娟, 张荣珍, 王梅洲, 张显, 杨套伟, 饶志明
- Liu Qianni, Xu Meijuan, Zhang Rongzhen, Wang Meizhou, Zhang Xian, Yang Taowei, Rao Zhiming
- 重组钝齿棒杆菌全细胞转化生产L-瓜氨酸条件优化
- Production of L-citrulline by a recombinant Corynebacterium crenatum SYPA 5-5 whole‑cell biocatalyst
- 生物工程学报, 2017, 33(11): 1889-1894
- Chinese Journal of Biotechnology, 2017, 33(11): 1889-1894
- 10.13345/j.cjb.170028
-
文章历史
- Received: January 23, 2017
- Accepted: May 17, 2017
2 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122
2 State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
L-瓜氨酸(L-Cit,C6H13N3O3)是一种非蛋白质氨基酸,在人体中易于消化和吸收。研究表明瓜氨酸在炎症和败血症的免疫应答中起到至关重要的作用,减少瓜氨酸在败血症和内毒素血症中的利用率将导致死亡率升高,补充瓜氨酸能回复精氨酸代谢平衡,提高血浆精氨酸浓度,同时提高NO的含量[1]。瓜氨酸在氮稳态中起到重要作用,它通过精氨酸和谷氨酰胺来抑制氮素循环中的不适当激活;利用瓜氨酸运输NO,能治疗新生儿肺动脉高压症[2]。瓜氨酸缺乏会导致一些自身免疫疾病,例如类风湿关节炎、牛皮癣和多发性硬化等[3]。
精氨酸脱亚胺酶(ADI)存在于生物体内的ADI途径即精氨酸降解途径中,此途径包含3种酶,分别为精氨酸脱亚氨酶(ADI)、鸟氨酸转氨基甲酰酶(OTC)和氨基甲酸酯激酶(CK),它们共同作用使1 mol精氨酸转化为鸟氨酸、氨和CO2并释放出1 mol ATP,ADI途径是某些微生物的主要能量来源。
钝齿棒杆菌SYPA 5-5 (Corynebacterium crenatum SYPA 5-5)是符合工业化安全生产的微生物菌株,发酵菌体量大,适合用于全细胞转化生产高附加值产品,主要用于各种氨基酸的生产[4],且适用于外源酶的高效表达[5-6]。本研究室前期对该菌株有过较为深入的研究。徐美娟等[7]通过对argB基因进行定点突变,提高精氨酸产量;满在伟等[4, 8]通过对该菌株进行代谢工程改造,使精氨酸产量得到进一步提升。本研究选取粪肠球菌Enterococcus faecalis来源的编码ADI基因arcA连接到表达载体pXMJ19上,电转化到钝齿棒杆菌C. crenatum中,构建高效转化L-精氨酸合成L-瓜氨酸的重组菌株。本研究首次将ADI在棒杆菌中表达,为工业化高效生产L-瓜氨酸提供借鉴。
1 材料与方法 1.1 菌株和质粒E. faecalis由本实验室保藏;C. crenatum SYPA 5-5、C. crenatum SYA 5、谷氨酸棒杆菌Corynebacterium glutamicum ATCC 13032由本实验保藏[9];表达载体pXMJ19由本实验室保藏。
本研究所用的引物为arcA F:5′-ACCGGGATC CATGAGTCATCCAATTAATG-3′(BamH Ⅰ)和arcA R:5′-ACCGGAATTCTTAATGATGATGATGATGATG AAGATCTTCACGGTAAAG-3′(EcoR Ⅰ)。
1.2 培养基及培养方法LBG培养基、种子培养基、发酵培养基及钝齿棒杆菌的菌种活化、种子培养及发酵培养均参照文献[10]。
1.3 试剂及工具酶BamH Ⅰ、EcoR Ⅰ限制性内切酶、T4 DNA连接酶、Ex Taq DNA聚合酶、dNTPs等购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒、小量质粒提取试剂盒、细菌DNA基因组提取试剂盒购于上海捷瑞生物工程有限公司;氯霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、蛋白质相对分子质量标准、L-精氨酸标样、L-瓜氨酸标样购自生工生物工程(上海)股份有限公司;其他分析纯试剂均购自国药集团化学试剂有限公司。
1.4 重组菌构建提取E. faecalis的基因组,PCR扩增目的基因arcA,将所得片段割胶回收后,经BamH I和EcoR I双酶切与经过相同双酶切的表达载体pXMJ19连接,将连接产物电转化入3种宿主感受态细胞中,感受态细胞的制备和电转化按文献[5]操作。在LBG固体培养基上培养,挑取转化子至LBG液体培养基中培养,提取得到重组质粒pXMJ19-arcA,并送至生工生物工程(上海)股份有限公司测序,结果表明成功构建重组菌株。
1.5 ADI酶的表达、纯化和酶活测定将3株重组菌按文献[4]方法表达,选择酶活最高的重组ADI进行后续实验。N端带有组氨酸标签的ADI通过Ni-NTA亲和层析,利用不同浓度的咪唑进行梯度洗脱获得纯化蛋白,将发酵上清、粗酶液和纯化酶液经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析重组菌表达和纯化结果。
配制含终浓度0.2 mol/L L-精氨酸的底物缓冲液(pH 6.5,0.2 mol/L磷酸盐缓冲液),取1.8 mL底物溶液,加入0.2 mL酶液,37 ℃反应10 min。将酶反应液稀释适当的倍数后按文献[11]测定酶活。ADI酶活定义:每分钟催化L-精氨酸转化生成1 μmol瓜氨酸的酶量定义为一个单位ADI酶活力(1 U)。比酶活定义:每毫克蛋白里包含的酶活数量(U/mg)。蛋白浓度采用Bradford法测定[12]。
1.6 L-精氨酸及L-瓜氨酸含量的测定将转化液稀释适当的倍数,以邻苯二甲醛(OPA)作为衍生化试剂进行氨基酸柱前衍生,利用HPLC进行氨基酸含量的测定[13]。
1.7 重组菌C. crenatum SYPA 5-5/pXMJ19-arcA摇瓶培养及全细胞转化生产L-瓜氨酸将重组菌C. crenatum SYPA 5-5/pXMJ19-arcA单菌落在含终浓度10 μg/mL氯霉素的10 mL LBG液体培养基中于30 ℃活化24 h,并以3%转接量转入含50 mL LBG的250 mL摇瓶中于30 ℃培养,当生长10 h时添加终浓度为0.8 mmol/L的IPTG于30 ℃诱导表达12 h。诱导结束时4 ℃离心收集细胞,用pH 6.5、0.02 mmol/L磷酸缓冲液洗涤菌体2次,用含300 g/L L-精氨酸(L-Arg)的50 mL的底物溶液(pH 6.5,0.02 mol/L磷酸缓冲液)重悬菌体,37 ℃下进行转化。
1.8 重组菌5 L罐发酵放大及罐上全细胞转化生产L-瓜氨酸重组菌5 L罐发酵参考文献[10]方法,发酵完成后收集全部菌体用pH 6.5、0.02 mol/L磷酸缓冲液洗涤2次,再投入2 L底物溶液(pH 6.5,0.02 mol/L磷酸缓冲液,300 g/L L-Arg),于37 ℃进行罐上全细胞转化。
2 结果与分析 2.1 重组菌C. crenatum SYPA 5-5/pXMJ19-arcA的构建提取E. faecalis的基因组,PCR扩增目的基因arcA,按1.5中所述方法构建重组质粒pXMJ19-arcA,将重组质粒分别电转化入C. crenatum SYPA 5-5、C. crenatum SYA 5和C. glutamicum ATCC 13032中,对获取的转化子提取质粒。重组质粒经BamH Ⅰ和EcoR Ⅰ双酶切验证arcA的大小约为1 200 bp。
2.2 重组ADI的表达和分离纯化将C. crenatum SYPA 5-5和3株重组菌C. crenatum SYPA 5-5/pXMJ19-arcA、C. crenatum SYA 5/pXMJ19-arcA和C. glutamicum ATCC 13032/ pXMJ19-arcA在相同条件下表达,并测定粗酶液酶活,结果如表 1所示。重组菌C. crenatum SYPA 5-5/pXMJ19-arcA的ADI酶活高于其他菌株,因此后续实验选择该重组菌进行全细胞转化生产L-瓜氨酸的进一步研究并对其重组ADI进行酶学性质的研究。
| Strain | Activity (U/(mL·OD600)) |
| C. crenatum SYPA 5-5 | ND |
| C. crenatum SYPA 5-5/pXMJ19-arcA | 0.058±0.003 |
| C. crenatum SYA 5/pXMJ19-arcA | 0.041±0.002 |
| C. glutamicum ATCC 13032/pXMJ19-arcA | 0.052±0.003 |
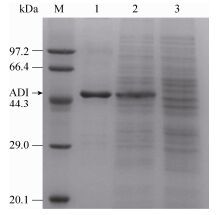
将C. crenatum SYPA 5-5/pXMJ19-arcA粗酶液进行纯化,获得纯化ADI结果如图 1所示。纯化酶液在47 kDa左右出现一条蛋白条带,与ProtParam tool (http://web.expasy.org/protparam/)在线分析理论ADI蛋白大小46.76 kDa相符,测定纯化ADI比酶活为(3.38±0.13) U/mg。
|
| 图 1 重组ADI的SDS-PAGE分析 Figure 1 SDS-PAGE analysis of the recombinant ADI. M: protein molecular weight marker; 1: purified arginase deiminase; 2: C. crenatum SYPA 5-5/pXMJ19-arcA cell extract; 3: C. crenatum SYPA 5-5 cell extract. |
| |
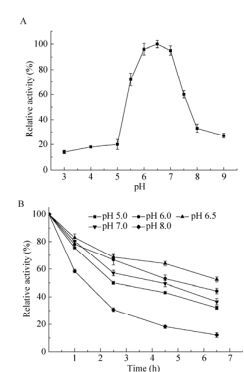
将纯化ADI在不同pH反应体系下反应,并将酶液分别置于冰上不同pH条件下分别保温1 h、2.5 h、4.5 h、6.5 h测其pH稳定性。结果如图 2A显示,重组ADI的最适pH为6.5,不同于小眼虫Euglena gracilis来源的ADI,它的最适pH为9.7,是一种碱性酶[14]。如图 2B所示重组ADI在pH范围5.0-7.0之间具有较好的稳定性。在最适pH 6.5条件下保存6.5 h仍具有52%相对酶活。但当pH > 8.0时,重组酶的稳定性迅速降低。
|
| 图 2 重组精氨酸脱亚胺酶最适反应pH(A)和pH稳定性(B) Figure 2 The optimum pH (A) and pH stability (B) of recombinant ADI. |
| |
将纯化ADI在不同温度反应体系下反应10 min,结果如图 3A显示,此研究中重组ADI的最适温度为37 ℃,与变形假单胞菌Pseudomonas plecoglossicida来源的ADI最适温度相似[15]。将重组酶置于不同温度下处理研究其热稳定性,结果如图 3B显示,重组ADI在37 ℃保存3 h仍具有50%以上相对酶活,并且在高温50 ℃下保存0.5 h仍具有37%的相对酶活。

|
| 图 3 重组精氨酸脱亚胺酶最适反应温度(A)和温度稳定性(B) Figure 3 The optimum temperature (A) and temperature stability (B) of recombinant ADI. |
| |
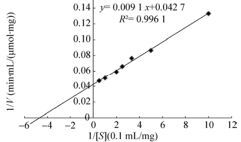
将重组纯酶与含不同摩尔浓度(0.01-0.2 mol/L)的L-Arg底物溶液(pH 6.5,0.2 mol/L磷酸缓冲液溶液)在37 ℃反应10 min,测定反应速度。以反应速度的倒数为纵坐标(1/V),L-Arg摩尔浓度的倒数(1/[S])为横坐标作Lineweaver-Burk图,如图 4得出ADI米氏常数Km为12.18 mmol/L,最大反应速率Vm值为0.36 μmol/(min·mL)。
|
| 图 4 重组精氨酸脱亚胺酶的酶动力学常数图 Figure 4 Lineweaver-Burk plots of the recombinant ADI. |
| |
将重组菌于5 L罐培养,菌体转入罐中后开始添加IPTG至终浓度为0.8 mmol/L诱导表达,设置其他组依次延后数小时添加相同浓度IPTG诱导,每组均于30 ℃诱导12 h。测定诱导时OD600,诱导结束时4 ℃离心收集细胞测定酶活。如图 5所示,重组菌生长0-18 h时开始诱导,随着起始诱导时间的增加,ADI酶活逐渐增加,当初始诱导时间为18 h左右时开始诱导效果最好,酶活达0.34 U/mL。但当初始诱导时间大于24 h后,最终酶活随初始诱导时间的增加而逐渐降低。当菌体生长96 h开始诱导,重组菌的酶活仅为0.03 U/mL,仅为18 h开始诱导酶活的0.09倍。可见合适的诱导时间对高效全细胞转化L-Cit十分重要。
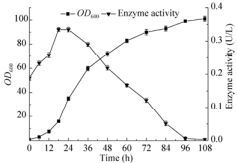
|
| 图 5 诱导起始时间对重组菌酶活的影响 Figure 5 Effects of induction time on whole-cell bioconversion. |
| |
重组菌在30 ℃培养18 h (OD600=17.2)时,补加IPTG至终浓度0.8 mmol/L。每隔一定时间取样测定发酵上清液含糖量、pH值和OD600,开始诱导后每隔一定时间取菌液测定酶活。由图 6可知,当发酵时间为48 h即诱导30 h时,重组菌的酶活达0.42 U/mL,此后酶活趋于稳定,当发酵进行120 h时酶活明显下降。可见重组菌进行5 L罐放大时培养48 h效率最高。
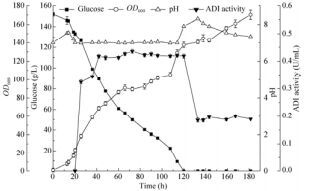
|
| 图 6 C. crenatum SYPA 5-5/pXMJ19-arcA的5 L罐发酵 Figure 6 Fermentation by C. crenatum SYPA 5-5/pXMJ19-arcA in 5 L fermentor. |
| |
将重组菌在含不同浓度底物L-Arg (0-400 g/L)条件下转化12 h,并计算L-Cit的平均生成速率。结果如图 7所示,当L-Arg浓度小于300 g/L时,随着底物浓度的增加,L-Cit的平均生成速率逐渐增加,至200 g/L时平均生成速率升至6.74 g/(L·h),随后平均生成速率缓慢增加, 当底物浓度达到300 g/L时平均转化速率升至7.05 g/(L·h)。然而当底物浓度大于300 g/L时由于底物抑制转化速率快速下降,当底物浓度为400 g/L时平均生成速率仅为3.28 g/(L·h)。因此当L-Arg浓度为200-300 g/L时,更适合L-Cit的高效转化。
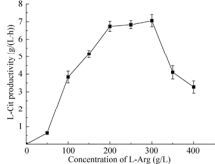
|
| 图 7 底物浓度对全细胞转化的影响 Figure 7 Effects of L-Arg concentration on whole-cell bioconversion. |
| |
将重组菌进行5 L罐发酵,诱导28 h后于37 ℃进行罐上全细胞转化,当转化液中底物L-精氨酸将耗尽时,离心收集细胞并用磷酸缓冲液洗涤,将细胞在上述条件下继续转化,重复多次操作。结果如图 8所示,第一批次(0-36 h)生产效率最高,转化进行36 h时L-Cit浓度达299.9 g/L,平均L-Cit生成速率高达8.33 g/(L·h),转化率达99%。第三批次(72-108 h)转化时部分菌体开始死亡,生产速率逐渐下降,至第七批次(252-348 h) L-Cit的平均生产速率仅为2.66 g/(L·h)。最终在348 h内共投入底物L-Arg 2 100 g/L,全细胞转化生成L-Cit共1 940 g/L,总平均生产速率为5.57 g/(L·h),总平均转化率为92.4%。

|
| 图 8 C. crenatum SYPA 5-5/pXMJ19-arcA的5 L罐多批次全细胞转化 Figure 8 Whole-cell bioconversion for the production of L-Cit in 5 L fermenter. |
| |
本研究首次将E. faecalis来源的ADI在棒杆菌C. crenatum SYPA 5-5中进行表达,并用于全细胞转化生产L-瓜氨酸。通过酶学性质研究得知重组酶反应的最适温度为37 ℃,最适pH为6.5,反应条件温和适用于工业化放大生产。重组ADI与P. plecoglossicida来源的ADI最适温度相似,但重组ADI在20-50 ℃之间相对酶活优于P. plecoglossicida来源[15]。乳酸乳球菌Lactococcus lactis来源的ADI具有高达60 ℃的最适温度[16],但此温度既不适合微生物生长也不利于后续的发酵生产和工业化。此外重组ADI在最适反应温度37 ℃下保温5 h后仍有50%以上相对酶活,在高温50 ℃下保存0.5 h仍具有37%的相对酶活。恶臭假单胞菌Pseudomonas putida来源的ADI在55 ℃ (P. putida来源ADI的最适反应温度为50 ℃)下保存仅3 min,酶活降低50%[17];L. lactis来源的ADI在此酶的最适反应温度60 ℃下保存15 min后酶活下降一半[16],可见E. faecalis来源的ADI在该酶的最适温度下有较高的热稳定性。
任丽梅等将单增李斯特菌Listeria monocytogenes来源ADI通过大肠杆菌进行高效表达,通过一步酶促反应使L-精氨酸分解生成L-瓜氨酸,5.5 h内可使94-258 g/L的精氨酸转化为瓜氨酸,但需添加7 920-17 600 U/L的ADI[18]。马越等将P. putida ACCC 10185的ADI通过大肠杆菌表达,并将此酶用于转化L-精氨酸盐酸盐生成L-瓜氨酸,在最佳转化条件下可使650 g/L L-精氨酸盐酸盐于7 h内完全转化,但添加酶量高达24 U/g底物[19]。酶转化生产L-瓜氨酸具有反应条件温和、效率高等特点,但酶转化法对ADI酶添加量要求较高需耗费大量发酵原料且转化过程中要求较高的酶稳定性,但ADI酶普遍具有稳定性不高的特点[15-17],难以实现ADI酶的重复利用。本研究利用全细胞法转化生产L-瓜氨酸,构建重组C. crenatum SYPA 5-5菌株能使ADI在细胞体内保持高效酶转化活力,反应条件温和,重组菌株符合工业化安全生产[4]且细胞可多次利用,后续重组细胞与产物仅需离心便可分离,具有更好的工业化应用前景。
此前全细胞转化生产L-瓜氨酸文献报道多集中于大肠杆菌宿主,Song等[20]将L. lactis来源的ADI在E. coli BL21 (DE3)中表达,并通过易错PCR获得一株高酶活突变体FMMME106,此突变体能转化176.9 g/L的L-瓜氨酸,转化率为92.6%;Yang等[21]使用壳聚糖固定化E. faecalis细胞并放大到工业化规模,210 kg的固定化细胞能转化1 000 kg L-精氨酸生成974.6 kg L-瓜氨酸。本研究首次将ADI在棒杆菌中表达,并进行了5 L罐发酵和罐上转化,首批次转化300 g/L L-精氨酸转化速率高达8.33 g/(L·h),转化率达99%,C. crenatum SYPA 5-5表达菌株不需固定化也能进行多批次转化,能大大减少发酵原料和能源的消耗,且菌株多批次转化生产L-瓜氨酸的累计产量的产量能达到1 940 g/L,总平均转化率高达92.4%。
| [1] | Wijnands KAP, Castermans TMR, Hommen MPJ, et al. Arginine and citrulline and the immune response in sepsis. Nutrients, 2015, 7(3): 1426–1463. DOI: 10.3390/nu7031426 |
| [2] | Fike CD, Summar M, Aschner JL. L-citrulline provides a novel strategy for treating chronic pulmonary hypertension in newborn infants. Acta Paediatr, 2014, 103(10): 1019–1026. DOI: 10.1111/apa.2014.103.issue-10 |
| [3] | Curis E, Nicolis I, Moinard C, et al. Almost all about citrulline in mammals. Amino Acids, 2005, 29(3): 177–205. DOI: 10.1007/s00726-005-0235-4 |
| [4] | Man ZW, Rao ZM, Xu MJ, et al. Improvement of the intracellular environment for enhancing L-arginine production of Corynebacterium glutamicum by inactivation of H2O2-forming flavin reductases and optimization of ATP supply. Metab Eng, 2016, 38: 310–321. DOI: 10.1016/j.ymben.2016.07.009 |
| [5] | Zhang X, Wu D, Yang TW, et al. Over-expression of Mycobacterium neoaurum 3-ketosteroid-Δ1-dehydrogenase in Corynebacterium crenatum for efficient bioconversion of 4-androstene-3, 17-dione to androst-1, 4-diene-3, 17-dione. Electron J Biotechnol, 2016, 24: 84–90. DOI: 10.1016/j.ejbt.2016.10.004 |
| [6] | Xu MJ, Qin JR, Rao ZM, et al. Effect of Polyhydroxybutyrate (PHB) storage on L-arginine production in recombinant Corynebacterium crenatum using coenzyme regulation. Microb Cell Fact, 2016, 15(1): 15. DOI: 10.1186/s12934-016-0414-x |
| [7] | Xu MJ, Rao ZM, Dou WF, et al. Site-directed mutagenesis and feedback-resistant N-acetyl-L-glutamate kinase (NAGK) increase Corynebacterium crenatum L-arginine production. Amino Acids, 2012, 43(1): 255–266. DOI: 10.1007/s00726-011-1069-x |
| [8] | Man ZW, Xu MJ, Rao ZM, et al. Systems pathway engineering of Corynebacterium crenatum for improved L-arginine production. Sci Rep, 2016, 6: 28629. DOI: 10.1038/srep28629 |
| [9] |
Xiong XJ, Dou WF, Xu ZH, et al. L-arginine production by arginine analog-resistant mutant of microorganisms.
J Wuxi Univer of Light Ind, 2003, 22(2): 10–13.
(in Chinese). 熊筱晶, 窦文芳, 许正宏, 等. L-精氨酸高产菌的诱变育种及其摇瓶产酸条件. 无锡轻工大学学报, 2003, 22(2): 10-13. |
| [10] | Xu H, Dou WF, Xu HY, et al. A two-stage oxygen supply strategy for enhanced L-arginine production by Corynebacterium crenatum based on metabolic fluxes analysis. Biochem Eng J, 2009, 43(1): 41–51. DOI: 10.1016/j.bej.2008.08.007 |
| [11] |
Qian JN, Sun ZH, Liu YP, et al. Determination of L-citrulline in enzymatic conversion solution by diacetylmonoxime-thiosemicarbazide colorimetry.
Chin J Pharmaceuticals, 2007, 38(7): 519–522.
(in Chinese). 钱嘉南, 孙志浩, 刘宇鹏, 等. 二乙酰一肟-氨基硫脲比色法测定酶转化液中的L-瓜氨酸. 中国医药工业杂志, 2007, 38(7): 519-522. |
| [12] | Kruger NJ. The bradford method for protein quantitation//Walker JM, Ed. The Protein Protocols Handbook. Totowa, NJ: Humana Press Inc., 2002: 15-21. |
| [13] | Mao HM, Wei W, Xiong WJ, et al. Simultaneous determination of L-citrulline and L-arginine in plasma by high performance liquid chromatography. Clin Biochem, 2010, 43(13/14): 1141–1147. |
| [14] | Park BS, Hirotani A, Nakano Y, et al. Purification and some properties of arginine deiminase in Euglena gracilis Z. Agric Biol Chem, 1984, 48(2): 483–489. |
| [15] | Ni Y, Li ZW, Sun ZH, et al. Expression of arginine deiminase from Pseudomonas plecoglossicida CGMCC2039 in Escherichia coli and its anti-tumor activity. Curr Microbiol, 2009, 58(6): 593–598. DOI: 10.1007/s00284-009-9376-0 |
| [16] | Kim JE, Jeong DW, Lee HJ. Expression, purification, and characterization of arginine deiminase from Lactococcus lactis ssp. lactis ATCC 7962 in Escherichia coli BL21. Protein Expr Purif, 2007, 53(1): 9–15. DOI: 10.1016/j.pep.2006.12.002 |
| [17] | Shibatani T, Kakimoto T, Chibata I. Crystallization and properties of L-arginine deiminase of Pseudomonas putida. J Biol Chem, 1975, 250(12): 4580–4583. |
| [18] |
Ren LM, Cheng ZY, Li XJ, et al. Studies of arginine deiminase activity and conversion of L-citrulline.
Amino Acids Biotic Res, 2015, 37(3): 69–74.
(in Chinese). 任丽梅, 成志远, 李晓静, 等. 精氨酸脱亚胺酶活性以及瓜氨酸转化研究. 氨基酸和生物资源, 2015, 37(3): 69-74. |
| [19] |
Ma Y, Su LQ, Wu D, et al. Optimization of preparing L-citrulline by recombinant arginine deiminase.
Biotechnol Bull, 2015, 31(8): 180–185.
(in Chinese). 马越, 宿玲恰, 吴丹, 等. 重组精氨酸脱亚胺酶制备L-瓜氨酸的工艺条件优化. 生物技术通报, 2015, 31(8): 180-185. |
| [20] | Song W, Sun X, Chen XL, et al. Enzymatic production of L-citrulline by hydrolysis of the guanidinium group of L-arginine with recombinant arginine deiminase. J Biotechnol, 2015, 208: 37–43. DOI: 10.1016/j.jbiotec.2015.05.012 |
| [21] | Yang ZY. Immobilization of Enterococcus faecalis cells with chitosan: a new process for the industrial production of L-citrulline. Process Biochem, 2015, 50(7): 1056–1060. DOI: 10.1016/j.procbio.2015.02.010 |
 2017, Vol. 33
2017, Vol. 33