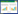中国科学院微生物研究所、中国微生物学会主办
文章信息
- 严丽蔚, 巩蔚, 朱文兵, 张雪梅, 徐婧雯, 吴忠香, 卢孔杰, 孙明, 董少忠
- Yan Liwei, Gong Wei, Zhu Wenbing, Zhang Xuemei, Xu Jingwen, Wu Zhongxiang, Lu Kongjie, Sun Ming, Dong Shaozhong
- 狂犬病病毒糖蛋白表达及纯化及其记忆性B细胞结合能力的分析
- Expression and purification of rabies virus glycoprotein and analysis of its specific binding capacity to memory B cells
- 生物工程学报, 2017, 33(11): 1840-1849
- Chinese Journal of Biotechnology, 2017, 33(11): 1840-1849
- 10.13345/j.cjb.170060
-
文章历史
- Received: February 21, 2017
- Accepted: May 8, 2017
狂犬病病毒糖蛋白(RVG)是一种典型的跨膜糖蛋白,作为唯一暴露在病毒颗粒表面并诱导产生病毒中和抗体的抗原[1],其介导病毒与细胞表面受体的结合[2-3],与病毒毒力直接相关,是有效的保护性抗原[4]。目前,主要运用不同表达系统对RVG基因全长进行表达,表达系统包括大肠杆菌、酵母[5-6]和昆虫细胞[7-8]等。但大多数情况下表达产量较低且纯度不高,不利于后续的研究应用[9]。鉴于狂犬病毒糖蛋白膜外区是决定抗原性、组织嗜性及毒力的最重要部分,RVG上第Ⅱ和第Ⅲ抗原部位是病毒与中和抗体的主要结合部位[10],因此,也有研究尝试采用截断的RVG基因片段进行表达和纯化[11]。
抗体是由浆细胞分泌产生,记忆性B细胞在机体再次感染同一抗原时,可以快速分化为分泌抗体的浆细胞,介导迅速的记忆性免疫应答[12],故对特异性记忆性B细胞进行分析,也是对机体产生免疫评价的一个重要补充。同时,单个B细胞分选单抗技术要求具备高亲和力结合记忆B细胞特异性抗原[13]。单个特异性记忆性B细胞分选制备单克隆抗体是一种制备单克隆抗体的新型方法[14]。此方法的关键点是利用流式技术获得单个特异性记忆性B细胞,候选抗原的纯度、浓度以及和抗体的亲和力等对分选至关重要[15]。鉴于狂犬病病毒的糖蛋白与感染、免疫和抗体水平评价、抗体分选的紧密关系,本实验通过研究不同表达系统获得不同的目的蛋白,以期能够获取用于分选特异性记忆B细胞的候选抗原。
本实验采用基因工程的方法,利用不同的原核表达系统(pGEX-5X-1,pET28a,pET30a)分别表达带有不同标签(GST-tag和His-tag)的全长和膜外区RVG,纯化后鉴定、分析比较和狂犬免疫球蛋白的结合能力,再利用荧光标记和流式细胞技术,用于目标记忆B细胞的分选。
1 材料与方法 1.1 材料 1.1.1 菌株大肠杆菌Escherichia coli DH5α、BL21(DE3)和Rosetta (DE3) pLysS以及原核表达载体pGEX-5X-1(4 972 bp,GST-tag)、pET28a(5 369 bp,His-tag)、pET30a(5 422 bp,His-tag)均由本实验室保存;毒株狂犬病病毒CTN-1株由本实验室保存。
1.1.2 主要试剂限制性内切酶EcoRⅠ和XhoⅠ,T4 DNA连接酶均购自BioLab;Trizol、DNA纯化回收试剂盒和质粒小提试剂盒均购自天根生化科技(北京)有限公司;HRP标记的羊抗人抗体购自碧云天生物技术研究所;逆转录试剂盒PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit、Primer StarMax(2×)均购自宝生物工程(大连)有限公司;蛋白荧光标记试剂盒购自Innova Bioscience;人狂犬病免疫球蛋白购自广东双林生物制药有限公司。CD19、CD27抗体购自美国BD生物公司。
1.2 方法 1.2.1 表达载体的构建根据狂犬病病毒CTN-1株G基因的序列(GenBank登录号为FJ959397.1),采用Primer Premier 5.0软件设计狂犬病毒CTN-1株G基因全长序列(1 575 bp)和膜外区去除信号肽序列(1 308 bp)的引物,并在上下游引物中分别引入酶切位点EcoRⅠ和XhoⅠ(用下划线表示),见表 1。Trizol法提取病毒RNA,经逆转录合成cDNA,以cDNA为模板进行特异PCR扩增。用EcoRⅠ和XhoⅠ对扩增出的DNA片段和载体pGEX-5X-1、pET28a、pET30a进行双酶切,然后将酶切后的载体pGEX-5X-1和pET28a与G基因全长序列连接,载体pET30a和G基因膜外区连接,16 ℃过夜,将连接后质粒转化到E. coli DH5α,提取质粒,经双酶切鉴定,并送铂尚生物技术(上海)有限公司测序。鉴定正确的质粒命名为pGEX-5X-1-RVG、pET28a-RVG和pET30a-G。
| Primer name | Primer sequence (5′-3′) |
| RVG-F | GGAATTCATTCCTCAAGCTCTGTTGTTT |
| RVG-R | GGCTCGAGTTACAGCTTGGTCTCACCTCC |
| G-F | GGAATTCAAATTCCCCATTTACACGA |
| G-R | CCTCGAGTTATTTGGGAGACCGAGAT |
| Restriction sites were underlined. | |
将鉴定为阳性的表达载体的pGEX-5X-1-RVG转化到Rosetta(DE3) pLysS感受态中,pET28a-RVG、pET30a-G转化到BL21(DE3)感受态中;挑取重组工程菌接种于含有1%葡萄糖的LB液体培养基中,37 ℃、200 r/min摇床过夜;将培养物按1:50的比例接种至10 mL新鲜LB液体培养基,37 ℃、220 r/min振荡培养约3 h至菌液A600为0.6时,进行诱导表达。IPTG诱导终浓度为0.5 mmol/L,温度为16 ℃,诱导12 h。收集菌体,超声波破菌后,4 ℃、8 000 r/min离心15 min,分别收集上清和沉淀,进行12% SDS-PAGE分析目的蛋白的表达情况。其中,载体pGEX-5X-1-RVG、pET28a-RVG、pET30a-G对应表达的重组蛋白形式分别为GST-RVG (约85.2 kDa)、His-RVG (约62.4 kDa)、His-G (约54.8 kDa)。同时用空载体pGEX-5X-1、pET28a和pET30a作为阴性对照。
1.2.3 蛋白纯化根据目的蛋白所带标签和表达情况的不同,选择不同的纯化方法。其中蛋白GST-RVG采用GST亲和层析柱纯化;蛋白His-RVG采用阴离子柱层析和镍柱亲和层析纯化;蛋白His-G采用包涵体变性复性的方法纯化。
1.2.4 重组蛋白的抗原特异性鉴定采用Western blotting鉴定。纯化后重组蛋白GST-RVG、His-RVG、His-G经12% SDS-PAGE分离后,转移至PVDF膜上,以5%脱脂奶粉封闭1 h,加入抗狂犬病病毒免疫球蛋白(1:10 000),室温孵育2 h;TBST洗涤3次,每次5 min,再加入HRP标记的羊抗人IgG (1:30 000稀释),室温孵育1 h;TBST洗涤4次,每次10 min;ECL显影。
1.2.5 重组蛋白与抗狂犬病病毒免疫球蛋白的亲和力检测通过竞争ELISA法来检测纯化后重组蛋白与狂犬免疫球蛋白的亲和力大小。用纯化后的重组蛋白包被两块抗原板,4 ℃过夜,用PBST洗板3次后,用3%的MPBS (MPBS即含有脱脂奶粉的PBS)室温封闭2 h,PBST洗板3次;在一排12个试管中,建立从0.1 nmol/L-1 μmol/L浓度梯度的抗原即蛋白PBS溶液,加入终浓度为0.5 nmol/L的抗狂犬病病毒抗体,加入抗体溶液使总体积为100 μL,室温孵育30 min后,加入90 μL反应混合物到前述已被包被抗原的微孔中,微孔中预先加入30 μL的30% MPBS后孵育,时间不超过10 min;孵育结束后,将反应混合物转入另一块包被抗原的板中,第二块板的ELISA操作与第一块相同。充分洗涤第一块和第二块板,加入带HRP标记的羊抗人IgG (1:750稀释),室温1 h,PBST洗板3次,加入TMB显色液100 μL/孔,37 ℃避光10 min,加入2 mol/L H2SO4终止反应;检测各孔的吸光度值。在半饱和状态下(ELISA信号强度是最高强度的一半)所得到的抗原浓度约等于解离常数Kdis (Kdis=C/nM,C为蛋白总浓度,n为蛋白稀释倍数,M为蛋白相对分子质量),解离常数的倒数即为亲和力。
1.2.6 免疫后血清中抗狂犬病病毒抗体水平检测采用间接ELISA法。志愿者按照暴露前程序接受狂犬疫苗接种,在接种第3针后14 d,采集志愿者血液5 mL,分离血清。将纯化的GST-RVG包被酶标板,包被液为碳酸盐缓冲液(pH 9.6),每孔0.7 μg蛋白,4 ℃过夜;PBST洗板3次后,用1% BSA封闭液室温封闭1 h;洗板3次,加入稀释的阴性血清(志愿者免疫前血清),狂犬病毒免疫球蛋白以及志愿者免疫后血清(稀释倍数为1:6 400),室温孵育2 h;洗板3次,加入HRP标记的羊抗人二抗(1:750稀释),孵育1 h后加入TMB显色液100 μL/孔,37 ℃避光10 min,加入2 mol/L H2SO4终止反应;检测各孔的吸光度值。
1.2.7 GST-RVG标记FITC使用Lightning-Link荧光标记试剂盒。将1 mL GST-RVG (516 μg/mL)和100 μL LL-modifier reagent混匀后,加入到Lightning-Link®mix中轻轻混匀,避光,4 ℃过夜后,加入100 μL LL-quencher FD reagent,放置30 min。
1.2.8 流式细胞术检测特异性结合记忆性B细胞采用流式细胞术。志愿者按照暴露前程序接受狂犬疫苗接种,在接种第3针后14 d,采集志愿者血液5 mL,用来分离外周血淋巴细胞(Peripheral blood mononuclear cells,PBMCs)。将ELISA鉴定为阳性志愿者的PBMCs样品进行流式细胞术分析,并将接种疫苗前的血清和PBMCs作为阴性对照。将冻存的PBMCs复苏后,37 ℃过夜培养,离心收集细胞并计数,细胞数量达到约1×106个1管,PBS洗涤2次,离心后弃上清。为确定最佳的标记蛋白使用量,我们分别采用10、20、40 μg的GST-RVG-FITC对PBMCs进行细胞染色,同时加入10 μL anti-CD19-PE抗体,10 μL anti-CD27-APC[16]抗体4 ℃避光30 min,用PBS洗涤,离心后弃上清,加入200 μL PBS,流式细胞仪检测并分选。
2 结果 2.1 重组表达载体的构建PCR扩增产物pGEX-5X-1-RVG、pET28a-RVG和pET30a-G经EcoRⅠ和XhoⅠ双酶切后,1%琼脂糖凝胶电泳分析产物,载体片段、全长序列(1 575 bp)和膜外区序列(1 308 bp)的基因片段均与预期相符(图 1A和1B);测序结果与GenBank标准序列一致,表明质粒pGEX-5X-1-RVG、pET28a-RVG和pET30a-G均构建成功。
|
| 图 1 重组蛋白原核表达载体构建 Figure 1 Construction of expression vectors of the recombinant proteins. M: DNA marker DL10000. (A) 1: PCR products of G gene; 2: PCR products of G gene extracellular membrane sequence; (B) 3: pGEX-5X-1-RVG digested with EcoRⅠ and XhoⅠ; 4: pET28a-RVG digested with EcoRⅠand XhoⅠ; 5: pET30a-G digested with EcoRⅠ and XhoⅠ. |
| |
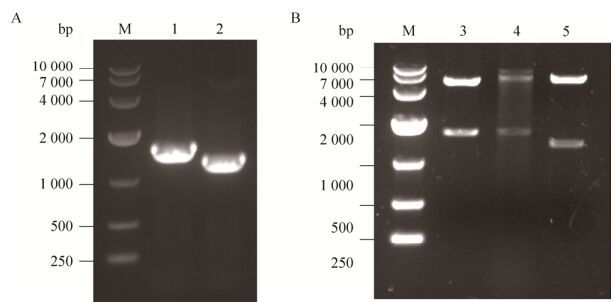
12% SDS-PAGE结果显示,可见相对分子质量约为85 kDa (pGEX-5X-1-RVG)、62 kDa (pET28a-RVG)和55 kDa (pET30a-G)的目的蛋白条带,大小均与预期相符,且GST-RVG、His-RVG在添加1%葡萄糖培养表达量明显增多,见图 2。
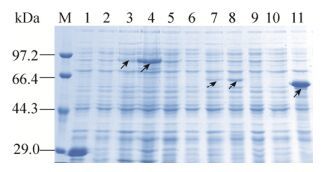
|
| 图 2 表达产物的SDS-PAGE分析 Figure 2 SDS-PAGE profile of expressed proteins. M: protein marker; 1: total protein of pGEX-5X-1 after induction; 2: total protein of pGEX-5X-1-RVG before induction; 3: total protein of pGEX-5X-1-RVG after induction; 4: total protein of pGEX-5X-1-RVG after induction incubated in culture with 1% glucose; 5: total protein of pET28a after induction; 6: total protein of pET28a-RVG before induction; 7: total protein of pET28a-RVG after induction; 8: total protein of pET28a-RVG after induction. |
| |
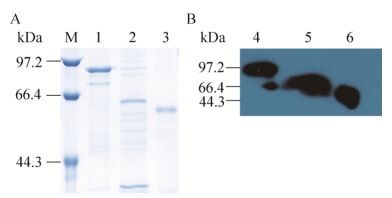
12% SDS-PAGE分析纯化上述表达蛋白,可见相对分子质量约为85 kDa (亲和层析)、62 kDa (阴离子交换层析和亲和层析)和55 kDa (包涵体变性复性)大小条带(图 3A)。Bradford法检测蛋白浓度,GST-RVG:516 μg/mL,His-RVG:1 224 μg/mL,His-G:320 μg/mL。Scion Image灰度扫描计算蛋白纯度,GST-RVG:87.12%,His-RVG:23.1%,His-G:95.2%,见表 2。Western blotting结果显示,纯化后蛋白均可与人狂犬病毒免疫球蛋白特异性结合(图 3B)。
|
| 图 3 纯化后蛋白SDS-PAGE (A)和Western boltting (B)鉴定 Figure 3 Identification of purified proteins by SDS-PAGE (A) and Western blotting (B). M: protein marker; 1, 4: purified GST-RVG; 2, 5: purified His-RVG; 3, 6: purified His-G. |
| |
| Mr (kDa) | Tag | Purity (%) | Affinity | |||
| Low ( < 105L/mol) | Middle (107-108L/mol) | High ( > 108L/mol) | ||||
| GST-RVG | 85.2 | GST | 87.12 | 1.38×108 | ||
| His-RVG | 62.4 | 6×His | 23.1 | 5.1×107 | ||
| His-G | 54.8 | 6×His | 95.2 | 1.7×105 | ||
竞争ELISA法结果显示,纯化后不同蛋白与人狂犬病毒免疫球蛋白的亲和力大小分别为:GST-RVG:1.38×108 L/mol,His-RVG:5.1×107 L/mol,His-G:1.7×105 L/mol,结果见表 2。通常,抗原抗体反应的亲和常数Ka (Affinity constant)小于105 L/mol为低亲和力,107-108 L/mol为中等亲和力,大于108 L/mol为高等亲和力。故GST-RVG与人狂犬病毒免疫球蛋白为高亲和力结合,His-RVG与特异性抗体属于中等亲和力结合,His-G与则以低亲和力结合特异性抗体。由此,后续实验将使用GST-RVG作为阳性血清和特异性B细胞的候选抗原进行分析。
2.5 免疫后血清中抗狂犬病病毒抗体水平检测为了进行特异性单个记忆性B细胞的分选,我们对志愿者免疫前后的血清进行了ELISA检测,结果显示,高亲和力的GST-RVG可用于免疫后血清样本的分析检测,与亲和力的计算结果吻合,由此,我们最终确认GST-RVG用于记忆B细胞的分选(图 4)。且当血清稀释度为6 400倍时,阴性血清和志愿者1的免疫后血清OD450值相比P < 0.01(**),差异具有较强的统计学意义,阴性血清和人狂犬病毒免疫球蛋白OD450值相比P < 0.05(*),差异具有统计学意义,故选择志愿者1的PBMCs进行下一步实验。

|
| 图 4 间接ELISA检测免疫后志愿者血清抗体结果 Figure 4 Indirect ELISA detection of serum antibody results of volunteers after immunization. |
| |
在比较了10、20和40 μg GST-RVG-FITC染色1×106个PBMCs的荧光信号强弱后,确定以20 μg GST-RVG-FITC标记1×106个PBMCs,随后采用anti-CD19-PE抗体(CD19,B细胞特异性表面分子)、anti-CD27-APC抗体(CD27,记忆B细胞特异性表面分子)和GST-RVG-FITC进行狂犬病毒抗原特异性记忆B细胞的分选,流式细胞术检测结果显示,阴性对照组(免疫前)和实验组(免疫后)的B细胞、记忆B细胞分群及所占比例情况基本一致(图 5B、C、F、G);阴性对照组中记忆B细胞(CD19+和CD27+)能识别GST-RVG而被GST-RVG-FITC染色的数量极少,而实验组中有相当数量的FITC阳性记忆B细胞(CD19+和CD27+),提示实验组中GST-RVG可以特异性结合记忆B细胞。如图 5D、5H所示,我们选取了GST-RVG-FITC染色标记的部分记忆B细胞,初步比较了阴性对照组和实验组间的差别,即0% vs 8.11%。实验组中GST-RVG-FITC染色的记忆B细胞,可能含有抗狂犬病病毒抗体基因的B细胞克隆。
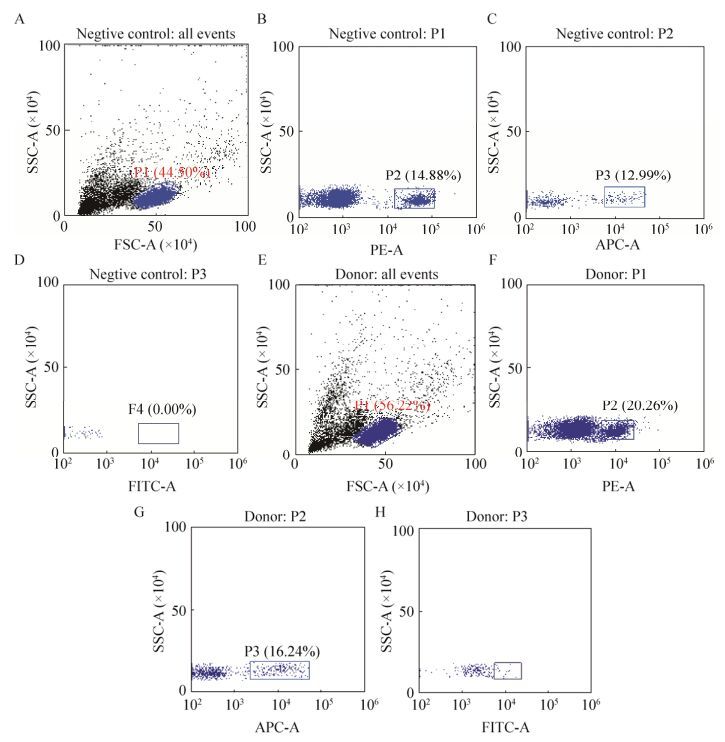
|
| 图 5 流式细胞术分析PBMC的抗狂犬病病毒记忆B细胞 Figure 5 Flow cytometry analysis of anti-rabies virus memory B cells of PBMCs. (A, E) PBMCs population selected on the basis of forward and side light scatter. (B, F) B cell selected from PBMCs (anti-CD19). (C, G) Memory B cell selected from B cell (anti-CD27). (D, H) Anti-rabies virus memory B cell selected from memory B cell (rabies virus glycoprotein labelled with FITC). |
| |
本实验采用基因工程的方法构建了pGEX-5X-1-RVG、pET28a-RVG和pET30a-G三个原核表达载体。通过不同温度、添加葡萄糖等诱表达条件的摸索,获得了大小分别为85 kDa (GST-RVG)、62 kDa (His-RVG)及55 kDa (His-G)的重组蛋白。经过不同纯化方法获得的3种蛋白,Western blotting结果显示均能够与阳性血清特异性结合,竞争性ELISA[17]结果显示,3个蛋白中,仅GST-RVG与抗狂犬病病毒抗体为较高亲和力结合。随后,以GST-RVG为初步候选抗原进行下一步实验,间接ELISA结果显示GST-RVG能够用于检测狂犬病毒疫苗免疫后志愿者血清抗体水平高低,FITC荧光标记GST-RVG后,结合CD19、CD27抗体,流式细胞术检测志愿者1的PBMCs,可以检测分选到抗原特异性的记忆B细胞。
采用原核系统表达RVG是一个快速有效获得目的蛋白的方法[18]。本实验表达纯化并分析了带不同标签的不同分子量的糖蛋白。由于膜蛋白的高度疏水性和错误的折叠可能引起蛋白聚集,从而导致快速降解或是形成沉淀,故膜蛋白通常很难大量表达和纯化。但是如果膜蛋白以融合蛋白的形式表达,这个问题可以在一定程度上得到缓解[19]。可能的原因包括:1)狂犬病毒G蛋白胞外区蛋白(His-G)是带有6×His标签的重组蛋白,其标签对目的蛋白空间结构的影响相对较小。His-G表达量高,但多以包涵体的形式存在,针对包涵体变性、复性和后续检测发现,其与阳性血清结合的亲和力较低,原因可能是狂犬病毒胞外区G蛋白的不完整性部分制约了其生物学功能[20],变性和复性也可能影响了其折叠及功能[21]。2)对于重组蛋白His-RVG,由于RVG全长基因信号肽、跨膜区和膜内区含有大量的稀有密码子,导致RVG全长基因难以获得高表达[22],超声菌体上清中包含少量His-RVG,而在添加1%葡萄糖培养后,其表达量明显增高,可能原因是完整的狂犬病毒G蛋白在此表达系统中毒性较大[23],宿主菌受到了抑制,1%的葡萄糖可以抑制毒性增强表达。但对其上清进行离子交换和亲和层析后,得到的His-RVG纯度偏低,杂蛋白可能会影响His-RVG与免疫球蛋白的结合,无法在后续实验中使用。3)对于重组蛋白GST-RVG,GST是一种高度可溶的蛋白,可增加外源蛋白的可溶性[24]。亲和层析纯化获得了纯度、浓度均满足我们实验目的的GST-RVG,具备和抗体高亲和力结合的特性(Ka=1.38×108 L/mol),流式细胞技术显示GST-RVG能够和抗原特异性记忆B细胞结合,分离特异性群落的分群显示为阳性,阳性率为0.15%。鉴于其与特异性细胞结合的高亲和力特性,该候选蛋白还可用来判断疫苗接种后的免疫效果及毒株间的抗原性比较。
目前,狂犬病的防治主要是通过疫苗进行预防和使用免疫球蛋白进行紧急治疗,但免疫球蛋白多来源于马及人血清,异源性和副作用导致了免疫球蛋白的使用受限[25]。单个特异性记忆性B细胞分选制备单克隆抗体是一种制备单克隆抗体的新型方法,该方法的关键点是分选得到单个抗原特异性记忆性B细胞,如何获得用于分选的高要求抗原至关重要。本研究基于表达不同的狂犬病病毒糖蛋白,进而选择具有较高纯度以及与阳性血清具有较高亲和力特性的蛋白,用于筛选抗狂犬病病毒糖蛋白的记忆性B细胞,为分离纯化得到单克隆抗体奠定基础。
| [1] | Perrin P, Thibodeau L, Sureau P. Rabies immunosomes (sub-unit vaccine) structure and immunogenicity. Pre-and post-exposure protection studies. Vaccine, 1985, 3(3): 325–332. |
| [2] | Sun X, Roth SL, Bialecki MA, et al. Internalization and fusion mechanism of vesicular stomatitis virus and related rhabdoviruses. Future Virol, 2010, 5(1): 85–96. DOI: 10.2217/fvl.09.72 |
| [3] | Roche S, Gaudin Y. Characterization of the equilibrium between the native and fusion-inactive conformation of rabies virus glycoprotein indicates that the fusion complex is made of several trimers. Virology, 2002, 297(1): 128–135. DOI: 10.1006/viro.2002.1429 |
| [4] | Wunner WH, Larson JK, Dietzschold B, et al. The molecular biology of rabies viruses. Rev Infect Dis, 1988, 10(S4): S771–S784. |
| [5] | Benazoun S, Benzakour M, Sghaier S, et al. Expression of rabies virus glycoprotein in the methylotrophic yeast Pichia pastoris. Biotechnol Appl Bioche, 2017, 64(1): 50–61. DOI: 10.1002/bab.2017.64.issue-1 |
| [6] | de Pourcq K, de Schutter K, Callewaert N. Engineering of glycosylation in yeast and other fungi: current state and perspectives. Appl Microbiol Biotechnol, 2010, 87(5): 1617–1631. DOI: 10.1007/s00253-010-2721-1 |
| [7] | Ramya R, Subramanian BM, Sivakumar V, et al. Expression and solubilization of insect cell-based rabies virus glycoprotein and assessment of its immunogenicity and protective efficacy in mice. Clin Vaccine Immunol, 2011, 18(10): 1673–1679. DOI: 10.1128/CVI.05258-11 |
| [8] | Prehaud C, Takehara K, Flamand A, et al. Immunogenic and protective properties of rabies virus glycoprotein expressed by baculovirus vectors. Virology, 1989, 173(2): 390–399. DOI: 10.1016/0042-6822(89)90551-5 |
| [9] |
Zhang JM, Wang LL, Deng YQ, et al. Expression and purification of glycoprotein gene of rabies virus in prokaryotic system.
Strait J Prev Med, 2009, 15(2): 1–4.
(in Chinese). 张建明, 王灵岚, 邓艳琴, 等. 狂犬病毒糖蛋白基因在原核系统中的表达及纯化. 海峡预防医学杂志, 2009, 15(2): 1-4. |
| [10] | Tordo N, Poch O, Ermine A, et al. Walking along the rabies genome: is the large G-L intergenic region a remnant gene?. Proc Natl Acad Sci USA, 1986, 83(11): 3914–3918. DOI: 10.1073/pnas.83.11.3914 |
| [11] | Hu RL, Zhang SF, Fooks AR, et al. Prevention of rabies virus infection in dogs by a recombinant canine adenovirus type-2 encoding the rabies virus glycoprotein. Microbes Infect, 2006, 8(4): 1090–1097. DOI: 10.1016/j.micinf.2005.11.007 |
| [12] |
Jia WH, Luo DY, Wang XL. Research progress in memory B cell.
Int J Immunol, 2009, 32(5): 362–368.
(in Chinese). 贾卫红, 罗德炎, 王希良. 记忆性B细胞的研究进展. 国际免疫学杂志, 2009, 32(5): 362-368. |
| [13] | Cox KS, Tang AM, Chen ZF, et al. Rapid isolation of dengue-neutralizing antibodies from single cell-sorted human antigen-specific memory B-cell cultures. mAbs, 2016, 8(1): 129–140. DOI: 10.1080/19420862.2015.1109757 |
| [14] | Ho IY, Bunker JJ, Erickson SA, et al. Refined protocol for generating monoclonal antibodies from single human and murine B cells. J Immunol Methods, 2016, 438: 67–70. DOI: 10.1016/j.jim.2016.09.001 |
| [15] | Tiller T. Single B cell antibody technologies. N Biotechnol, 2011, 28(5): 453–457. DOI: 10.1016/j.nbt.2011.03.014 |
| [16] | Tiller T, Meffre E, Yurasov S, et al. Efficient generation of monoclonal antibodies from single human B cells by single cell RT-PCR and expression vector cloning. J Immunol Methods, 2008, 334(1/2): 112–124. |
| [17] |
Shen BF, Chen ZN, Liu MP.
Recombinant Antibody. Beijing: Science Press, 2005: 459-463(in Chinese).
沈倍奋, 陈志南, 刘民培. 重组抗体. 北京: 科学出版社, 2005: 459-463. |
| [18] | Gómez S, López-Estepa M, Fernández FJ, et al. Protein complex production in alternative prokaryotic hosts//Vega MC, Ed. Advanced Technologies for Protein Complex Production and Characterization. Switzerland: Springer International Publishing, 2016. |
| [19] | Singh A, Yadav D, Rai KM, et al. Enhanced expression of rabies virus surface G-protein in Escherichia coli using SUMO fusion. Protein J, 2012, 31(1): 68–74. DOI: 10.1007/s10930-011-9373-6 |
| [20] | Sato S, Ohara S, Tsutsui KI, et al. Effects of G-gene deletion and replacement on rabies virus vector gene expression. PLoS ONE, 2015, 10(5): e0128020. DOI: 10.1371/journal.pone.0128020 |
| [21] | Basharov MA. Residual ordered structure in denatured proteins and the problem of protein folding. Indian J Biochem Biophys, 2012, 49(1): 7–17. |
| [22] | Atanasiu P, Tsiang H, Perrin P, et al. Immunogenicity and protective activity of glycoprotein extracted from rabies virus: results from comparison of preparations obtained by different methods of purification (author's transl). Ann Microbiol, 1976, 127B(2): 257–267. |
| [23] | Ohara S, Sato S, Oyama K, et al. Rabies virus vector transgene expression level and cytotoxicity improvement induced by deletion of glycoprotein gene. PLoS ONE, 2013, 8(11): e80245. DOI: 10.1371/journal.pone.0080245 |
| [24] | Zhao XY, Li GS, Liang SF. Several affinity tags commonly used in chromatographic purification. J Anal Methods Chem, 2013, 2013: 581093. |
| [25] | Ega TT, Luboobi LS, Kuznetsov D. Modeling the dynamics of rabies transmission with vaccination and stability analysis. Appl Comput Math, 2015, 4(6): 409–419. DOI: 10.11648/j.acm.20150406.13 |
 2017, Vol. 33
2017, Vol. 33