中国科学院微生物研究所、中国微生物学会主办
文章信息
- 侯勇, 田莎, 郭超, 周霞, 陈世达, 杨欢, 赵萍, 夏庆友
- Yong Hou, Sha Tian, Chao Guo, Xia Zhou, Shida Chen, Huan Yang, Ping Zhao, Qingyou Xia
- 家蚕蜕皮液蛋白质双向电泳及质谱分析
- Analysis of molting fluid in silkworm (Bombyx mori) by two-dimensional electrophoresis and mass spectrometry
- 生物工程学报, 2017, 33(1): 99-110
- Chin J Biotech, 2017, 33(1): 99-110
- 10.13345/j.cjb.160219
-
文章历史
- Received: June 2, 2016
- Accepted: August 4, 2016
蜕皮和变态是自然界一种奇妙的生物学现象,旧的表皮褪去,新的表皮形成,伴随着生物体不断生长和发育,代表着生物体组织器官的新生。以家蚕为例,大部分家蚕品种在幼虫阶段会经历4次蜕皮,每次蜕皮前,家蚕都停止进食桑叶,进入到“眠”状态[1]。在家蚕眠过程中,旧表皮渐渐变薄变软,新的表皮逐渐形成,并且在新旧表皮之间出现了一种液体,人们称之为“蜕皮液”[2]。蜕皮液可以将新旧表皮进行隔离,并负责将表皮之间的组织进行降解和融化,从而帮助家蚕完成蜕皮过程[3]。
1993年,有研究者从烟草天蛾Manduca sexta的蜕皮液纯化出一种几丁质酶,它可以在体外降解昆虫几丁质外表皮,因而被推测在蜕皮过程中发挥了重要的作用[4]。20世纪90年代,陈长琨曾用电镜以及组织化学方法对小地老虎幼虫蜕皮腺的形态与结构进行过分析,结果表明,蜕皮液是粘多糖或糖蛋白性质的,它由导管分泌到新旧表皮之间发挥作用[5];2000年,有学者从烟草天蛾Manduca sexta的蜕皮液中分离得到了一种蛋白酶抑制剂,它对真菌的蛋白酶具有很强的抑制活性[6]。虽然人们知道蜕皮液的存在,但是蜕皮液仅在眠期或变态发育前由蜕皮腺分泌,存在于昆虫的新旧表皮的缝隙之间,量微少且很快就会消失,因此,大部分昆虫之前很少有对蜕皮液单独的研究报道。
家蚕是一种可以人工饲养的鳞翅目昆虫,在末龄期的家蚕个体较大,取材方便。在过去的几十年中,家蚕在生理学、组织形态学、遗传学和基因组学等方面积累了丰富的研究数 据[7-8]。2014年,有研究学者利用HPLC-MS的方法对家蚕的蜕皮液进行了研究,重点对其中与几丁质酶相关的蛋白进行了分析,为蜕皮液的研究提供了良好的借鉴[9];同年,Zhang等利用LC-MS/MS的方法对家蚕眠期蜕皮液、预蛹期蜕皮液和羽化前蜕皮液进行了分析,对三者的成分进行了比较研究,并利用RNAi的方法对其中20余个基因的功能进行了验证[10]。为了获得更加丰富的信息,本研究采用另外一种蛋白质组的研究方法——双向电泳结合质谱技术对家蚕的蜕皮液进行了分析,获得了高精度的蜕皮液双向电泳图谱,并利用MALDI TOF/TOF的方法对其中部分蛋白质进行了鉴定,本结果将进一步丰富家蚕蜕皮液蛋白质的研究信息,为阐明其功能提供参考。
1 材料与方法 1.1 试剂及仪器设备双向电泳所用等电聚焦胶条、IPG缓冲液、低熔点琼脂糖等均购自GE Healthcare公司。缓冲溶液试剂,包括尿素、DTT、CHAPS均购自Sigma公司。SDS-PAGE电泳凝胶及缓冲溶液配制试剂均购自生工生物工程 (上海) 股份有限公司。质谱所用试剂,包括a-氰基-4羟基肉桂酸、三氟乙酸、乙腈等购置于Sigma公司。RNA提取试剂盒 TRIZOL Reagent购自Invitrogen公司。M-MLV反转录试剂盒购自Promega公司。引物合成在上海英骏公司完成。双向电泳仪器Ettan IPGPhor 3,SE600 垂直型电泳设备、Image scanner扫描仪及软件Image master 购自GE Healthcare 公司。质谱分析设备MALDI TOF-TOF (AB Sciex 5800) 购自AB Sciex 公司。双向电泳和质谱分析均在家蚕基因组生物学国家重点实验室完成。
1.2 材料家蚕大造品种由家蚕基因组生物学国家重点实验室 (西南大学) 提供,12 h光照、12 h黑暗交替,25 ℃培养箱恒温内饲养,以桑叶喂食直到羽化。蜕皮液取材参照文献[9],预蛹期蜕皮液取材:取化蛹前6 h家蚕,用镊子小心地剥开头部,用微量注射器小心吸取新旧表皮间蜕皮液,取15头蚕蜕皮液作为1个样本;羽化前蜕皮液取材:取化蛹后第9天材料,用解剖针在蛹的尾部轻轻扎小洞,然后将蛹放入1.5 mL离心管中,300 r/min离心1 min,以15头蛹蜕皮液为一个样本,获得的无色透明液体即为羽化前蜕皮液。每种蜕皮液准备3个样本,采用Bradford法对蜕皮液蛋白质进行定量[11],加入苯基硫脲和蛋白酶抑制剂防止黑化和蛋白降解,-80 ℃冰箱进行保存。为进行荧光实时定量PCR (Q-PCR) 实验,取5龄起蚕到蛹第9天的材料,去除幼虫家蚕中肠内的桑叶,液氮冷冻后,研磨成粉,置于TRIZOL中保存。
1.3 SDS-PAGE电泳和双向电泳分析每个样品取15 μg蛋白质样品进行SDS-PAGE电泳实验分析,凝胶浓度为12.5%,100 V恒压进行电泳,电泳结束后采用考马斯亮蓝进行染色。双向电泳实验采用Ettan IPGPhor 3进行等电聚焦分析,采用13 cm胶条,pH 3-10,总蛋白质上样量为150 μg,采用梯度升压的方式进行聚焦电泳:50 V水化12 h,100 V 1 h,500 V 2 h,1 000 V 1 h,5 000 V 1 h,8 000 V,40 000 Vh。聚焦结束后进行第一步平衡,平衡液配方为 6 mol/L尿素,50 mmol/L Tris-HCl,0.07% SDS,30% 甘油,1% DTT;之后进行第二步平衡,平衡液配方为 6 mol/L 尿素,50 mmol/L Tris-HCl,0.07% SDS,30% 甘油,1.25%碘乙酰胺,每次平衡需15 min。平衡结束后,将胶条转移至已制好的SDS-PAGE胶面上,凝胶浓度为12.5%,用低熔点琼脂糖进行密封。采用SE600 垂直型电泳设备进行电泳,20 mA/min,电泳大约进行4-5 h,待溴酚蓝电泳至距玻璃板底部0.5 cm处时,停止电泳,按照标准双向电泳银染染色的方法进行银染分析,每个样品重复3次。采用Image scanner扫描仪对双向电泳图谱进行扫描,利用Image master软件对图谱中的蛋白点进行分析。
1.4 MALDI TOF/TOF质谱分析在羽化前蜕皮液的双向电泳凝胶中,选取42个表达量较高的蛋白点进行挖取,参考之前的方法对银染的样品进行处理[12],采用胰蛋白酶Trypsin进行胶内消化20 h,处理结束后将样品按照1∶1比例与基质液CHCA (a-氰基-4羟基肉桂酸) 进行混合,取1 μL点样,空气中晾干后采用MALDI TOF-TOF (AB Sciex 5800) 进行质谱分析。在质谱分析实验中,首先采用反射模式收集信号,激光电压为3 300 V,收集信号强度较好的5-10个母离子肽段进行碎裂,产生二级碎片信息,采用外标的方式对母离子峰图和二级碎片峰图进行校正。
1.5 利用蛋白质数据库进行鉴定分析下载家蚕基因组蛋白数据库 (ftp://ftp.genomics.org.cn/pub/Silkdb/Gene_Annotation/Protein/SW_ge2k_BGF.pep)[13],利用Mascot软件构建本地质谱鉴定数据库,酶切方式设置为Trypsin,母离子最大误差设为100 ppm,离子类型选择为Monoisotopic mass,最大missed cleavages值设置为2,固定修饰设为 Carbamidomethyl (C),可变修饰设置为Oxidation (M) 和Deamidated (NQ),按照Mascot软件标准的程序进行检索鉴定分析,阴影区域以外的鉴定结果视为可信的结果。
1.6 Apolipoprotein D基因实时荧光定量PCR分析按照TRIZOL说明书提取不同发育时期的整蚕材料总RNA,采用反转录试剂盒进行反转录。以5龄起蚕到化蛹后第9天发育时期的cDNA为模板,并将其稀释至100 ng/μL后,通过Q-PCR对Apolipoprotein D基因的时期表达情况进行分析。Q-PCR反应体系如下:ddH2O 6 μL,正向引物0.8 μL,反向引物 0.8 μL,SYBR 10 μL,Reference DyeⅡ 0.4 μL,cDNA模板 2 μL。反应条件为:95 ℃ 预变性30 s,循环反应进行40次,条件为95 ℃ 5 s,60 ℃ 30 s,以家蚕的探针号sw22934为内参基因,定量的结果用2-ΔΔCt方法进行比较分析,每个样品重复3次。
| Primer name | Primer sequence (5'-3') |
| Apoliprotein D 5'-primer | GCGTCTCCCATCCTT |
| Apoliprotein D 3'-primer | CTCTACGGGCTCTTTCT |
| sw22934 5'-primer | TTCGTACTGGCTCTTCTCGT |
| sw22934 3'-primer | caaaGTTGATAGCAATTCCCT |
下载家蚕Apolipoprotein D序列 (Genbank Accession No. NP_001140192.1) 和美国白蛾序列hyphantrin (GenBankAccession No. AAM18117.2),采用Bioedit 软件将家蚕Apolipoprotein D蛋白序列与美国白蛾同源序列hyphantrin进行比对分析。保守结构域利用NCBI在线的CCD软件进行分析,脂蛋白结合结构域用粗实线标出。
2 结果与分析 2.1 家蚕蜕皮液蛋白质电泳分析利用SDS-PAGE对家蚕蜕皮液蛋白质进行了电泳分析,考马斯亮蓝的染色结果表明,蜕皮液蛋白质在SDS-PAGE凝胶中条带分布清晰,并且两个时期的蜕皮液在不同的分子量处存在明显的差异条带 (图 1)。为了获得更加详细的研究信息,用双向电泳技术对两个时期的蜕皮液进行了分析。结果表明,在银染的条件下,两种蜕皮液蛋白质都呈现了清晰的二维电泳图谱,在每种蜕皮液样品中都能检测到超过200个蛋白点,它们主要分布在中性等电点区域4-9之间,分子量主要分布在10-180 kDa之间 (图 2)。重复电泳的结果表明,不同批次实验所获得的电泳图谱重复性好,蛋白的重复度在95%以上,高精度的双向电泳图谱的获得为后续研究奠定了基础。

|
| 图 1 家蚕蜕皮液蛋白质的SDS-PAGE分析 Figure 1 SDS-PAGE analysis of silkworm molting fluid. M: protein marker; 1: molting fluid of prepupa; 2: molting fluid before eclosion. |
| |

|
| 图 2 析家蚕化蛹前 (A) 和羽化前 (B) 蜕皮液双向电泳分 Figure 2 Two-dimensional electrophoresis map of molting fluid extracted from prepupa (A) and late pupa before eclosion (B). |
| |
对比不同时期的双向电泳图谱,发现主要差异蛋白发生在分子量30-60 kDa之间的区域 (图 2)。预蛹期的蜕皮液在此范围的蛋白点数量多,表达量高,甚至出现了蛋白融合的现象,而羽化前蜕皮液相对来讲蛋白质点数量少,分布更加清晰、均匀。此外,低分子量的蛋白在不同样品之间也有一些明显的差异。为了进一步了解蜕皮液的功能,在羽化前的双向电泳图谱中选取了42个表达量较高的蛋白点进行了挖取 (图 3),在进行胶内酶解等一系列实验之后,采用飞行时间质谱对它们进行鉴定和分析。

|
| 图 3 家蚕羽化前蜕皮液蛋白点的挖取与鉴定 Figure 3 Excision and identification of spots from the map of silkworm molting fluid before eclosion. |
| |
采用一级质谱和二级碎片相结合的鉴定方法,大部分蛋白点都可以获得良好的肽质量指纹图谱峰图,所选的母离子肽段经碰撞碎裂获得了比较丰富的碎片信息,为蛋白的鉴定提供了有利的帮助。经过Mascot 软件的分析,最终确定了34个蛋白质鉴定结果,它们得分较高,蛋白质的等电点和分子量与预期都相符,二级碎片信息有效支持了肽质量指纹图谱的鉴定结果。经分析,发现这其中包括了触角结合蛋白 (Antennal binding protein)、营养贮藏蛋白 (30 kDa proteins)、载脂蛋白 (Apolipoprotein)、蛋白酶 (Peptidase)、蛋白酶抑制剂 (CI-8) 等。进一步的分析表明,有部分蛋白出现在不同的蛋白点中,如编码为BGIBMGA003660的蛋白出现在3、8、9、12号蛋白点,编码为BGIBMGA004397的蛋白出现在28、29号蛋白点中 (表 2)。
| Number | Annotation | Accession number | SilkDB number | Theoretical molecular weight | Theoretical pI | Coverage (%) | Score |
| 1 | antennal binding protein | gi|87248601 | BGIBMGA002626 | 15.4 | 7.55 | 5 | 71 |
| 2 | 32 kDa apolipoprotein precursor | gi|226501956 | BGIBMGA002703 | 29.2 | 4.75 | 34 | 549 |
| 3 | C-type lectin-like protein | gi|512922298 | BGIBMGA003660 | 41.2 | 5.08 | 12 | 345 |
| 5 | lysozyme-like protein | gi|512906873 | BGIBMGA007458 | 17.4 | 4.75 | 9 | 92 |
| 8 | C-type lectin-like protein | gi|512922322 | BGIBMGA003660 | 41.2 | 5.08 | 10 | 122 |
| 9 | C-type lectin-like protein | gi|512922322 | BGIBMGA003660 | 41.2 | 5.08 | 7 | 83 |
| 10 | chitin binding protein | gi|512916360 | BGIBMGA007899 | 27.4 | 4.89 | 15 | 162 |
| 11 | chitin binding protein | gi|512916360 | BGIBMGA007899 | 27.4 | 4.89 | 8 | 82 |
| 12 | C-type lectin-like protein | gi|512922322 | BGIBMGA003660 | 41.2 | 5.08 | 7 | 76 |
| 14 | uncharacterized protein LOC101741978 | gi|512925198 | BGIBMGA011399 | 11.9 | 4.64 | 45 | 153 |
| 15 | 32 kDa apolipoprotein precursor | gi|226501956 | BGIBMGA002703 | 29.2 | 4.75 | 8 | 112 |
| 16 | serpin-10 | gi|22634288 | BGIBMGA010214 | 53.8 | 4.94 | 5 | 62 |
| 17 | diapause bioclock protein | gi|68144076 | BGIBMGA002907 | 18.3 | 6.19 | 17 | 235 |
| 19 | phosphatidylethanolamine- binding protein homolog F40A3.3-like | gi|512891705 | BGIBMGA013261 | 20.3 | 5.42 | 21 | 139 |
| 20 | serpin-10 | gi|22634288 | BGIBMGA010214 | 53.8 | 4.94 | 7 | 128 |
| 23 | 30 kDa protein Bmlp6 | gi|379046524 | BGIBMGA004457 | 26.07 | 6.22 | 8 | 43 |
| 24 | 30 kDa protein Bmlp15 | gi|512890626 | BGIBMGA004403 | 30.1 | 5.98 | 5 | 67 |
| 25 | 30 kDa protein Bmlp2 | gi|379046488 | BGIBMGA004399 | 29.2 | 5.7 | 6 | 72 |
| 25 | 30 kDa protein Bmlp4 | gi|379046486 | BGIBMGA004395 | 30.4 | 6.84 | 10 | 82 |
| 26 | 30 kDa protein Bmlp1 | gi|379046494 | BGIBMGA004394 | 29.7 | 6.11 | 5 | 73 |
| 27 | 30 kDa protein Bmlp3 | gi|379046476 | BGIBMGA004396 | 29.5 | 6.44 | 39 | 357 |
| 28 | 30 kDa protein Bmlp7 | gi|379046478 | BGIBMGA004397 | 29.5 | 7.64 | 14 | 73 |
| 29 | 30 kDa protein Bmlp7 | gi|379046478 | BGIBMGA004397 | 29.5 | 7.64 | 14 | 76 |
| 30 | imaginal disk growth factor | gi|152061158 | BGIBMGA000648 | 43.8 | 6.47 | 9 | 113 |
| 31 | serpin-10 | gi|226342882 | BGIBMGA010214 | 53.8 | 4.94 | 5 | 65 |
| 32 | alpha-crystallin B chain-like | gi|512896393 | BGIBMGA005755 | 26.8 | 4.57 | 4 | 83 |
| 33 | aldo-keto reductase family 1 member C4-like | gi|512935651 | BGIBMGA009801 | 37.9 | 6.02 | 9 | 133 |
| 34 | putative peptidase | gi|281398206 | BGIBMGA009184 | 78.1 | 6.37 | 6 | 91 |
| 35 | chymotrypsin inhibitor CI-8A | gi|14028769 | BGIBMGA001983 | 41.9 | 5.14 | 31 | 370 |
| 36 | antichymotrypsin II | gi|113052 | BGIBMGA009953 | 41.4 | 5.26 | 13 | 69 |
| 37 | hemolin | gi|41350232 | BGIBMGA008736 | 45.3 | 5.12 | 19 | 93 |
| 38 | SCO-spondin-like,partial | gi|512912011 | 47.2 | 4.92 | 26 | 240 | |
| 39 | 32 kDa apolipoprotein precursor | gi|226501956 | BGIBMGA002703 | 29.2 | 4.75 | 8 | 73 |
| 41 | transferrin | gi|68066547 | BGIBMGA011424 | 72.8 | 6.68 | 9 | 283 |
| 42 | uncharacterized protein LOC101744039 | gi|512924445 | BGIBMGA006371 | 83.5 | 4.8 | 23 | 801 |
| 4,6,7,13,18,21,22,40 | unidentified |
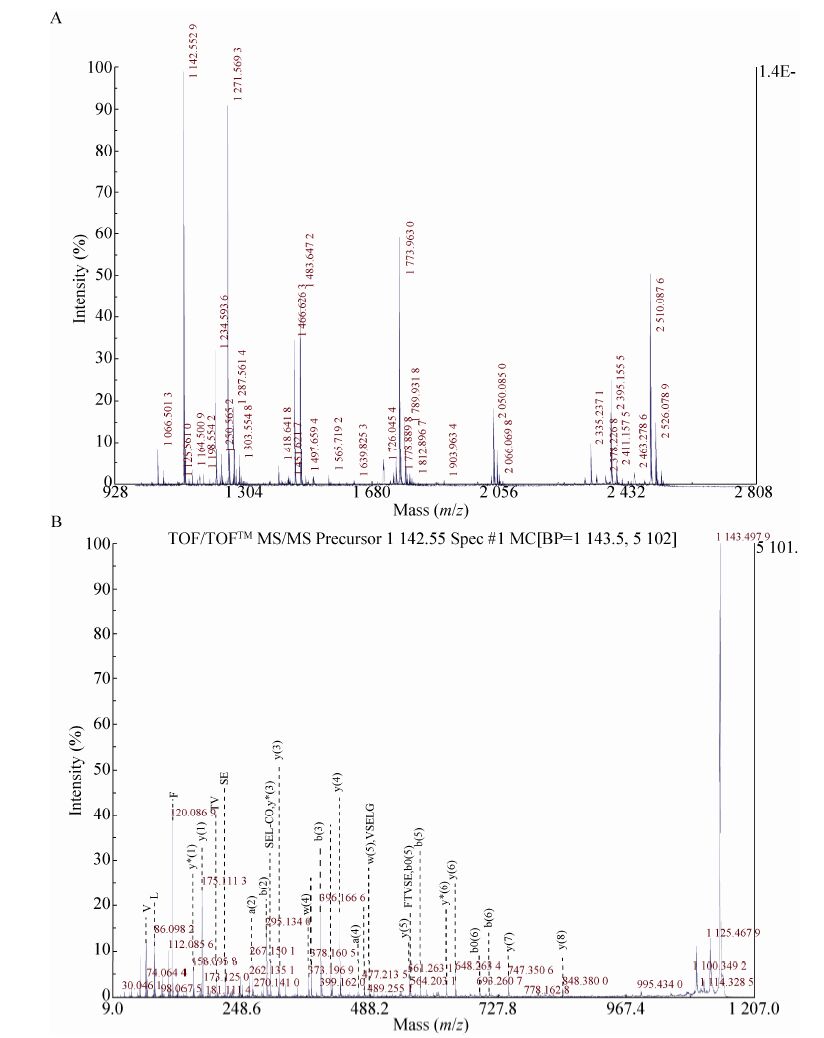
为了进一步分析两个时期蜕皮液的差异蛋白质,我们将低分子量处部分蛋白点进行了比较,从图中可以看出 (图 2和图 3),有些蛋白质在预蛹前的蜕皮液中表达量较高,如蛋白点1,被鉴定为触角结合蛋白;另外一些蛋白质在羽化期的蜕皮液中的含量相对较高,如蛋白点9和12,被鉴定为C型凝集素蛋白 (C-type lectin protein)。对于蛋白点15,它在羽化前的蜕皮液中的蛋白含量较高,而在预蛹期的蜕皮液中几乎不存在。Mascot的结果显示,该蛋白被鉴定为32 kDa载脂蛋白前体 (32 kDa apolipoprotein precursor),SilkDB数据库中的蛋白质编号BGIBMGA002703。分析表明,该蛋白具有Lipocalin结构域,与其他物种的Apolipoprotein D具有较高的相似度。为验证该蛋白的鉴定结果,对其一级质谱峰图及二级质谱峰图进行了分析,结果显示,其肽质量指纹图谱中产生了超过20个肽段峰,信噪比高,二级碎片图谱中碎裂效果好,质荷比为1 142的母离子产生的碎片信息可以被良好解析,证实了该蛋白鉴定结果的准确性 (图 4)。
|
| 图 4 蛋白点15肽质量指纹图谱及二级碎片峰图 Figure 4 Identification of spot 15 from map of molting fluid by peptide mass fingerprint and MS/MS. (A) peptide mass fingerprint of spot 15 under the positive ion reflection mode after digestion by trypsin. (B) Fragment ion segments from the precursor ions of 1 142.55. |
| |
为了进一步确认Apolipoprotein蛋白 (蛋白点15) 随着家蚕发育时期的表达情况,对该蛋白进行了信息学的调查,并采用Q-PCR的方法对其编码基因在发育时期的表达情况进行分析。结果表明,该蛋白属于载脂蛋白家族成员,目前没有明确的功能报道,但是其与美国白蛾的hyphantrin基因具有较高的相似性 (图 5)。Q-PCR的结果显示,该蛋白在化蛹第1天到第4天存在高量的表达 (图 6),暗示了该蛋白随着蛹的发育逐渐转运到蜕皮液中,并在蜕皮液中进行高度富集。

|
| 图 5 家蚕和美国白蛾Apoliprotein D同源蛋白比对分析 Figure 5 Sequence alignment of Apoliprotein D from Bombyx mori and Hyphantria cunea. The accession numbers for the sequences were as following: Bombyx mori (NP_001140192.1),Hyphantria cunea (AAM18117.2). The conserved domain were marked by the solid lines under the sequences. |
| |

|
| 图 6 Apoliprotein D基因在发育时期表达分析 Figure 6 Expression patterns of Apoliprotein D during the developmental stages. 5Q: new silkworm of the 5th instar; 5-1 to 5-7: the 1st day of the 5th instar to the 7th day of the 5th instar; W1,W2: the 1st day of wandering stage and the 2nd day of wandering stage; P1 to P9: the 1st day of pupa to the 9th day of pupa. |
| |
随着蛋白质组技术的发展,人们对蛋白质的鉴定数量和精度越来越高,液相色谱结合质谱技术在现代蛋白质组学研究中的应用越来越广泛[14]。但是,双向电泳技术由于其分辨率高、成本相对较低的特点仍然在目前蛋白质组研究中占有重要地位[15]。双向电泳所获得图谱清晰、直观,容易给研究者留下深刻的印象,并且在图谱中可发现潜在的蛋白质磷酸化、糖基化等蛋白质修饰作用,为下一步研究提供重要的参考信息。
之前,本课题组利用双向电泳等技术对家蚕的血液、丝腺、生殖腺和马氏管等组织进行了系统的研究,为家蚕蛋白质组的研究提供了丰富的信息[16-17]。2010年,我们利用双向电泳技术对家蚕不同发育时期的血液样品进行过调查,鉴定了一些重要的蛋白质,为后期的研究提供了重要的参考[18]。本文利用了双向电泳结合飞行质谱的研究方法对家蚕的蜕皮液进行分析,每个时期的图谱中都可以分离出超过200个蛋白点。整体来看,不同时期蜕皮液蛋白质在中分子量处差异较大,而低分子量处的分布更为清晰,蜕皮液双向电泳图谱的获得可以为今后蜕皮液蛋白质的研究提供参考。
在蛋白质鉴定实验中,采用了一级质谱结合二级碎片共同鉴定的方法,在42个蛋白中,有34个蛋白质获得了可信的鉴定结果。分析结果显示,营养蛋白30 kDa仍然集中分布于蜕皮液中,成功鉴定到了Bmlp1-3、Bmlp6-7、Bmlp15等蛋白质,由于30 kDa蛋白质丰度的差异,我们相信还有更多种类的30 kDa蛋白质存在于蜕皮液中[19-20]。从图谱中可以看出,预蛹期的蜕皮液的30 kDa蛋白分布和羽化前期的30 kDa蛋白的分布模式明显不同,暗示了不同30 kDa蛋白在不同发育时期的作用。蜕皮液中有很多蛋白质与免疫活动有关系,如C型凝集素蛋白 (C-type lectin protein)、抑血细胞聚集素 (Hemolin)、抑凝乳蛋白酶抑制剂 (Antichymotrypsin)、丝氨酸蛋白酶抑制剂 (Serpin) 等,它们在蜕皮液的表达量都比较高,有些蛋白,如C-type lectin,出现在不同的分子量和等电点处,推测这类蛋白存在着潜在的蛋白质翻译后修饰,这也与之前人们对蜕皮液蛋白质多为糖蛋白的推论相符[5]。家蚕在蜕皮变态的过程中,容易受到外界环境的影响,蜕皮液中的免疫蛋白对于新组织的形成会起到保护作用。有研究者将不同时期提取的蜕皮液与病原微生物进行了混合培养,发现不同时期的蜕皮液均可以有效抑制病原微生物的生长[10]。
家蚕蜕皮过程中,大量的旧组织被溶解,组织蛋白酶和几丁质酶在其中扮演了重要角色。Qu等从蜕皮液中鉴定出4个几丁质酶、3个几丁质去乙酰化酶、4个β-乙酰氨基己糖苷酶,它们变态发育阶段呈现了较为活跃的表达特征[9]。当这些基因被干涉时,昆虫出现了蜕皮异常的现象[21-23]。蛋白质组定量分析的结果表明,这些蛋白在化蛹前蜕皮液中的峰度要比羽化前蜕皮液峰度高[9]。从本研究获得的蜕皮液的双向电泳图谱可以看出,化蛹前蜕皮液图谱中40-80 kDa处有大量的蛋白点存在,几丁质酶、几丁质去乙酰化酶、β-N-乙酰葡萄糖胺糖苷酶等蛋白质的分子量大多在此范围,我们推测这些蛋白点可能包含了与几丁质相关的蛋白酶类。 翅原基生长因子 (Imaginal disk growth factor,蛋白点30) 是本研究鉴定出来的一种具有几丁质酶结构的蛋白质,它没有几丁质酶的活性,可能是在长期的分子进化过程中丧失了几丁质降解功能[9]。本次实验鉴定蛋白质来源于羽化前期的双向电泳凝胶中,鉴于蛋白点选择和鉴定数量的原因,我们没有鉴定到其他的几丁质相关的蛋白酶。几丁质结合蛋白 (Chitin binding protein,蛋白点10,11) 是具有几丁质结合结构域蛋白质,它们虽然可以与几丁质进行结合,但是其缺乏酶催化功能性结构域[24],果蝇中研究表明,该类蛋白质可与Knk等蛋白质发生结合,可能参与到了新表皮免于被蜕皮液降解的功能[25],在后续的研究中我们将对其组织定位和功能进行进一步分析。本实验中我们还鉴定到了组织蛋白酶 (Peptidase) 和蛋白酶抑制剂 (Serpin 10) 等,有研究报道,组织蛋白酶参与昆虫的变态发育,RNAi干涉组织蛋白酶基因可导致昆虫无法正常蜕皮[26];丝氨酸蛋白酶抑制剂对于许多酶来讲具有调节活性的功能[27],蛋白酶抑制剂 (Serpin 10) 在蛹的后期蜕皮液中有高水平的表达,推测该蛋白可能在羽化变态的发育过程中扮演了重要的角色。
从蛋白质组的结果来看,Apoliprotein D (蛋白点15) 在羽化前的蜕皮液中表达量很高,然而在预蛹期的蜕皮液中几乎不存在。Apoliprotein D是一类载脂蛋白,它在昆虫中研究报道较少,但是在脊柱动物中却是一种重要的生物标志物,如在阿尔茨海默病的病人脑组织中,随着病症的加重,Apoliprotein D的表达量持续上升[28]。在不同发育时期的血液的蛋白质组分析中,我们在蛹后期的血液中鉴定到了另外一种Apoliprotein D蛋白,编号为BGIBMGA002704,它在蛹后期的血液中有特异表达[18]。我们认为这类蛋白可能跟蛹后期羽化变态的过程有关系,其具体的功能有待进一步研究分析。除此之外,蛋白点2和39同样被鉴定为Apoliprotein D,这一结果暗示了该蛋白可能与其他蛋白具有结合作用,以复合物的形式执行其生理功能。
综上所述,本研究利用双向电泳结合质谱的方法成功地对家蚕预蛹阶段和羽化前的蜕皮液进行了分析,获得了分辨率比较好的蛋白质双向电泳图谱,并对其中表达量较高的蛋白质进行了鉴定。在后续的研究中,我们将选取其中靶标蛋白进行深入研究,为揭示蜕皮液蛋白质在家蚕蜕皮和变态发育过程中的作用提供帮助。
| [1] |
Huang JT, Zhu WM, Xia JG, et al.
Complete Works of Sericultural Technology in China. Chengdu: Sichuan Publishing House of Science & Technology, 1996 : 278 -279(in Chinese).
黄君霆, 朱万民, 夏建国, 等. 中国蚕丝大全. 成都: 四川科学技术出版社, 1996 : 278-279. |
| [2] |
Wu ZD.
Anatomy and Physiology of Silkworm. Beijing: China Agriculture Press, 1989 : 30 (in Chinese).
吴载德. 蚕体解剖生理学. 北京: 中国农业出版社, 1989 : 30. |
| [3] | Jungreis AM. Physiology and composition of molting fluid and midgut lumenal contents in the silkmoth Hyalophora cecropia. J Comp Physiol, 1974, 88 (2) : 113–127. DOI: 10.1007/BF00695403 |
| [4] | Samuels RI, Charnley AK, Reynolds SE. A cuticle-degrading proteinase from the moulting fluid of the tobacco hornworm, Manduca sexta. Insect Biochem Mol Biol, 1993, 23 (5) : 607–614. DOI: 10.1016/0965-1748(93)90034-P |
| [5] |
Chen CK, Wang YC, Han ZH, et al. Morphology and structure of moulting glands in the black cutworm Agrotis ypsilon.
Acta Entomol Sin, 1992, 35 (2) : 142–147.
(in Chinese). 陈长琨, 王荫长, 韩振华, 等. 小地老虎蜕皮腺的形态和结构. 昆虫学报, 1992 , 35 (2): 142-147. |
| [6] | Samuels RI, Reynolds SE. Proteinase inhibitors from the molting fluid of the pharate adult tobacco hornworm, Manduca sexta. Arch Insect Biochem Physiol, 2000, 43 (1) : 33–43. DOI: 10.1002/(ISSN)1520-6327 |
| [7] | Goldsmith MR, Shimada T, Abe H. The genetics and genomics of the silkworm, Bombyx mori. Annu Rev Entomol, 2005, 50 (1) : 71–100. DOI: 10.1146/annurev.ento.50.071803.130456 |
| [8] | Xia QY, Li S, Feng QL. Advances in silkworm studies accelerated by the genome sequencing of Bombyx mori. Annu Rev Entomol, 2014, 59 (1) : 513–536. DOI: 10.1146/annurev-ento-011613-161940 |
| [9] | Qu MB, Ma L, Chen P, et al. Proteomic analysis of insect molting fluid with a focus on enzymes involved in chitin degradation. J Proteome Res, 2014, 13 (6) : 2931–2940. DOI: 10.1021/pr5000957 |
| [10] | Zhang J, Lu AR, Kong LL, et al. Functional analysis of insect molting fluid proteins on the protection and regulation of ecdysis. J Biol Chem, 2014, 289 (52) : 35891–35906. DOI: 10.1074/jbc.M114.599597 |
| [11] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72 (1/2) : 248–254. |
| [12] | Hou Y, Xia QY, Zhao P, et al. Studies on middle and posterior silk glands of silkworm (Bombyx mori) using two-dimensional electrophoresis and mass spectrometry. Insect Biochem Mol Biol, 2007, 37 (5) : 486–496. DOI: 10.1016/j.ibmb.2007.02.011 |
| [13] | Duan J, Li RQ, Cheng DJ, et al. SilkDB v2.0: a platform for silkworm (Bombyx mori) genome biology. Nucl Acids Res, 2010, 38 (S1) : D453–D456. |
| [14] | Xie F, Liu T, Qian WJ, et al. Liquid chromatography-mass spectrometry-based quantitative proteomics. J Biol Chem, 2011, 286 (29) : 25443–25449. DOI: 10.1074/jbc.R110.199703 |
| [15] | Rabilloud T, Lelong C. Two-dimensional gel electrophoresis in proteomics: a tutorial. J Proteomics, 2011, 74 (10) : 1829–1841. DOI: 10.1016/j.jprot.2011.05.040 |
| [16] | Yi QY, Zhao P, Wang X, et al. Shotgun proteomic analysis of the Bombyx mori anterior silk gland: an insight into the biosynthetic fiber spinning process. Proteomics, 2013, 13 (17) : 2657–2663. DOI: 10.1002/pmic.v13.17 |
| [17] | Zhong XW, Zou Y, Liu SP, et al. Proteomic-based insight into Malpighian tubules of silkworm Bombyx mori. PLoS ONE, 2013, 8 (9) : e75731. DOI: 10.1371/journal.pone.0075731 |
| [18] | Hou Y, Zou Y, Wang F, et al. Comparative analysis of proteome maps of silkworm hemolymph during different developmental stages. Proteome Sci, 2010, 8 (1) : 45. DOI: 10.1186/1477-5956-8-45 |
| [19] | Zhang Y, Dong ZM, Wang DD, et al. Proteomics of larval hemolymph in Bombyx mori reveals various nutrient-storage and immunity-related proteins. Amino Acids, 2014, 46 (4) : 1021–1031. DOI: 10.1007/s00726-014-1665-7 |
| [20] | Hou Y, Zhang Y, Gong J, et al. Comparative proteomics analysis of silkworm hemolymph during the stages of metamorphosis via liquid chromatography and mass spectrometry. Proteomics, 2016, 16 (9) : 1421–1431. DOI: 10.1002/pmic.v16.9 |
| [21] | Hogenkamp DG, Arakane Y, Kramer KJ, et al. Characterization and expression of the β-N-acetylhexosaminidase gene family of Tribolium castaneum. Insect Biochem Mol Biol, 2008, 38 (4) : 478–489. DOI: 10.1016/j.ibmb.2007.08.002 |
| [22] | Zhu QS, Arakane Y, Beeman RW, et al. Functional specialization among insect chitinase family genes revealed by RNA interference. Proc Natl Acad Sci USA, 2008, 105 (18) : 6650–6655. DOI: 10.1073/pnas.0800739105 |
| [23] | Arakane Y, Dixit R, Begum K, et al. Analysis of functions of the chitin deacetylase gene family in Tribolium castaneum. Insect Biochem Mol Biol, 2009, 39 (5/6) : 355–365. |
| [24] | Jasrapuria S, Specht CA, Kramer KJ, et al. Gene families of cuticular proteins analogous to peritrophins (CPAPs) in Tribolium castaneum have diverse functions. PLoS ONE, 2012, 7 (11) : e49844. DOI: 10.1371/journal.pone.0049844 |
| [25] | Petkau G, Wingen C, Jussen LCA, et al. Obstructor-A is required for epithelial extracellular matrix dynamics, exoskeleton function, and tubulogenesis. J Biol Chem, 2012, 287 (25) : 21396–21405. DOI: 10.1074/jbc.M112.359984 |
| [26] | Wang GH, Liu C, Xia QY, et al. Cathepsin B protease is required for metamorphism in silkworm, Bombyx mori. Insect Sci, 2008, 15 (3) : 201–208. DOI: 10.1111/j.1744-7917.2008.00201.x |
| [27] | An CJ, Kanost MR. Manduca sexta serpin-5 regulates prophenoloxidase activation and the Toll signaling pathway by inhibiting hemolymph proteinase HP6. Insect Biochem Mol Biol, 2010, 40 (9) : 683–689. DOI: 10.1016/j.ibmb.2010.07.001 |
| [28] | Ordóñez C, Navarro A, Pérez C, et al. Gender differences in apolipoprotein D expression during aging and in Alzheimer disease. Neurobiol Aging, 2012, 33 (2) : 433.e11–433.e20. DOI: 10.1016/j.neurobiolaging.2011.01.010 |
 2017, Vol. 33
2017, Vol. 33