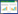中国科学院微生物研究所、中国微生物学会主办
文章信息
- 关晓宇, 徐志超, 王永强, 李晓齐, 曹红, 郑世军
- Xiaoyu Guan, Zhichao Xu, Yongqiang Wang, Xiaoqi Li, Hong Cao, Shijun Zheng
- 抗鸡白细胞介素 4 单克隆抗体的制备及鉴定
- Generation and characterization of monoclonal antibodies against chicken interleukin 4
- 生物工程学报, 2017, 33(1): 44-54
- Chin J Biotech, 2017, 33(1): 44-54
- 10.13345/j.cjb.160221
-
文章历史
- Received: June 6, 2016
- Accepted: August 15, 2016
白细胞介素4 (Interleukin 4,IL-4) 是20世纪80年代初发现的,具有多种免疫学调节功能的细胞因子,对B细胞、T细胞等免疫细胞以及造血细胞等非免疫细胞均有免疫调节作用,可通过与多种类型细胞相互作用来调节宿主的免疫应答[1]。
由于IL-4重要的生物学活性,近年来关于鸡白细胞介素4 (chIL-4) 的体外表达及生物学功能的研究变得越来越热。2004年Avery等[2]在克隆鸡T2细胞因子基因簇时发现单拷贝的功能性IL-4基因,发表了鸡Gallus gallus (AJ621249) IL-4 mRNA基因序列,其全长为 411 bp,chIL-4前体是137肽,信号肽为25个氨基酸,分泌的成熟的chIL-4有112个氨基酸残基,含3个分子内二硫键和2个可能的N端糖基化位点。日本学者 Kubota等[3]从外周血和胸腺中提取mRNA,反转录成cDNA后插入pFastBac1,通过昆虫表达系统转入AcNPV杆状病毒表达,获取的成熟的chIL-4蛋白分子量大约为12.4 kDa。戴华等[4]利用RT-PCR从被诱导的鸡脾脏淋巴细胞中扩增出chIL-4基因的cDNA,并构建出原核表达载体pGEX-6P-chIL-4和pET-chIL-4,经IPTG诱导和SDS-PAGE分析,结果表明,chIL-4基因在上述载体中均获得表达,融合蛋白大小分别为38 kDa和18 kDa。
目前,已有在蛋白水平上检测人和小鼠IL-4的商品化试剂盒,但是由于chIL-4与人和小鼠IL-4的同源性仅分别为22.48%和21.23%,所以在学术研究和临床疾病分析中主要还是以RT-PCR检测chIL-4的相对含量。因此,建立针对chIL-4在蛋白水平上的检测方法,将有助于评价chIL-4在机体内的动态变化水平,对于了解禽类传染性疾病的发生、发展、转归情况及机体保护性免疫反应的动态规律具有重要意义。
单克隆抗体制备技术为建立蛋白质检测方法提供了有利的条件。翁凌等[5]利用抗鸡白细胞介素2 (chIL-2) 单克隆抗体作包被抗体、生物素标记的抗chIL-2多克隆抗体作检测抗体建立了双抗体夹心ELISA测定方法,该方法对chIL-2的检测灵敏度为50 pg/mL。王肖祎[6]利用抗鸡白细胞介素18 (chIL-18) 单克隆抗体为包被抗体、HRP标记的抗chIL-18单克隆抗体为检测抗体建立的双抗体夹心ELISA方法,其检测灵敏度可达31.5 pg/mL。郑玉姝[7]利用生物素- 链霉亲和素放大系统建立的双抗体夹心ELISA方法,以鼠抗鸡IFN-γ单克隆抗体为包被抗体,以针对不同抗原表位的生物素化单克隆抗体为检测抗体对IFN-γ进行定量测定,结果显示,在10-1 000 pg/mL的浓度范围内,IFN-γ标准品浓度与吸光度值线性关系良好,相关系数为r=0.992 1。
本研究旨在利用重组chIL-4蛋白制备识别不同抗原表位的抗chIL-4单克隆抗体,为建立chIL-4双抗体夹心ELISA检测方法奠定基础,为监测鸡体免疫状态和研究鸡体免疫机制提供技术平台。
1 材料与方法 1.1 菌株、细胞、质粒及实验动物大肠杆菌Escherichia coli DH5α和BL21,骨髓瘤细胞SP2/0和鸡胚成纤维细胞DF-1,pGEX-6p-1、pET-28a和pRK5-flag质粒为本实验室保存;pMD19-T-chIL-4由中国农业大学索勋教授惠赠;BALB/c小鼠购自中国医学科学院实验动物研究所。
1.2 主要试剂及仪器限制性内切酶、LA Taq酶和DNA连接酶购自TaKaRa公司;dNTPs购自CNS公司;DNA胶回收试剂盒购自ZYMO RESEARCH公司;高纯度质粒小量快速提取试剂盒购自北京艾德莱公司;鼠源His-tag、GST-tag单克隆抗体购自Abmart公司;HRP标记山羊抗小鼠IgG、马抗山羊IgG和FITC标记兔抗小鼠IgG购自北京鼎国公司;弗氏完全佐剂、弗氏不完全佐剂、HAT、HT、flag-tag单克隆抗体以及Mouse Monoclonal Antibody Isotyping Reagents购自Sigma公司;PEG4000购自MERCK公司;DMEM高糖培养基、非必需氨基酸购自Gibco公司;标准胎牛血清购自Hyclone公司;Vigofect转染试剂购自威格拉斯生物技术 (北京) 有限公司;压力搅拌式浓缩杯购自默克化工技术 (上海) 有限公司;Centrifuge581 0R型低温冷冻高速离心机购自Eppendorf公司;Alpha ImagerTM 2200型凝胶成像分析仪购自美国Alpha公司;Kodak医学X光显影机102型购自美国Kodak公司;Sunrise型96孔酶标仪购自TECAN公司。
1.3 原核表达载体的构建及蛋白纯化以pMD19-T-chIL-4为模板,设计引物F1 (5'-GGATCCTTACAGCTCTCAGTGCCG-3')、R1 (5'-CTCGAGCTTATTTTTAGCTAGTTG-3')、F2 (5'-GGATCCTTACAGCTCTCAGTGCCG-3')、R2 (5'-CTCGAGTCACTTATTTTTAGCTAG-3') 扩增不含信号肽序列的chIL-4基因,经胶回收、双酶切、连接,分别构建到pET-28a和pGEX-6p-1原核表达载体上,得到质粒pET-28a-chIL-4和pGEX-6p-1-chIL-4,将其转化到E. coli BL21中,在37 ℃、6 h、IPTG浓度为1 mmol/L的条件下诱导重组蛋白的表达。通过SDS-PAGE分析蛋白的表达情况并用Western blotting进行验证后,提取包涵体,并按照文献[8]所述方法进行稀释复性,获得重组蛋白。
1.4 chIL-4单克隆抗体的制备以重组蛋白His-chIL-4为抗原,免疫8周龄雌性BALB/c小鼠。首次免疫,抗原与等体积的弗氏完全佐剂混合乳化,颈背部皮内多点注射,50 μg/只。3周后进行二免,抗原与等体积弗氏不完全佐剂混合乳化,颈背部皮下多点注射,50 μg/只。3周后进行三免,免疫剂量与途径同二免[9]。三免1周后,小鼠断尾采血分离血清,以重组蛋白GST-chIL-4所包被的酶标反应板用间接ELISA的方法测定血清抗体效价,当效价大于1:10 000时,小鼠达到融合以制备单克隆抗体的标准。在细胞融合前3 d,进行加强免疫,小鼠腹腔注射抗原,50 μg/只。
细胞融合,阳性杂交瘤细胞的筛选参照文献[10]。筛选时用重组蛋白GST-chIL-4包被的酶标反应板进行间接ELISA,初次筛选后,间隔2 d进行第2次筛选。选取2次筛选阳性值较高的孔按照有限稀释法进行亚克隆,连续亚克隆3次,选择能稳定分泌单克隆抗体的阳性杂交瘤细胞作为建株细胞。
腹水的制备和纯化采用常规方法[11],挑选经产BALB/c小鼠,腹腔注射灭菌液体石蜡 1 mL/只,7 d后腹腔注射杂交瘤细胞2.0×106 个/只,收集的腹水经离心后收集上清。按照正辛酸饱和硫酸铵沉淀法进行纯化,透析除盐,分装保存于-80 ℃。
1.5 chIL-4单克隆抗体的鉴定 1.5.1 单克隆抗体亚型的鉴定按照Sigma公司的Mouse Monoclonal Antibody Isotyping Reagents鉴定试剂盒说明书进行单克隆抗体亚型的鉴定。
1.5.2 单克隆抗体亲和力的鉴定利用间接ELISA方法测定单克隆抗体的亲和力,以1 g/mL重组蛋白GST-chIL-4包被酶标反应板,封闭后加入倍比稀释的单克隆抗体,以HRP标记的山羊抗小鼠IgG为二抗,酶标仪读取OD450吸光值。当连续几个稀释度的OD450读数不再增大时视为抗原抗体100%结合,以抗体浓度 (mol/L) 为横坐标,OD450吸光值为纵坐标做散点图,生成对数趋势线和公式。将OD450最大值的一半带入公式,求出此时的抗体浓度即为单克隆抗体的亲和力解离常数 (Kd)[12]。
1.5.3 单克隆抗体特异性的鉴定以原核表达的重组蛋白His-chIL-4、His-chIL-2、His-chIL-10和His-chIFN-γ为抗原,分别以His-tag单克隆抗体和3株chIL-4单克隆抗体1G11-3B、2E5-3D和1G11-5H为一抗,以HRP标记山羊抗小鼠IgG为二抗进行Western blotting,检测单克隆抗体的特异性。
1.5.4 间接免疫荧光鉴定单克隆抗体将DF-1细胞接种于48孔板,4×104个细胞/孔,待细胞密度达到60%左右时,按照Vigofect的转染方法转染pRK5-flag-chIL-4和pRK5-flag质粒,并设置相应对照组。转染24 h后依次用4%多聚甲醛固定,0.2% Triton X-100透化,1% BSA封闭,然后以制备的单克隆抗体作为一抗,以FITC标记的兔抗小鼠IgG抗体为二抗,进行间接免疫荧光试验,以鉴定单克隆抗体能否识别真核表达的chIL-4。
1.5.5 单克隆抗体抗原识别区的确定成熟chIL-4含有112个氨基酸 (aa) 残基,分别以N端第80位和第40位氨基酸为截点,构建chIL-4的截短表达载体Δ1 (His-chIL-4 1-80 aa) 和Δ2 (His-chIL-4 40-112 aa)。在E. coli BL21中分别诱导截短蛋白表达后,以此为抗原,以单克隆抗体为一抗,通过Western blotting分析3株单克隆抗体的抗原识别区。
2 结果与分析 2.1 原核表达载体的构建及蛋白纯化所构建的载体经菌液PCR鉴定,所得结果与预期一致 (图 1A和1B)。构建成功的载体在E. coli BL21中诱导表达后,经SDS-PAGE分析及Western blotting鉴定,确定重组蛋白His-chIL-4和GST-chIL-4均以包涵体的形式表达 (图 1C和1D),通过稀释复性的方法对重组蛋白进行纯化,获得较好的纯化效果 (图 1E和1F)。
|
| 图 1 原核表达载体的构建及蛋白纯化 Figure 1 Construction of prokaryotic expression vectors and purification of the recombinant proteins. (A) Identification of pET-28a-chIL-4 by PCR. (B) Identification of pGEX-6p-1-chIL-4 by PCR. (C) Western blotting analysis of His-chIL-4 protein. 1: uninduced His-chIL-4; 2: induced His-chIL-4; 3: induced pET-28a. (D) Western blotting analysis of GST-chIL-4 protein.1: uninduced GST-chIL-4; 2: induced GST-chIL-4; 3: induced pGEX-6p-1. (E) Purification of His-chIL-4 protein. M: protein marker; 1: induced pET-28a; 2: uninduced His-chIL-4; 3: supernatant of induced His-chIL-4; 4: precipitate of induced His-chIL-4; 5: purified His-chIL-4. (F) Purification of GST-chIL-4 protein. M: protein marker; 1: induced pGEX-6p-1; 2: uninduced GST-chIL-4; 3: supernatant of induced GST-chIL-4; 4: precipitate of induced GST-chIL-4; 5: purified GST-chIL-4. |
| |
小鼠经3次免疫后,血清中chIL-4抗体效价达到1:64 000。细胞融合后利用间接ELISA方法进行筛选,将筛选到的阳性杂交瘤细胞株经过3次亚克隆后,得到3株可稳定分泌抗chIL-4蛋白的杂交瘤细胞株,分别命名为1G11-3B、2E5-3D和1G11-5H。将杂交瘤细胞注射到小鼠腹腔,收获腹水后利用正辛酸饱和硫酸铵法纯化,获得纯度较高的单克隆抗体 (图 2) 。

|
| 图 2 单克隆抗体的纯化 Figure 2 Purification of anti-chIL-4 McAbs. M: protein marker; lanes 1,3,and 5: 1G11-3B,2E5-3D,and 1G11-5H before purification,respectively; lanes 2,4,and 6: 1G11-3B,2E5-3D,and 1G11-5H after purification,respectively. |
| |
根据Mouse Monoclonal Antibody Isotyping Reagents试剂盒的检测方法,确定3株单克隆抗体的亚型均为IgG1。
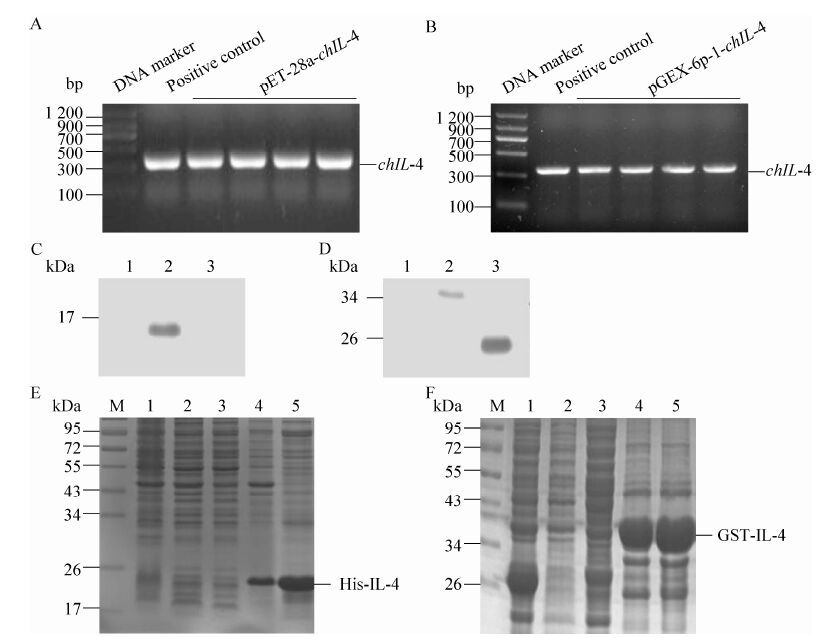
2.3.2 单克隆抗体亲和力的鉴定利用间接ELISA方法测定单克隆抗体的亲和力,结果表明1G11-3B、2E5-3D和1G11-5H的亲和力解离常数 (Kd) 分别为1.79×10-9、1.61×10-9和2.36×10-9 (图 3) 。
|
| 图 3 单克隆抗体亲和力测定 Figure 3 Affinity test of anti-chIL-4 McAbs. (A-C) Affinity test of 1G11-3B,2E5-3D,and 1G11-5H,respectively. |
| |
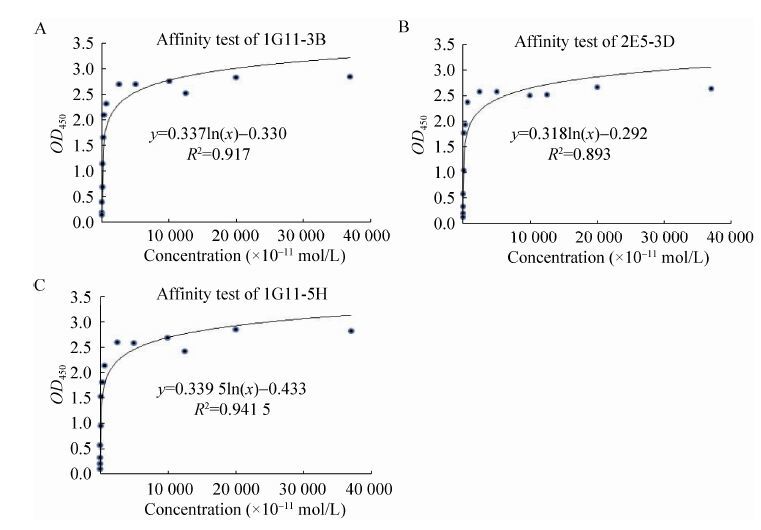
利用Western blotting鉴定单克隆抗体对原核表达的细胞因子的识别情况,结果表明3株单克隆抗体均能识别His-chIL-4,而不识别带有His标签的其他细胞因子,表现出良好的特异性 (图 4) 。
|
| 图 4 单克隆抗体特异性鉴定 Figure 4 Identification of specificity of anti-chIL-4 McAbs by Western blotting. |
| |
利用间接免疫荧光试验鉴定单克隆抗体对真核细胞表达的chIL-4的识别情况,结果表明,3株单克隆抗体均能识别真核细胞表达的chIL-4。图 5是其中1株的鉴定结果,另外2株鉴定结果与此相同。

|
| 图 5 间接免疫荧光鉴定单克隆抗体 Figure 5 Identification of anti-chIL-4 McAbs by indirect immunofluorescence assay. The scale bar represents 2 mm. |
| |
以chIL-4截短蛋白为抗原,单克隆抗体为一抗,利用Western blotting确定单克隆抗体的抗原识别区。结果表明,1G11-3B、2E5-3D和1G11-5H的抗原识别区分别为chIL-4蛋白N端的第1-40 aa、80-112 aa和40-80 aa (图 6) 。

|
| 图 6 单克隆抗体抗原识别区分析 Figure 6 Mapping of the recognition regions of anti-chIL-4 McAbs. (A) Schematic of the genes encoding the full-length or truncated chIL-4 proteins. (B) Recognition regions analysis of anti-chIL-4 McAbs by Western blotting. (C) Schematic of the possible recognition regions of anti-chIL-4 McAbs. |
| |
IL-4是Th2细胞产生的特征性细胞因子,主要由CD4+ T细胞分泌[13]。IL-4在免疫反应中具有重要的调控作用,不仅对B细胞、T细胞、单核细胞和树突状细胞等免疫细胞有免疫调节效应,还对内皮细胞和成纤维细胞等非免疫细胞也发挥着不同的作用[14-15]。
IL-4作为B细胞的生长因子,能增强B细胞增殖活性,上调细胞表面分子,包括MHCⅡ类分子[16]、低亲和力IgE受体CD23[17]和IL-4R[18]。IL-4作为T细胞的生长因子,能诱导细胞增殖和抗凋亡[19]。天然T细胞在抗原刺激后分化为Th2细胞的过程中需要IL-4,而这些Th2细胞又能分泌大量的IL-4和其他细胞因子,如IL-5和IL-13,由此激活正反馈回路,阻断分泌IFN-γ的Th1细胞的发育,由此稳定Th2占主导地位的免疫反应[20]。在一些感染性疾病模型中,IL-4对感染后免疫系统是Th1型还是Th2型免疫反应起着决定性作用。IL-4这一重要性已经在中和抗IL-4抗体[20]、sIL-4R[21]或者IL-4基因缺失小鼠[22]等许多小鼠模型中得到证实。此外,IL-4通过上调单核细胞MHCⅡ类分子的表达增强巨噬细胞的抗原递呈作用,同时下调促炎性细胞因子的产生[23]。IL-4还参与炎症反应,影响血管粘附分子1 (VCAM-1) [24]或内皮型选择素[25]等内皮粘附分子的表达,促进趋化因子的产生,因而有利于嗜酸性粒细胞向感染部位的移行。
目前已有大量文献研究了人、小鼠、大鼠和猪等哺乳动物的IL-4基因及其生物学活性,但关于家禽Th2类细胞因子了解的较少[26-30]。本研究按照常规方法将chIL-4基因构建在2个不同的原核表达载体上,进而在大肠杆菌中表达带有不同标签的重组蛋白,将它们分别作为免疫蛋白和筛选蛋白。考虑到chIL-4全长基因编码的蛋白包括25个氨基酸大小的信号肽和 112个氨基酸大小的成熟chIL-4,所以在设计引物时只将编码成熟chIL-4的碱基序列克隆到原核表达载体上。在小鼠脾细胞与骨髓瘤细胞融合之后,利用间接ELISA对阳性细胞株进行筛选,然后利用有限稀释法进行3次亚克隆,最终获得3株能够稳定分泌抗chIL-4单克隆抗体的杂交瘤细胞株。经过鉴定确定这3株单克隆抗体均有良好的特异性和亲和力。由于制备该单克隆抗体的最终目的是建立双抗体夹心ELISA,因此要求所得到的单克隆抗体至少要有两个不同的抗原识别区。在本研究中,为了初步确定单克隆抗体的抗原识别区,构建了chIL-4的截短蛋白,然后利用Western blotting确定了3株单克隆抗体分别识别chIL-4不同的抗原表位。另外,免疫小鼠所用是原核细胞表达的重组蛋白,而原核细胞表达的蛋白与真核细胞表达的蛋白是有差异的,因此,本研究利用间接免疫荧光试验验证了所制备的单抗隆抗体同样能够识别真核表达的chIL-4。综上所述,本研究所获得的3株抗chIL-4单克隆抗体为制备chIL-4的双抗体夹心ELISA检测试剂盒提供了材料,也为深入研究chIL-4的生物学作用奠定了基础。
| [1] |
Chen JH. Development of monoclonal antibodies against chicken IL-4 and an antibody sandwich ELISA for the detection of chicken IL-4 [D]. Yangzhou: Yangzhou University, 2009 (in Chinese). 陈俊华. 抗鸡IL-4单克隆抗体的研制及其双抗体夹心ELISA方法的初步建立 [D]. 扬州: 扬州大学, 2009. |
| [2] | Avery S, Rothwell L, Degen WD, et al. Characterization of the first nonmammalian T2 cytokine gene cluster: the cluster contains functional single-copy genes for IL-3, IL-4, IL-13, and GM-CSF, a gene for IL-5 that appears to be a pseudogene, and a gene encoding another cytokine-like transcript, KK34. J Interferon Cytokine Res, 2004, 24 (10) : 600–610. DOI: 10.1089/jir.2004.24.600 |
| [3] | Kubota T, Yokayama M, Kishima M, et al. Gene expression of chicken interleukine-4 by baculovirus. Vet Immunol Immunopathol, 2009, 128 (1/3) : 309. |
| [4] |
Dai H, Zheng JY, Chen JH, et al. Cloning and expression of chicken interleukin-4 gene.
Chin J Prev Veter Med, 2008, 30 (6) : 473–477.
(in Chinese). 戴华, 郑佳玉, 陈俊华, 等. 鸡白细胞介素4基因的克隆及其原核表达. 中国预防兽医学报, 2008 , 30 (6): 473-477. |
| [5] |
Weng L, Zhang LJ, Zhang QB, et al. Development of a sensitive sandwich ELISA to chicken interleukin-2(ChIL-2).
J Xiamen Univ: Nat Sci, 2006, 45 (S1) : 142–145.
(in Chinese). 翁凌, 张凌晶, 张其标, 等. 抗体夹心酶联免疫吸附法测定鸡白细胞介素-2. 厦门大学学报: 自然科学版, 2006 , 45 (S1): 142-145. |
| [6] |
Wang XY. Development and preliminary application of double sandwich ELISA for detecting chicken interleukin-18 [D]. Tai’an: Shandong Agricultural University, 2013 (in Chinese). 王肖祎. 鸡白细胞介素18双抗体夹心ELISA检测方法的建立及初步应用 [D]. 泰安: 山东农业大学, 2013. |
| [7] |
Zheng YS. Effects of immunosuppressive virus infection on interferon-gamma production in the splenic leukocytes of SPF chickens [D]. Tai’an: Shandong Agricultural University, 2006 (in Chinese). 郑玉姝. 免疫抑制性病毒感染对SPF鸡脾细胞IFN-γ产生的影响 [D]. 泰安: 山东农业大学, 2006. |
| [8] |
Sun BB. Identification and crystal structure of MDV CTL epitope presenting by chicken B15 and study of its immune protection [D]. Beijing: China Agricultural University, 2013 (in Chinese). 孙贝贝. 鸡B15 MDV CTL表位的鉴定与晶体结构解析及其免疫保护效果研究 [D]. 北京: 中国农业大学, 2013. |
| [9] |
Luo Z, Liu RC, Zheng SJ. Prokaryotic expression of Listeria monocytogene (LM) hly and development of monoclonal antibodies against listeriolysin O (LLO).
Chin J Biotech, 2009, 25 (11) : 1652–1657.
(in Chinese). 罗正, 刘若尘, 郑世军. 单核增生性李氏杆菌溶血素的原核表达及其单克隆抗体的制备. 生物工程学报, 2009 , 25 (11): 1652-1657. |
| [10] | Yokoyama WM. Current Protocols in Immunology. New York: John Wiley & Sonc, Inc, 1995 (in Chinese). |
| [11] |
Li SJ. Development and application of monoclonal antibodies against the IBDV VP2 and VP5 proteins [D]. Beijing: China Agricultural University, 2013 (in Chinese). 李善吉. 传染性法氏囊病毒VP2和VP5单克隆抗体的制备鉴定及应用 [D]. 北京: 中国农业大学, 2013. |
| [12] | Liddell JE, Cryer A. A Practical Guide to Monoclonal Antibodies. New York: John Wiley & Sonc, Inc, 1991 : 110 -115(in Chinese). |
| [13] | Seder RA, Paul WE, Davis MM, et al. The presence of interleukin 4 during in vitro priming determines the lymphokine-producing potential of CD4+ T cells from T cell receptor transgenic mice. J Exp Med, 1992, 176 (4) : 1091–1098. DOI: 10.1084/jem.176.4.1091 |
| [14] | Yokota T, Arai N, de Vries J, et al. Molecular biology of interleukin-4 and interleukin-5 genes and biology of their products that stimulate B cells, T cells and hemopoietic cells. Immunol Rev, 1988, 102 : 137–187. DOI: 10.1111/imr.1988.102.issue-1 |
| [15] | Estes DM, Hirano A, Heussler VT, et al. Expression and biological activities of bovine interleukin 4: effects of recombinant bovine interleukin-4 on T cell proliferation and B cell differentiation and proliferation in vitro. Cell Immunol, 1995, 163 (2) : 268–279. DOI: 10.1006/cimm.1995.1126 |
| [16] | Noelle R, Krammer PH, Ohara J, et al. Increased expression of Ia antigens on resting B cells: an additional role for B-cell growth factor. Proc Natl Acad Sci USA, 1984, 81 (19) : 6149–6153. DOI: 10.1073/pnas.81.19.6149 |
| [17] | Defrance T, Aubry JP, Rousset F, et al. Human recombinant interleukin-4 induces Fc epsilon receptors (CD23) on normal human B lymphocytes. J Exp Med, 1987, 165 (6) : 1459–1467. DOI: 10.1084/jem.165.6.1459 |
| [18] | Ohara J, Paul WE. Up-regulation of interleukin 4/B-cell stimulatory factor 1 receptor expression. Proc Natl Acad Sci U S A, 1988, 85 (21) : 8221–8225. DOI: 10.1073/pnas.85.21.8221 |
| [19] | Hu-Li J, Shevach EM, Mizuguchi J, et al. B cell stimulatory factor 1 (interleukin-4) is a potent costimulant for normal resting T lymphocytes. J Exp Med, 1987, 165 (1) : 157–172. DOI: 10.1084/jem.165.1.157 |
| [20] | Romani L, Mencacci A, Grohmann U, et al. Neutralizing antibody to interleukin-4 induces systemic protection and T helper type 1-associated immunity in murine candidiasis. J Exp Med, 1992, 176 (1) : 19–25. DOI: 10.1084/jem.176.1.19 |
| [21] | Puccetti P, Mencacci A, Cenci E, et al. Cure of murine candidiasis by recombinant soluble interleukin-4 receptor. J Infect Dis, 1994, 169 (6) : 1325–1331. DOI: 10.1093/infdis/169.6.1325 |
| [22] | Kopf M, Le Gros G, Bachmann M, et al. Disruption of the murine IL-4 gene blocks Th2 cytokine responses. Nature, 1993, 362 (6417) : 245–248. DOI: 10.1038/362245a0 |
| [23] | Bogdan C, Nathan C. Modulation of macrophage function by transforming growth factor beta, interleukin-4, and interleukin-10. Ann N Y Acad Sci, 1993, 685 : 713–739. DOI: 10.1111/nyas.1993.685.issue-1 |
| [24] | Thornhill MH, Wellicome SM, Mahiouz DL, et al. Tumor necrosis factor combines with IL-4 or IFN-gamma to selectively enhance endothelial cell adhesiveness for T cells. The contribution of vascular cell adhesion molecule-1-dependent and - independent binding mechanisms. J Immunol, 1991, 146(2): 592-598. |
| [25] | Bennett BL, Cruz R, Lacson RG, et al. Interleukin-4 suppression of tumor necrosis factor α-stimulated E-selectin gene transcription is mediated by STAT6 antagonism of NF-κB. J Biol Chem, 1997, 272 (15) : 10212–10219. DOI: 10.1074/jbc.272.15.10212 |
| [26] | Wondimu A, Veit M, Kohn B, et al. Molecular cloning, expression and characterization of the Canis familiaris interleukin-4. Cytokine, 2001, 16 (3) : 88–92. DOI: 10.1006/cyto.2001.0953 |
| [27] | Nuntaprasert A, Mori Y, Fujita K, et al. Expression and purification of recombinant swine interleukin-4. Comp Immunol Microbiol Infect Dis, 2005, 28 (1) : 17–35. DOI: 10.1016/j.cimid.2004.03.012 |
| [28] |
Chen GH, Jing ZZ, Sun SD. Cloning and expression of porcine IL-4 gene.
Chin J Prev Veter Med, 2005, 27 (6) : 469–473.
(in Chinese). 陈国华, 景志忠, 孙世铎. 猪白细胞介素-4基因的克隆与表达. 中国预防兽医学报, 2005 , 27 (6): 469-473. |
| [29] | Cottrez F, Auriault C, Capron A, et al. Murine interleukin-4 production with baculovirus: an easy and rapid method for a small scale production of functional interleukins. Eur Cytokine Netw, 1994, 5 (5) : 481–487. |
| [30] | Jayaram B, Devos R, Guisez Y, et al. Purification of human interleukin-4 produced in Escherichia coli. Gene, 1989, 79 (2) : 345–354. DOI: 10.1016/0378-1119(89)90216-3 |
 2017, Vol. 33
2017, Vol. 33