中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陈晨辉, 赵自叶, 徐进, 曹雪松, 郭尚敬, 李军, 王皓, 侯盛
- Chen Chenhui, Zhao Ziye, Xu Jin, Cao Xuesong, Guo Shangjing, Li Jun, Wang Hao, Hou Sheng
- 重组人心房利钠肽(ANP)的原核表达、纯化及鉴定
- Prokaryotic expression, purification and identification of recombinant human atrial natriuretic peptide
- 生物工程学报, 2016, 32(9): 1273-1285
- Chin J Biotech, 2016, 32(9): 1273-1285
- 10.13345/j.cjb.160018
-
文章历史
- Received: January 10, 2016
- Accepted: March 24, 2016
2 聊城大学 生命科学学院,山东 聊城 252000
3 聊城大学 药学院,山东 聊城 252000
4 上海张江生物技术有限公司,上海 201203
5 第二军医大学肿瘤研究所,上海 200433
6 抗体药物与靶向治疗国家重点实验室,上海 201203
2 School of Life Sciences, Liaocheng University, Liaocheng 252000, Shandong, China ;
3 School of Pharmacy, Liaocheng University, Liaocheng 252000, Shandong, China ;
4 Shanghai Zhangjiang Biotechnology Co., Shanghai 201203, China ;
5 Cancer Institute, the Second Military Medical University, Shanghai 200433, China ;
6 State Key Laboratory of Antibody Medicine and Targeted Therapy, Shanghai 201203, China
人心房利钠肽(ANP)是由人心房肌细胞分泌的一种小肽激素,由28个氨基酸组成,其中的17个氨基酸通过一对二硫键连接形成闭合环,而氨基端和羧基端分别有6个和5个氨基酸组成的短链(图 1)。研究表明,ANP具有舒张血管、降低血压、增加血管通透性以及利钠、利尿等作用[1],并能对抗肾素-血管紧张-醛固酮系统,在调节心血管系统[2-4]和盐水代谢平衡中也发挥着重要的作用[5-6]。目前,重组人心房利钠肽[7],主要用于心力衰竭的治疗[8-10]。
作为多肽类药物,ANP因分子量较小,目前主要采用化学合成的方法和重组表达进行大规模制备。然而,基因重组表达技术的发展,尤其是串联表达技术开发为多肽的制备提供了另一种选择方案[5-8]。为提高ANP的表达量,降低重组表达成本,本研究采用3个ANP基因进行串联表达的模式,首次在大肠杆菌中重组表达融合蛋白His6-K-ANP-K-ANP-K-ANP(His6-ANP3),其中在ANP与融合标签以及ANP之间均加入赖氨酸K。串联融合蛋白在经过变复性,Lys-C (Endoproteinase Lys-C)和CPB (Carboxypeptidase B)酶切后,经过层析纯化,可得到正确形成二硫键内肽环的单体ANP。经Tricine-SDS-PAGE[15]和HPLC鉴定,蛋白纯度大于90%,LC-MS结果显示目的蛋白为单体ANP且无明显氧化及脱氨基修饰。
1 材料与方法 1.1 材料 1.1.1 质粒及菌株大肠杆菌TG1、BL21 (DE3)及质粒pET28a(+)为本实验室保存,pGEM-T vector购自Promega公司。
1.1.2 基因合成及引物设计由Invitrogen公司全基因合成含3个通过赖氨酸K连接的串联ANP基因序列(每个片段84 bp),即pMD18-T/ANP3,并设计引物:正向引物(5′-3′) CATATGGACGACGACGACAAGTCT (含DDDDK,以利于复性后蛋白标签的酶切去除),限制性酶切位点是NdeⅠ;反向引物为(5′-3′) AAGCTTCTATCATTAGTAGCGAAAGGAGTTACAGC,限制性酶切位点是Hind Ⅲ。
1.1.3 主要试剂限制性内切酶、DNA Marker 2000、λ-Hind III digest DNA Marker购自TaKaRa公司。T4 DNA连接酶、Go-Taq Green Master Mix购自Promega公司。ANP标准品购自Chinese Peptide Company。蛋白Marker购自Thermo Scientific公司。琼脂糖购自Amresco公司。胰蛋白胨、酵母提取物购自Oxoid公司。色谱级乙腈、质谱级甲酸购自Sigma公司。色谱级三氟乙酸购自TEDIA公司。Ni2+层析填料购自美国GE Healthcare公司。Nuvia S层析填料购自美国Bio-Rad公司。ACQUITY UPLC BEH C18 Column (1.7 µm,2.1 mm×100 mm)、ACQUITY UPLC BEH300 C4 (1.7 μm,2.1 mm×50 mm)均购自美国Waters公司。Human ANP (h-ANP) ELISA Kit (检测范围:20-480 pg/mL)购自上海酶研生物技术有限公司。其他试剂均为国产分析纯。
1.2 主要仪器设备超纯水,Milli-Q系统:Millipore公司产品;AKTA Purifier纯化仪:GE公司;串联四级杆飞行时间质谱仪Xevo G2-S QTof:Waters公司;超高效液相色谱层析系统,Acquity UPLC H-Class Bio系统:Waters公司;多功能酶标仪,SpectraMax M5,Molecular Devices。
1.3 方法 1.3.1 pET28a(+)/ANP3原核表达载体的构建和鉴定以全基因合成的pMD18-T/ANP3克隆质粒为模板,PCR扩增获得含有限制性内切酶Nde Ⅰ和Hind Ⅲ酶切位点的目的基因片段。2%琼脂糖凝胶电泳后,切胶纯化回收目的DNA片段,并将回收片段与载体pGEM-T-Vector连接,转化TG1感受态细胞,利用质粒DNA抽提试剂盒提取质粒后酶切鉴定,并测序鉴定;再用Nde Ⅰ和Hind Ⅲ从测序正确的T载体上切下目的片段,2%琼脂糖凝胶电泳,胶回收目的片段,与经过同样酶切的表达载体pET28a(+)连接,转化TG1,然后挑克隆,提取质粒,再进行酶切鉴定,选一个鉴定正确的质粒,再转化表达菌株BL21 (DE3),最后鉴定并保存正确的种子菌株。
1.3.2 ANP3重组蛋白的诱导表达及条件优化将菌液pET28a(+)/ANP3 BL21 (DE3)接种于5 mL LB培养基中37 ℃振荡过夜,按1:50体积比扩大培养,在OD600值达到0.6-1.0后,分别加入不同终浓度的IPTG,在25 ℃、37 ℃进行诱导表达4 h,取样处理,进行15% SDS-PAGE电泳分析,确定最佳诱导表达条件。
1.3.3 ANP3重组蛋白包涵体变性、复性、纯化及鉴定根据最佳优化条件培养菌体,离心收集菌体,并用1×PBS缓冲液充分悬浮,于冰上超声破碎菌体(超声2 s,间隙6 s,360 W功率,30 min),离心(9 000 r/min,30 min)弃上清,获得包涵体。包涵体变性处理(变性液:8 mol/L尿素+20 mmol/L Tris,pH 8.0):包涵体称重,溶解,离心,经0.45 μm滤膜过滤。初步纯化:首先用Ni+亲和色谱柱纯化(平衡液:20 mmol/L PB +500 mmol/L氯化钠+20 mmol/L咪唑+ 8 mol/L尿素,pH 7.4;洗脱液:20 mmol/L PB+ 500 mmol/L氯化钠+500 mmol/L咪唑+8 mol/L尿素,pH 7.4),UV280波长检测,收集洗脱峰;然后使用Sephadex G25脱盐柱将所得主峰置换至Tris尿素缓冲液中(20 mmol/L Tris+8 mol/L尿素,pH 7.5),UV280波长检测。复性处理(复性液:100 mmol/L醋酸+0.2%聚山梨酯80,pH 3.0,4 ℃提前预冷):按照一定的体积比例(1:25)进行稀释复性,4 ℃放置过夜。调节复性液pH,利用蛋白酶Lys-C进行酶切,然后采用阳离子交换Nuvia S进行纯化,UV215波长检测,获得ANP单体蛋白以及末端含K的ANP蛋白;再将末端含赖氨酸K的ANP洗脱峰调节pH至中性,利用羧肽酶CPB进行酶切,再次采用阳离子交换柱NuviaS纯化,UV215波长检测,获得单体蛋白ANP。最后,利用12% Tricine-SDS-PAGE、UPLC-C18反相检测柱以及LC-MS分析和鉴定各纯化阶段的蛋白。
1.3.4 UPLC-C18反相检测以标准品作为参照,用ACQUITY UPLC BEH C18 Column (1.7 µm,2.1 mm×100 mm)色谱柱以超纯水-0.1%甲酸为流动相A,乙腈-0.1%甲酸为流动相B,15%-90% B液进行15 min梯度洗脱,流速0.4 mL/min,上样量10 μL,检测波长设置为214 nm及280 nm。
1.3.5 质谱分析目的蛋白ANP以及含K的ANP片段将末端含赖氨酸K的ANP洗脱峰(Nu-E4),即酶切前以及CPB酶切后的样品置换缓冲液至碳酸氢铵(50 mmol/L,pH 7.8)中,通过UPLC-ESI-Q-TOF技术对其进行质量分析。用ACQUITY UPLC BEH300 C4 (1.7 μm,2.1 mm×50 mm)反相柱,以10%乙腈-1%甲酸为流动相A,乙腈为流动相C,10%-30%流动相C进行10 min梯度洗脱,流速0.3 mL/min,上样量为2 μL。
1.3.6 ELISA分析检测首先将ANP参比品(960 pg/mL)以2倍比进行稀释,即:960、480、240、120、60、30 pg/mL。再将纯化获得的样品ANP利用样品稀释液稀释至960 pg/mL,然后再以2倍比进行稀释样品。分别以50 μL/孔体积加样,同时设置空白孔;37 ℃温育30 min;用洗涤液重复洗板5次,拍干;加酶:每孔加入酶标试剂50 μL,空白孔除外;37 ℃再温育30 min;洗板;显色10 min;终止反应;450 nm波长测定。
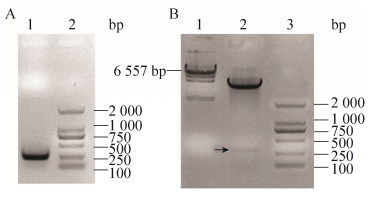
2 结果与分析 2.1 重组质粒pET28a(+)/ANP3构建以pMD18-T/ANP3克隆质粒为模板,PCR扩增含ANP3的目的片段,产物经2%琼脂糖凝胶电泳检测,在约250 bp处可见扩增产物,大小与预期相符。然后与pET28a(+)载体连接,用NdeⅠ和Hind Ⅲ双酶切鉴定,结果表明重组原核表达载体pET28a(+)/ANP3构建成功(图 2)。
|
| 图 2 重组原核表达质粒pET28a(+)/ANP3的构建 Figure 2 Construction of pET28a(+)/ANP3 recombinant prokaryotic expression plasmid. (A) 1: PCR products of ANP3; 2: DL2000 DNA marker. (B) 1: λ-Hind Ⅲ digest DNA marker; 2: digestion identification of pET28a(+)/ANP3 with Nde Ⅰ和Hind Ⅲ; 3: DL2000 DNA marker. |
| |
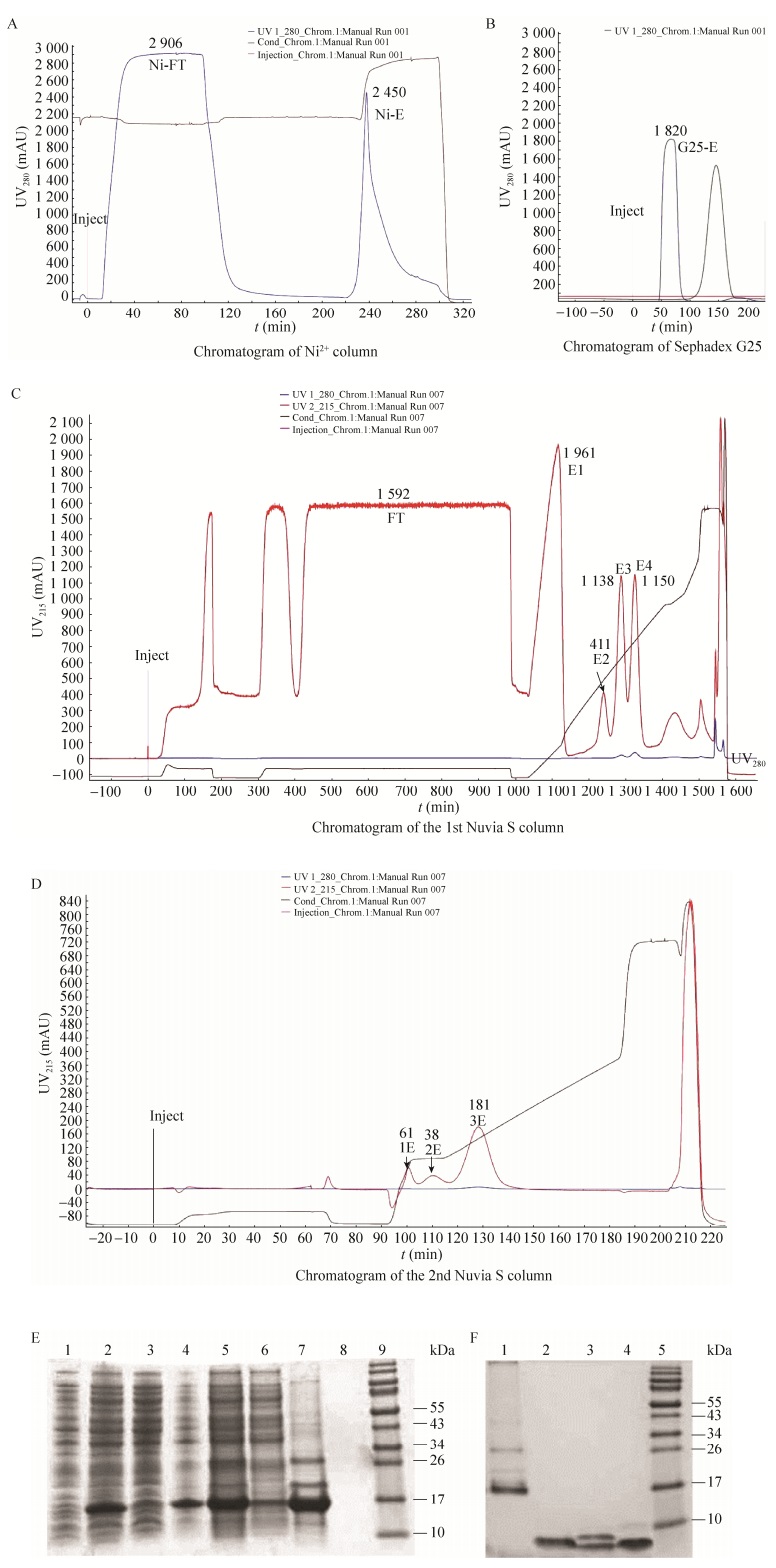
pET28a(+)/ANP3/BL21菌液在扩大培养后OD600为0.6-1.0,经0.025 mmol/L IPTG诱导培养,15% SDS-PAGE结果显示在分子量约14 kDa诱导出目的蛋白(图 3,箭头指示位置),与理论值相符,并确定最佳诱导条件为:0.025 mmol/L的IPTG,温度37 ℃,时间4 h。通过摇瓶培养,将重组蛋白依次经过变复性酶切及进一步层析纯化,可获得约3 kDa的目的蛋白,其纯度可达到90%以上(图 4),最终每升摇瓶菌液可获得约16 mg目的蛋白。后期我们可尝试使用10 μm C18制备填料进行纯化,缓冲液及梯度条件同分析条件,可以将蛋白纯度进一步提高。

|
| 图 3 诱导温度及时间对重组蛋白ANP3表达量的影响 Figure 3 Effect of inducing temperature and time on the expression of ANP3; 1: pET28a(+)/ANP3/BL21(DE3) noninduced; 2: supernatant of pET28a(+)/ANP3/BL21 (DE3) induced by 25 ℃, 2 h; 3: inclusion body of pET28a (+)/ANP3/BL21(DE3) induced by 25 ℃, 2 h; 4: supernatant of pET28a(+)/ANP3/BL21(DE3) induced by 37 ℃, 2 h; 5: inclusion body of pET28a(+)/ANP3/BL21 (DE3) induced by 37 ℃, 2 h; 6: unstained protein ladder; 7: supernatant of pET28a(+)/ANP3/BL21(DE3) induced by 25 ℃, 4 h; 8: inclusion body of pET28a(+) /ANP3/BL21(DE3) induced by 25 ℃, 4 h; 9: supernatant of pET28a(+)/ANP3/BL21(DE3) induced by 37 ℃, 4 h; 10: inclusion body of pET28a(+)/ ANP3/BL21(DE3) induced by 37 ℃, 4 h. |
| |
|
| 图 4 重组蛋白ANP3纯化图及12% Tricine-SDS-PAGE分析 Figure 4 Purification chromatogram and 12% Tricine-SDS-PAGE analysis. (A-D) Chromatogram of Ni2+column, Sephadex G25, the 1st Nuvia S column, the 2nd Nuvia S column respectively. (E)1: pET28a(+)/ANP3/BL21(DE3) noninduced; 2: bacterium of induced pET28a(+)/ANP3/BL21(DE3); 3: supernatant of induced pET28a(+)/ANP3/ BL21(DE3); 4: inclusion body of induced pET28a(+)/ANP3/BL21(DE3); 5: denatured solution of the inclusion body; 6–7: flowthrough of Ni2+column (Ni-FT), elution of Ni2+column(Ni-E); 8: loading buffer control; 9: unstained protein ladder. (F) 1: elution of Sephadex G25 (G25-E); 2–3: elution 4 and elution 3 of the 1st Nuvia S column (Nu-E4/E3) after Lys-C digestion; 4: elution from the 2nd Nuvia S column (Nu-3E) after CPB digestion; 5: pageRuler prestained protein ladder. |
| |
包涵体复性液调节pH至6.5,以质量比1:50加入蛋白酶Lys-C,4 ℃酶切2 h后,0.45 μm滤膜过滤,即为组分[1]上样液sample,然后进行第一次阳离子交换柱Nuvia S纯化,分别收集洗脱峰,第一个峰为[2]杂质峰(Nu-E1),第二个峰为[3]杂质峰(Nu-E2),第三个为目的峰[4] ANP单体(Nu-E3),第四个峰为目的峰[5]末端含K的ANP片段(Nu-E4),以浓度为0.1 mg/mL的ANP标准品[6]作为参照,利用反相UPLC-C18进行检测(图 4C;图 5A、B)。

|
| 图 5 UPLC-C18检测蛋白酶LysC酶切重组蛋白ANP3色谱图 Figure 5 UPLC-C18 chromatogram of recombinant protein ANP3after LysC digestion. (A-B): ANP standard sample eluted around 5.27 min, ANP fractions contained K(Nu-E4) eluted at around 4.72 min, ANP monomer(Nu-E3) eluted at around 5.27 min. |
| |
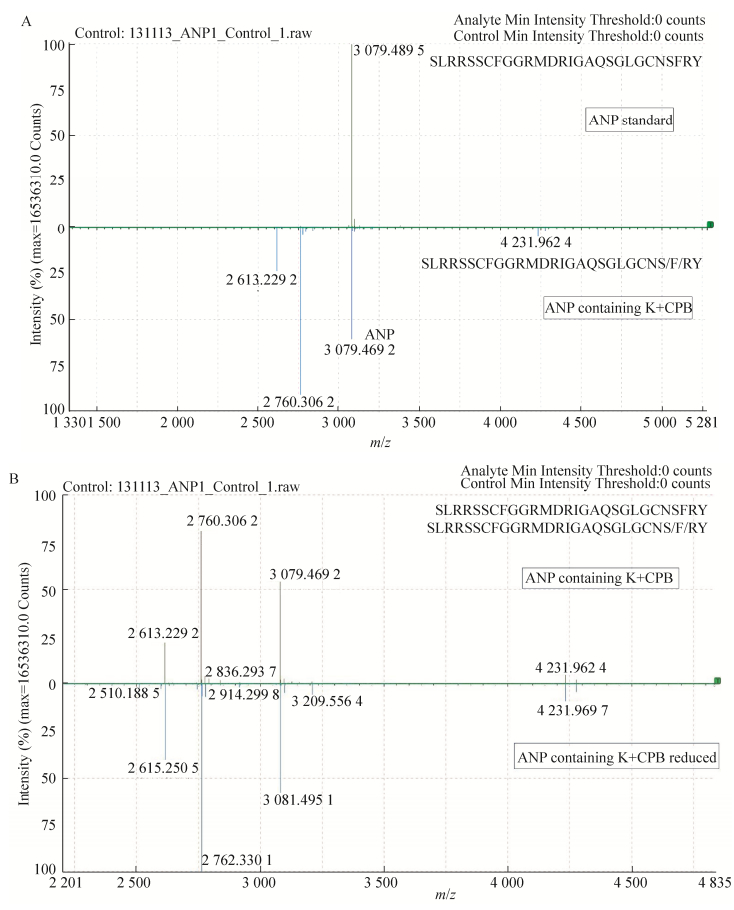
对于末端含赖氨酸K的ANP片段(Nu-E4),调节pH至中性(pH 7.65),按酶与蛋白1:800的质量比,室温酶切反应2 h,样品处理后,利用LC-ESI-TOF质谱检测,结果如下:图 6A显示酶切反应后可获得质荷比为3 079.469 2的ANP单体,与标准品ANP大小一致;图 6B表明还原后的目的蛋白分子量比未还原的目的蛋白大2 Da,与理论分子量一致,说明目的蛋白ANP单体中存在完整的二硫键,即初步判断纯化获得的ANP单体具有较为完整的环状结构。
|
| 图 6 含K的ANP(Nu-E4)及CPB酶切后的质谱鉴定图(TIC) Figure 6 MS spectrum of ANP containing K (Nu-E4) and Nu-E4 digested by CPB. (A) Comparative spectrum of ANP standard substance and Nu-E4 digested by CPB. (B) Comparative spectrum of digested Nu-E4 nonreduced(up) and reduced by DTT(down). |
| |
经常规CPB酶切条件酶切后,通过质谱计算,发现CPB也存在非特异性酶切,酶切位置分别位于ANP序列C端的CNSF|RY与CNS|FRY处,对应质荷比分别为2 760.306 2和2 613.229 2 (图 6B)。故为了提高目的蛋白的得率,需要对CPB酶切条件进行优化,从而减少非特异性酶切。
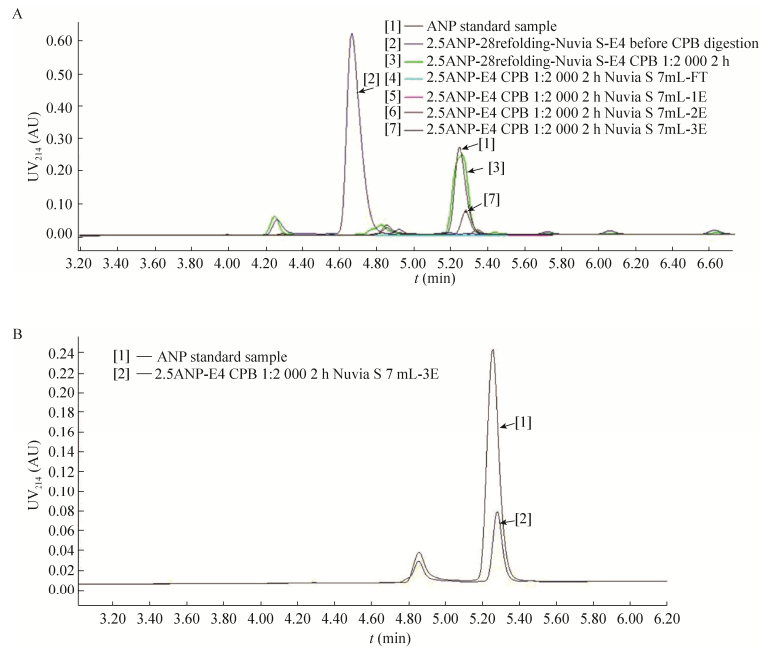
2.4.3 CPB酶切条件优化后的UPLC-C18检测通过减少酶切时间或酶用量,CPB与目的蛋白以1:2 000质量比,室温,酶切2 h反应后,非特异性酶切显著降低(图 7A),0.45 μm滤膜进行过滤,即为组分[3]上样液sample,其中[2]为CPB酶切前的样品,然后再利用第二次阳离子交换柱Nuvia S纯化,首先组份[4]为过柱流出液FT (Flow through),再分别收集洗脱峰,第一个峰为[5]杂质峰(Nu-1E),第二个峰为[6]杂质峰(Nu-2E),第三个为目的峰[7] ANP单体(Nu-3E),以[1]标准品ANP (0.1 mg/mL)作为参照,利用反相UPLC-C18进行检测(图 4D;图 7A、B)。结果显示:以CPB与Nu-E4按1:2 000质量比进行酶切反应的条件适中,收集到的目的峰为Nu-3E。
|
| 图 7 UPLC-C18检测蛋白酶CPB酶切含K的ANP色谱图 Figure 7 UPLC-C18 chromatogram of ANP fractions contained K after CPB digestion. (A) ANP fractions contained K after CPB digestion. (B) ANP standard sample and ANP monomer (Nu-3E) eluted at around 5.30 min. |
| |
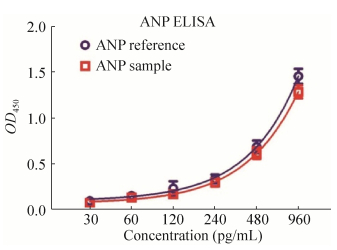
通过450 nm波长依序测量各孔的吸光度(OD值),4参数回归拟合作图(图 8)。结果显示本研究表达纯化的ANP单体蛋白与ANP参比品具有相似的活性。从另一方面证明了所表达的ANP与参比品具有一致的抗原识别表位。
|
| 图 8 ELISA检测目的蛋白ANP Figure 8 ELISA assay of ANP. Cycle: ANP reference product; square: ANP sample. |
| |
心房利钠肽(ANP)是目前用于心力衰竭治疗的一种多肽类药物,其对于防止高血压、心肾等相关疾病的治疗方面[16-21]以及抗肿瘤的作用[14, 22]方面具备良好的应用前景。由于直接重组表达小肽药物的表达量低、稳定性差及容易降解等性质,ANP及其他多肽的制备目前仍以体外多肽合成为主。本研究采用多拷贝基因串联表达的方式进行ANP制备。在目的基因与融合标签(His6-tag)间以及各拷贝基因之间均有赖氨酸(K)作为linker,即可以被限制性Lys-C酶切。而CPB的使用,则可以进一步水解去除ANP羧基端残留的K。新构建的表达载体His6-ANP3在大肠杆菌中可实现高效表达,并产生大量包涵体。同时,可以使用His标签进行初步的纯化,在包涵体的变性及复性条件优化后,ANP的得率明显提升,但对于表达量占菌体约60%的包涵体进行复性纯化,后续仍有较大的提升空间。我们在前期的探索性研究阶段也尝试过串联1个、2个及3个ANP在pET22b(+)中进行表达,但是经过诱导后,包涵体含量为3个串联的最多,1个及2个串联表达量比较低;随后换成pET28a(+)后,3个串联的表达量得到了进一步提高,考虑到这种情况,我们在最终表达质粒的选择上使用了3个串联表达。因此,在表达量方面也许存在更进一步的优化空间。
在本研究中,还发现CPB在酶切末端含赖氨酸K的ANP片段时存在非特异酶切,且这一现象可在优化酶切条件后得以改善,同时非特异性酶切的片段可以经过优化后续纯化予以去除。同时,在使用CPB时需要严格控制酶切比例及时间,减少由于非特异酶切带来的蛋白损失。
此外,UPLC及质谱技术的应用,可实现对小分子药物序列及结构进行快速准确的初步鉴定。ANP中由两个半胱氨酸所形成的环状结构以及羧基端的氨基酸残基对于维持其生物活性起到至关重要的作用[23],因此十分有必要采用质谱技术进行精确的分子量鉴定,以此来确定ANP结构及序列的正确性,同时也可以对蛋白的降解、氧化及脱氨基予以鉴定。在后续的研究中,我们将对得到的ANP单体进行大鼠体内降压、利尿、体外舒张血管等相关的实验[13, 24-26],并在纯化工艺及鉴定方法上进一步优化,以用于大规模生产。
| [1] | Gardner DG, Chen S, Glenn DJ, et al. Molecular biology of the natriuretic peptide system: implications for physiology and hypertension. Hypertension,2007, 49 (3) : 419 –426. DOI: 10.1161/01.HYP.0000258532.07418.fa |
| [2] | Hisatomi K, Eishi K. Multicenter trial of carperitide in patients with renal dysfunction undergoing cardiovascular surgery. Gen Thorac Card Surg,2012, 60 (1) : 21 –30. DOI: 10.1007/s11748-011-0846-5 |
| [3] | Morita Y, Kohsaka S, Oshima K, et al. Use of carperitide infusion for acutely decompensated heart failure. Criti Care,2012, 16 (1) : 406 . DOI: 10.1186/cc10606 |
| [4] | McKie PM, Burnett JC. Rationale and therapeutic opportunities for natriuretic peptide system augmentation in heart failure. Curr Heart Fail Rep,2014, 12 (1) : 7 –14. |
| [5] | Frossard PM, Coleman RT. Human atrial natriuretic peptides (ANP) gene locus: Bgl I RFLP. Nucleic Acids Res,1986, 14 (22) : 9223 . DOI: 10.1093/nar/14.22.9223 |
| [6] | Lema G. Human atrial natriuretic peptide, renal function, and cardiac surgery: do we all read the same?. Ann Thorac Cardiovasc Surg,2009, 15 (2) : 138 –139. |
| [7] | Kangawa K, Matsuo H. Purification and complete amino acid sequence of α-human natriuretic polypeptide (α-hANP). Biochem Biophys Res Commun,1984, 118 (1) : 131 –139. DOI: 10.1016/0006-291X(84)91077-5 |
| [8] | Richards A M. The natriuretic peptides in heart failure. Basic Res Cardiol,2004, 99 (2) : 94 –100. DOI: 10.1007/s00395-004-0461-z |
| [9] | Ezekowitz J A. Novel pharmacologic therapies in development for acute decompensated heart failure. Curr Cardiol Rep,2013, 15 (2) : 329 . DOI: 10.1007/s11886-012-0329-z |
| [10] | George M, Rajaram M, Shanmugam E, et al. Novel drug targets in clinical development for heart failure. Eur J Clin Pharmacol,2014, 70 (7) : 765 –774. DOI: 10.1007/s00228-014-1671-4 |
| [11] |
Zhao M, Ma KT, Zhang NH. Expression of multi-copied atrial natriuretic peptide in solube form in E. coli.
Chin J Biochem Mol Biol,1999, 15 (3) : 383 –386.
(in Chinese). 赵明, 马康涛, 张迺蘅. 在大肠杆菌中表达可溶的多串心钠素. 中国生物化学与分子生物学报, 1999 , 15 (3) : 383-386. |
| [12] |
Chen WJ, Wang J, Lu JZ, et al. High level expression of human atrial natriuretic peptide in fusion form in E. coli system.
Acta Acad Med Sin,2001, 23 (6) : 573 –579.
(in Chinese). 陈伟京, 王俊, 路金芝, 等. 在大肠杆菌中以融合蛋白高效表达基因工程产品人心钠素. 中国医学科学院学报, 2001 , 23 (6) : 573-579. |
| [13] |
Chen WJ.
The genetic engineering study on atrial natriuretic peptide and an exploration on the technologic strategy of small peptide genetic engineering. Beijing: Peking Union Medical College, 2003 (in Chinese).
陈伟京. 心钠素基因工程研究及小肽基因工程技术路线探索. 北京: 中国协和医科大学, 2003 . |
| [14] |
Gao B, Wu XY, Lu Y. Anticancer effects of atrial natriuretic peptide and recombinant expression of the peptide.
Chin J Clin Med,2012, 19 (4) : 437 –439.
(in Chinese). 高波, 吴晓琰, 陆怡. 心房利钠肽的抗肿瘤作用及其基因工程表达. 中国临床医学, 2012 , 19 (4) : 437-439. |
| [15] | Haider SR, Reid HJ, Sharp BL. Tricine-SDS-PAGE. Methods Mol Biol,2012, 869 : 81 –91. DOI: 10.1007/978-1-61779-821-4 |
| [16] | Kanzaki M, Wada J, Kikumoto Y, et al. The therapeutic potential of synthetic human atrial natriuretic peptide in nephrotic syndrome: a randomized controlled trial. Int J Nephrol Renovasc Dis,2012, 5 : 91 –96. |
| [17] | Sowers JR. Diabetes mellitus and vascular disease. Hypertension,2013, 61 (5) : 943 –947. DOI: 10.1161/HYPERTENSIONAHA.111.00612 |
| [18] | Lee CYW, Burnett Jr JC. Natriuretic peptides and therapeutic applications. Heart Fail Rev,2007, 12 (2) : 131 –142. DOI: 10.1007/s10741-007-9016-3 |
| [19] | Moro C, Klimcakova E, Lolmède K, et al. Atrial natriuretic peptide inhibits the production of adipokines and cytokines linked to inflammation and insulin resistance in human subcutaneous adipose tissue. Diabetologia,2007, 50 (5) : 1038 –1047. DOI: 10.1007/s00125-007-0614-3 |
| [20] | Shinagawa K. Clinical development and regulatory approval of acute heart failure drugs in Japan. Cardiovasc Drugs Ther,2015, 29 (2) : 107 –109. DOI: 10.1007/s10557-015-6579-4 |
| [21] | Nakamura Y, Hagino I, Aoki M, et al. Changes in plasma atrial and brain natriuretic peptide levels in children undergoing surgical isolated atrial septal defect closure. Ped Cardiol,2015, 36 (6) : 1219 –1224. DOI: 10.1007/s00246-015-1148-y |
| [22] | Nojiri T, Hosoda H, Tokudome T, et al. The world's first clinical randomized trial of atrial natriuretic peptide for preventing cancer recurrence following lung cancer surgery. BMC Pharmacol Toxicol,2015, 16 (Suppl 1) : A72 . DOI: 10.1186/2050-6511-16-S1-A72 |
| [23] |
Qin N, Wei N, Yao XH, et al. The synthesis and secretion of human atrial natriuretic peptide in yeast cells.
Chin Sci,1991, 21 (1) : 62 –66.
(in Chinese). 秦宁, 魏楠, 姚锡惠, 等. 人心钠素在酵母细胞中的合成与分泌. 中国科学, 1991 , 21 (1) : 62-66. |
| [24] | Zhao M, Ma KT, Zhang NH. Purification of multi-copied atrial natriuretic peptide and the identification of its activity. Chin J Biochem Mol Biol,1999, 15 (5) : 836 –838. |
| [25] |
Daniel D, Correa de sa MD, Chen HH. The role of natriuretic peptides in heart failure.
Curr Heart Fail Rep,1999, 15 (5) : 836 –838.
(in Chinese). 赵明, 马康涛, 张迺蘅. 多串心钠素的纯化与活性测定. 中国生物化学与分子生物学报, 1999 , 15 (5) : 836-838. |
| [26] | Guido Boerrigter MD, Burnett Jr MD. Cardiorenal syndrome in decompensated heart failure: prognostic and therapeutic implications. Curr Heart Fail Rep,2004, 1 : 113 –120. DOI: 10.1007/s11897-004-0020-9 |
 2016, Vol. 32
2016, Vol. 32





