中国科学院微生物研究所、中国微生物学会主办
文章信息
- 高利芬, 刘鹏程, 夏志辉, 赵纪莹, 史佳楠, 江光怀, 刘国振, 翟文学
- Gao Lifen, Liu Pengcheng, Xia Zhihui, Zhao Jiying, Shi Jianan, Jiang Guanghuai, Liu Guozhen, Zhai Wenxue
- 水稻转基因系CX8621中Xa21的整合和表达
- Integration and expression of Xa21 in transgenic rice CX8621
- 生物工程学报, 2016, 32(9): 1255-1263
- Chin J Biotech, 2016, 32(9): 1255-1263
- 10.13345/j.cjb.150549
-
文章历史
- Received: December 24, 2015
- Accepted: January 28, 2016
2 江汉大学 系统生物学研究院,湖北 武汉 430056
3 河北农业大学 生命科学学院,河北 保定 071001
2 Institute for System Biology, Jianghan University, Wuhan 430056, Hubei, China ;
3 College of Life Sciences, Hebei Agricultural University, Baoding 071001, Hebei, China
水稻白叶枯病是导致水稻严重减产的主要病害之一,利用来源于水稻自身的抗病基因可以经济有效地控制病害的发生[1]。其中,水稻中克隆的第一个广谱显性抗病基因Xa21,是十分理想的抗源之一[2]。目前,在我国生产上广泛应用的主要栽培品种中,基本上都不含有该基因。因此,利用Xa21培育抗白叶枯病新品种具有重要的生产意义[3]。
鉴于Xa21的优良抗性,自克隆以来,已被广泛用于改良水稻对白叶枯病的抗性。育种家先后将其转育明恢63[4]、矮培64[5]、9311[6]、中恢218[7]、蜀恢527[8]、R8006[9]等重要恢复系,并培育出诸如国稻1号、中优218等抗病新品种。此外,国内多家实验室用农杆菌介导、基因枪转化等方法先后将Xa21转入到多个水稻品种中,这些转基因植株都显示出对白叶枯病的广谱抗性[10-14]。然而按照我国《农业转基因生物安全评价管理办法》的规定,对获得的这些转基因材料中外源基因的遗传分析却鲜有报道。
本实验室以明恢86 (MH86)为受体,通过农杆菌介导的双元转化系统获得了转Xa21纯合的转基因系CX8621。此前,我们确定了所获得的CX8621为无选择标记、无载体骨架残留的单拷贝抗性株系[15]。目前,CX8621已经稳定遗传了16代,依然保持着对白叶枯病的优良抗性。按照我国农业部《农业转基因生物安全评价管理办法》的规定,先后通过了中间试验、环境释放和生产性试验,目前正在申请国家转基因生产应用的安全证书。按照我国《转基因植物安全评价指南》的要求,本文对Xa21在CX8621中整合的完整性、在染色体上的整合位点以及在RNA水平和蛋白水平的表达情况进行了分析,以期为CX8621的转基因生物安全性提供科学依据。
1 材料与方法 1.1 水稻材料供试水稻明恢86 (MH86)为籼稻恢复系,CX8621是以MH86为受体,pBXa21[16]为转化载体获得的转Xa21纯合株系,实验室前期遗传分析已证实为无选择标记、无载体骨架残留的单拷贝植株[15]。IRBB21为国际水稻所转育的含有Xa21的分子标记辅助育种材料。MH86-Xa21是以MH86为受体,IRBB21为Xa21供体,通过分子标记辅助回交转育的含Xa21抗性材料。4021[17]是通过转基因途径获得的Xa21过表达水稻材料,由佛罗里达大学宋文源博士提供。
1.2 T-DNA侧翼序列扩增与染色体定位参照刘耀光教授Tail-PCR的原理[18],按照Takara LA-PCR体外克隆试剂盒的操作方法,对CX8621中Xa21左右边界的侧翼序列进行扩增。扩增片段电泳回收后,连接到Transgene公司的pT-easy载体上进行测序。测序结果去除测序载体序列后,与NCBI和RGAP数据库中的水稻基因组序列进行比对,根据获得的侧翼序列与水稻基因组序列之间的相似性,确定Xa21在CX8621的整合位点。
1.3 目的基因在RNA水平的表达分析Trizol法提取CX8621和IRBB21萌芽期、三叶期、分蘖盛期和灌浆期的叶片总RNA,以及根、茎、叶、叶鞘、穗和种子部位的RNA,用Promega公司的反转录系统合成cDNA后,以水稻actin基因为内参,利用RT-PCR方法对Xa21在CX8621的不同时期、不同组织的表达情况进行分析。Xa21的RT-PCR分析所用的引物是Xa21-RTF/R,文中所用引物见表 1。
| Primer name | Primer sequence (5'–3') |
| LBF1 | GTACCGAGCTCGAATTCAGTACAT |
| LBF2 | ACGTCCGCAATGTGTTATTAAG |
| 109R1 | GAAAATATCGAGATTCCTGAATCCGGTGGT |
| 109R2 | GTGTTCGACCACATTCATAATCACGCTA |
| 109F4 | AAGTACCGCGAACGGATGGAGCATT |
| Xa21-RT | F: CAAGTCTAAGCAGCCAAACA R: ATTGCCAGCTCTTACGGT |
| Actin | F: AGCAACTGGGATGATATGGA R: CAGGGCGATGTAGGAAAGC |
SDS-PAGE分离水稻总蛋白质,电泳前将提取的水稻总蛋白加入上样缓冲液,100 ℃处理5 min,上样量为20 μL。用湿转法转移到PVDF膜上,5%脱脂奶粉封闭PVDF膜,用制备的XA21蛋白质的抗体室温孵育3 h,TTBS (2 mmol/L Tris·HCl, ph 7.6, 13.6 mmol/L NaCl, 0.1% Tween-20)洗膜3次,每次5 min。然后加入二抗室温孵育1 h,TTBS洗膜3次,每次5 min,加ECL-Plus检测液,暗室曝光后X光片检测。
2 结果与分析 2.1 Xa21在CX8621中的实际整合序列分析为了分析Xa21在CX8621中的整合是否完整,在T-DNA的左、右边界内侧和Xa21基因内部设计嵌套引物进行配对扩增。在左边界内侧设计LBR1、LBR2、LBR3、LBR4四条引物分别和LBR配对(图 1A),以MH86、CX8621以及转基因质粒pBXa21为模板进行扩增。以pBXa21为模板时,能获得目标条带,而在对照MH86中未能进行扩增,这说明了引物的有效性(图 1B)。LBR1、LBR2和LBR3分别与LBR配对,在转基因系CX8621中都能扩增出特异的目标条带,而LBR4与LBR配对时在转基因系CX8621中没有扩增(图 1B),表明Xa21的3′端被完整地整合在CX8621的染色体上,并且T-DNA的左边界内侧序列可能有一定程度的丢失。同样,在右边界内侧设计引物RBR1、RBR2与RBF配对(图 1A),同样以MH86、CX8621和转基因质粒pBXa21为模板进行扩增,两对引物在对照MH86中未能有效扩增,在CX8621和转基因质粒pBXa21中都能扩增出大小一致的目标条带(图 1C),表明Xa21的5′端同样被完整的整合到CX8621的基因组。根据以上结果,结合前期Southern杂交实验[15];可以确定Xa21在CX8621中有完整的整合。
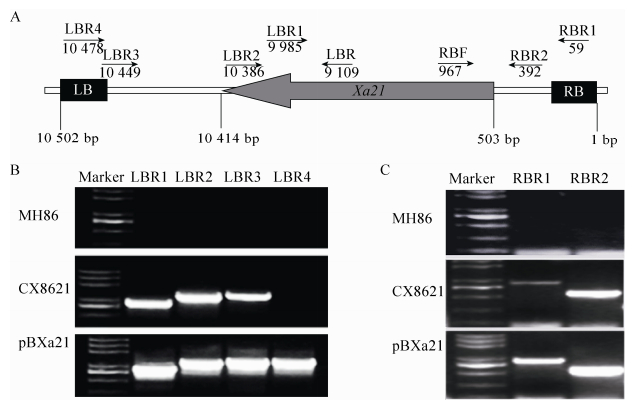
|
| 图 1 Xa21在CX8621中的整合完整性分析 Figure 1 The integration integrity analysis of Xa21 in CX8621. (A) Primers location on the transgenic plasmid. (B) PCR results of left border. (C) PCR results of right border. MH86: transformation receptor variety; CX8621: Xa21 transgenic plants; pBXa21: plasmid with Xa21; marker: Genstar 2 000 plus. |
| |
借助Takara的体外克隆试剂盒,对CX8621进行边界序列的扩增。获得候选条带后,连到T载体上进行测序。除去测序结果中的载体序列后,获得了298 bp的左边界侧翼序列和460 bp的右边界侧翼序列。右边界侧翼序列填充了大量重复的水稻基因组DNA,未能有效地定位插入片段的位置。对左边界侧翼序列的分析显示(图 2A),1-24 bp (斜体)和载体左边界序列完全一致。25-48 bp (小写)与水稻基因组多位点同源,但与之后的片段不连锁。49-298 bp (下划线)与2号染色体上的序列完全匹配,插入片段被整合到Os02g0541000与Os02g0541300之间。

|
| 图 2 Xa21在CX8621整合位点的定位与验证 Figure 2 Integration site location and validation of Xa21 in CX8621. (A) The left flanking sequences. Italic: left border sequences; lowercase: rice sequences homology with multiple chromosomes; underline: rice sequences located on chromosome 2. (B) Primers location of CX8621 on chromosome 2. (C) PCR results with primer pair 109R2 and LBF1. (D) PCR results with primer pair 109R1 and LBF2. (E) PCR results with primer pair 109F4 and 109R1. MH86: transformation receptor variety; CX8621: Xa21 transgenic plants; Marker: DL2 000. |
| |
为了验证整合位点的正确性,在2号染色体上设计引物109F4、109R1和109R2,与左边界特异引物LBF1、LBF2进行配对扩增(图 2B)。109R2+LBF1、109R1+LBF2两对引物都在转基因材料CX8621中特异的扩增,在对照材料MH86中无扩增(图 2C, D),此结果印证了整合位置的正确性;109R2+LBF1、109R1+LBF2可以作为CX8621转基因材料特异的分子标记。109F4+109R1配对在对照MH86中扩增到和预计大小一致的520 bp片段;在转基因系CX8621中,由于插入了1个9.9 kb的Xa21基因,在较短的扩增时间内没有扩增片段(图 2E)。
2.3 Xa21在CX8621中的表达分析通过Trizol法提取了转基因系CX8621不同组织的RNA,采用RT-PCR的方法,检测了Xa21在CX8621不同组织的表达情况。结果显示,和在IRBB21中的表达模式类似,在转基因系CX8621的叶、叶鞘和茎内都能检测到Xa21的表达,而在穗、根和种子中检测不到表达(图 3A)。由于Xa21介导的抗性受发育阶段的调控,导入Xa21的受体植株,生长到分蘖期才能表现出完全的抗性[19]。于是,我们对不同时期CX8621中Xa21的表达进行分析,与IRBB21表达模式一样,Xa21在三叶期开始检测到表达,分蘖盛期达到最高,此后略有下降(图 3B)。这与之前报道的CX8621的抗性结果吻合,在三叶期表现为部分抗性,随着生育进程的推进,分蘖盛期抗性达到最佳[15]。
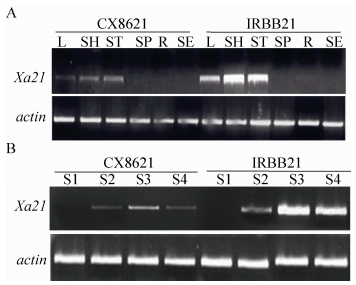
|
| 图 3 Xa21在CX8621中的表达分析 Figure 3 Expression analysis of Xa21 in transgenic rice CX8621. (A) Expression analysis of CX8621 in different tissues. L: leaf; SH: sheath; ST: stem; SP: spike; R: root; SE: seed. (B) Expression analysis of CX8621 at different developmental stages. S1: sprouting stage; S2: three-leaf stage; S3: high tillering stage; S4: filling stage. |
| |
Xa21编码受体类蛋白激酶,全长1 025个氨基酸,包含LRR区、跨膜区和丝氨酸/苏氨酸激酶区3个结构域[2]。XA21蛋白能进行自我磷酸化,与XA21结合的多个蛋白都能影响XA21的表达,进而影响对白叶枯病的抗性[20-21]。Xa21作为抗病反应的启动基因,其自身的蛋白表达量非常低。目前,国际上还未能成功通过免疫印迹法(Western blotting)在植物中检测到天然XA21蛋白的表达。对XA21蛋白表达的分析均是在外加标签的基础上,针对特异的标签进行检测。外加标签的方法可以用于常规的分子生物学研究中,然而对于以生产应用为目的转基因育种,在目标基因中引入外加标签等同于新添加了一个潜在的不安全因素。因此,在转基因育种中不能采用这种设计来进行蛋白含量的检测。对于CX8621中XA21蛋白表达量的检测,必须制备出天然XA21蛋白的单克隆抗体。为此,我们与国内外的合作者不断进行研究,并在最近,与北京华大蛋白质研发中心合作,制备出了XA21蛋白特异的单克隆抗体。
在得到XA21特异的单克隆抗体后,我们对MH86、Xa21高表达材料4021,以MH86为背景的Xa21回交育种材料MH86-Xa21和CX8621进行了根、茎、叶和种子内XA21蛋白质含量的检测。结果显示在Xa21高表达材料4021的叶子中检测到了XA21,在CX8621和MH86-Xa21的根、茎、叶和种子中均没有检测到XA21蛋白的表达(图 4)。在我们的实验条件下,所制备抗体的检测下限为0.5-1.0 ng,综合RT-PCR的结果,认为XA21蛋白在CX8621的种子中没有表达。
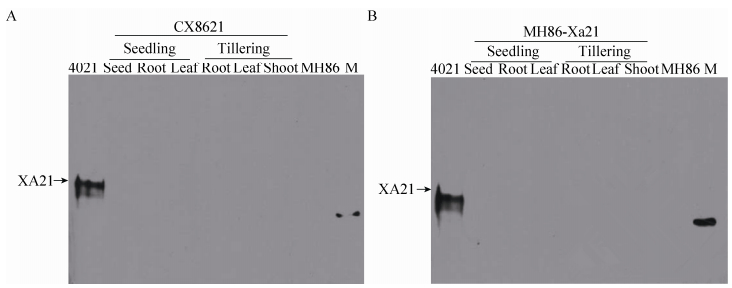
|
| 图 4 XA21蛋白在CX8621中的表达分析 Figure 4 Expression analysis of XA21 in transgenic rice CX8621. (A) Expression analysis of XA21 in CX8621. (B) Expression analysis of XA21 in MH86-Xa21. 4021: Xa21 overexpression rice line; CX8621: Xa21 transgenic plants; MH86: transformation receptor variety; MH86-Xa21: Xa21 backcross breeding line; M: 90 kDa protein. |
| |
外源基因在转基因植物中的稳定遗传与高效表达是其具有利用价值的先决条件,而转基因植物目标基因的稳定遗传与表达主要取决于受体基因组的遗传背景(背景效应)、目的基因的拷贝数(剂量效应)、以及整合位点的结构(位置效应)[22]。实验室前期工作中,将Xa21转入不同的水稻材料,通过Tail-PCR扩增出携带有T-DNA-Xa21的侧翼序列,并以此为探针,通过RFLP分析,将T-DNA-Xa21定位在水稻的染色体上。结果发现T-DNA-Xa21在受体整合的自主性强,不依赖于受体中Xa21同源序列的染色体位置;并且在相同背景材料、不同插入位点的转基因系中显示出几乎相同的抗性水平,说明转基因的位置效应不明显。此外,对同一材料不同拷贝数的转Xa21基因水稻的抗性进行分析发现,抗性水平不会随着Xa21拷贝数的增加而增加,表明剂量效应不是影响抗性水平的主要因素。然而,不同遗传背景的转Xa21水稻材料,虽然都保持了对白叶枯病的高抗水平,但不同材料之间仍显示出了明显的差异,表明转Xa21基因的水稻其抗性有比较明显的遗传背景效应[23-24]。
T-DNA整合进入植物基因组,往往伴随着T-DNA自身或受体基因组的缺失、重复和倒置等现象[25]。本文在分析CX8621的侧翼序列时也发现,左边界内侧的部分序列发生了缺失而填充了24 bp水稻基因组片段。Buck等在对T-DNA整合的转基因水稻研究中发现,在插入位点也存在类似边界序列的缺失和填充现象,同时还发现缺失的序列和大小不存在规律性,而填充序列与宿主植物或T-DNA的左右边界存在一定的同源性[26-27]。Kumar等在完善T-DNA的整合模型时认为,这些同源序列是在T-DNA整合过程中,植物靶DNA双链断裂,游离出的植物基因组3'端找到与其同源的小段DNA后开始修复合成,新合成的DNA序列与植物基因组另一端游离的一小段序列直接连接到平末端,通过单链退火使余下的单链缺口修复形成的[28]。
Xa21在CX8621的表达呈现出受发育阶段性的调控,这与我们前期研究CX8621对白叶枯病的抗性表现一致,即随着水稻植株的发育成熟,含有Xa21的水稻植株对白叶枯病的抗性逐渐提高[15]。Park等通过在水稻中过表达Xa21,使其在苗期就表现出了对白叶枯病较强的抗性,同样说明了Xa21的抗性水平与其表达量存在相关性[29]。此外,Park还通过外加标签的方法在过表达水稻材料的叶片中检测到了XA21蛋白的表达,然而对于以生产应用为目的的转基因育种来说,这种方法引入了新的安全隐患,难以被采用。于是,我们通过制备天然的抗体检测CX8621中XA21的表达,结果在过表达材料4021中检测到了XA21,在CX8621及其相同遗传背景的MH86-Xa21中均未能检测到表达。这可能是由于Xa21作为抗病的启动基因,其蛋白表达量很少,低于实验所能检测的下限所致,我们会继续改善检测的灵敏度,希望能对其表达量进行更加精确的定量。
此外,Xa21基因在CX8621中的表达模式和在分子标记辅助选育的IRBB21材料中保持一致,说明转基因操作并没有改变目标基因的表达模式。我们前期从整体转录组水平的研究也表明,转基因材料和分子标记辅助选育材料可以同等对待[30]。此外,在人类食用的种子部分,Xa21基因和XA21蛋白在CX8621中均没有检测到表达。以上这些结果为CX8621的转基因安全性评价提供了部分科学证据。
| [1] | Ogawa T. Methods and strategy for monitoring race distribution and identification of resistance genes to bacterial leaf blight (Xanthomonas campestris pv. oryzae) in rice. Jpn Agr Res Q,1993, 27 (2) : 71 –80. |
| [2] | Song WY, Wang GL, Chen LL, et al. A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21. Science,1995, 270 (5243) : 1804 –1806. DOI: 10.1126/science.270.5243.1804 |
| [3] |
Zhai WX, Zhu LH. Research on bacteria blight resistance and molecular breeding in rice.
Prog Biotech,1999, 19 (6) : 9 –15.
(in Chinese). 翟文学, 朱立煌. 水稻白叶枯病抗性基因的研究与分子育种. 生物工程进展, 1999 , 19 (6) : 9-15. |
| [4] |
Xue QZ, Zhang NY, Xion ZF, et al. Application of molecular marker-assisted selection to cultivate bacterial blight resistance restorer line in rice.
J Zhejiang Agric Univ,1998, 24 (6) : 581 –582.
(in Chinese). 薛庆中, 张能义, 熊兆飞, 等. 应用分子标记辅助选择培育抗白叶枯病水稻恢复系. 浙江农业大学学报, 1998 , 24 (6) : 581-582. |
| [5] |
Chen XR. Identifying on photo-thermo sensitive genic male sterile lines in rice and study on Xa21 transgenic progeny Peiai64S [D]. Hangzhou: Zhejiang University, 2002 (in Chinese). 陈小荣.水稻光温敏核不育系鉴定及培矮64S转Xa21后代分析[D].杭州:浙江大学, 2002. |
| [6] |
Zhou YF, Qi HX, Wan BL, et al. Studies on increasing resistance of 9311 to bacterial blight by molecular marker assisted selection.
Mol Plant Breeding,2004, 1 (5) : 835 –836.
(in Chinese). 周元飞, 戚华雄, 万丙良, 等. 运用分子标记辅助选择技术改良9311白叶枯病抗性的研究. 分子植物育种, 2004 , 1 (5) : 835-836. |
| [7] |
Peng YC, Li WH, Fang YP. Breeding and application of indica hybrid rice Zhongyou218 by molecular marker-assisted selection.
Hybrid Rice,2004, 19 (3) : 13 –16.
(in Chinese). 彭应财, 李文宏, 方又平, 等. 采用分子标记技术育成优质抗病杂交稻新组合中优218. 杂交水稻, 2004 , 19 (3) : 13-16. |
| [8] |
Huang TY. Improvement of bacteria blight resistance of Shuhui527 by molecular maker-assisted selection and mapping the genes involved in fertility of Pingxiang genic male sterile rice [D]. Ya'an: Sichuan Agriculture University, 2004 (in Chinese). 黄廷友.分子标记辅助选择改良蜀恢527对白叶枯病的抗性和萍乡核不育水稻育性相关基因的定位分析[D].雅安:四川农业大学, 2004. http://www.cnki.com.cn/Article/CJFDTOTAL-AHNY200106000.htm |
| [9] |
Cao LY, Zhan XD, Zhuang JY, et al. Breeding of indica hybrid rice Guodao1 with good quality, high yield and resistance to bacterial leaf blight by marker-assisted selection technique.
Hybrid Rice,2005, 20 (3) : 16 –18.
(in Chinese). 曹立勇, 占小登, 庄杰云, 等. 利用分子标记辅助育种技术育成优质高产抗病杂交稻国稻1号. 杂交水稻, 2005 , 20 (3) : 16-18. |
| [10] |
Zhao B, Wang WM, Zheng XW, et al. Utilization of Agrobacterium tumefaciens-mediated system inducing Xa21 to photo-thermo sensitive genic male sterile line Peiai64S.
J Yunnan Univ: Nat Sci Ed,1999, 21 (3) : 197 .
(in Chinese). 赵彬, 王文明, 郑先武, 等. 应用农杆菌介导法将白叶枯病抗性基因Xa21导入水稻光敏不育系培矮64S. 云南大学学报:自然科学版, 1999 , 21 (3) : 197. |
| [11] |
Li XB, Yi CD. A genetically modified japonica restorer line, C418-Xa21, and its hybrid rice with bacterial blight resistance.
Chin J Biotech,2001, 17 (4) : 380 –384.
(in Chinese). 李晓兵, 裔传灯. 经基因工程改良的抗白叶枯病水稻粳型恢复系"C418-Xa21"及其杂交稻. 生物工程学报, 2001 , 17 (4) : 380-384. |
| [12] |
Zhou YL, Zhang Q, Wang CL. Resistance of Xa21 transgenic hybrid rice Shanyou63 and Shanyou559 to bacterial blight.
Chin J Rice Sci,2002, 16 (1) : 93 –95.
(in Chinese). 周永力, 章琦, 王春连. 转基因杂交稻组合汕优63和汕优559对白叶枯病的抗性. 中国水稻科学, 2002 , 16 (1) : 93-95. |
| [13] | Zhang SP, Song WY, Chen LL, et al. Transgenic elite indica rice varieties, resistant to Xanthomonas oryzae pv. oryzae. Mol Breeding,1998, 4 (6) : 551 –558. DOI: 10.1023/A:1009601520901 |
| [14] | Gao LF, Xia ZH, Jiang GH, et al. Generation of marker-free, bacterial blight resistant transgenic sterile line and hybrid rice with Xa21. Plant Breeding,2011, 130 (4) : 438 –443. DOI: 10.1111/pbr.2011.130.issue-4 |
| [15] |
Xia ZH, Liu PC, Gao LF, et al. Generation and genetic analysis of Xa21 transgenic rice line CX8621 without selectable markers.
Chin J Rice Sci,2016, 30 (1) : 10 –16.
(in Chinese). 夏志辉, 刘鹏程, 高利芬, 等. 水稻无选择标记Xa21转基因系CX8621的获得与遗传分析. 中国水稻科学, 2016 , 30 (1) : 10-16. |
| [16] |
Xia ZH, Li XB, Chen CY, et al. Generation of selectable, marker-free and vector backbone sequence-free Xa21 transgenic rice.
Chin J Biotech,2006, 22 (2) : 204 –210.
(in Chinese). 夏志辉, 李晓兵, 陈彩艳, 等. 无选择标记和载体骨干序列的Xa21转基因水稻的获得. 生物工程学报, 2006 , 22 (2) : 204-210. |
| [17] | Wang YS, Pi LY, Chen XH, et al. Rice XA21 binding protein 3 is a ubiquitin ligase required for full Xa21-mediated disease resistance. Plant Cell,2006, 18 (12) : 3635 –3646. DOI: 10.1105/tpc.106.046730 |
| [18] | Liu YG, Chen YL, Zhang QY. Amplification of genomic sequences flanking T-DNA insertions by thermal asymmetric interlaced polymerase chain reaction// Transgenic Plants: Methods and Protocols. New York: Humana Press, 2004 : 341 -348(in Chinese). |
| [19] | Century KS, Lagman RA, Adkisson M, et al. Developmental control of Xa21-mediated disease resistance in rice. Plant J,1999, 20 (2) : 231 –236. DOI: 10.1046/j.1365-313x.1999.00589.x |
| [20] | Xu WH, Wang YS, Liu GZ, et al. The auto-phosphorylated Ser686, Thr688, and Ser689 residues in the intracellular juxtamembrane domain of XA21 are implicated in stability control of rice receptor-like kinase. Plant J,2006, 45 (5) : 740 –751. DOI: 10.1111/tpj.2006.45.issue-5 |
| [21] | Liu GZ, Pi LY, Walker JC, et al. Biochemical characterization of the kinase domain of the rice disease resistance receptor-like kinase XA21. J Biol Chem,2002, 277 (23) : 20264 –20269. DOI: 10.1074/jbc.M110999200 |
| [22] | Gambino G, Chitarra W, Maghuly F, et al. Characterization of T-DNA insertions in transgenic grapevines obtained by Agrobacterium-mediated transformation. Mol Breeding,2009, 24 (3) : 305 –320. DOI: 10.1007/s11032-009-9293-8 |
| [23] |
Zhu XF, Chen XW. Genetic mapping of T-DNA integration sites in Xa21 transgenic rice.
Acta Genet Sin,2002, 29 (10) : 880 –886.
(in Chinese). 朱雪峰, 陈学伟. 转Xa21水稻中T-DNA整合的遗传定位. 遗传学报, 2002 , 29 (10) : 880-886. |
| [24] | Zhai WX, Chen CY, Zhu XF, et al. Analysis of T-DNA-Xa21 loci and bacterial blight resistance effects of the transgene Xa21 in transgenic rice. Theor Appl Genet,2004, 109 (3) : 534 –542. |
| [25] | Forsbach A, Schubert D, Lechtenberg B, et al. A comprehensive characterization of single-copy T-DNA insertions in the Arabidopsis thaliana genome. Plant Mol Biol,2003, 52 (1) : 161 –176. DOI: 10.1023/A:1023929630687 |
| [26] | Zhang J, Guo D, Chang Y, et al. Non-random distribution of T-DNA insertions at various levels of the genome hierarchy as revealed by analyzing 13 804 T-DNA flanking sequences from an enhancer trap mutant library. Plant J,2007, 49 (5) : 947 –959. DOI: 10.1111/tpj.2007.49.issue-5 |
| [27] | DeBuck S, Podevin N, Nolf J, et al. The T-DNA integration pattern in Arabidopsis transformants is highly determined by the transformed target cell. Plant J,2009, 60 (1) : 134 –145. DOI: 10.1111/tpj.2009.60.issue-1 |
| [28] | Kumar S, Fladung M. Transgene integration in aspen: structures of integration sites and mechanism of T-DNA integration. Plant J,2002, 31 (4) : 543 –551. DOI: 10.1046/j.1365-313X.2002.01368.x |
| [29] | Park CJ, Lee SW, Chen M, et al. Ectopic expression of rice Xa21 overcomes developmentally controlled resistance to Xanthomonas oryzae pv. oryzae. Plant Sci,2010, 179 (5) : 466 –471. DOI: 10.1016/j.plantsci.2010.07.008 |
| [30] | Gao LF, Cao YH, Xia ZH, et al. Do transgenesis and marker-assisted backcross breeding produce substantially equivalent plants? -a comparative study of transgenic and backcross rice carrying bacterial blight resistant gene Xa21. BMC genomics,2013, 14 (1) : 738 –749. DOI: 10.1186/1471-2164-14-738 |
 2016, Vol. 32
2016, Vol. 32




