中国科学院微生物研究所、中国微生物学会主办
文章信息
- 郭静, 曹玉锦, 咸漠, 刘会洲
- Jing Guo, Yujin Cao, Mo Xian, and Huizhou Liu
- 大肠杆菌生产异戊二烯的代谢工程研究进展
- Advances in metabolic engineering of Escherichia coli for isoprene biosynthesis
- 生物工程学报, 2016, 32(8): 1026-1037
- Chin J Biotech, 2016, 32(8): 1026-1037
- 10.13345/j.cjb.150516
-
文章历史
- Received: December 9, 2015
- Accepted: February 9, 2016
2 中国科学院大学, 北京 100049
2 University of Chinese Academy of Sciences, Beijing 100049, China
随着世界经济和汽车行业的迅猛发展,全球橡胶需求量不断攀升。目前我国已经成为世界上最大的橡胶消费国,天然橡胶和合成橡胶的消费量均位居世界第一[1]。根据美国行业研究机构弗里多尼亚集团 (Freedonia) 2015年发布的预测报告,中国对橡胶制品的需求量预计将以每年8.8%的速率增长,到2017年将达到7 400亿元人民币。轮胎行业仍将是最大的橡胶产品部门。天然橡胶的供应受社会环境,地理位置和气候条件等多种因素影响,其价格走势很难把握,对下游生产成本影响很大。异戊二烯 (2-甲基- 1,3-丁二烯) 橡胶作为一种合成橡胶,在供应上比较稳定,价格也有规律可循,而且聚异戊二烯橡胶的综合性能优异,最接近天然橡胶。因此,轮胎、制鞋等行业对异戊二烯橡胶有着强烈的需求。
异戊二烯是聚异戊二烯橡胶的重要单体,其成本占总生产成本的70%以上。因此,能否提供价格低廉、供应稳定的异戊二烯单体对橡胶行业的发展至关重要。目前,异戊二烯的制备主要有石油基原料异戊烷、异戊烯脱氢法、化学合成法 (包括丙烯二聚法、乙炔-丙酮法、异丁烯-甲醛法) 和裂解C5馏分萃取蒸馏法等[2-3]。然而,随着化石资源的日益枯竭和价格的不断攀升,原料供给问题必然成为制约异戊二烯生产的重要瓶颈。另外,化学法制备异戊二烯的过程中普遍存在能耗高、工艺复杂、对设备要求高、环境污染严重和产物收率低等问题,制约着异戊二烯工业化生产的发展[4-5]。因此,寻找可持续的异戊二烯生产方式是今后异戊二烯工业生产的重要发展趋势。
与传统化学法相比,以生物转化和生物催化为核心的微生物发酵法具有环境友好、利用廉价的可再生原料和可持续发展等优势。因此,微生物合成成为异戊二烯制备领域的重要研究方向。这篇文章介绍了微生物法生产异戊二烯的代谢途径和关键酶,并综述了大肠杆菌生产异戊二烯的研究进展,总结了影响异戊二烯产量的关键酶及改造方式,指导碳代谢流向目标产物异戊二烯,为构建异戊二烯高产工程菌株提供参考。
1 微生物产异戊二烯的代谢途径及关键酶类异戊二烯化合物生物合成的前体物质是异戊烯基焦磷酸 (IPP) 和其异构体3,3-二甲基烯丙基焦磷酸 (DMAPP)。自然界中合成这两种前体物质的代谢途径有两种 (图 1)[6]:一种是甲羟戊酸 (MVA) 代谢途径,主要存在于原核细胞、藻类及高等植物的叶绿体中;另一种是 4-磷酸甲基赤藻糖醇 (MEP) 代谢途径,主要存在于真核细胞、古细菌和高等植物的胞液中[6-10]。
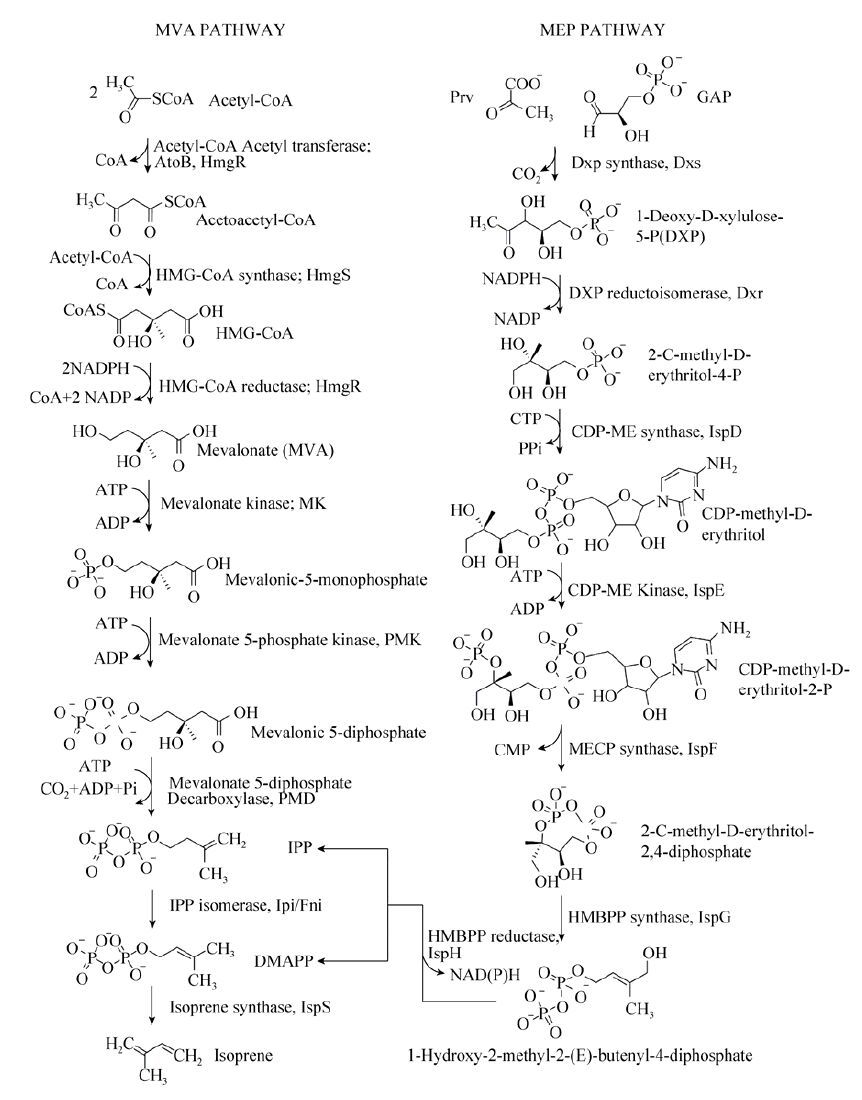
|
| 图 1 类异戊二烯生物合成途径(MVA途径和MEP途径) Figure 1 Biosynthetic pathway of isoprenoids (MVA pathway and MEP pathway). |
| |
上世纪90年代初,人们才从细菌和植物中发现了MEP代谢途径[11-12]。直到2001年,MEP途径中的基因才被完全鉴定出来[8]。虽然MVA途径和MEP途径都起始于中心碳代谢中间体,但不同于MVA途径 (以乙酰辅酶A为起始物),MEP途径的起始反应物是丙酮酸和3-磷酸甘油醛,二者缩合生成1-脱氧-D-木酮糖-5-磷酸 (DXP),这一步反应由DXP合成酶 (DXS) 催化完成,也是MEP途径的第一个限速酶。DXP在5-磷酸脱氧木酮糖还原异构酶 (DXR) 的催化下经重排和还原生成MEP,DXR的催化活性需要NADPH和二价金属离子 (Mg2+,Mn2+,Co2+) 作为辅因子,这是MEP途径的第二个限速反应。接下来,MEP与CMP在ispD酶催化下偶联生成4-(胞嘧啶-5’-磷酸)-2-C-甲基-D-赤藻糖醇 (CDP-ME),C2的羟基被磷酸化,脱去CMP并生成2-C-甲基-D-赤藻糖醇2,4-环焦磷酸 (MECDP),再还原成1-羟基-2甲基-2-(E)-丁烯基-4-焦磷酸,最后经一步反应生成IPP和DMAPP。MEP转化为IPP和DMAPP经过了5步反应,依次由ispD、ispE、ispF、ispG和ispH酶催化完成。目前对大肠杆菌MEP途径的研究发现,该途径存在严格的内源调控机制,可以发生在转录中、转录后、翻译后、前体物质的生成与消耗、变构调节、代谢反馈和前馈等不同水平上,然而其调控机理尚不清楚。
1.2 MVA代谢途径及关键酶在MVA途径中,起始反应物乙酰辅酶A在乙酰辅酶A硫解酶 (AACT) 和HMG-CoA合成酶 (HMGS) 的催化下缩合生成β-羟基-β甲基戊二酰辅酶A (HMG-CoA)。接着,HMG-CoA在HMG-CoA还原酶 (HMGR) 的作用下生成甲羟戊酸 (MVA)[13],至此为MVA上游途径 (MVA upper pathway)。MVA经焦磷酸化和脱羧作用形成IPP,经异构化转化为DMAPP,至此为MVA下游代谢途径 (MVA lower pathway),共4步反应,需要甲羟戊酸激酶 (MK)、磷酸甲羟戊酸激酶 (PMK)、二磷酸甲羟戊酸脱羧酶 (MVD) 和异戊烯基焦磷酸异构酶 (IDI) 的催化完成。
1.3 异戊二烯合成酶异戊二烯合成酶 (EC 4.2.3.27) 能催化DMAPP转化为异戊二烯。1957年,Sanadze第一次发现植物释放异戊二烯[14],然而关于异戊二烯合成酶的研究相对较晚。2001年,Miller等首次从杨树 (Populus alba×Populus tremula) 中分离到异戊二烯合成酶 (ispS) 并在大肠杆菌中表达[15]。2005年Sasaki等从P. alba分离到异戊二烯合成酶 (PaIspS) 并进行了酶学特征研究,结果表明其特异性底物为DMAPP[16]。接着,Sharkey等从葛根kudzu vine (Pueraria montana) 中分离了异戊二烯合成酶基因[17]。最近,Ilmén等从甘薯Ipomoea batatas、芒果Mangifera indica和杜英Elaeocarpus photiniifolius中分离到3种新的异戊二烯合成酶基因,它们与无梗花栎Quercus petraea ispS的序列相似度分别为55%、65%和60%[18]。分别将这3种新的ispS以及杨树 (P. alba) 和葛根 (P. montana) 的ispS在大肠杆菌中过表达,通过测定异戊二烯的产量对不同来源ispS的催化效率进行评价,结果表明甘薯ispS催化活性最高。
2 微生物法合成异戊二烯的代谢改造策略大肠杆菌具有合成异戊二烯前体物质DMAPP的MEP代谢途径,但是自身缺少异戊二烯合成酶,不能在生长过程中产生异戊二烯。因此,需要利用代谢工程手段对微生物的代谢途径进行改造,以提高异戊二烯的生物转化效率。大肠杆菌不仅是第一个被改造生产异戊二烯的微生物,而且是当下异戊二烯产量最高的工程菌株[19]。其他微生物 (包括酿酒酵母、泛菌、解脂耶氏酵母、里氏木霉以及链霉菌等) 也都进行了异戊二烯生物合成途径的代谢工程研究[20-22],但其异戊二烯产量都低于工程大肠杆菌。因此,本文着重介绍和总结了大肠杆菌异戊二烯合成途径的代谢改造策略。
2.1 大肠杆菌异源表达异戊二烯合成酶自然界中有些微生物可以合成异戊二烯[23-24],其中枯草芽孢杆菌为异戊二烯产量最高的天然菌[25-26],但是目前还没有从微生物中分离到异戊二烯合成酶基因,人们获得的ispS全部来源于植物。因此,对大肠杆菌异戊二烯合成途径的第一个改造策略就是将植物来源的ispS在大肠杆菌中过表达。Miller等首次将杨树ispS在大肠杆菌中过表达,异戊二烯产量提高了1.85倍[15]。由于天然的植物异戊二烯合成酶cDNA序列密码子偏好性与大肠杆菌有差异,为了使其在大肠杆菌中高效表达,苏思正等按照大肠杆菌偏好密码子进行优化后利用化学方法合成,并且去掉编码信号肽部分的氨基酸的核苷酸序列,该重组异戊二烯合成酶能够催化异戊二烯的合成,重组菌的异戊二烯产量可达到60 μg/L[27]。但仅仅过表达异源异戊二烯合成酶的大肠杆菌异戊二烯产量还是很低。为了进一步提高异戊二烯的产量,需要用其他代谢工程手段对大肠杆菌进行改造。
2.2 大肠杆菌MEP代谢途径改造策略在大肠杆菌MEP途径中,催化前两步反应的DXS和DXR是关键限速酶,DXS和DXR的高效表达可以提高类异戊二烯的产量[28-31]。Zhao等将来自大肠杆菌自身的DXS、DXR和来自黑杨Populus nigra的ispS在大肠杆菌中过表达,异戊二烯产量达到160 mg/L[32]。而异源表达枯草芽孢杆菌MEP途径中的关键酶DXS和DXR使异戊二烯产量进一步提高到314 mg/L,提高了两倍。另一方面,代谢中IPP和DMAPP在异戊二烯焦磷酸异构酶的作用下相互转化,而DMAPP在ispS的催化作用下生成异戊二烯。因此,过表达异戊二烯焦磷酸异构酶可以提高异戊二烯的产量[22-33]。杰能科 (Genencor) 的研究发现,过表达DXS、IDI和葛根ispS的工程大肠杆菌异戊二烯产量达到300 mg/L,相比于只过表达了ispS基因的大肠杆菌,异戊二烯产量提高了5-12倍[22]。本课题组刘敏和杨建明等将来自大肠杆菌的异戊二烯焦磷酸异构酶基因 (IDI) 和来自枯草芽孢杆菌的异戊二烯焦磷酸异构酶基因 (FNI) 构建到原核表达载体上,并在大肠杆菌中异源过量表达[34]。研究发现,来自枯草芽孢杆菌FNI具有更高的催化活性,异戊二烯的产量由0.80 mg/L提高到2.96 mg/L。由以上研究结果可以推测,大肠杆菌中表达异源基因有利于提高酶的催化活性,其原因可能是提高了酶自身的催化活性,也可能是避免了MEP途径的内源调控机制。
2.3 大肠杆菌MVA代谢途径改造策略从理论计算结果来看,以葡萄糖为底物时MEP途径的异戊二烯产率 (30.2%) 要高于MVA途径 (25.2%)[19],但是由于MEP途径研究较晚,代谢中相关酶的功能及其调控机制研究不透彻使得整个途径催化效率不高[35]。尽管上述研究取得了一些进展,但是由于内源MEP代谢途径的调控机制限制了异戊二烯的最终产量。为了避免大肠杆菌自身MEP途径的内源调控机制限制,研究者开辟了新的途径,在大肠杆菌中异源表达部分或完整的MVA途径,提高细胞内萜烯前体物质 (DMAPP) 的浓度,进而提高类异戊二烯的产量。2003年,Martin等首次在大肠杆菌中过表达了酿酒酵母的MVA途径和紫穗槐-4,11-二烯合酶提高了萜类物质青蒿酸的产量[36]。Pitera等在研究中发现,虽然在大肠杆菌中异源表达MVA途径可以提高萜类物质的产量,但是细胞内中间代谢产物HMG-CoA的大量积累会抑制细胞的生长,通过调节HMGR的表达量可以解决代谢途径中的瓶颈限制,提高上游途径的MVA产量[37]。Anthony等发现MK是大肠杆菌MVA途径中的限速酶,使用强启动子和高拷贝的质粒提高MK的表达量,萜类物质青蒿酸的产量提高了7倍[38]。随后,定量蛋白质组学分析也表明MVA下游途径中的MK和PMK是代谢瓶颈[39]。Ma等对含有整个酿酒酵母MVA途径的工程大肠杆菌进行了优化,通过选择合适酶活性质的HMGR和提高细胞内还原当量,萜类物质青蒿酸的产量提高了120%[40]。另一方面,细胞内异戊二烯前体物质IPP和DMAPP的过量积累会对细胞产生毒性作用。这主要是由于下游的异戊二烯合成酶催化活性不高所造成的,为了减少或避免中间代谢产物浓度过高的毒性作用,必须提高异戊二烯合成酶的催化效率。有文献指出,利用蛋白工程手段可以提高异戊二烯合成酶的催化活性,但目前尚无详细的研究报道[4]。由以上研究报道可以看出,尽管在大肠杆菌中构建MVA代谢途径比其自身MEP途径更有效地合成了类异戊二烯化合物,但整个代谢途径涉及多个编码基因的表达,使用了多个重组质粒的表达系统来实现完整的代谢通路构建,这就涉及到不同表达模块在细胞内的调控。冯凡等基于蛋白质预算理论的指导,通过优化质粒拷贝数和稀有密码子来调控系统内关键限速酶编码基因的表达量,在摇瓶发酵水平上使异戊二烯产量比对照菌株提高了73%,达到了761.1 mg/L[41]。此外,异源基因来源不同表达效率也不同。Yoon等评价了不同微生物来源 (包括肺炎链球菌、粪肠球菌、金黄色葡萄球菌、酿脓链球菌及酿酒酵母) 的MVA上下游途径基因在大肠杆菌中表达后的生物转化效率,其中粪肠球菌的上游MVA途径和肺炎链球菌的MVA下游途径转化效率相对较高[42]。本课题组杨建明等在大肠杆菌中构建了完整的酿酒酵母MVA途径,同时过表达了白杨ispS,在发酵罐水平48 h发酵后异戊二烯产量达到532 mg/L[43]。虽然比利用MEP途径的产量有所提高,但是离工业化还相差甚远。造成目标产量低的原因可能是MVA途径中存在限速步骤。因此,杨建明等将酿酒酵母MVA下游基因和ispS基因在大肠杆菌中过表达,考察了添加外源MVA对该菌株异戊二烯产量的影响。结果发现,异戊二烯产量随着加入MVA浓度的增加而增加,说明MVA下游途径具有很高的转化效率。然而异源表达酿酒酵母MVA上游途径仅产生了低浓度的MVA。以上研究表明,MVA上游途径是整个MVA途径的限速步骤。为了优化MVA代谢途径,将来自粪肠球菌和酿酒酵母的MVA上游途径的转化效率进行了对比,发现来自粪肠球菌的MVA上游途径转化效率较高,其产生的MVA浓度比酿酒酵母MVA上游途径提高了50倍[44],这与Yoon等的研究结果相一致。此外,本课题组还发现表达宿主的选择对异戊二烯的产量也有影响,同等条件下,BL21 starTM (DE3) 的异戊二烯产量最高,其次是BL21 (DE3),JM109 (DE3) 产量最低。因此,在大肠杆菌BL21 starTM (DE3) 中过表达粪肠球菌MVA上游途径、酿酒酵母的MVA下游途径以及白杨ispS,经摇瓶发酵培养24 h后异戊二烯产量进一步提高到1 091 mg/L。在发酵罐水平经48 h的诱导培养,异戊二烯累积浓度达到6.3 g/L,从葡萄糖到异戊二烯的转化效率为7%,达到理论转化率的28%。
杰能科公司和美国固特异轮胎与橡胶公司 (Goodyear Tire & Rubber Company) 在异戊二烯的生物合成中做了大量工作[4]。他们在大肠杆菌中过表达了来自粪肠球菌的mvaS和mvaE基因 (MVA上游途径基因) 和来自酿酒酵母的MK、PMK、MVD和IDI基因 (MVA下游途径基因),以及来自葛根的异戊二烯合成酶基因,该工程菌株的异戊二烯产量比MEP途径工程菌株提高了3倍,40 h的发酵培养可以产生20 g/L的异戊二烯[45]。在此基础上,他们过表达了对下游产物法尼烯基焦磷酸 (FPP) 反馈抑制作用不敏感的马氏甲烷八叠球菌甲羟戊酸激酶MK和杨树的ispS。在批次发酵中,该工程菌株的异戊二烯产量达到35 g/L,葡萄糖转化为异戊二烯的产率为5.2%,该菌株比只表达了ispS基因的工程大肠杆菌异戊二烯产量提高了73倍,而相比于含有MEP途径的工程菌株,异戊二烯产量提高了10-20倍。虽然研究表明粪肠球菌MVA上游途径转化效率最高,但是将其基因整合到大肠杆菌染色体上之后MVA途径的转化效率受到了下游途径的限制。
2.4 中心碳代谢流改造策略MVA途径反应的起始物是乙酰辅酶A,经两步反应使3分子的乙酰辅酶A缩合成HMG-CoA。而在微生物代谢过程中还存在其他消耗乙酰辅酶A的代谢支路,减少这些途径对乙酰辅酶A的消耗,保证细胞内足够的乙酰辅酶A供给是提高MVA途径转化效率的重要因素之一。另一方面,减少其他途径的碳源消耗,为MVA途径提供更多的还原力,也是提高MVA途径转化效率的重要途径。研究发现,过表达磷酸葡萄糖酸内酯酶 (pgl) 可以提高戊糖磷酸途径的效率,促进NADPH的生成,从而提供给粪肠球菌HMGR更多的还原力。将pgl和密码子优化的ispS、完整的MVA途径以及马氏甲烷八叠球菌甲羟戊酸激酶MK在大肠杆菌中过表达,经过发酵条件优化后,该工程菌株异戊二烯产量达到了79 g/L,转化率为10.2 %[5]。在此基础上,将柠檬酸合成酶基因gltA表达下调,敲除磷酸葡萄糖酸内酯酶pgl并过表达磷酸转酮酶pkl基因,从而提高中心碳源代谢流中木酮糖-5-磷酸转化为甘油醛-3-磷酸的效率,为MVA途径提供更多的前体物质,提高异戊二烯产量[19]。在这个策略中,pkl起到了关键作用,将鹑鸡肠球菌的pkl基因在含有MVA途径的大肠杆菌中过表达,同时过表达密码子优化后的白杨ispS,异戊二烯产量达到123.6 g/L,转化率达到16.3%,是目前报道的异戊二烯最高产量。表 1对目前大肠杆菌生产异戊二烯的代谢改造策略及其产量和转化率进行了总结。
| No. | Strains | Isoprene production | Pathways | References | |
| Titer (g/L) | Yield (%) | ||||
| 1 | BL21(DE3)/pACY-ispSpn | 0.096 | - | MEP | [32] |
| 2 | BL21(DE3)/pACY-DXSE. coli-DXRE. coli-ispS | 0.16 | - | MEP | [32] |
| 3 | BL21(DE3)/pACY-DXSB. subtilis-DXRB. subtilis-ispS | 0.31 | - | MEP | [32] |
| 4 | BL21(DE3)/pET-DXS-IspS/pESF-IDI(ispA-weakened) | 0.02 | - | MEP | [46] |
| 5 | BL21(DE3)/pCOLAUpperS. cerevisiae/pTrcLowerS. cerevisiae /pACY-ispSpa | 0.53 | - | MVA | [43] |
| 6 | BL21(DE3)/pACY-mvaEE. faecalis-mvaSE. faecalis(MT)-ispSpa /pTrcLower | 6.3 | 7 | MVA | [44] |
| 7 | BL21(DE3)/pCLpTrcUpper/pTrcKKDyIKIs | 3.0 | 1.0 | MVA | [47] |
| 8 | BL21(DE3)/pCLpTrcUpperHGS2/pTrcKKDyIKIs | 3.3 | 1.2 | MVA | [47] |
| 9 | BL21(DE3)::GI1.2-Lower/pCLpTrcUpper/pTrcKudzu | 1.6 | 0.4 | MVA | [47] |
| 10 | BL21(DE3) Tuner/pCLpTrcUpper/pTrcKKDyIKIs | 1.3 | 0.6 | MVA | [47] |
| 11 | MG1655/pCLpTrcUpper/pTrcKKDyIKIs | 0.39 | - | MVA | [47] |
| 12 | FM5/pCLpTrcUpper/pTrcKKDyIKIs | 0.24 | - | MVA | [47] |
| 13 | ATCC11301/pCLpTrcUpper/pTrcKKDyIKIs | 1.4 | 0.5 | MVA | [47] |
| 14 | BL21(DE3)::GI1.2-Lower/pCLpTrcUpper/pTrcKudzu-mMVK | 23.8 | 6.3 | MVA | [48] |
| 15 | BL21(DE3)::GI1.2-Lower/pCLpTrcUpper/pTrcAba-MVKM. mazei/pBBR-pgl | 60.5 | 10.7 | MVA | [45] |
| 16 | BL21(DE3)::PL.2mKKDyI/pCLUpper/pTrcAlba(truncated)-MVKM. mazei | 76 | 11 | MVA | [5] |
| 17 | BL21(DE3)::PL.2mKKDyI/pCLUpper/pTrcAlba(truncated)-MVKM. mazei+restroed chromosomal 17257bp containing pgl | 68 | 14.5 | MVA | [5] |
| 18 | BL21(DE3)::PL.2mKKDyI/pCLUpper/pTrcAlba(truncated)-MVKM. mazei+restroed chromosomal 17257bp without pgl | 79 | 10.2 | MVA | [5] |
| 19 | BL21(DE3)Δpgl::PL.2mKKDyI,GI1.2-Lower,yhfSFRTPyddVIsp,AyhfS,thiFRTtruncIspA,bMVK | 123.6 | 16.3 | MVA | [19] |
以IPP和DMAPP为起始物,在MEP和MVA途径中还存在着下游异戊烯基磷酸盐代谢途径 (图 2)[49]。根据微生物体内异戊烯转移酶的不同而产生不同的异戊烯基磷酸盐。相比于异戊烯转移酶,异戊二烯合成酶IspS的Km(DMAPP) 较高,微生物代谢产生的大量IPP和DMAPP将更倾向于作为下游异戊烯基磷酸盐合成的前体物质,从而对异戊二烯的合成途径产生反馈抑制作用。为了降低异戊烯基磷酸盐的积累,将单萜和半萜合成酶与ispS在含有MVA途径的工程大肠杆菌内共表达可以提高异戊二烯的产量,该策略已经应用于目前异戊二烯产量最高的工程菌株中[19]。
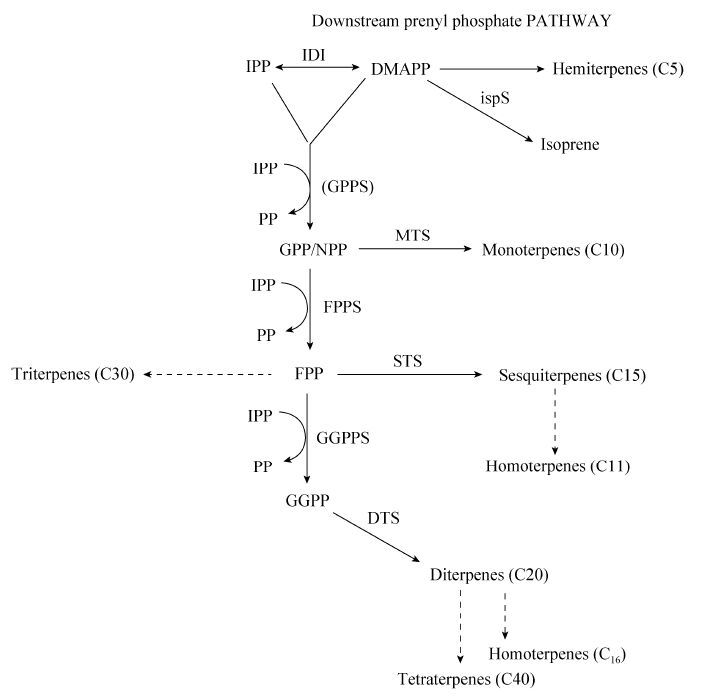
|
| 图 2 下游异戊烯基磷酸盐代谢途径 Figure 2 Downstream prenyl phosphate metabolism. |
| |
纵观国内外的研究现状,尽管微生物法生产异戊二烯的研究取得了一定的进展,但微生物生产异戊二烯的代谢工程技术中仍有许多工作有待进一步研究。异戊二烯的生物合成代谢途径和调控机制复杂,大肠杆菌自身MEP途径的内源调控机制限制了异戊二烯的产量。虽然目前已经将完整的外源MVA代谢途径在大肠杆菌中实现了异源表达,但由于所需的编码酶基因较多,只通过一个载体的表达系统很难将
整个代谢通路完全构建成功,需要使用多个重组质粒完成整个MVA代谢途径的构建,这其中就涉及到多个表达模块在细胞内的调控。过表达代谢系统中某一个或几个酶不仅无法使目标产物的产量明显提高,还很可能造成细胞毒性作用。只有使整个系统内蛋白质的表达处于相对平衡状态,异戊二烯的产量才会得到提高。另一方面,虽然本文并未涉及发酵控制方面的研究,但是就整个生物转化过程而言,发酵控制点的研究和菌株的代谢改造同样对转化效率有很大的影响。应根据微生物的代谢特性,对发酵过程进行代谢调控,合理地设计发酵工艺,增加异戊二烯代谢途径的代谢流分配,使底物最大程度地转化为异戊二烯,减少代谢过程中碳源以其他途径的损耗 (如降低CO2的排放等)。
| [1] |
Wang QF, Yu Y, Zhang HB, et al. Analysis of prospects for developing isoprene rubber in China.
Sino-Global Energy, 2011, 16
(8)
: 68–71
(in Chinese).
王启飞, 于洋, 张红兵, 等. 我国发展异戊二烯橡胶前景分析. 中外能源,2011,16 (8) :68–71. |
| [2] |
Yue P. Production technology and market analysis of isoprene.
Ref Chem Ind, 2006, 17
(2)
: 3–5
(in Chinese).
岳鹏. 异戊二烯的生产技术及市场分析. 炼油与化工,2006,17 (2) :3–5. |
| [3] |
Zhang HF, Sheng YN, Fu Y, et al. Preparation and application of isoprene.
Technol Dev Chem Ind, 2011, 40
(10)
: 35–41
(in Chinese).
张慧芳, 盛永宁, 付燕, 等. 异戊二烯的制备及其应用. 化工技术与开发,2011,40 (10) :35–41. |
| [4] | Whited GM, Feher FJ, Benko DA, et al. Development of a gas-phase bioprocess for isoprene-monomer production using metabolic pathway engineering. Ind Biotechnol, 2010, 6 (3) : 152–163 .DOI:10.1089/ind.2010.6.152 (in Chinese). |
| [5] | Beck ZQ, Cervin MA, Nielsen AT, et al. Compositions and methods of PGL for the increased production of isoprene: US, 8455236 B2. 2013-06-04. |
| [6] | Zurbriggen A, Kirst H, Melis A. Isoprene production via the mevalonic acid pathway in Escherichia coli (Bacteria). Bioenerg Res, 2012, 5 (4) : 814–828 .DOI:10.1007/s12155-012-9192-4 (in Chinese). |
| [7] | Kuzuyama T. Mevalonate and nonmevalonate pathways for the biosynthesis of isoprene units. Biosci Biotechnol Biochem, 2002, 66 (8) : 1619–1627 .DOI:10.1271/bbb.66.1619 (in Chinese). |
| [8] | Rodríguez-Concepción M, Boronat A. Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids. A metabolic milestone achieved through genomics. Plant Physiol, 2002, 130(3): 1079-1089. |
| [9] | Rohmer M. Mevalonate-independent methylerythritol phosphate pathway for isoprenoid biosynthesis. Elucidation and distribution. Pure Appl Chem, 2003, 75 (2/3) : 375–388 (in Chinese). |
| [10] | Eisenreich W, Bacher A, Arigoni D, et al. Biosynthesis of isoprenoids via the non-mevalonate pathway. Cell Mol Life Sci, 2004, 61 (12) : 1401–1426 (in Chinese). |
| [11] | Rohmer M, Knani M, Simonin P, et al. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate. Biochem J, 1993, 295 (Pt 2) : 517–524 (in Chinese). |
| [12] | Schwarz KM. Terpen-biosynthese in Ginkgo biloba: eine Uberraschende geschichte. Zurich, Switzerland: Eidgenossischen Technischen Hochschule, 1994. |
| [13] | Kalita R, Patar L, Shasany AK, et al. Molecular cloning, characterization and expression analysis of 3-hydroxy-3-methylglutaryl coenzyme A reductase gene from Centella asiatica L. Mol Biol Rep, 2015, 42 (9) : 1431–1439 .DOI:10.1007/s11033-015-3922-6 (in Chinese). |
| [14] | Sanadze JA. Emission of organic matters by leaves of Robinia pseudoacacia L. Soobshch Akad Nauk Gruz SSR, 1957 : 83–86 (in Chinese). |
| [15] | Miller B, Oschinski C, Zimmer W. First isolation of an isoprene synthase gene from poplar and successful expression of the gene in Escherichia coli. Planta, 2001, 213 (3) : 483–487 .DOI:10.1007/s004250100557 (in Chinese). |
| [16] | Sasaki K, Ohara K, Yazaki K. Gene expression and characterization of isoprene synthase from Populus alba. FEBS Lett, 2005, 579 (11) : 2514–2518 .DOI:10.1016/j.febslet.2005.03.066 (in Chinese). |
| [17] | Sharkey TD, Yeh S, Wiberley AE, et al. Evolution of the isoprene biosynthetic pathway in kudzu. Plant Physiol, 2005, 137 (2) : 700–712 .DOI:10.1104/pp.104.054445 (in Chinese). |
| [18] | Ilmén M, Oja M, Huuskonen A, et al. Identification of novel isoprene synthases through genome mining and expression in Escherichia coli. Metab Eng, 2015 : 153–162 .DOI:10.1016/j.ymben.2015.08.001 (in Chinese). |
| [19] | Beck ZQ, Eliot AC, Peres CM, et al. Utilization of phosphoketolase in the production of mevalonate, isoprenoid precursors, and isoprene: US, 20130089906. 2013-04-11. |
| [20] | Hong SY, Zurbriggen AS, Melis A. Isoprene hydrocarbons production upon heterologous transformation of Saccharomyces cerevisiae. J Appl Microbiol, 2012, 113 (1) : 52–65 .DOI:10.1111/jam.2012.113.issue-1 (in Chinese). |
| [21] | Hayashi Y, Harada M, Takaoka S, et al. Isoprene synthase and gene encoding the same, and method for producing isoprene monomer: US, 20140113344. 2014-04-24. |
| [22] | Calabria AR, Cervin MA, Chotani GK, et al. Compositions and methods for producing isoprene free of C5 hydrocarbons under decoupling conditions and/or safe operating ranges: US, 20140155660. 2014-06-05. |
| [23] | Berenguer JA, Calderon V, Herce MD, et al. Spoilage of a bakery product by isoprene-producing molds. Rev Agroquim Technol Aliment, 1991 : 580–583 (in Chinese). |
| [24] | Kuzma J, Nemecek-Marshall M, Pollock WH, et al. Bacteria produce the volatile hydrocarbon isoprene. Curr Microbiol, 1995, 30 (2) : 97–103 .DOI:10.1007/BF00294190 (in Chinese). |
| [25] | Julsing MK, Rijpkema M, Woerdenbag HJ, et al. Functional analysis of genes involved in the biosynthesis of isoprene in Bacillus subtilis. Appl Microbiol Biotechnol, 2007, 75 (6) : 1377–1384 .DOI:10.1007/s00253-007-0953-5 (in Chinese). |
| [26] | Sivy TL, Shirk MC, Fall R. Isoprene synthase activity parallels fluctuations of isoprene release during growth of Bacillus subtilis. Biochem Biophys Res Commun, 2002, 294 (1) : 71–75 .DOI:10.1016/S0006-291X(02)00435-7 (in Chinese). |
| [27] |
Su SZ, Liu JZ, Yang JM, et al. Expression of isoprene synthase in Escherichia coli for isoprene production.
Chin J Bioprocess Eng, 2011, 9
(3)
: 6–10
(in Chinese).
苏思正, 刘建忠, 杨建明, 等. 异戊二烯合成酶(IspS) 在大肠杆菌中的表达及其产异戊二烯的研究. 生物加工过程,2011,9 (3) :6–10. |
| [28] | Albrecht M, Misawa N, Sandmann G. Metabolic engineering of the terpenoid biosynthetic pathway of Escherichia coli for production of the carotenoids β-carotene and zeaxanthin. Biotechnol Lett, 1999, 21 (9) : 791–795 .DOI:10.1023/A:1005547827380 (in Chinese). |
| [29] | Harker M, Bramley PM. Expression of prokaryotic 1-deoxy-D-xylulose-5-phosphatases in Escherichia coli increases carotenoid and ubiquinone biosynthesis. FEBS Lett, 1999, 448 (1) : 115–119 .DOI:10.1016/S0014-5793(99)00360-9 (in Chinese). |
| [30] | Wang CW, Oh MK, Liao JC. Engineered isoprenoid pathway enhances astaxanthin production in Escherichia coli. Biotechnol Bioeng, 1999, 62 (2) : 235–241 .DOI:10.1002/(ISSN)1097-0290 (in Chinese). |
| [31] | Rodríguez-Villalón A, Pérez-Gil J. Rodríguez- Concepción M. Carotenoid accumulation in bacteria with enhanced supply of isoprenoid precursors by upregulation of exogenous or endogenous pathways. J Biotechnol, 2008, 135(1): 78-84. |
| [32] | Zhao YR, Yang JM, Qin B, et al. Biosynthesis of isoprene in Escherichia coli via methylerythritol phosphate (MEP) pathway. Appl Microbiol Biotechnol, 2011, 90 (6) : 1915–1922 .DOI:10.1007/s00253-011-3199-1 (in Chinese). |
| [33] | Bott RR, Cervin MA, Kellis Jr. JT, et al. Isoprene synthase variants for improved microbial production of isoprene: US, 8173410. 2012-05-08. |
| [34] |
Liu M, Liu JZ, Feng HR, et al. Expression of isopentenyl diphosphate isomerase and confirmation of its catalytic effect.
J Wuhan Univ Sci Technol, 2013, 36
(3)
: 214–218
(in Chinese).
刘敏, 刘建忠, 冯红茹, 等. 异戊二烯焦磷酸异构酶的表达及其催化功能验证. 武汉科技大学学报,2013,36 (3) :214–218. |
| [35] | Steinbüchel A. Production of rubber-like polymers by microorganisms. Curr Opin Microbiol, 2003, 6 (3) : 261–270 .DOI:10.1016/S1369-5274(03)00061-4 (in Chinese). |
| [36] | Martin VJJ, Pitera DJ, Withers ST, et al. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat Biotechnol, 2003, 21 (7) : 796–802 .DOI:10.1038/nbt833 (in Chinese). |
| [37] | Pitera DJ, Paddon CJ, Newman JD, et al. Balancing a heterologous mevalonate pathway for improved isoprenoid production in Escherichia coli. Metab Eng, 2007, 9 (2) : 193–207 .DOI:10.1016/j.ymben.2006.11.002 (in Chinese). |
| [38] | Anthony JR, Anthony LC, Nowroozi F, et al. Optimization of the mevalonate-based isoprenoid biosynthetic pathway in Escherichia coli for production of the anti-malarial drug precursor amorpha-4, 11-diene. Metab Eng, 2009, 11 (1) : 13–19 .DOI:10.1016/j.ymben.2008.07.007 (in Chinese). |
| [39] | Redding-Johanson AM, Batth TS, Chan R, et al. Targeted proteomics for metabolic pathway optimization: application to terpene production. Metab Eng, 2011, 13 (2) : 194–203 .DOI:10.1016/j.ymben.2010.12.005 (in Chinese). |
| [40] | Ma SM, Garcia DE, Redding-Johanson AM, et al. Optimization of a heterologous mevalonate pathway through the use of variant HMG-CoA reductases. Metab Eng, 2011, 13 (5) : 588–597 .DOI:10.1016/j.ymben.2011.07.001 (in Chinese). |
| [41] |
Feng F, Xu Y, Tao Y, et al. Improving isoprene production by engineered heterologous mevalonate pathway in Escherichia coli.
Chin J Biotech, 2015, 31
(7)
: 1073–1081
(in Chinese).
冯凡, 许杨, 陶勇, 等. 提高大肠杆菌通过MVA途径合成异戊二烯. 生物工程学报,2015,31 (7) :1073–1081. |
| [42] | Yoon SH, Lee SH, Das A, et al. Combinatorial expression of bacterial whole mevalonate pathway for the production of β-carotene in E. coli. J Biotechnol, 2009, 140 (3/4) : 218–226 (in Chinese). |
| [43] | Yang JM, Zhao G, Sun YZ, et al. Bio-isoprene production using exogenous MVA pathway and isoprene synthase in Escherichia coli. Bioresour Technol, 2012 : 642–647 .DOI:10.1016/j.biortech.2011.10.042 (in Chinese). |
| [44] | Yang JM, Xian M, Su SZ, et al. Enhancing production of bio-isoprene using hybrid MVA pathway and isoprene synthase in E. coli. PLoS ONE, 2012, 7 (4) : e33509.DOI:10.1371/journal.pone.0033509 (in Chinese). |
| [45] | Cervin MA, Whited GM, Chotani GK, et al. Compositions and methods for producing isoprene: US, 20090203102 A1. 2009-08-13. |
| [46] | Liu CL, Fan LH, Liu L, et al. Combinational biosynthesis of isoprene by engineering the MEP pathway in Escherichia coli. Process Biochem, 2014, 49 (12) : 2078–2085 .DOI:10.1016/j.procbio.2014.06.025 (in Chinese). |
| [47] | Chotani GK, Nielsen A, Sanford KJ. Reduction of carbon dioxide emission during isoprene production by fermentation: US, 20100167370 A1. 2010-07-01. |
| [48] | Beck ZQ, Calabria AR, Miller MC, et al. Increased isoprene production using mevalonate kinase and isoprene synthase: US, 20100184178 A1. 2010-07-22. |
| [49] | Vickers CE, Sabri S. Isoprene. Adv Biochem Eng Biotechnol, 2015 : 289–317 (in Chinese). |
 2016, Vol. 32
2016, Vol. 32




