中国科学院微生物研究所、中国微生物学会主办
文章信息
- 尹进, 车雪梅, 陈国强
- Yin Jin, Che Xuemei, Chen Guoqiang
- 聚羟基脂肪酸酯的研究进展
- Progress on polyhydroxyalkanoates (PHA)
- 生物工程学报, 2016, 32(6): 726-737
- Chin J Biotech, 2016, 32(6): 726-737
- 10.13345/j.cjb.160061
-
文章历史
- Received: February 1, 2016
- Accepted: March 3, 2016
聚羟基脂肪酸酯 (PHA) 是一类完全由微生物合成高分子聚酯的统称[1]。PHA具有生物可降解性和生物相容性,因而被认为是环境友好型材料,有助于解决日益严重的环境污染问题。PHA从合成、提取、加工到最终产品的生产环节较多,并且涉及到发酵工程、材料提纯和加工工艺等多个领域。多年来关于PHA的微生物合成有诸多研究,而对于PHA的应用研究则相对较少。本文主要介绍聚羟基脂肪酸酯的多样性、聚羟基脂肪酸酯的低成本生产及其应用研究进展。
1 聚羟基脂肪酸酯的多样性PHA由于其单体是手性R型的羟基脂肪酸,单体可以有多种侧链、多种碳链长度,所以其聚合形成的PHA也就多种多样。1995年就已经报道存在91种脂肪酸可作为PHA的单 体[2]。绝大多数的PHA单体为3-羟基脂肪酸,但是羟基在其他位置的脂肪酸也同样可作为PHA单体。例如重组恶臭假单胞菌能够合成含有5-羟基己酸、4-羟基庚酸、4-羟基辛酸组成的PHA[3]。Li等报道了利用侧链含有不饱和双键的羟基脂肪酸作为单体合成PHA[4],进一步拓宽了PHA的单体多样性。而含有不饱和双键的PHA可以进行后续的化学修饰和加工,例如在PHA的线性骨架上嫁接其他具有特殊功能的聚合物,可带来新的高附加值应用。
不同单体之间的聚合反应的方式是影响PHA多样性的另一重要因素。只有一种单体的PHA被称为均聚物;两种或两种以上单体聚合形成的PHA被称为共聚物。天然微生物合成的共聚PHA一般为随机共聚物;且由于微生物代谢背景的影响,有些单体无法合成对应的均聚物,例如以长链脂肪酸作为底物时,由于微生物会通过脂肪酸代谢来减少脂肪酸的碳链长度,其合成的PHA是由不同碳链长度单体形成的随机共聚物。而随着分子生物学和遗传学的发展,微生物合成PHA的过程变得可控,从而能够利用重组微生物生产天然微生物所无法合成的新型PHA。在恶臭假单胞菌Pseudomonas entomophila中敲除脂肪酸代谢途径的相关酶的基因,可实现以某一碳链长度的长链脂肪酸作为底物,合成对应碳链长度的均聚PHA[5]。共聚PHA的合成过程也变得可控,从而出现了嵌段共聚物这一新型聚合物[6-7]。嵌段共聚物理论上大大增加了PHA的多样性,根据嵌段的组成和顺序可以有多种单体的均聚物之间的嵌段、均聚物和随机共聚物之间的嵌段、均聚物和嵌段共聚物之间的嵌段、随机共聚物和嵌段共聚物之间的嵌段等多种形式,将PHA的多样性拓宽到了近乎无限多种。
PHA的多样性还体现在分子量上,可从几万到上千万道尔顿。即便是在同一个微生物细胞当中,其合成的PHA的分子量也分布在某一范围内,因此现今的检测方法给出的是所有PHA分子的平均分子量。PHA合成过程的可控使得PHA的分子量也可以实现可控,例如对PHA合酶基因的N端进行突变增大PHA聚合能力[8],利用甲醇诱导终止PHA合成链[9],培养基添加聚乙二醇调控PHA分子量[10]等。若能通过分子生物学手段精确调控PHA合成过程中的关键酶的活性,将有可能实现对PHA分子量的更精细控制。
PHA多样性PHAome示意见图 1。

|
| 图1 PHA的多样性PHAome示意 Figure1 The diversity of PHA, “PHAome”. |
| |
由图 1可见,PHA的单体组成、聚合方式、排布方式、分子量等因素决定了PHA的多样性,多种单体及其分布、不同的嵌段长度、不同的分子量、均聚物、随机共聚物、嵌段共聚物、接枝高分子和功能高分子等带来了PHA的多样性。嵌段共聚物、含有特殊官能团的PHA、嫁接PHA等新型PHA又进一步拓宽了PHA的多样性和潜在的应用方向。对PHA这一大类高分子聚酯的研究类似于基因组、转录组、蛋白组、代谢组,有了PHA组 (PHAome) 的概念[11]。
2 聚羟基脂肪酸酯的低成本生产PHA的生产成本居高不下是限制其应用发展和大规模商业化的主要因素。为此,生物学家们多年来一直致力于从多角度逐步降低PHA的生产成本,包括底物成本、底物到产物的转化率、发酵生产过程的能耗等等。
2.1 低成本底物PHA合成途径的构建合成某一种PHA需要以相应结构的化合物作为底物,例如合成中长链PHA需要以中长链脂肪酸作为底物,合成含有4-羟基丁酸 (4HB) 单体的PHA时需要以丁酸、1,4-丁二醇、γ-丁内酯等作为底物。而这些底物成本过高,大大增加了PHA的生产成本。
使用糖类化合物等廉价底物直接合成各种PHA,是降低生产成本的一种思路。天然微生物以糖类为底物时,合成的PHA主要为聚3-羟基丁酸酯 (PHB),这也是在自然界被发现的第一种PHA[12]。也有一些微生物以糖类为底物合成3-羟基丁酸和3-羟基戊酸的共聚物 (PHBV)[13]。目前尚无天然微生物以糖为单一碳源合成其他种类PHA的报道。
合成生物学和代谢工程技术,可以在微生物当中构建全新的代谢途径来实现非天然化合物的合成。以葡萄糖为单一碳源合成PHA为例,Wang等构建了2种葡萄糖合成3-羟基丁酸和3-羟基己酸共聚物 (PHBHHx) 的代谢途径;Wang等构建了2种不同的葡萄糖合成PHBV的代谢途径,这2种代谢途径之间组合可以得到不同单体组成比例的PHBV[14];加上已经报道的葡萄糖合成P3HB4HB (3-羟基丁酸和4-羟基丁酸共聚物)[15]和P4HB (聚4-羟基丁酸酯)[16]的代谢途径,以及天然微生物可从葡萄糖合成PHB,所有商业化的4代PHA从理论上可实现以葡萄糖为底物生产。除了商业化PHA,其他种类的PHA也实现了从葡萄糖合成的代谢途径的构建:Meng等在重组大肠杆菌中构建了葡萄糖合成聚3-羟基丙酸 (P3HP) 和3-羟基丁酸和3-羟基丙酸共聚物 (P3HB3HP) 的代谢途径[17];Zhuang等通过在重组大肠杆菌中构建反脂肪酸氧化途径来合成含有中链单体的PHA[18];聚乳酸的单体乳酸也可以通过新的代谢途径引入到PHA的合成过程当中,形成含有乳酸单体的新型PHA[19]。截至目前,几乎所有的常见PHA都实现了可从葡萄糖为唯一碳源来合成[20]。
2.2 PHA产量的提高和产品优化的新策略对微生物进行代谢工程改造,引入新的代谢途径能够实现低成本底物合成目标PHA,而想要提高PHA的产量,还需要通过调控代谢途径中基因的表达量和调控整个细胞的代谢网络来实现优化。
PHA的合成,可以通过调节代谢途径中基因启动子的转录强度或核糖体结合位点RBS的翻译强度,来实现PHA合成代谢流的强弱调控。然而PHA的合成途径并非独立于微生物自身的代谢网络,盲目地过表达PHA合成途径,并不一定会提高PHA的生产,有可能会影响细胞中的其他代谢途径,从而反过来抑制细胞生长和PHA积累。系统生物学可以从细胞的全体代谢网络出发,系统地分析各个代谢途径对于目标产物的影响,通过对其他代谢途径的调控来优化PHA的合成。例如,恶臭假单胞菌比起葡萄糖更倾向于利用脂肪酸作为底物,而敲除了葡萄糖脱氢酶基因gcd之后,重组菌中葡萄糖代谢及PHA合成相关基因的表达量都得到了上调,而其他代谢途径的基因表达几乎没有受到影响,重组菌合成PHA的能力也提高了100%[21]。在敲除了gcd基因的重组菌中过表达编码丙酮酸脱氢酶亚基的acoA基因,可进一步提高PHA合成,比野生型恶臭假单胞菌提高了121%[22]。
合成生物学技术也可以调控PHA合成途径。例如CRISPR技术可以实现基因的敲除、替换等编辑目的,而其衍生技术CRISPRi则能够抑制目标基因的表达量从而实现代谢途径的调控。该技术也可以应用到PHA的合成。Lü等在含有葡萄糖合成P3HB4HB代谢通路的重组大肠杆菌中,利用CRISPRi技术抑制了编码琥珀酸半醛脱氢酶的sad基因,从而调控4HB合成方向的代谢流。通过设计不同的sgRNA,抑制sad基因的效果不同,流向4HB合成的代谢流强度就不同,最终可以合成从1%到9%含有不同摩尔比例4HB的P3HB4HB。在此基础上再抑制琥珀酰辅酶A合成酶基因和琥珀酸脱氢酶基因 (sucC、sucD、sdhA和sdhB) 可进一步增强4HB合成的代谢流,将P3HB4HB中4HB的组成比例的调控范围扩大到了1.4%到18.4%[23]。按照传统的分子生物学手段,对这些基因逐个进行基因敲除费时费力,而且有些是必需基因,无法进行基因敲除。而CRISPRi技术则能够实现包括必需基因在内的多个目标基因的同时抑制,且通过设计不同的sgRNA实现对目标基因不同程度的抑制,能够做到对代谢途径的精细可控调控。
除了代谢途径的调控,对微生物细胞的形态改造,也可以提高PHA合成[24]。通过表达或抑制参与细胞分裂过程的蛋白的表达量,可以使细胞变得更长或更大,胞内就会有更多的空间用于PHA积累。例如,过表达细胞分裂抑制因子SulA蛋白的基因可以阻遏细胞的正常分裂,使得细胞变成狭长的线形,增大的胞内空间使PHA积累量提高了27%[25]。在大肠杆菌中敲除细胞骨架蛋白MreB的基因,并在低拷贝质粒上弱表达回复MreB,可以减弱细胞壁的强度,当胞内有PHA积累时则撑大了细胞体积,而增大的胞内空间又增加了PHA的积累量。在摇瓶实验中重组大肠杆菌的PHA积累量从野生型的5.72 g/L提高到了9.29 g/L[26]。
提高PHA产量,是降低PHA生产成本的一种思路;而从发酵过程中制约生产成本的因素入手来改造菌株,则是另一种思路。微生物合成PHA是一个好氧过程,因此发酵中通常需要鼓入空气,而使用空压机鼓入空气则带来能耗和相应成本;而且到了发酵后期随着细胞密度的上升,鼓入的空气也难以满足所有细胞的氧气需求,整个发酵体系会一直处于低氧状态。Wu等基于减少发酵过程中鼓气能耗的思路,在大肠杆菌中用8个串联重复的微氧启动子来表达PHB合成基因,提高了重组大肠杆菌在微氧条件下合成PHB的能力,积累量达到90%,有可能在发酵后期低氧条件下也能实现高效的PHA生产[27]。
2.3 低成本生产PHA的底盘菌降低PHA的生产成本,可以从发酵过程中制约成本的因素来入手,上文所述的提高低氧条件下的PHA合成便是其中之一,然而生物发酵过程还需解决的问题有很多,包括:底物成本、耗水问题、灭菌带来的能耗、批次发酵造成的低效率生产、不锈钢设备的固定资产成本以及人力成本[28]。通过菌种改造逐一解决这些问题,将是一个庞大而复杂的工程。
寻找一种新的PHA生产菌株作为底盘菌,若其可以解决上述问题中的几项,再经过菌种改造解决剩余的其他问题,就有可能实现PHA生产成本的大幅度降低。上述问题很多是由发酵的灭菌过程引起的:例如灭菌需要高温高压蒸汽,制备蒸汽就消耗能量;同时对设备提出了耐受高温高压的要求 (不锈钢);为了防止染菌,发酵过程就分为多个批次;灭菌相关的操作复杂、耗时耗力,最终会算进人力成本当中。因此新的底盘菌应当是无需灭菌也不会被其他杂菌污染的PHA生产菌。而极端微生物由于其生长条件的特殊性,抑制其他杂菌的生长,恰好能够满足无灭菌发酵的要求。
嗜盐微生物作为极端微生物的一种,已被用来研究PHA的无灭菌发酵。这种微生物生长所需条件为高浓度的盐 (NaCl),很多嗜盐微生物还同时喜欢碱性条件,在这种双重压力下普通的细菌无法生长,因此用嗜盐微生物进行发酵生产,可进行无灭菌的连续发酵,且降低了灭菌过程带来的相关成本 (能耗、设备、人力成本等)[29]。除此以外,嗜盐微生物需要含盐培养基意味着能够用海水来替代发酵培养基中的淡水,因而不会与日益严重的水资源问题产生冲突。这种基于海水的发酵生产技术被称为蓝水生物技术。
嗜盐微生物中能够合成PHA的代表性菌株包括盐单胞菌属的玻利维亚盐单胞菌Halomonas boliviensis、盐单胞菌Halomonas TD01、盐单胞菌Halomonas campaniensis LS21、嗜盐古菌地中海富盐菌Haloferax mediterranei等。这些菌株均可以在无灭菌发酵条件下进行PHA生产,且不会发生杂菌污染。例如,盐单胞菌TD01在无灭菌条件下连续发酵14 d,PHB含量在70%以上[30];而盐单胞菌LS21更是连续发酵了65 d没有发生杂菌污染,细胞干重达到70 g/L,PHB含量达到74%[31]。经粗略估算,蓝水生物技术生产PHA的成本能够降低近一半[32]。
合成生物学和代谢工程改造手段也可以应用到嗜盐微生物上。近年来,越来越多的嗜盐微生物有了全基因组序列和分析信息,对于嗜盐微生物的改造更具有靶向性。例如,对盐单胞菌TD01及其衍生菌进行代谢工程改造,表达异源基因构建以葡萄糖为唯一碳源合成PHBV的代谢途径[33]。在盐单胞菌TD01中过表达细胞分裂抑制因子MinCD的基因,可以对细胞进行形态改造,使细胞纤长化达到近百微米,增加了胞内积累PHA的空间,PHA含量从野生型对照的69%提高到82%[34]。在地中海富盐菌Haloferax mediterranei中敲除pyrF基因 (乳清酸核苷-5-磷酸脱羧酶),用5-氟乳清酸和尿嘧啶作为选择压力,大大提高了基因重组的效率,这种高效基因敲除技术可广泛应用于嗜盐微生物的基因组改造[35]。
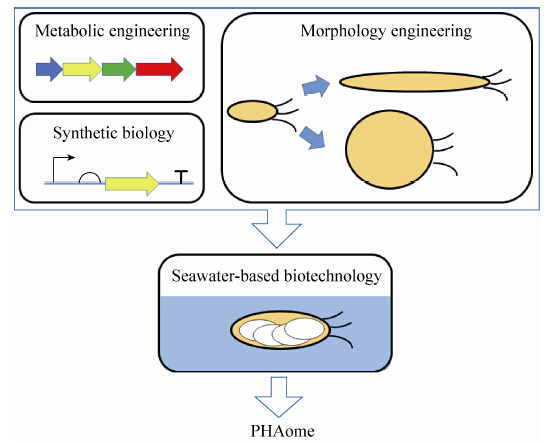
随着对嗜盐微生物的改造技术日益成熟,所有的PHA合成代谢途径都有可能转移到嗜盐微生物这一底盘菌当中,再通过合成生物学手段改造底盘菌,将有可能实现利用蓝水生物技术低成本生产所有种类的PHA (图 2)。代谢工程、合成生物学、形态学工程等改造手段与蓝水生物技术整合,可以提高PHA生产的竞争性,并获得PHA材料的多样性。
|
| 图2 代谢工程、合成生物学、形态学工程等改造手段与蓝水生物技术整合 Figure2 Metabolic engineering, synthetic biology and morphology engineering, combined with seawater-based biotechnology. |
| |
PHA由于其繁多的单体种类,造成了不同PHA 之间的物理化学性能也有很大的差异,既可以获得坚硬质脆的硬塑料,又可得到柔软的弹性体,可以满足不同需求。通常情况下,短链PHA 具有比较高的结晶度,表现出强而硬的塑料特性[36];而中长链的PHA 由于结晶度很低,表现出软而韧的弹性体特征。
目前商业化的PHA,主要是可降解热塑性材料,其性能可以和传统的石油基材料相媲美 (表 1),当前多数用于包装和涂层等领域。PHA 先后被Wella AG 、P&G、Biomers、Metabolix 及其他的一些公司开发为包装膜,主要用于购物袋、集装箱、纸张涂层和一次性的用品,例如剃面刀、器皿、尿布、女性卫生产品、化妆品容器、杯子、医疗器械手术服、家居装饰材料、地毯、包装袋和堆肥袋等[36]。
| Polymer | Young’s modulus (MPa) | Tensile strength (MPa) | Elongation at break (%) | Reference |
| P(3HB) | 3 500 | 40 | 6 | 37 |
| P(4HB) | 149 | 104 | 1 000 | 38 |
| P(3HB-co-3% 3HV) | 2 900 | 38 | 39 | |
| P(3HB-co-20% 3HV) | 1 200 | 32 | 50–100 | 39 |
| P(3HB-co-16% 4HB) | 26 | 444 | 40 | |
| P(3HB-co-3% 4HV) | 28 | 45 | 39 | |
| P(3HB-co-10% 4HV) | 24 | 242 | 39 | |
| P(3HB-co-17% 3HHx) | 0.173 | 20 | 850 | 39 |
| P(HO) | 17 | 250–350 | 41 | |
| P(3HO-co-12% 3HHx-co2% 3HD) | 7.6 | 9.3 | 380 | 42 |
| P(3HO-co-4.6% 3HHx) | 599.9 | 22.9 | 6.5 | 43 |
| P(3HO-co-5.4% 3HHx) | 493.7 | 23.9 | 17.6 | 43 |
| P(3HO-co-7% HHx) | 288.9 | 17.3 | 23.6 | 43 |
| P(3HO-co-8.5% HHx) | 232.3 | 15.6 | 34.3 | 43 |
| P(3HO-co-9.5% HHx) | 155.3 | 8.8 | 43 | 43 |
| High density polyethylene | 400–1 000 | 17.9–33.1 | 12–700 | 44 |
| Low density polyethylene | 50–100 | 15.2–78.6 | 150–600 | 44 |
| Polystyrene | 3 000–3 100 | 50 | 3–4 | 44 |
| Nylon-6,6 | 2 800 | 83 | 60 | 44 |
通常情况下,PHA的原始状态并不能很好地满足工业产品的要求,常采用化学和物理等方法对其改性,以满足不同的性能要求。最简单的方法就是通过物理共混改变结晶性能,以提高其机械性能。同时,PHA的引入也可以提高其他生物基材料的性能。中国科学院宁波材料所研究人员将PLA与PHBV反应性共混,再经熔融纺丝制得品质优异的新型生物基化学纤维——禾素TM[45]。在加工过程中,PHBV和PLA相互促进结晶,短时间内可以达到较高的结晶度,得到性能优异的纤维,其风格与手感等方面与真丝、铜氨等高档纤维品种相媲美。美国Metabolix公司还将PHA作为一种新型环保的增塑剂改性PVC,拓展了PHA在塑料添加剂方面的应用[46]。Sudesh等研究发现PHA 具有明显吸油效果,可能在化妆品和护肤品领域具有应用市场[47],基于吸油性,也可用于处理污水,吸附污水中的有机物[48]。
3.2 PHA在医药领域的应用PHA除了具有生物可降解性外,还具有良好的生物相容性,能够提供多种组织器官细胞生长的环境,且不具有致癌性,其降解产物大多在动物体内存在。以最常见的PHB来说,其降解产物3HB的血液中的浓度在0.3−1.3 mmol/L之 间[49-50],因此PHA材料作为医用的植入性材料具有极大的潜力。研究者针对 PHB、PHBV、P3HB4HB、P4HB、聚-3羟基辛酸P3HO (poly-R-3-hydroxyoctanoate) 和PHBHHx等 PHA 材料在外科手术中用到的 (外科缝合线、绷带、纱布、防黏连膜) 和各类支架 (关节软骨修复支架、脊髓支架、人造食道、心脏支架) 等方面的应用进行了开发[51]。PHA材料制备的三维支架可以支持细胞生长,随后降解保留修复组织,可以用于心血管系统、角膜、胰腺、消化系统、肾脏、泌尿生殖系统、神经系统、牙齿、口腔和皮肤等[52]。美国Tepha的P4HB以PHA4400为名字作为医用材料进入市场[53]。近期研究显示,PHBHHx因其良好的压电性而被成功地用于促进骨骼再生[54]。研究者对于PHBHHx在神经损伤的修复和人工血管方面的应用也加以开发[54]。理想情况下,组织工程支架在实现组织修复的同时,自身完全降解,因而PHA制成的支架需要满足各种组织器官的结构和力学性能同时以合理的速率进行降解,在这两个方面PHA材料性能仍有待提高。
PHA作为可降解的载体用于药物和激素等的可控靶向释放也越来越多地引起研究者的关注[52, 55]。PHA可以以凝胶、微团、微球、纳米颗粒、多孔支架等多种形式进行载药[56-57],P(3HB)、P(3HB-co-3HV)、P(3HB-co-4HB)等均已被用于制备微米/纳米颗粒进行载药[57]。通过改进和修饰PHB聚合物的组成,得到的共聚物可以改善表面特性,可以很好地控制药物的释放速率和载体的降解。Gref等的研究中,成功地将PHB和PEG共聚,显著提高了PHB纳米颗粒在血液中的循环时间,从而提高药物的生物利用率、降低给药剂量、减轻毒副作用[58]。
在水产养殖业,PHA作为饲料添加剂表现出抑制细菌性病原体的效果。研究者发现,喂养PHB的对虾的肠道菌群得到明显改善,抗病能力增强,存活率增加,PHB可以作为抗生素的替代品,缓解海产品的抗生素耐药性问 题[59-60]。
此外,研究者发现 PHA 的寡聚物具有营养和治疗的功效,3HB单体对治疗骨质疏松、糖尿病和神经性退行等疾病具有一定的效果,表现出潜在的医疗保健药用价值[61-63]。
4 展望随着PHA多样性的日益拓宽,PHA的应用领域也必然越来越广。然而PHA的大规模产业化和商业化一直受到生产成本的制约,特别是新型PHA的生产成本大大高于传统PHA,在一定程度上限制了对其应用研究的开展。通过合成与系统生物学、蓝水生物技术等手段整合各种PHA的合成,实现一种底盘菌、多个代谢途径、按需合成某一种PHA的低成本生产平台,最终将有可能降低所有种类PHA的生产成本,从而促进不同类型PHA应用于不同领域。
| [1] | Chen GQ, Patel MK. Plastics derived from biological sources: present and future: a technical and environmental review. Chem Rev, 2012, 112 (4) : 2082–2099 (in Chinese). |
| [2] | Steinbüchel A, Valentin HE. Diversity of bacterial polyhydroxyalkanoic acids. FEMS Microbiol Lett, 1995, 128 (3) : 219–228 (in Chinese). |
| [3] | Valentin HE, SchÖnebaum A, Steinbüchel A. Identification of 5-hydroxyhexanoic acid, 4-hydroxyheptanoic acid and 4-hydroxyoctanoic acid as new constituents of bacterial polyhydroxyalkanoic acids. Appl Microbiol Biotechnol, 1996, 46 (3) : 261–267 (in Chinese). |
| [4] | Li SJ, Cai LW, Wu LP, et al. Microbial synthesis of functional homo-, random, and block polyhydroxyalkanoates by β-oxidation deleted Pseudomonas entomophila. Biomacromolecules, 2014, 15 (6) : 2310–2319 (in Chinese). |
| [5] | Chung AL, Jin HL, Huang LJ, et al. Biosynthesis and characterization of poly (3-hydroxydodecanoate) by β-oxidation inhibited mutant of Pseudomonas entomophila L48. Biomacromolecules, 2011, 12 (10) : 3559–3566 (in Chinese). |
| [6] | Tripathi L, Wu LP, Chen JC, et al. Synthesis of diblock copolymer poly-3-hydroxybutyrate -block-poly-3-hydroxyhexanoate. Microb Cell Fact, 2012, 11 (1) : 44 (in Chinese). |
| [7] | Tappel RC, Kucharski JM, Mastroianni JM, et al. Biosynthesis of Poly. Biomacromolecules, 2012, 13 (9) : 2964–2972 (in Chinese). |
| [8] | Zheng Z, Li M, Xue XJ, et al. Mutation on N-terminus of polyhydroxybutyrate synthase of Ralstonia eutropha enhanced PHB accumulation. Appl Microbiol Biotechnol, 2006, 72 (5) : 896–905 (in Chinese). |
| [9] | Ashby RD, Solaiman DKY, Strahan GD, et al. Methanol-induced chain termination in poly (3-hydroxybutyrate) biopolymers: molecular weight control. Int J Biol Macromol, 2015 : 195–201 (in Chinese). |
| [10] | Ashby RD, Shi FY, Gross RA. Use of poly (ethylene glycol) to control the end group structure and molecular weight of poly (3-hydroxybutyrate) formed by Alcaligenes latus DSM 1122. Tetrahedron, 1997, 53 (45) : 15209–15223 (in Chinese). |
| [11] | Chen GQ, Hajnal I. The 'PHAome'. Trends Biotechnol, 2015, 33 (10) : 559–564 (in Chinese). |
| [12] | Lemoigne M. Products of dehydration and of polymerization of β-hydroxybutyric acid. Bull Soc Chem Biol, 1926 : 770–782 (in Chinese). |
| [13] | Han J, Hou J, Zhang F, et al. Multiple propionyl coenzyme A-supplying pathways for production of the bioplastic poly (3-hydroxybutyrate-co-3-hydroxyvalerate) in Haloferax mediterranei. Appl Environ Microbiol, 2013, 79 (9) : 2922–2931 (in Chinese). |
| [14] | Wang Q, Liu XL, Qi QS. Biosynthesis of poly (3-hydroxybutyrate-co-3-hydroxyvalerate) from glucose with elevated 3-hydroxyvalerate fraction via combined citramalate and threonine pathway in Escherichia coli. Appl Microbiol Biotechnol, 2014, 98 (9) : 3923–3931 (in Chinese). |
| [15] | Li ZJ, Shi ZY, Jian J, et al. Production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) from unrelated carbon sources by metabolically engineered Escherichia coli. Metab Eng, 2010, 12 (4) : 352–359 (in Chinese). |
| [16] | Zhou XY, Yuan XX, Shi ZY, et al. Hyperproduction of poly(4-hydroxybutyrate) from glucose by recombinant Escherichia coli. Microb Cell Fact, 2012 : 54 (in Chinese). |
| [17] | Meng DC, Wang Y, Wu LP, et al. Production of poly (3-hydroxypropionate) and poly (3-hydroxybutyrate-co-3-hydroxypropionate) from glucose by engineering Escherichia coli. Metab Eng, 2015 : 189–195 (in Chinese). |
| [18] | Zhuang QQ, Wang Q, Liang QF, et al. Synthesis of polyhydroxyalkanoates from glucose that contain medium-chain-length monomers via the reversed fatty acid β-oxidation cycle in Escherichia coli. Metab Eng, 2014 : 78–86 (in Chinese). |
| [19] | Park SJ, Jang YA, Lee H, et al. Metabolic engineering of Ralstonia eutropha for the biosynthesis of 2-hydroxyacid-containing polyhydroxyalkanoates. Metab Eng, 2013 : 20–28 (in Chinese). |
| [20] | Chen GQ, Hajnal I, Wu H, et al. Engineering biosynthesis mechanisms for diversifying polyhydroxyalkanoates. Trends Biotechnol, 2015, 33 (10) : 565–574 (in Chinese). |
| [21] | Poblete-Castro I, Binger D, Rodrigues A, et al. In-silico-driven metabolic engineering of Pseudomonas putida for enhanced production of poly-hydroxyalkanoates. Metab Eng, 2013 : 113–123 (in Chinese). |
| [22] | Borrero-de AcuÑa JM, Bielecka A, Häussler S, et al. Production of medium chain length polyhydroxyalkanoate in metabolic flux optimized Pseudomonas putida. Microb Cell Fact, 2014 : 88 (in Chinese). |
| [23] | Lü L, Ren YL, Chen JC, et al. Application of CRISPRi for prokaryotic metabolic engineering involving multiple genes, a case study: controllable P(3HB-co-4HB) biosynthesis. Metab Eng, 2015 : 160–168 (in Chinese). |
| [24] | Jiang XR, Chen GQ. Morphology engineering of bacteria for bio-production. Biotechnol Adv, 2015 .DOI:10.1016/j.biotechadv.2015.12.007. (in Chinese). |
| [25] | Wang Y, Wu H, Jiang XR, et al. Engineering Escherichia coli for enhanced production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) in larger cellular space. Metab Eng, 2014 : 183–193 (in Chinese). |
| [26] | Jiang XR, Wang H, Shen R, et al. Engineering the bacterial shapes for enhanced inclusion bodies accumulation. Metab Eng, 2015 : 227–237 (in Chinese). |
| [27] | Wu H, Wang H, Chen JC, et al. Effects of cascaded vgb promoters on poly(hydroxybutyrate) (PHB) synthesis by recombinant Escherichia coli grown micro-aerobically. Appl Microbiol Biotechnol, 2014, 98 (24) : 10013–10021 (in Chinese). |
| [28] | Wang Y, Yin J, Chen GQ. Polyhydroxyalkanoates, challenges and opportunities. Curr Opin Biotechnol, 2014 : 59–65 (in Chinese). |
| [29] | Yin J, Chen JC, Wu Q, et al. Halophiles, coming stars for industrial biotechnology. Biotechnol Adv, 2015 : 1433–1442 (in Chinese). |
| [30] | Tan D, Xue YS, Aibaidula G, et al. Unsterile and continuous production of polyhydroxybutyrate by Halomonas TD01. Bioresour Technol, 2011, 102 (17) : 8130–8136 (in Chinese). |
| [31] | Yue HT, Ling C, Yang T, et al. A seawater-based open and continuous process for polyhydroxyalkanoates production by recombinant Halomonas campaniensis LS21 grown in mixed substrates. Biotechnol Biofuels, 2014 : 108 (in Chinese). |
| [32] | Li T, Chen XB, Chen JC, et al. Open and continuous fermentation: products, conditions and bioprocess economy. Biotechnol J, 2014 : 1503–1511 (in Chinese). |
| [33] | Yin J, Wang H, Fu XZ, et al. Effects of chromosomal gene copy number and locations on polyhydroxyalkanoate synthesis by Escherichia coli and Halomonas sp.. Appl Microbiol Biotechnol, 2015 : 5523–5534 (in Chinese). |
| [34] | Tan D, Wu Q, Chen JC, et al. Engineering Halomonas TD01 for the low-cost production of polyhydroxyalkanoates. Metab Eng, 2014 : 34–47 (in Chinese). |
| [35] | Liu HL, Han J, Liu XQ, et al. Development of pyrF-based gene knockout systems for genome-wide manipulation of the archaea Haloferax mediterranei and Haloarcula hispanica. J Genet Genomics, 2011, 38 (6) : 261–269 (in Chinese). |
| [36] | Chen GQ. A microbial polyhydroxyalkanoates (PHA) based bio- and materials industry. Chem Soc Rev, 2009, 38 (8) : 2434–2446 (in Chinese). |
| [37] | Lee SY. Bacterial polyhydroxyalkanoates. Biotechnol Bioeng, 1996, 49 (1) : 1–14 (in Chinese). |
| [38] | Sudesh K, Abe H, Doi Y. Synthesis, structure and properties of polyhydroxyalkanoates: biological polyesters. Prog Polym Sci, 2000, 25 (10) : 1503–1555 (in Chinese). |
| [39] | Van der Walle GAM, De Koning GJM, Weusthuis RA, et al. Properties, modifications and applications of biopolyesters//Babel W, Steinbüchel A, Eds. Biopolyesters. Berlin Heidelberg: Springer, 2001: 263-291. |
| [40] | Chen GQ, Wang Y. Medical applications of biopolyesters polyhydroxyalkanoates. Chinese J Polym Sci, 2013 : 719–736 (in Chinese). |
| [41] | Marschessault RH, Monasterios CJ, Morin FG, et al. Chiral poly (β-hydroxyalkanoates): an adaptable helix influenced by the alkane side-chain. Int J Biol Macromol, 1990, 12 (2) : 158–165 (in Chinese). |
| [42] | Gagnon KD, Lenz RW, Farris RJ, et al. The mechanical properties of a thermoplastic elastomer produced by the bacterium Pseudomonas oleovorans. Rubber Chem Technol, 1992, 65 (4) : 761–777 (in Chinese). |
| [43] | Asrar J, Valentin HE, Berger PA, et al. Biosynthesis and properties of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) polymers. Biomacromolecules, 2002, 3 (5) : 1006–1012 (in Chinese). |
| [44] | Castilho LR, Mitchell DA, Freire DMG. Production of polyhydroxyalkanoates (PHAs) from waste materials and by-products by submerged and solid-state fermentation. Bioresour Technol, 2009, 100 (23) : 5996–6009 (in Chinese). |
| [45] | Li LZ, Huang W, Wang BJ, et al. Properties and structure of polylactide/poly (3-hydroxybutyrate-co-3-hydroxyvalerate) (PLA/PHBV) blend fibers. Polymer, 2015 : 183–194 (in Chinese). |
| [46] | Kann Y, Weinlein R. Biobased modifiers for polyvinylchloride blends: US, 20140051787 A1. 2013-10-1. |
| [47] | Sudesh K, Loo CY, Goh LK, et al. The oil-absorbing property of polyhydroxyalkanoate films and its practical application: a refreshing new outlook for an old degrading material. Macromol Biosci, 2007, 7 (11) : 1199–1205 (in Chinese). |
| [48] | Zhang X, Wei C, He Q, et al. Enrichment of chlorobenzene and o-nitrochlorobenzene on biomimetic adsorbent prepared by poly-3-hydroxybutyrate (PHB). J Hazard Mater, 2010, 177 (1-3) : 508–515 (in Chinese). |
| [49] | Reddy CSK, Ghai R, Kalia VC. Polyhydroxyalkanoates: an overview. Bioresour Technol, 2003, 87 (2) : 137–146 (in Chinese). |
| [50] | Adams JH, Irving G, Koeslag JH, et al. Beta-adrenergic blockade restores glucose's antiketogenic activity after exercise in carbohydrate-depleted athletes. J Physiol, 1987, 386 (1) : 439–454 (in Chinese). |
| [51] | Chen GQ, Wu Q. The application of polyhydroxyalkanoates as tissue engineering materials. Biomaterials, 2005, 26 (33) : 6565–6578 (in Chinese). |
| [52] | Chen GQ, Wu Q. Microbial production and applications of chiral hydroxyalkanoates. Appl Microbiol Biotechnol, 2005, 67 (5) : 592–599 (in Chinese). |
| [53] | Martin DP, Williams SF. Medical applications of poly-4-hydroxybutyrate: a strong flexible absorbable biomaterial. Biochem Eng J, 2003, 16 (2) : 97–105 (in Chinese). |
| [54] | He Y, Hu ZW, Ren MD, et al. Evaluation of PHBHHx and PHBV/PLA fibers used as medical sutures. J Mater Sci: Mater M, 2014, 25 (2) : 561–571 (in Chinese). |
| [55] | Bansal SS, Goel M, Aqil F, et al. Advanced drug delivery systems of curcumin for cancer chemoprevention. Cancer Prev Res, 2011, 4 (8) : 1158–1171 (in Chinese). |
| [56] | Ueda H, Tabata Y. Polyhydroxyalkanonate derivatives in current clinical applications and trials. Adv Drug Deliver Rev, 2003, 55 (4) : 501–518 (in Chinese). |
| [57] | Nigmatullin R, Thomas P, Lukasiewicz B, et al. Polyhydroxyalkanoates, a family of natural polymers, and their applications in drug delivery. J Chem Technol Biot, 2015, 90 (7) : 1209–1221 (in Chinese). |
| [58] | Li J, Li X, Ni XP, et al. Self-assembled supramolecular hydrogels formed by biodegradable PEO-PHB-PEO triblock copolymers and α-cyclodextrin for controlled drug delivery. Biomaterials, 2006, 27 (22) : 4132–4140 (in Chinese). |
| [59] | Nhan DT, Wille M, De Schryver P, et al. The effect of poly β-hydroxybutyrate on larviculture of the giant freshwater prawn Macrobrachium rosenbergii. Aquaculture, 2010, 302 (1/2) : 76–81 (in Chinese). |
| [60] | Defoirdt T, Sorgeloos P, Bossier P. Alternatives to antibiotics for the control of bacterial disease in aquaculture. Curr Opin Microbiol, 2011, 14 (3) : 251–258 (in Chinese). |
| [61] | Zhang JY, Cao Q, Li SW, et al. 3-Hydroxybutyrate methyl ester as a potential drug against Alzheimer's disease via mitochondria protection mechanism. Biomaterials, 2013, 34 (30) : 7552–7562 (in Chinese). |
| [62] | Thurston JH, Hauhart RE, Schiro JA. β-Hydroxybutyrate reverses insulin-induced hypoglycemic coma in suckling-weanling mice despite low blood and brain glucose levels. Metab Brain Dis, 1986, 1 (1) : 63–82 (in Chinese). |
| [63] | Lim S, Chesser AS, Grima JC, et al. D-β-hydroxybutyrate is protective in mouse models of Huntington’s disease. PLoS ONE, 2011, 6 (9) : e24620 (in Chinese). |
 2016, Vol. 32
2016, Vol. 32