服务
文章信息
- 张艳凤, 许勇, 陈雷, 胡俊, 张学成, 房伟, 方泽民, 肖亚中
- Zhang Yanfeng, Xu Yong, Chen Lei, Hu Jun, Zhang Xuecheng, Fang Wei, Fang Zemin, Xiao Yazhong
- 海绵内/共生稀有放线菌Dermacoccus sp. X4 次级代谢产物分离纯化及结构解析
- Isolation, identification and structural characterization of secondary metabolites from amarine sponge-derived rare actinobacterium Dermacoccus sp. X4
- 生物工程学报, 2016, 32(5): 599-609
- Chin J Biotech, 2016, 32(5): 599-609
- 10.13345/j.cjb.150391
-
文章历史
- Received: September 10, 2015
- Accepted: December 21, 2015
2 安徽省微生物与生物催化工程技术研究中心,安徽 合肥 230039
2 Anhui Provincial Engineering Technology Research Center of Microorganisms and Biocatalysis, Hefei 230039, Anhui, China
海洋占据地球70%以上的面积,是新型海 洋天然产物来源的巨大宝库。自20 世纪50 年 代Bergmann 和Feeney 首次从海绵Tethya crypta 中获得新颖的核酸衍生物以来[1-2],此后每年都 有上百种结构新颖且具有良好活性的新化合物 被报道[3]。
软体动物是海洋生物的重要成员,在海洋 生态平衡中发挥功能。其中,海绵由于其固着 生活方式,缺乏有效的物理性防御,在激烈的 生存竞争中,主要通过积聚或分泌多种具有攻击 性、甚至毒害性的次级代谢产物来维护种群的 生存,是新型活性化合物的重要来源。目前,已经从各类海绵中分离获得多个具有显著生物 活性 (包括抗菌、抗肿瘤、抗病毒、抗炎等) 的 化合物[4-19]。然而,海绵资源有限,对海绵资源 的过量捕捞会破坏海洋的生态平衡。因此,来 源于海洋软体生物如海绵的药源材料短缺已经 成为限制海洋药物开发的瓶颈。
近年来,随着对微生物及其宿主关系研究 的不断深入,人们发现,来源于海绵的某些活性 物质实际上是由与其共附生的微生物产生的[5],无疑为海洋药物药源问题的解决提供了思路,即可以通过对共附生微生物的发酵制备来解决 海洋药物的药源问题。
海绵共附生微生物物种多样,具有广泛的 代谢产物多样性[14-15],是新型生物活性物质的 重要源泉[16-20]。目前,已从其共附生微生物中 发现了若干结构新颖、活性独特的次级代谢产 物,如从海绵Ircinia sp.中分离得到一个二倍半 萜硫酸胍盐sulfircin,它具有抗真菌病原体活性(MIC 为25 μg/mL),它还能促进神经肌肉传导,也是乙酞胆碱酷酶的抑制剂[21] ,来自海绵 Xestospongia testudinaria 共附生真菌Aspergillus sp.的2 个新的倍半萜二聚体类化合物disydonols A和C,对HepG-2 和Caski 癌细胞有细胞毒性[22]。
为了更多了解海绵共附生微生物及其代谢 产物,前期我们从南海海域10 m 深处采集若干 海绵样品。本研究中,我们对1 株未鉴定海绵 进行了共附生微生物的分离鉴定,获得16 株微生 物菌株,并对得到1 株具有抑菌活性的稀有放线 菌——皮生球菌属菌株Dermacoccus sp. X4 合成 的活性化合物进行初步分离纯化及结构解析。
1 材料与方法 1.1 材料Sephadex TMLH-20 (GE Healthcare Bio- Sciences);YMC·GEL ODS-A-HG 12 nm S-50 μm (YMC Co.Ltd) ; 色谱纯甲醇及乙腈 (Merck KGaA);硅胶200-300 目及硅胶H 板 (青岛海 洋化工有限公司)。其他试剂均为进口或国产分 析纯级。
1.2 仪器旋转蒸发仪 (EYELAN-1100 ,Tokyo RikakikaiCo.LTD);高效液相色谱仪 (AGILENT 1260);液质联用质谱仪 (SATUKN2200);核磁 共振波谱仪 (DMX500,Bruker)。
1.3 分离培养基细菌使用伊莫逊氏培养基进行分离;放线 菌分别使用高氏培养基、琼脂培养基、淀粉干 酪素琼脂以及葡萄糖硝酸盐琼脂进行分离;真菌 使用马丁培养基和察贝克氏琼脂进行分离[23]。
1.4 海绵共附生微生物的分离海绵样品处理:取20 g 海绵样品,无菌海水冲洗表面后,用75%酒精漂洗4 min,然后再 用无菌海水冲洗4 次 (最后一次清洗用的水涂 布于相应培养基上检查表面消毒效果),表面消 毒的样品在无菌条件下剪碎,加入50 mL 无菌 海水,经漩涡振荡器振荡1 min 后,静置至澄清,取上清液备用。
吸取0.5 mL 经预处理的样液于装有4.5 mL 无菌海水的试管中,充分混匀,按照10-1−10-5 的比例稀释,用微量移液器吸取100 μL 经稀释 后的样品溶液至装有各相应分离培养基的培养 皿中,用涂棒均匀涂布,涂好的平板置于28 ℃ 培养箱进行培养。生长的菌落挑出后进一步分 离纯化,并记录菌落培养特征与个体形态。
1.5 海绵共附生微生物的初步鉴定细菌和真菌基因组DNA分别使用细菌和真 菌基因组提取试剂盒 (康为世纪生物科技有限 公司) 提取。使用引物27F 及1492R (表 1) 扩 增各细菌菌株的16S rRNA 基因序列[24];使用引 物P1 及P2 (表 1) 扩增各真菌菌株的ITS 序列[25]。 获得的DNA 序列使用NCBI 中的Blast 程序进 行相似性比对,确定各菌株的种属归类。
| Primers | Primer sequence (5'–3') |
| 27F | AGAGTTTGATCMTGGCTCAG |
| 1492R | GGTTACCTTGTTACGACTT |
| P1 | TCCGTAGGTGAACCTGCGG |
| P2 | TCCTCCGCTTATTGATATGC |
收集各菌株培养至稳定期的发酵液备用。 将活化好的金黄色葡萄球菌 (Staphylococcus aureus subsp.,ATCC25923 T)、大肠杆菌 (Escherichia coli,ATCC25922T)、新型隐球菌(Cryptococcus neoformans,ATCC14116T) 及白 假丝酵母菌 (Candida albicans,ATCC10231T) 等4 株待测菌的1 mL 菌液 (OD600=1) 与100 mL 伊莫逊氏培养基或沙氏琼脂培养基 (麦芽糖 40 g,蛋白胨10 g,琼脂20 g,补充蒸馏水至 1 L)混合均匀后制备待测琼脂平板,将牛津杯置 于琼脂平板上,每板放置4 个,分别加入100 μL 无菌水 (阴性对照)、发酵上清原液、1/2 浓度发 酵原液、1/4 浓度发酵原液,每种菌设置3 个平 行。细菌置于37 ℃培养24 h,真菌置于28 ℃ 培养48 h 后,观察是否有抑菌圈出现并测量抑 菌圈直径大小。
1.7 Dermacoccus sp. X4 的分子生物学及形 态学鉴定将菌株Dermacoccus sp. X4 的16S rRNA 基 因序列在GenBank (http://www.ncbi.nlm.nih.gov/ blast/) 及模式菌比对软件EzTaxon-e (http:// www.ezbiocloud.net/eztaxon) 进行比对后,在 GenBank 上获取相关的16S rRNA 基因序列,使 用MEGA 5.0 进行比对分析后,采用Kimura 2-parameter 模型和临接法 (Neighbor-Joining) 构建菌株Dermacoccus sp. X4 的系统发育聚类 图,进一步确定该菌株的分类地位。
挑取菌株Dermacoccus sp. X4 的单菌落在 MT 固体培养基平板上划线,置于28 ℃条件下 培养生长72 h 后观察其菌落大小及形态。取对 数期的菌体用磷钨酸染色后采用透射电镜 (FEI Tecnai G2 F20,FEI) 观察菌体大小及形状。
1.8 Dermacoccus sp. X4 次级代谢产物提取菌株发酵上清制备:对Dermacoccus sp. X4 的发酵培养基进行优化后,选用生长对数期菌 液作为种子液 (OD600=2.1),按照1%接种量接 种至马丁培养基中 (400 mL 培养基/1 L 三角 瓶),28 ℃、120 r/min 条件下培养至90 h,收 集发酵液,8 000×g 离心去除菌体,得到澄清发 酵液。
次级代谢产物的提取:采用等体积乙酸乙 酯对发酵液进行萃取,分离小分子脂溶性物质,等体积萃取3 次,收集乙酸乙酯组分,将乙酸 乙酯相蒸发浓缩去除有机溶剂,得到菌株发酵 液粗浸膏。
1.9 次级代谢产物的分离纯化发酵液浸膏570 mg 溶于适当溶剂中,与5 g 干硅胶拌样,干法上样后,采用硅胶200−300 目层析柱 (内径40 mm,长度400 mm) 进行分 离。用石油醚溶剂进行装柱后,采用梯度洗脱,洗脱体系分别为:石油醚∶丙酮=10∶0;9∶1; 8∶2;7∶3;6∶4;5∶5;二氯甲烷∶甲醇= 9∶1;7∶3;5∶5;0∶10,每个梯度洗脱400 mL,收集各洗脱馏分,每管收集10 mL,并进行薄层 层析分析,根据层析情况合并相同组分,共得 到17 个组分。将质量较大的组分15、16 及17 进一步进行凝胶色谱分离 (内径22 mm,长度 1 200 mm),柱材料为Sephadex TMLH-20,采用 甲醇作洗脱液,洗脱3 个柱体积 (400 mL),收 集各洗脱馏分,并进行薄层层析分析,根据层 析情况合并相同组分,将质量较大的组分15-1、 16-2 及17-1 过ODS 离子交换色谱柱 (内径 22 mm,长度400 mm),采用甲醇∶水=3∶7; 4∶6;1∶1;7∶3 及10∶0 作洗脱剂,收集各 洗脱馏分,并进行薄层层析分析,根据层析情 况合并相同组分,将质量较大的组分15-1-B、 16-2-A 及17-1-4 利用高效液相色谱进行分离,采用C18 半制备柱 (Pheno-menex Gemini 5uC18110A,250 mm×10.00 mm 5 micron),210 nm 波 长下进行检测,分离得到化合物单体。
1.10 化合物的结构解析取0.5 mg 样品溶于0.5 mL 色谱级甲醇中 进行质谱分析;将各样品分别以0.5 mL CH3DO 溶解,反复交换2 次。最后以0.7 mL CH3DO 将 样品溶于核磁管,加入一滴氘代丙酮作为内标,在23 ℃下,利用1H-NMR、13C-NMR 等核磁技 术对各样品进行结构分析。
2 结果与分析 2.1 海绵共附生微生物的分离基于16S rRNA 及ITS 编码基因的序列聚类 分析表明 (表 2),共得到16 个不同种微生物菌 株,分布于枝孢属 (Cladosporium sp.)、丛赤壳 属 (Nectria sp.)、踝节菌属 (Talaromyces sp.)、 青霉菌属 (Penicillium sp.) 、锁掷酵母属 (Sporidiobolus sp.) 等真菌,考克氏菌属 (Kocuria sp.)、皮生球菌属 (Dermacoccus sp.) 等放线菌及类芽孢杆菌属 (Paenibacillus sp.) 等细菌。
| Ttaxonomy position/genera | Strain number | The similar strain (Accession No.) | Similarity (%) |
| Alternaria | 13XS-f1 | Alternaria alternata strain NFML_CH44_376 | 100.00 |
| Alternaria | 13XS-f2 | Alternaria tenuissima strain CHR-1 | 99.00 |
| Penicillium | 13XS-f3 | Penicillium oxalicum | 99.00 |
| Cladosporium | 13XS-f4 | Cladosporium perangustum | 98.00 |
| Talaromyces | 13XS-f5 | Talaromyces sp. NRRL 62223 | 99.00 |
| Aspergillus | 13XS-f6 | Aspergillus awamori strain SRRC332 | 99.00 |
| Eutypella | 13XS-f7 | Eutypella sp. W57-7 (AB693818) | 99.00 |
| Bacillus | 13XS-f8 | Bacillus methylotrophicusCBMB205T | 99.38 |
| Kocuria | 13XS-f9 | Kocuria palustris strain JPR-01 | 99.00 |
| Nectria | 13XS-f11 | Nectria cinnabarina strain 5175 (HM054135) | 99.00 |
| Dermacoccus | 13XS-X4 | Dermacoccus nishinomyaensis DSM20448T | 99.16 |
| Penicillium | 13XS-X8 | Penicillium chrysogenum strain FRR 807 | 99.00 |
| Penicillium | 13XS-X9 | Talaromyces purpurogenus (AB872825) | 100.00 |
| Kocuria | 13XS-Z6 | Kocuria palustris DSM11925T | 99.93 |
| Sporidiobolus | 13XS-fr | Sporidiobolus pararoseus (HQ670681) | 98.00 |
| Penicilliumchrysogenum | 13XS-f12 | Penicillium chrysogenum (AY373902) | 100.00 |
经过培养观察,分离菌株Dermacoccus sp.X4 (16S rRNA gene GenBank ID:KT944034) 对金黄色葡萄球菌显示出抑菌活性,且抑菌活 性随发酵液的浓度的增加而增强,菌株发酵液 原液、倍比稀释至1/2 及1/4 的发酵液的抑菌圈 直径分别为:25 mm、23 mm 及19 mm (图 1)。

|
| 图1 Dermacoccus sp. X4 对新型隐球菌 (A)、白假 丝酵母菌 (B)、大肠杆菌 (C) 及金黄色葡萄球菌 (D) 的抑制作用 Figure1 The inhibitory effects of Dermacoccus sp. X4 fermentation broth on C. neoformans (A), C. albicans (B), E. coli (C), and S. aureus subsp. (D). NC: negative control; FL: fermentation liquor. |
| |
基于菌株Dermacoccus sp. X4 的16S rRNA 基因序列构建Neighbor-Joining 系统发育聚类图 (图 2),系统发育聚类图显示,该菌株与已经报 道的模式菌株Dermacoccus nishinomyaensis DSM20448T 亲缘关系最近,且与Dermacoccus 属的其他几个种也具有很近的亲缘关系,因此 确定该菌株归属于Dermacoccus sp.。

|
| 图2 菌株Dermacoccus sp. X4 的系统发育聚类图 (邻接法) Figure2 The Neighbor-Joining tree of strain Dermacoccus sp. X4. |
| |
Dermacoccus sp. X4 为不运动的放线菌,在 28 ℃条件下,在马丁培养基上生长72 h 后,菌 落呈规则圆形,直径约为1 mm,淡黄色,表面 光滑湿润,中部隆起,为表面有光泽的克隆。 电镜观察菌体为椭圆形,直径约为0.5-1.5 μm (图 3)。

|
| 图3 菌株Dermacoccus sp. X4 的菌落 (A) 和菌体 (B) 形态 Figure3 The morphology of the clony (A) and the cell (B) of Dermacoccus sp. X4. |
| |
通过大量摇瓶发酵,获得Dermacoccus sp. X4 发酵液10 L,得到乙酸乙酯萃取浸膏570 mg。 经过各分离技术的综合运用,最终获得6 个单 一化合物 (表 3 和图 4)。

|
| 图4 单一化合物HPLC 及TLC 分析图谱 Figure4 The high performance liquid chromatography (HPLC) and thin layer chromatography (TLC) spectra of the purified compounds. |
| |
| Fraction No. | Quantities (mg) | Fraction No. | Quantities (mg) |
| x4-16A1 | 1.1 | X4-17-4 | 14.6 |
| x4-15B | 2.0 | X4-17-6 | 3.0 |
| x4-16A4 | 1.0 | X4-17-5 | 4 |
化合物X4-15:
1H-NMR (600 MHz,MeOD) δ:8.10 (1H,d,J=7.44 Hz,4-H),7.86 (1H,s,2-H),7.38 (1H,d,J=7.80 Hz,7-H),7.13 (2H,m,5-H,6-H);
13C-NMR (150 MHz ,MeOD) δ:138.17 (C-8),132.53 (C-2),127.88 (C-9),123.19 (C-6),122.26 (C-4),121.91 (C-5),112.63 (C-7)。该化 合物为白色粉末,质谱显示该化合物的相对分 子质量为149,表明其含有N 元素,推测其分 子式为C8H7NO2。
结合1H-NMR 谱图,发现氢的出峰位置均 在δ6.0-8.5 (一般苯环上的氢出峰位置) 左右,另外δ7.86 处为一单峰,故判断该化合物的骨架 为吲哚结构。由1H-1HCOSY 图谱可知,H-4 和 H-5 相关,H-5 和H-6 相关,H-6 和H-7 相关,再由HMBC 谱图和HMQC 谱图可知,H-4/C-4,H-4/C-6,H-4/C-8,H-2/C-2,H-2/C-8,H-2/C-9,H-7/C-7,H-7/C-9,H-7/C-5,H-5/C-5,H-5/C-7,H-5/C-9,H-6/C-6,H-6/C-8,H-6/C-4,可判断 该化合物为吲哚结构。质谱信息表明该化合物 的相对分子质量为149,故确定该化合物为 3-hydroperoxy-1H-indole,将该化合物的核磁数 据与文献[26]比较,确定该化合物结构如下:

|
化合物X4-16A:
1H-NMR (600 MHz,MeOD) δ:7.52 (1H,d,J=8.34 Hz,4-H),7.31 (1H,d,J=7.74 Hz,7-H),7.14 (1H,s,2-H),7.06 (1H,m,6-H),6.98 (1H,m,5-H),3.69 (2H,s,10-H),3.63 (1H,m,2´-H),3.56 (2H,m,1´-H),3.50 (2H,m,3´-H);
13C-NMR (150 MHz ,MeOD) δ:179.38 (C-11),138.15 (C-8),128.76 (C-9),124.53 (C-2),122.35 (C-6),119.72 (C-5),119.48 (C-4),112.16 (C-7),109.62 (C-3),73.86 (C-2´),64.40 (C-1´,3´),32.45 (C-10)。
化合物为白色粉末,分子量256,推测其分 子式为C13H14NO4。将该化合物的核磁数据与 X-4-2-15B 比较,发现低场信号基本一样,而是 在高场位置增加了几组峰,故初步判断该化合 物的骨架为一个吲哚结构。由1H-1HCOSY 图谱 可知,H-4 和H-5 相关,H-5 和H-6 相关,H-6 和H-7 相关,再由HMBC 谱图和HMQC 谱图 可知,H-4/C-4,H-4/C-3,H-4/C-6,H-4/C-8,H-4/C-9,H-4/C-5,H-4/C-7,H-7/C-7,H-7/C-9,H-7/C-5,H-2/C-2,H-2/C-10,H-2/C-3,H-2/C-8,H-2/C-9,H-6/C-6,H-6/C-4,H-6/C-7,H-5/C-5,H-5/C-7,H-5/C-9,判断该化合物为一个在3 号 位被取代的吲哚结构。进一步分析δ:3.0-4.0 的高场区域,结合氢谱、碳谱以及DEPT135 谱 图可发现,该区域为1 个叔碳,3 个仲碳。由 HMBC 谱图和HMQC 谱图可知,H-10/C-10,H-10/C-11,H-10/C-3,H-10/C-4,H-10/C-9,H-2´/C-2´,H-2´/C-1´,H-2´/C-3´,H-1´/C-1´,H-1´/C-2´,H-1´/C-10,H-3´/C-3´,H-3´/C-2´,从而判断被取代部分为一个甘油酯片段,将以 上两个片段结构按HMBC 给出相关性,结合 HMQC、1H-1HCOSY 图谱数据,确定该化合物 为3-吲哚乙酸甘油酯,将该化合物的核磁数据 与文献[27]比较,确定该化合物结构如下:

|
化合物X4-17-4:
1H-NMR (600 MHz,MeOD) δ:7.02 (2H,d,J=8.10 Hz,2´,6´-H),7.02 (2H,d,J=8.16 Hz,3´,5´-H),4.35 (1H,s,3-H),4.03 (1H,m,8-H),3.53 (1H,m,5-H),3.31 (1H,m,5-H),3.03 (2H,m,10-H),2.07 (1H,m,7-H),1.78 (2H,m,6-H),1.20 (1H,m,7-H);
13C-NMR (150 MHz ,MeOD) δ:170.77 (C-1),166.94 (C-4),157.67 (C-4´),132.12 (C-2´,6´),127.61 (C-1´),116.17 (C-3´,5´),60.04 (C-8),57.89 (C-3),45.91 (C-5),37.65 (C-10),29.39 (C-7),22.71 (C-6)。化合物为白色粉末,从质谱 图上可以看出该化合物的相对分子质量为260; 从碳谱上看,该化合物有14 个碳原子,推测其 分子式为C14H16N2O3。
由1H-NMR 谱图中的δ:7.02 (2H,d ,J=8.10 Hz),7.02 (2H,d,J=8.16 Hz),并通过 1H-1HCOSY 谱图知其相互耦合,判断该化合物 存在一个1,4 取代的苯环结构。另外,由13C-NMR 谱图中的δ:170.77 和δ:166.94 可判断该化合物 还存在2 个羰基。由1H-1HCOSY 图谱可知H-3 和H-10 相关,H-8 和H-7 相关,H-5 和H-6 相 关,H-6 和H-7 相关,再由HMBC 谱图和HMQC 谱图可知,H-2´,6´/C-2´,6´,H-2´,6´/C-10,H-2´,6´/C-3´,5´,H-2´,6´/C-4´,H-3´,5´/C-3´,5´,H-3´,5´/C-1´,H-3´,5´/C-4´,H-3/C-3,H-3/C-10,H-3/C-1´,H-3/C-4,H-8/C-8,H-8/C-7,H-8/C-1 ,H-5/C-5 ,H-5/C-6 ,H-5/C-7 ,H-,10/C-10 ,H-10/C-1´ ,H-10/C-3 ,H-10/C-4 ,H-7/C-7,H-7/C-6,H-7/C-5,H-7/C-8,H-7/C-1,H-6/C-6,H-6/C-7,H-6/C-5,H-6/C-8,综上,判断该化合物为3-(4-hydroxybenzyl) hexahydropyrrolo-[1,2-a]pyrazine-1,4-dione。将该 化合物的核磁数据与文献[28]比较,确定该化合 物结构如下:
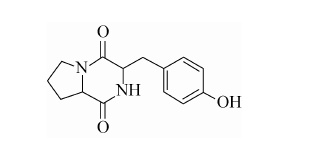
|
对从中国南海西沙群岛10 m 深海水中采集 得到1 株未鉴定海绵样品进行共附生微生物分 离,得到1 株对金黄色葡萄球菌等具有抑菌活 性的菌株Dermacoccus sp. X4,对该菌株的次级 代谢产物进行初步分离,得到了6 个单一化合 物,对其中3 个化合物的结构进行了解析。结 果表明,这3 个化合物分别为: 1) 3-hydroperoxy-1H-indole;2) 3-吲哚乙酸甘油酯; 3) 3-(4-hydr-oxybenzyl) hexahydropyrrolo [1,2-a]pyrazine-1,4-dione。其中化合物1) 和2) 为首次从微生物代谢产物中分离鉴定。由于本 次研究中获得的这3 个化合物的纯品质量分别 为2.0 mg、1.1 mg 及14.6 mg,质量较小,所以 未对纯品化合物的抗菌活性进行测定。但根据 文献调研的结果,Golubev 和Suvorov 对化合物 1) 及2) 进行了合成,发现其具有抗结核分支 杆菌活性和促进植物生长活性,并且作用于中 枢神经系统[26-27],但是由于化学合成成本高且 步骤繁琐,限制了其应用开发。对化合物3) 的 研究,有诸多抗菌、抗肿瘤及免疫活性的报 道[28-30]。该研究为这3 种活性化合物的制备提 供了新的技术途径,也进一步表明海洋微生物 是获取活性化合物的重要资源。
| [1] | Bergmann W, Feeney RJ. Contributions to the study of marine products. XXXII. The nucleosides of sponges. J Org Chem, 1951, 16 (6) : 981–987 (in Chinese). |
| [2] | Bergmann W, Feeney RJ. The isolation of a new thymine pentoside from sponges. J Am Chem Soc, 1950, 72 (6) : 2809–2810 (in Chinese). |
| [3] | Hu YW, Chen JH, Hu GP, et al. Statistical research on the natural products discovered during the 28 years from 1985 to 2012. J Nat Prod, 2012, 75 (3) : 311–335 (in Chinese). |
| [4] | Blunt JW, Copp BR, Keyzers RA, et al. Marine natural products. Nat Prod Rep, 2014, 31 (2) : 160–258 (in Chinese). |
| [5] | Wang GY. Diversity and biotechnological potential of the sponge-associated microbial consortia. J Ind Microbiol Biotechnol, 2006, 33 (7) : 545–551 (in Chinese). |
| [6] | Ahn YB, Rhee SK, Fennell DE, et al. Reductive dehalogenation of brominated phenolic compounds by microorganisms associated with the marine sponge Aplysina aerophoba. Appl Environ Microbiol, 2003, 69 (7) : 4159–4166 (in Chinese). |
| [7] |
Sun JZ. Studies on five south China sea sponges: chemistry and bioactivities[D]. Ji’nan: Shandong University, 2010(in Chinese). 孙继政. 五种中国南海海绵的化学成分及生物活 性研究[D]. 济南: 山东大学, 2010. |
| [8] |
Zhu H. Studies on the metabolites of the fungi associated with the marine sponge Gelliodes carnosa[D]. Beijing: Chinese Academy of Medical Sciences & Peking Union Medical College Hospital, 2013(in Chinese). 朱虹. 丰肉结海绵相关真菌次级代谢产物研究 [D]. 北京: 中国医学科学院&北京协和医院, 2013. 朱虹. 丰肉结海绵相关真菌次级代谢产物研究 [D]. 北京: 中国医学科学院&北京协和医院, 2013. |
| [9] | De Rosa S, Mitova M, Tommonaro G. Marine bacteria associated with sponge as source of cyclic peptides. Biomol Eng, 2003, 20 (4/6) : 311–316 (in Chinese). |
| [10] | He HY, Ding WD, Bernan VS, et al. Lomaiviticins A and B, potent antitumor antibiotics from Micromonospora lomaivitiensis. J Am Chem Soc, 2001, 123 (22) : 5362–5363 (in Chinese). |
| [11] | Bugni TS, Janso JE, Williamson RT, et al. Dictyosphaeric acids A and B: new decalactones from an undescribed Penicillium sp. obtained from the alga Dictyosphaeria versluyii. J Nat Prod, 2004, 67 (8) : 1396–1399 (in Chinese). |
| [12] | Li DL, Li XM, Wang BG. Natural anthraquinone derivatives from a marine mangrove plant-derived endophytic fungus Eurotium rubrum: structural elucidation and DPPH radical scavenging activity. J Microbiol Biotechnol, 2009, 19 (7) : 675–680 (in Chinese). |
| [13] | Zheng CJ, Shao CL, Guo ZY, et al. Bioactive hydroanthraquinones and anthraquinone dimers from a soft coral-derived Alternaria sp. fungus. J Nat Prod, 2012, 75 (2) : 189–197 (in Chinese). |
| [14] | Mehbub MF, Lei J, Franco C, et al. Marinesponge derived natural products between 2001 and 2010: trends and opportunities for discovery of bioactives. Mar Drugs, 2014, 12 (8) : 4539–4577 (in Chinese). |
| [15] | Blunt JW, Copp BR, Hu WP, et al. Marine natural products. Nat Prod Rep, 2009, 26 (2) : 170–244 (in Chinese). |
| [16] | Zhang W, Guo YW, Gu YC. Secondary metabolites from the South China Sea invertebrates: chemistry and biological activity. Curr Med Chem, 2006, 13 (17) : 2041–2090 (in Chinese). |
| [17] | Jadulco R, Brauers G, Edrada RA, et al. New metabolites from sponge-derived fungi Curvularia lunata and Cladosporium herbarum. J Nat Prod, 2002, 65 (5) : 730–733 (in Chinese). |
| [18] | Wang CY, Wang BG, Brauers G, et al. Microsphaerones A and B, two novel γ-pyrone derivatives from the sponge-derived fungus Microsphaeropsis sp. J Nat Prod, 2002, 65 (5) : 772–775 (in Chinese). |
| [19] | Edrada RA, Heubes M, Brauers G, et al. Online analysis of xestodecalactones A-C, novel bioactive metabolites from the fungus Penicillium cf. montanense and their subsequent isolation from the sponge Xestospongia exigua. J Nat Prod, 2002, 65 (11) : 1598–1604 (in Chinese). |
| [20] | Mapperson RR, Kotiw M, Davis RA, et al. The diversity and antimicrobial activity of Preussia sp. endophytes isolated from Australian dry rainforests. Curr Microbiol, 2014, 68 (1) : 30–37 (in Chinese). |
| [21] | Wright AE, McCarthy PJ, Schulte GK. Sulfircin: a new sesterterpene sulfate from a deep-water sponge of the genus Ircinia. J Org Chem, 1989, 54 (14) : 3472–3474 (in Chinese). |
| [22] | Sun LL, Shao CL, Chen JF, et al. New bisabolane sesquiterpenoids from a marine-derived fungus Aspergillus sp. isolated from the sponge Xestospongia testudinaria. Bioorg Med Chem Lett, 2012, 22 (3) : 1326–1329 (in Chinese). |
| [23] |
Hu SC. Isolation and screening of marine microorganisms with cytotoxicity and studies on the secondary metabolites[D]. Nanjing: Huazhong Agricultural University, 2005(in Chinese). 胡申才. 具细胞毒活性海洋微生物的分离筛选及 次级代谢物研究[D]. 南京: 华中农业大学, 2005. |
| [24] | Shahina M, Hameed A, Lin SY, et al. Sphingomicrobium astaxanthinifaciens sp. nov., an astaxanthin-producing glycolipid-rich bacterium isolated from surface seawater and emended description of the genus Sphingomicrobium. Int J Syst Evol Microbiol, 2013, 63 (Pt9) : 3415–3422 (in Chinese). |
| [25] |
Sui X, Feng FJ, Lou X, et al. Total DNA extraction from soil microorganisms and construction of ITS-PCR system for soil fungi.
China Brewing, 2011,
(9)
: 166–168
(in Chinese).
隋心, 冯富娟, 娄鑫, 等. 土壤微生物总DNA 的 提取以及土壤真菌ITS-PCR 体系的建立. 中国酿 造,2011, (9) :166–168. |
| [26] | Suvorov NN, Golubev VE. Indole derivatives. XXXVII. Synthesis of glycerides of indole-3- alkanoic acids and O-(indol-3-ylalkyl) glycerols. Khimiko-Farmatsevticheskii Zhurnal, 1967, 1 (8) : 13–18 (in Chinese). |
| [27] | Golubev VE, Suvorov NN. Indole derivatives. Indole derivatives. XXVI. Synthesis of monoglycerides of indole-3- carboxylic acids. Khim Geterotsikl Soedin, Sb. 1: Azotsoderzhashchie Geterotsikly, 1967 : 21–24 (in Chinese). |
| [28] | Li CS, An CY, Li XM, et al. Triazole and dihydroimidazole alkaloids from the marine sediment-derived fungus Penicillium paneum SD-44. J Nat Prod, 2011, 74 (5) : 1331–1334 (in Chinese). |
| [29] | Kilian G, Jamie H, Brauns SC, et al. Biological activity of selected Tyrosine-containing 2,5-diketopiperazines. Pharmazie, 2005, 60 (4) : 305–309 (in Chinese). |
| [30] | Kimura Y, Sawada A, Kuramata M, et al. Brevicompanine C, Cyclo-(D-Ile-L-Trp), and cyclo-(D-Leu-L-Trp), plant growth regulators from Penicillium brevi-compactum. J Nat Prod, 2005, 68 (2) : 237–239 (in Chinese). |
 2016, Vol. 32
2016, Vol. 32