服务
文章信息
- 梁航华, 高洪燕, 徐曼, 谭鹏, 崔红娟
- Hanghua Liang, Hongyan Gao, Man Xu, Peng Tan, and Hongjuan Cui
- 家蚕BmBrat 基因的克隆与鉴定
- Cloning and characterization of BmBrat in silkworm, Bombyx mori
- 生物工程学报, 2016, 32(3): 375-384
- Chin J Biotech, 2016, 32(3): 375-384
- 10.13345/j.cjb.150330
-
文章历史
- Received: July 17, 2015
- Accepted: November 14, 2015
NHL家族的名字源于发现的3个成员:NCL-1、HT2A和LIN-41,这3个因子与RNA代谢有关系,可能参与转录后基因的表达调控[1]。研究表明,NHL家族的成员均含有3个保守的基序:1个RING、1个或是2个B-box和1个coiled-coil [2]。在调节Brat (Brain tumor) 蛋白的活性中NHL结构起了至关重要的作用[3]。Brat本身是一类肿瘤抑制基因,但同时也是一个控制细胞增殖的候选基因,属于NHL蛋白家族的成员[4]。在果蝇神经系统中,Brat的表达在很大程度上限制了胚胎时期周围神经系统、腹神经索和脑的发育[5]。在干细胞发生系统中,Brat与Prospero、Numb等作为细胞命运决定因子,促进细胞命运的变化[6]。Numb是一种膜结合蛋白,参与Notch 信号通路的调控[7]。在神经前体细胞分裂期间,Numb聚集到细胞的一端,与细胞膜结合形成新月板,细胞分裂期间通过不对称分裂进入神经节母细胞中,Numb蛋白结合α-泛素介导蛋白质活性调节因子Sanpodo抑制Notch蛋白[8-9]。Notch 信号通路在神经母细胞的增殖分化过程中起着至关重要的作用。Notch信号通路受到抑制可以使细胞从自我更新逐渐开始分化分裂[10]。而Prospero是转录调节蛋白,在胚胎和幼虫的神经母细胞中均存在,最终在分化的胶质细胞中持续表达[11],在决定细胞命运和细胞增殖调控中Prospero作为Brat下游的一个调控因子起着关键的作用。研究Brat在细胞分化和增殖中的作用,能为干细胞的分化提供理论依据。在人与哺乳动物中brat的同源蛋白是TRIM蛋白家族,它们在发育、分化和宿主细胞的抗病毒防御以及癌症中都起到作用。TRIM家族是NHL结构域的一个亚群,该亚群包含哺乳动物的TRIM2、TRIM3、TRIM32和TRIM71等,包括果蝇中的Brat、Mei-p26、Abba和Wech,以及秀丽隐杆线虫中的Ncl-1、Nhl-1、Nhl-1、Nhl-3和Lin41[12],其中TRIM3是一个肿瘤抑制因子,能结合到cdk抑制因子p21WAF1/CIP1,通过隔绝p21并阻止它积累Cyclin D1-CDK4抑制癌症的发生[13-14]。在小鼠中降低TRIM3的表达将增加并加速血小板生长因子 (PDGF,platelet-derived growth factor) 引起的神经胶质瘤发生率[15]。
家蚕是我国重要的经济昆虫,同时也越来越多地作为无脊椎模式动物进行研究。目前家蚕BmBrat基因未见报道,本研究利用RACE技术获得BmBrat基因全长,通过诱导大肠杆菌原核表达获得重组蛋白进而制备抗体,为更深入研究Brat基因在细胞增殖分化与个体发育中的作用奠定了基础。
1 材料与方法 1.1 材料实验所用家蚕品种为大造,由西南大学家蚕基因库提供。蚕卵在25 ℃相对湿度60%-80%下催青,孵化后幼虫在25 ℃下桑叶饲育。感受态细胞购自全式金公司。质粒提取试剂盒购自Omega公司。胶回收试剂盒购自Axygen公司。Trizol试剂和RACE试剂盒购自Invitrogen公司。PMD19-T simple载体、限制性内切酶、Taq酶和T4 DNA连接酶均购自TaKaRa公司。反转录试剂购自Promega公司。引物由北京六合华大基因科技股份有限公司合成。多聚甲醛为上海生工生物工程公司产品。DAPI和抗荧光猝灭剂为碧云天生物技术公司产品。
1.2 方法 1.2.1 总RNA的提取和cDNA的合成取各发育时期的蚕卵和5龄3 d幼虫的头、体壁、血液、中肠、精巢、卵巢、马氏管、脂肪体等组织器官,除血液直接加入Trizol外,其他组织经液氮研磨后加入Trizol,按照Invitrogen公司Total RNA操作指南提取总RNA。利用琼脂糖电泳和紫外分光光度计分别检测RNA产物的完整性、纯度和浓度。使用DNA酶在37 ℃消化30 min后,依照反转录试剂盒说明书反转录获得cDNA。
1.2.2 RACE法扩增全长序列设计基因特异RACE引物GSP1、NGSP1、GSP2、NGSP2,引物序列见表 1。随后按照 RACE试剂盒进行5′RACE和3′RACE扩增。扩增产物经1%琼脂糖电泳后,回收目的条带,连接到PMD19-T simple载体上,转化后提取阳性克隆,测序后进行拼接,获得BmBrat基因全长cDNA序列。
| Primer names | Primer sequences (5´-3´) |
| GSP1 | GTGTCTTGGGCAGAATGCGGTTTT |
| NGSP1 | GCCGGTGCAACGAGCCAAGGGAGA |
| GSP2 | TCCCTTGGCTCGTTGCACCGGCTG |
| NGSP2 | GCCCTGACAGTGGTTGGACAAAAG |
| BmBrat -F BmBrat -R | GGTGCCAACTCAATAGGT AATGGCGAAGTAGACTGG |
| Bmbrat-P2-EcoR1-F | CCGGAATTCCAAGTTCAGTATCACAAGGCA |
| Bmbrat-P2-Xho1-R | CCGCTCGAGAAGCAGTCAGTGAGTATGGG |
拼接得到的序列在ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)网站进行ORF预测以及氨基酸序列翻译。使用Swiss-model (http://swissmodel.expasy.org),SMART (http://smart.embl-heidelberg.de/),SignalP 4.1 Serve (http://www.cbs.dtu.dk/services/SignalP/),TMHMM Server v. 2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/),ExPasy (http://www.expasy.org/tools/)等在线软件预测蛋白结构域、分子量和等电点等信息。
1.2.4 表达谱分析分别以家蚕5龄3 d各组织及胚胎各发育时期cDNA为模板对BmBrat进行半定量PCR 检测,检测引物为BmBrat (引物序列见表 1),以肌动蛋白3 (BmActin3) 为内参[16]。PCR总反应体系为25 µL:10×PCR缓冲液2.5 µL,2.5 mmol/L dNTPs 2 μL,10 µmol/L上、下游引物各0.5 µL,HiFi-Taq酶0.2 µL,模板1 µL,加灭菌的双蒸水至总体积为25 µL。反应条件为:94 ℃预变性4 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸90 s,共28个循环;72 ℃延伸10 min;4 ℃保存。扩增产物经1%琼脂糖电泳,EB 染色,Bio-Rad凝胶成像系统成像进行分析。
1.2.5 原核表达、蛋白纯化及抗体制备用软件预测BmBrat的抗原特异性,截取部分片段设计引物Bmbrat-P2 (引物序列见表 1),将扩增产物连接到pET-32a载体上,获得pET32a-BmBrat重组质粒。将重组质粒pET32a- BmBrat转化到Rosetta感受态细胞,获得单菌落并扩大培养,分别用0.6 mmol/L IPTG在15 ℃诱导12 h及37 ℃ 6 h后,收集菌液,超声裂解离心分离上清和沉淀,然后进行SDS-PAGE检测目的蛋白。考马斯亮蓝染色分析蛋白在上清和沉淀中的表达情况,最终选择37 ℃大规模诱导。振荡培养至OD600=0.6,用0.6 mmol/L IPTG 37 ℃诱导表达6 h后,收集菌体,用PBS重悬,裂解后超声破碎收集沉淀,尿素溶解后用0.45 µm滤膜抽滤进行Ni离子亲和柱纯化,使用不同咪唑浓度的洗脱液进行梯度洗脱,收集洗脱液后用SDS-PAGE分析蛋白纯化情况。注射重组蛋白前利用谷胱甘肽稀释还原法对其进行复性,加PBS将蛋白浓度稀释至0.5 mg/mL,加入氧化型谷胱甘肽 (GSH) 至终浓度为2 mmol/L,同时加入还原性谷胱甘肽 (GSSG) 至终浓度为10 mmol/L,4 ℃复性过夜,PBS透析,PEG2000浓缩[17]。使用纯化复性好的重组蛋白注射健康的成年雄性昆明小鼠3只,每只小鼠注射前剪尾尖取血,收集约50 µL正常血清,作为阴性对照,室温静置后离心收集上清,上清与甘油以1∶1的比例混合后于-80 ℃保存。小鼠进行免疫时每只腹腔注射5次蛋白,第一次与弗式完全佐剂等体积混合,后4次均与弗式不完全佐剂等体积混合,所用蛋白量依次为50、70、90、110和120 µg,前3次间隔10 d进行免疫,后2次间隔14 d免疫,最后1次免疫1周后,摘眼球取血,室温静置2 h,3 000 r/min离心10 min将血清取出,加入0.02%的NaN3后,-80 ℃中保存。
1.2.6 BmBrat抗体特异性检测将原核表达并纯化得到的重组蛋白作为样品,进行Western blotting检测免疫血清的特异性。蛋白经SDS-PAGE电泳及转膜后,于5%的牛奶封闭液中,室温缓慢摇荡封闭2 h。分别将免疫血清和免疫前血清以1∶1 000稀释后于4 ℃孵育过夜。之后将膜用TBST洗3次,每次15 min,用1×TBST 稀释二抗 (1∶5 000),将PVDF膜浸没于二抗液中,室温缓慢摇荡2 h。再次用TBST洗3次,每次10 min,用ECL显色液进行显色及用成像仪进行曝光。家蚕胚胎细胞系BME-SWU3铺到有爬片的24孔板中,爬片过夜。使用4%多聚甲醛固定15 min,0.5% Triton-100打孔15 min。室温条件下用10%山羊血清封闭2 h后分别用免疫前血清和抗BmBrat的免疫血清,4 ℃孵育过夜。孵育完二抗漂洗后DAPI染色,使用抗荧光猝灭剂封片,在荧光显微镜下观察检测。
1.2.7 血细胞定位BmBrat将家蚕血细胞用4%多聚甲醛固定30 min,加入1% Triton-100静置10 min后PBS漂洗。用10%山羊血清封闭液室温封闭2 h,之后分别用免疫前血清和抗BmBrat的免疫血清4 ℃孵育过夜。孵育完二抗漂洗后DAPI染色,使用抗荧光猝灭剂封片,在荧光显微镜下观察检测。
2 结果 2.1 家蚕BmBrat基因全长克隆与分析从NCBI下载不同物种的Brat基因序列,并在家蚕基因组数据库进行Blast分析以确定家蚕同源基因。以家蚕5龄3 d的头部cDNA为模板进行PCR扩增。通过RACE技术,得到了3′端的序列和5′端的序列,连接到pMD19T- simple载体测序,拼接后获得了3 614 bp全长序列,包括239 bp的5′UTR和795 bp的3′UTR,预测得到其ORF为2 580 bp,编码859个氨基酸残基,蛋白分子量为94.3 kDa,等电点为6.65 (图 1A-1C)。通过在线预测软件进行结构域分析,家蚕的Brat蛋白质序列中存在1个保守的RING结构域,2个B-BOX结构域、1个保守的BBC结构域和3个连续的NHL结构域 (图 1C)。利用SignalP 4.1 Server预测,发现在N端区域没有信号肽 (图 1D)。

|
| 图1 BmBrat 全长克隆及信息分析 Figure1 Cloning and bioinformatic analysis of BmBrat. (A) Full-length cDNA was cloned by RACE method. (B) Diagram of BmGATA6 complete cDNA sequence was analyzed. (C) Analysis of BmGATA6 protein domain and amino acid sequence was presented. (D) BmBrat protein signal peptide was predicted. |
| |
分别以等量的家蚕胚胎期1-9 d和幼虫5龄3 d (L5D3) 各组织的cDNA为模板,以肌动蛋白3 (Actin3) 为内参进行半定量PCR检测该BmBrat基因的表达情况。结果显示BmBrat在胚胎4 d、5 d的时候高量表达,之后其表达量开始逐步下降 (图 2B);而在L5D3幼虫各组织中均有表达,其中卵巢和头表达量最高,其次是丝腺、中肠、精巢和脂肪体,马氏管和表皮中BmBrat表达量相对较低 (图 2A)。

|
| 图2 BmBrat 在5 龄3 d 各组织 (A) 以及胚胎发育时期 (B) 表达谱检测 Figure2 Expression profile of BmBrat was detected. (A) Expression of BmBrat in different tissues at L5D3 was showed. (B) Expression of BmBrat at embryonic period from Day 1 to Day 9 was analyzed. |
| |
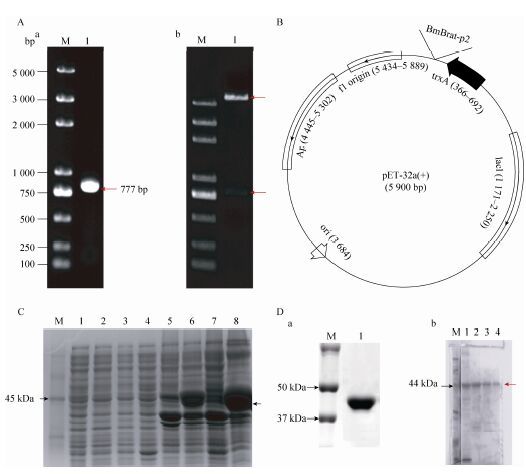
PCR扩增得到777 bp的片段用于构建原核表达载体 (图 3A-a),结构如图 3B所示。将载体经EcoRⅠ和XhoⅠ双酶切验证,有777 bp的片段出现 (图 3A-b),与预期结果相符,表明已成功构建重组表达质粒pET32a-BmBrat。在37 ℃和15 ℃温度下诱导表达重组蛋白,SDS-PAGE电泳检测发现BmBrat重组蛋白都属于包涵体,且在37 ℃诱导条件下,重组蛋白的表达量要比15 ℃条件下产生的多 (图 3C),于是后续采用37 ℃的条件下进行BmBrat重组蛋白大量诱导。根据重组蛋白上的6×His标签进行Western blotting检测,证明其确实为目的蛋白 (图 3D-a)。经不同浓度的咪唑洗脱液进行梯度洗脱后,对流出液进行SDS-PAGE分析 (图 3D-b),结果表明200 mmol/L与500 mmol/L咪唑洗脱液中只有目的蛋白大小的单一条带,而没有其他杂带,满足后续实验要求。
|
| 图3 重组蛋白pET32a-BmBrat 的诱导表达与纯化 Figure3 Induction and purification of recombinant protein pET32a-Bmbrat. (A) Construction of the BmBrat prokaryotic expression vector. (a) M: DNA marker; 1: PCR products. (b) M: DNA marker; 1: pET32a-BmBrat plasmid digested with EcoRⅠ and XhoⅠ . (B) Structure of BmBrat prokaryotic expression vector. (C) The recombinant Bmbrat protein was induced with IPTG at 15 ℃ or 37 ℃. M: protein marker; 1,5: the induction of BmBrat with 0 mmol/L IPTG at 15 ℃ in supernatant and cell pellet respectively; 2,6: the induction of BmBrat with 0.6 mmol/L IPTG at 15 ℃ in supernatant and cell pellet respectively; 3,7: the induction of BmBrat with 0 mmol/L IPTG at 37 ℃ in supernatant and cell pellet respectively; 4,8: the induction of BmBrat with 0.6 mmol/L IPTG at 37 ℃ in supernatant and cell pellet respectively. (D) a) Detection of recombinant BmBrat protein by His tag antibody. b) Purification of the BmBrat recombinant protein. M: protein marker; 1: 100 mmol/L imidazole; 2: 120 mmol/L imidazole; 3: 200 mmol/L imidazole; 4: 500 mmol/L imidazole. |
| |
在完成5次免疫后,通过摘除小鼠眼球的方法,获取免疫血清。使用重组蛋白通过Western blotting分析免疫血清的特异性。结果显示,BmBrat免疫血清能特异性地识别大肠杆菌诱导产生的重组BmBrat蛋白 (图 4B)。随后又以小鼠免疫前的正常血清作为对照,利用免疫血清对家蚕细胞系BME-SWU3进行免疫荧光检测。对照组中无荧光信号,但是实验组细胞中可以检测到BmBrat蛋白的表达 (图 4A)。以上结果说明我们所制备的BmBrat抗体可以特异性识别BmBrat蛋白,可为后续研究BmBrat基因的功能提供抗体支持。

|
| 图4 抗BmBrat 血清检测 Figure4 Detection of anti-BmBrat serum. (A) BmBrat protein in silkworm cell line BME-SWU3 was detected by Immunofluorescence with anti-BmBrat serum and negative control. (B) Recombinant BmBrat protein was detected by Western blotting with anti-BmBrat serum. M: protein marker; 1: the purified recombinant BmBrat protein. |
| |
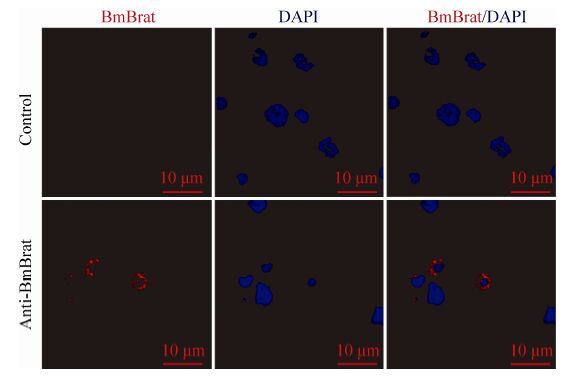
前面的实验结果显示BmBrat在家蚕细胞系中有表达,为了进一步了解BmBrat的表达情况及其可能发挥的作用,我们对其在家蚕血细胞中的定位进行了分析。免疫荧光结果显示,与使用阴性血清的对照组相比,实验组中可以明显检测到荧光信号,即家蚕血细胞中有BmBrat蛋白的表达,并且该蛋白只表达于部分血细胞的细胞质中 (图 5)。
|
| 图5 Bmbrat 蛋白在家蚕血细胞中定位分析 Figure5 Subcellular localization of BmBrat protein was analyzed in hemocytes with immunofluorescence staining. |
| |
本实验首先通过在NCBI和家蚕数据库中检索,获得家蚕中Brat同源基因BmBrat。利用RACE技术得到该基因的全长。通过信息学分析,发现该基因编码的蛋白有4个相对保守的结构域,从N端到C端分别是1个RING、2个B-Box和1个BBC结构域,具有典型的NHL结构域,暗示其可能在细胞的增殖分化中发挥功能[2]。对BmBrat在家蚕胚胎时期的表达谱分析中发现,该基因表达量在第4、5天达到高峰,之后逐天下降。蚕卵的催青期约需10 d,其间胚胎发育时期依次分为最长期、肥厚期、突起发生期、突起发达前期、突起发达后期、缩短期、反转期、反转终了期、气管显现期、点青期、转青期,之后便孵化收蚁[18]。其中前6天即到反转期属于胚胎的器官形成时期,而4、5 d时处于突起发达期和缩短期,是器官形成的高峰,这一时期该基因高表达,到了第6天后器官发育基本完成,这时该基因的表达也出现了显著下降。这表明BmBrat与家蚕胚胎发育过程中器官形成有关。而5龄3 d幼虫各组织表达谱分析发现,该基因在各组织中均有明显表达,且在生殖腺和头部表达量最高,这表示BmBrat在家蚕各组织的发育与生长中具有一定的功能。研究表明,在果蝇中Brat在正在分化的生殖细胞中有多种功能。已知生殖干细胞的维持是受Dpp信号途径[19]和翻译抑制因子Nanos (Nos)/Pumilio (Pum) 所调控的[20]。在卵巢中,Pum-Nos调节Brat的mRNA水平,限制其在包囊干细胞中的表达[21]。增大Dpp信号,能够促进Pum-Nos对Brat mRNA生成的抑制作用[22]。在分裂过程中,Dpp信号途径沉默,Dpp信号的减少使Nos下调,从而促进Brat的表达,与Pum形成新的复合物抑制了Dpp信号途径中的Mad和dMyc mRNAs,降低了包囊干细胞对Dpp信号的反应能力,促进细胞分化[23],使这个子细胞变成分化的包囊干细胞,另一个子细胞继续接受Dpp自我更新的信号[24]。家蚕BmBrat是否具有类似功能还有待进一步研究。另外,利用我们自制的BmBrat抗体在家蚕血细胞中对BmBrat蛋白进行亚细胞定位,发现该蛋白只存在于部分血细胞中,且只在细胞质中表达。家蚕血细胞有原血球细胞 (Prohemocyte)、小球细胞 (Spherule cell)、拟绛色细胞 (Oenocytoid)、颗粒细胞 (Granular cell) 和浆细胞 (Plasmatocyte) 5类[25],BmBrat只在部分细胞中表达,其是否与血细胞的分化有关也值得进一步研究。后续我们将利用不同种类血细胞的特异性分子标记,探索该蛋白具体存在于哪一类或几类血细胞中,有助于更好地揭示其功能。综上所述,BmBrat作为一个新基因至今鲜有报道,功能尚不清楚,猜测其与细胞增殖分化相关。本研究成功制备了BmBrat多克隆抗体,为后续实验提供了抗体工具。
| [1] | Loedige I, Filipowicz W. TRIM-NHL proteins take on miRNA regulation. Cell, 2009, 136 (5) : 818–820 (in Chinese). |
| [2] | Petrera F, Meroni G. TRIM proteins in development. Adv Exp Med Biol, 2012 : 131–141 (in Chinese). |
| [3] | Marchetti G, Reichardt I, Knoblich JA, et al. The TRIM-NHL protein Brat promotes axon maintenance by repressing src64B expression. J Neurosci, 2014, 34 (41) : 13855–13864 (in Chinese). |
| [4] | Loedige I, Stotz M, Qamar S, et al. The NHL domain of BRAT is an RNA-binding domain that directly contacts the hunchback mRNA for regulation. Genes Dev, 2014, 28 (7) : 749–764 (in Chinese). |
| [5] | Sonoda J, Wharton RP. Drosophila Brain Tumor is a translational repressor. Genes Dev, 2001, 15 (6) : 762–773 (in Chinese). |
| [6] | Lee CY, Wilkinson BD, Siegrist SE, et al. Brat is a Miranda cargo protein that promotes neuronal differentiation and inhibits neuroblast self-renewal. Dev Cell, 2006, 10 (4) : 441–449 (in Chinese). |
| [7] | Cotton M, Benhra N, Le Borgne R. Numb inhibits the recycling of Sanpodo in Drosophila sensory organ precursor. Curr Biol, 2013, 23 (7) : 581–587 (in Chinese). |
| [8] | Hutterer A, Knoblich JA. Numb and α-Adaptin regulate Sanpodo endocytosis to specify cell fate in Drosophila external sensory organs. EMBO Rep, 2005, 6 (9) : 836–842 (in Chinese). |
| [9] | Berdnik D, Török T, González-Gaitán M, et al. The endocytic protein α-Adaptin is required for numb-mediated asymmetric cell division in Drosophila. Dev Cell, 2002, 3 (2) : 221–231 (in Chinese). |
| [10] | Wang W, Liu WK, Wang Y, et al. Notch signaling regulates neuroepithelial stem cell maintenance and neuroblast formation in Drosophila optic lobe development. Dev Biol, 2011, 350 (2) : 414–428 (in Chinese). |
| [11] | Reichert H. Drosophila neural stem cells: cell cycle control of self-renewal,differentiation,and termination in brain development. Results Probl Cell Differ, 2011 : 529–546 (in Chinese). |
| [12] | Sardiello M, Cairo S, Fontanella B, et al. Genomic analysis of the TRIM family reveals two groups of genes with distinct evolutionary properties. BMC Evol Biol, 2008, 8 (1) : 225 (in Chinese). |
| [13] | Liu Y, Raheja R, Yeh N, et al. TRIM3,a tumor suppressor linked to regulation of p21Waf1/Cip1. Oncogene, 2014, 33 (3) : 308–315 (in Chinese). |
| [14] | Boulay JL, Stiefel U, Taylor E, et al. Loss of heterozygosity of TRIM3 in malignant gliomas. BMC Cancer, 2009, 9 (1) : 71 (in Chinese). |
| [15] | Chen G, Kong J, Tucker-Burden C, et al. Human Brat ortholog TRIM3 is a tumor suppressor that regulates asymmetric cell division in glioblastoma. Cancer Res, 2014, 74 (16) : 4536–4548 (in Chinese). |
| [16] | Cheng DJ, Qian WL, Meng M, et al. Identification and expression profiling of the BTB domain-containing protein gene family in the silkworm,Bombyx mori. Int J Genomics, 2014 : 865065 (in Chinese). |
| [17] |
Luo HX, Li M, Wang YJ. Refolding of inclusion body.
Biotechno Bull, 2007,
(5)
: 96–98
(in Chinese).
罗惠霞, 李敏, 王玉炯. 包涵体蛋白复性的几种方法. 生物技术通报,2007, (5) :96–98. |
| [18] |
Zhejiang Agricultural University.
Sericultural Science.2nd Ed. Beijing: China Agriculture Press, 1981 : 55 -60(in Chinese).
浙江农业大学. 养蚕学.2版. 北京: 中国农业出版社, 1981 : 55 -60. |
| [19] | Xie T, Spradling AC. Decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary. Cell, 1998, 94 (2) : 251–260 (in Chinese). |
| [20] | Forbes A, Lehmann R. Nanos and Pumilio have critical roles in the development and function of Drosophila germline stem cells. Development, 1998, 125 (4) : 679–690 (in Chinese). |
| [21] | Muraro N I, Weston AJ, Gerber AP, et al. Pumilio binds para mRNA and requires Nanos and Brat to regulate sodium current in Drosophila motoneurons. J Neurosci, 2008, 28 (9) : 2099–2109 (in Chinese). |
| [22] | Li Y, Minor NT, Park JK, et al. Bam and Bgcn antagonize Nanos-dependent germ-line stem cell maintenance. Proc Natl Acad Sci U S A, 2009, 106 (23) : 9304–9309 (in Chinese). |
| [23] | Harris E, Pargett M, Sutcliffe C, et al. Brat promotes stem cell differentiation via control of a bistable switch that restricts BMP signaling. Dev Cell, 2011, 20 (1) : 72–83 (in Chinese). |
| [24] | Ohlstein B, Mckearin D. Ectopic expression of the Drosophila Bam protein eliminates oogenic germline stem cells. Development, 1997, 124 (18) : 3651–3662 (in Chinese). |
| [25] | Beaulaton J. Hemocytes and hemocytopoiesis in silkworms. Biochimie, 1979, 61 (2) : 157–164 (in Chinese). |
 2016, Vol. 32
2016, Vol. 32




