服务
文章信息
- 林樟楠, 刘宏娟, 张建安, 王革华
- Zhangnan Lin, Hongjuan Liu, Jian’an Zhang, Gehua Wang
- 耐乙酸粘红酵母合成油脂
- Lipid synthesis by an acidic acid tolerant Rhodotorula glutinis
- 生物工程学报, 2016, 32(3): 339-346
- Chin J Biotech, 2016, 32(3): 339-346
- 10.13345/j.cjb.150318
-
文章历史
- Received: June 10, 2015
- Accepted: October 13, 2015
在全球经济高速发展的今天,能源需求缺口日益增大,常规能源的开发近乎饱和,寻求新型可再生能源迫在眉睫。生物柴油作为一种生物能源,因其环境友好且可以可再生资源为原料而受到了人们的广泛关注。目前工业上生产生物柴油的原料主要为动植物油脂和废弃油脂。以动植物油脂为原料成本较高;以废弃油脂为原料虽然成本较低,但很难大量回收,难以实现大规模生产。
微生物油脂是一种单细胞油脂,由微生物发酵产生[1]。其成分与植物油类似,经转酯化反应生成生物柴油[2, 3, 4, 5, 6]。由于微生物具有生长繁殖快、生长周期短和不受季节影响等优点,近年来受到研究者的广泛关注。一些产油微生物可以利用廉价废弃物中的单糖作为生产微生物油脂的原料,既能有效处理一些工农业废弃物,又能大大降低生产微生物油脂的成本。因此以木质纤维素为原料生产微生物油脂成为目前有关微生物油脂研究的热点。
在微生物油脂的生产中,找到廉价而又来源广泛的碳源至关重要。秸秆、甘蔗渣、玉米芯等可水解为单糖的木质纤维素是生产微生物油脂的极佳碳源[7, 8, 9, 10, 11]。但在木质纤维素水解的过程中,也会产生一些有机酸、醛类和酚类物质,其中乙酸为主要的降解产物之一[12]。当外界pH低于乙酸解离常数时,乙酸主要以亲脂性未解离的形式存在,其可通过简单扩散的方式穿过细胞膜进入细胞内,乙酸在细胞质环境中解离造成胞内pH下降,从而抑制细胞的正常生长[13]。乙酸对产油微生物的生长和油脂积累有显著影响[14],研究表明,培养基中乙酸浓度超过5 g/L时,圆红冬孢酵母的细胞生长和油脂合成受到严重抑制,而当乙酸浓度在20 g/L以上时,圆红冬孢酵母几乎无法生长[15]。Huang等研究了乙酸对发酵型丝孢酵母的抑制作用,结果表明乙酸会降低菌体对葡萄糖的摄取速率,同时也影响菌体油脂合成,当乙酸浓度在30 mmol/L (1.8 g/L) 和66.6 mmol/L (4.0 g/L) 时,油脂产量分别下降了25%和50%[16]。
粘红酵母Rhodotorula gutini As2.107,为本实验室保存菌种,具有较高的乙酸耐受性,能够在30 g/L的乙酸液体培养基中生长。本文以粘红酵母As2.107为研究对象,以与玉米芯水解液相同糖浓度配比的培养基进行实验,探讨了粘红酵母对乙酸的耐受性以及乙酸对粘红酵母油脂合成的影响。相关结果可加深对粘红酵母油脂合成代谢机理的认识,并为水解液发酵微生物油脂的工艺优化提供理论依据。
1 材料与方法 1.1 菌种及培养基粘红酵母Rhodotorula gutini As2.107,为本实验室保存菌种。
固体斜面培养基g/L:酵母粉10,蛋白胨20,葡萄糖20,琼脂,pH 5.0。
种子培养基g/L:葡萄糖15,(NH4)2SO4 2,酵母粉1,KH2PO4 7,Na2HPO4 2,MgSO4 1.5,pH 5.5。
发酵培养基g/L:葡萄糖6,木糖44,KNO3 3.8,酵母粉4,KH2PO4 6,Na2HPO4 2,MgSO4 2,CaCl2 0.1,FeCl3 0.07,乙酸0-30,用NaOH调节pH至6.0。
1.2 培养方法将斜面菌株接入种子培养基中,摇瓶装液量为20%,在摇床中以30 ℃、转速180 r/min条件下培养24 h。摇瓶发酵采用500 mL三角瓶,培养基装量100 mL,培养温度30 ℃,转速180 r/min,初始pH为6.0,接种量为10% (V/V) 。
1.3 分析方法 1.3.1 菌体生物量的测定离心收集菌体,用去离子水洗涤两次,60 ℃烘干至恒重,生物量以每升发酵液含干菌体的质量表示。
1.3.2 发酵液成分的测定实验中残糖量及抑制物浓度采用高效液相色谱法 (岛津公司LC-20A) 测定,色谱柱型号Aminex® HPX-87H柱 (Bio-Rad 美国),柱温65 ℃,流动相0.005 mol/L H2SO4,流速为0.8 mL/min,进样量20 μL,葡萄糖、木糖和乙酸用RID-10A 检测器检测。
1.3.3 油脂含量的测定发酵液离心集菌,菌体沉淀按每克湿菌 10 mL的比例加入4 mol/L盐酸,振荡混匀,75 ℃水浴处理2 h,冷却后加入2倍体积氯仿∶甲醇 (1∶1) 提取液,充分振荡混匀后,以5 000 r/min离心5 min,用分液漏斗,取氯仿层,再加入10 mL氯仿,重复前述操作,合并有机相后,蒸馏挥发除去氯仿即得粗油脂[12]。
1.3.4 油脂成分的测定取微生物油脂100 mg,加0.6 mol/L KOH-甲醇溶液2 mL和正己烷2 mL后,剧烈振荡 2 min,在30 ℃放置15 min,加水5 mL,静置分层。取正己烷层利用气相色谱分析脂肪酸成分。气相色谱工作条件:气相色谱仪岛津GC-2010,毛细管气相色谱柱FFAP-CB,FID检测器,程序升温,初始柱温180 ℃,保持0.5 min,然后以10 ℃/min的升温速率升至250 ℃,保持6 min;进样口温度为250 ℃,检测器温度为260 ℃[17]。
2 结果与讨论 2.1 混合糖培养基中乙酸浓度对油脂产量的影响在葡萄糖浓度为6 g/L、木糖浓度为44 g/L的混合糖培养基中添加乙酸,考察粘红酵母对乙酸的耐受性,乙酸的添加量分别为0、4、6、8、10和12 g/L,粘红酵母细胞生长、底物消耗、以及油脂合成情况如图 1所示。在不添加乙酸的混合糖培养基中,发酵进行至86 h结束,油脂产量为1.77 g/L,油脂含量为13.4%。乙酸的添加影响细胞生长,在发酵初期,细胞生长速率均低于对照。当培养基中乙酸的添加量低于10 g/L时,菌体生长和油脂合成随着乙酸浓度的增加而逐渐升高,乙酸添加量为10 g/L时,生物量、油脂产量、油脂含量和得率均达到最高,分别为16.07 g/L、4.80 g/L、29.4%和11%,较对照组分别提高了21.5%、171.2%、121.6%和175%。当乙酸添加量大于10 g/L时,油脂产量、油脂含量与得率均大幅度下降,乙酸浓度为 12 g/L时,油脂产量、油脂含量和得率分别为1.72 g/L、18.3%和6%,与添加10 g/L乙酸相比,分别下降了64.2%、38.8%和45.5%。由以上结果可知,当乙酸浓度低于10 g/L时,油脂合成受到了促进。
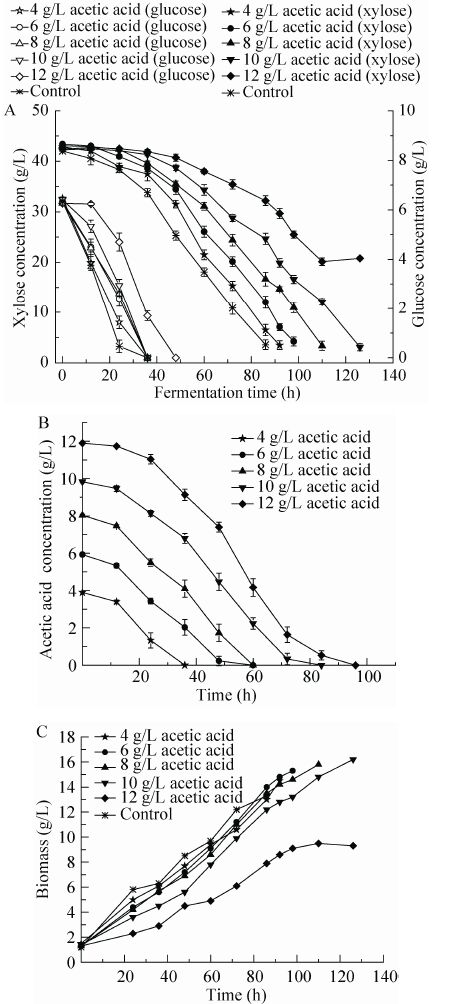
|
| 图1 粘红酵母在添加乙酸的混合糖培养基中底物消耗 (A)、乙酸代谢 (B) 及细胞生长 (C) 过程 Figure1 Sugar consumption (A),acetic acid consumption (B) and cell growth (C) of Rhodotorula glutinis in mixed sugar medium with acetic acid addition. |
| |
从液相色谱测定结果来看,发酵结束时,乙酸浓度均降为0 g/L,由此表明,粘红酵母可在一定浓度范围内代谢乙酸合成油脂。Xiong 等在其研究中也观察到了乙酸可以促进真皮毛孢子菌油脂合成的现象[18]。在适宜pH条件下,乙酸更多地以解离形式存在,从而很难穿过细胞膜造成细胞毒性,有些产油酵母可将乙酸作为碳源进行发酵,因此促进了油脂的合成。而当乙酸浓度高于10 g/L时,油脂产量显著下降,这主要是由于在培养过程中伴随着乙酸根离子的消耗,培养环境pH升高,达到碱性,从而对菌体生长和油脂合成造成影响[19]。
从底物代谢情况来看 (图 1A、图 1B),当葡萄糖、木糖和乙酸同时存在时,葡萄糖被优先利用。葡萄糖消耗完,木糖的消耗速率并未迅速增加,而此时乙酸进入快速代谢,当乙酸浓度降至较低水平时,木糖代谢速率则显著增加。因此,实验结果表明,3种底物代谢的顺序是葡萄糖优于乙酸,乙酸优于木糖。
2.2 粘红酵母以乙酸为单一碳源合成油脂由前面结果可知,在混合糖培养基中添加一定浓度的乙酸可促进粘红酵母油脂的合成,推测粘红酵母可代谢乙酸合成油脂,因此,本文进一步探讨了粘红酵母以乙酸为唯一碳源时细胞生长和油脂合成情况。乙酸的初始浓度分别为15、20、25、30 g/L,细胞生长、底物消耗及油脂合成情况如图 2所示。

|
| 图2 粘红酵母以乙酸为唯一碳源的乙酸代谢 (A) 和细胞生长 (B) 过程 Figure2 Acetic acidconsumption (A) and Cell growth (B) of Rhodotorula glutinis with acetic acid as single carbon source. |
| |
由图 2可知,粘红酵母能够以乙酸为唯一碳源进行油脂合成,随着乙酸初始浓度的增加,菌体生长迟滞期逐渐延长。发酵进行至36 h时,以15 g/L乙酸为底物的培养基中菌体浓度为 5.4 g/L,而此时以20、25、30 g/L乙酸为底物的培养基中,菌体几乎没有生长,但迟滞期过后,菌体能够生长并且进行油脂的合成,表明粘红酵母对乙酸有较强的耐受性。乙酸初始浓度为25 g/L时,油脂产量和油脂含量最高,分别为3.20 g/L和24.2%;乙酸初始浓度为15 g/L时,生产强度最高,为34 mg/(L·h)。当乙酸初始浓度为30 g/L时,菌体的生长和油脂合成受到了显著抑制,发酵结束时,剩余乙酸浓度为12.37 g/L。高浓度乙酸的抑制作用还是比较明显的,在发酵过程中,乙酸被菌体利用,pH值升高,尽管粘红酵母生长的pH范围较广,在摇瓶中,过高的pH值是影响菌体生长的一个重要因素[19]。从得率上看,初始浓度分别为15、20、25、30 g/L的乙酸培养基中,油脂得率相当,说明不同的底物浓度影响油脂产量和生产强度,但并不影响得率。
粘红酵母以乙酸为唯一底物进行油脂合成时,其对乙酸的代谢速率高于含有乙酸的混合糖培养基。其原因一方面是由于混合糖培养基中总糖浓度已达50 g/L,过高的乙酸添加会引起底物抑制的现象;另一方面,在混合糖培养基中,葡萄糖优先代谢,葡萄糖代谢完,乙酸代谢速率才显著增加。而以乙酸为唯一碳源时则避免了上述两方面的影响,因此,以乙酸为唯一碳源时,粘红酵母能够代谢更高浓度的乙酸,且对乙酸的代谢速率更快。
Lee等研究了酿酒酵母利用乙酸的代谢途径,发现酿酒酵母可将乙酸转化为乙酰辅酶A,其反应式可表示为:Acetate+ATP+CoASH↔ Acetyl-CoA+AMP+ Ppi,此反应是被乙酰辅酶A合成酶所催化[20, 21]。乙酰辅酶A是脂肪合成的第一步,乙酰辅酶A的形成为产油酵母利用乙酸合成微生物油脂提供了可能性。Christophe等检测了弯曲隐球菌Cryptococcus curvatus对乙酸的利用能力,先用15 g/L的葡萄糖培养基对弯曲隐球菌进行培养,当葡萄糖被消耗殆尽,且生物量积累到一定程度时,再添加乙酸为碳源进行发酵培养,乙酸的添加量为5 g/L,总油脂产量为2.4 g/L [22]。弯曲隐球菌也可以利用乙酸、丙酸、丁酸的混合酸培养基合成微生物油脂,当混合酸浓度为6.5 g/L时,油脂产量为0.32 g/L[23]。Li等报道了浅白色隐球酵母 Cryptococcus albidus利用乙酸合成微生物油脂的能力,当乙酸浓度为30 g/L时,其油脂产量达到最高,为0.96 g/L [24]。本文研究结果表明,粘红酵母对乙酸具有较高的耐受性,且具有利用乙酸合成油脂的能力。
2.3 微生物油脂成分分析将粘红酵母利用乙酸或混合糖 (葡萄糖 6 g/L;木糖44 g/L) 制得的微生物油脂的成分进行分析,并与大豆油的组成成分进行对比,结果如表 1所示。由表 1可知,粘红酵母利用乙
| Relative fatty acid content (%) | |||||
| Palmitic acid | Stearic acid | Oleic acid | Linoleic acid | Linolenic acid | |
| Soybean oil | 10.2 | 4.0 | 26.0 | 57.3 | 2.6 |
| Microbial lipid (Mixed sugar) | 15.9 | 23.0 | 53.1 | 7.6 | 0.5 |
| Microbial lipid (Acetic acid) | 21.1 | 19.9 | 51.3 | 7.2 | 0.6 |
酸为唯一碳源合成的油脂组成为棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸,与大豆油脂及以混合糖为底物合成的微生物油脂成分相似。与植物油相比,粘红酵母合成的微生物油脂中,油酸含量较高,而亚油酸含量低于植物油,以乙酸为底物时,生成的油脂中饱和脂肪酸和不饱和脂肪酸含量分别为40.9%和59.1%,油脂不饱和度为67.5。生物柴油中必须含有一定量的不饱和脂肪酸从而防止油脂固化,不饱和脂肪酸有利于柴油均匀燃烧,保持较高的热功率,但是脂肪酸不饱和度高于133.13的生物柴油在燃烧过程中易导致甘油三酯的聚合反应,产生沉积物,不利发动机的润滑[25]。以上结果表明粘红酵母以乙酸为底物制得的油脂可作为制备生物柴油的原料。
3 结论本文研究了乙酸对粘红酵母细胞生长和油脂合成的影响,结果表明,粘红酵母具有较高的乙酸耐受性并可以利用乙酸进行油脂合成。在初始葡萄糖、木糖浓度分别为6 g/L和44 g/L的混合糖培养基中,当乙酸添加量低于10 g/L时,不会对菌体生长产生抑制作用,同时还对油脂合成起到促进作用。粘红酵母可以以乙酸为唯一碳源合成油脂,乙酸初始浓度为25 g/L时,油脂产量和油脂含量分别可达3.20 g/L和24.2%。油脂成分分析结果表明,粘红酵母以乙酸为底物制得的油脂可以作为制备生物柴油的油脂原料。
| [1] | Ledesma-Amaro, R. Microbial oils: a customizable feedstock through metabolic engineering. Eur J Lipid Sci Technol, 2015, 117 (2) : 141–144 (in Chinese). |
| [2] |
Ma LJ, Xing DH, Wang HL, et al. Effect of culture conditions on cell growth and lipid accumulation of oleaginous microorganism.
Chin J Biotech, 2009, 25
(1)
: 55–59
(in Chinese).
马丽娟, 邢大辉, 王红蕾, 等. 培养条件对产油 微生物生长的影响. 生物工程学报,2009,25 (1) :55–59. |
| [3] |
Xu JY, Oura T, Liu DH, et al. Heat-alkaline treatment of excess sludge and the potential use of hydrolysate as nitrogen source for microbial lipid production.
Chin J Biotech, 2011, 27
(3)
: 482–488
(in Chinese).
徐静阳, 大浦宏隆, 刘德华, 等. 剩余污泥热碱解及其用于微生物油脂生产的探索. 生物工程学报,2011,27 (3) :482–488. |
| [4] |
Teng H, Mu Y, Yang TK, et al. Advances in biodiesel research. Chin J Biotech, 2010, 26(7): 892-902 ((in Chinese). 滕虎, 牟英, 杨天奎, 等. 生物柴油研究进展. 生物工程学报, 2010, 26(7): 892-902. |
| [5] |
Jia B, Wang YN, He WH, et al. New biodiesel raw material—microbial lipid.
Biotechnol Bull, 2014,
(1)
: 19–26
(in Chinese).
贾彬, 王亚南, 何蔚红, 等. 生物柴油新原料——微生物油脂. 生物技术通报,2014, (1) :19–26. |
| [6] |
Guo XY, Yang L, Li XZ, et al. Advance in enhancing production of microbial lipids.
Microbiol China, 2013, 40
(12)
: 2295–2305
(in Chinese).
郭小宇, 杨兰, 李宪臻, 等. 提高微生物油脂生产能力的研究进展. 微生物学通报,2013,40 (12) :2295–2305. |
| [7] |
Lin H. Conversion of straw wastes for microbial oils production by fungal fermentation [D]. Hangzhou: Zhejiang University, 2013 ((in Chinese). . 林辉. 真菌发酵转化废弃秸秆生产微生物油脂技术的研究[D]. 杭州: 浙江大学, 2013. |
| [8] |
Zhao ZB, Hu CM. Progress in bioenergy-oriented microbial lipid technology.
Chin J Biotech, 2011, 27
(3)
: 427–435
(in Chinese).
赵宗保, 胡翠敏. 能源微生物油脂技术进展. 生物工程学报,2011,27 (3) :427–435. |
| [9] |
Li YY, Wu H, Huang C, et al. Using rice straw hydrolysate for microbial oil production by Trichosporon fermentans HWZ004.
Chin J Biotech, 2011, 27
(9)
: 1309–1316
(in Chinese).
李园园, 吴虹, 黄超, 等. 发酵性丝孢酵母 HWZ004 利用水稻秸秆水解液发酵产油脂. 生物工程学报,2011,27 (9) :1309–1316. |
| [10] |
Li RF. Study on microbial oil production from bagasse hydrolysate by Trichosporon fermentans [D]. Guangzhou: South China University of Technology, 2010 ((in Chinese). 李日峰. 基于甘蔗渣水解液的发酵性丝孢酵母发酵产油脂的研究[D]. 广州: 华南理工大学, 2010. |
| [11] |
Peng F. Study on microbial oil production by fermentation of lignocellulose hydrolyzate [D]. Changsha: Hunan Agriculture University, 2009 ((in Chinese). . 彭枫. 利用木质纤维素水解液发酵生产微生物油脂的研究[D]. 长沙: 湖南农业大学, 2009. |
| [12] | Gong ZW, Shen HW, Yang XB, et al. Lipid production from corn stover by the oleaginous yeast Cryptococcus curvatus. Biotechnol Biofuels, 2014, 7 (1) : 158–167 (in Chinese). |
| [13] | Kawahata M, Masaki K, Fujii T, et al. Yeast genes involved in response to lactic acid and acetic acid: acidic conditions caused by the organic acids in Saccharomyces cerevisiae cultures induce expression of intracellular metal metabolism genes regulated by Aft1p. FEMS Yeast Res, 2006, 6 (6) : 924–936 (in Chinese). |
| [14] | Tanaka K, Ishii Y, Ogawa J, et al. Enhancement of acetic acid Tolerance in Saccharomyces cerevisiae by overexpression of the HAA1 gene, encoding a transcriptional activator. Appl Environ Microbiol, 2012, 78 (22) : 8161–8163 (in Chinese). |
| [15] | Zhao XB, Peng F, Du W, et al. Effects of some inhibitors on the growth and lipid accumulation of oleaginous yeast Rhodosporidium toruloides and preparation of biodiesel by enzymatic transesterification of the lipid. Bioprocess Biosyst Eng, 2012, 35 (6) : 993–1004 (in Chinese). |
| [16] | Huang C, Wu H, Liu ZJ, et al. Effect of organic acids on the growth and lipid accumulation of oleaginous yeast Trichosporon fermentans. Biotechnol Biofuels, 2012, 5 (1) : 4 (in Chinese). |
| [17] | Hu CM, Zhao X, Zhao J, et al. Effects of biomass hydrolysis by-products on oleaginous yeast Rhodosporidium toruloides. Bioresour Technol, 2009, 100 (20) : 4843–4847 (in Chinese). |
| [18] | Xiong L, Huang C, Yang XY, et al. Beneficial effect of corncob acid hydrolysate on the lipid production by oleaginous yeast Trichosporon dermatis. Prep Biochem Biotechnol, 2015, 45(5): 421-429. |
| [19] | Huang QT, Wang Q, Gong ZW, et al. Effects of selected ionic liquids on lipid production by the oleaginous yeast Rhodosporidium toruloides. Bioresour Technol, 2013 : 339–344 (in Chinese). |
| [20] | Lee YJ, Jang JW, Kim KJ, et al. TCA cycle-independent acetate metabolism via the glyoxylate cycle in Saccharomyces cerevisiae. Yeast, 2010, 28 (2) : 153–166 (in Chinese). |
| [21] | Papanikolaou S, Aggelis G. Lipids of oleaginous yeasts. Part I: biochemistry of single cell oil production. Eur J Lipid Sci Technol, 2011, 113 (8) : 1031–1051 (in Chinese). |
| [22] | Christophe G, Deo JL, Kumar V, et al. Production of oils from acetic acid by the oleaginous yeast Cryptococcus curvatus. Appl Biochem Biotechnol, 2012, 167 (5) : 1270–1279 (in Chinese). |
| [23] | Vajpeyi S, Chandran K. Microbial conversion of synthetic and food waste-derived volatile fatty acids to lipids. Bioresour Technol, 2015, 188: 49-55. |
| [24] | Li XM, Xiong L, Chen XF, et al. Effects of acetic acid on growth and lipid production by Cryptococcus albidus. J Am Oil Chem Soc, 2015, 92 (8) : 1113–1118 (in Chinese). |
| [25] |
Wang LB, Yu HY, He XH, et al. Influence of fatty acid composition of woody biodiesel plants on the fuel properties.
J Fuel Chem Technol, 2012, 40
(4)
: 397–404
(in Chinese).
王利兵, 于海燕, 贺晓辉, 等. 生物柴油树种油脂脂肪酸组成对燃料特性的影响. 燃料化学学报,2012,40 (4) :397–404. |
 2016, Vol. 32
2016, Vol. 32




