服务
文章信息
- 李爱玲, 张政
- Li Ailing, Zhang Zheng
- 长链非编码RNA与糖尿病及其并发症
- Role of long non-coding RNA in diabetes mellitus and its complications
- 生物工程学报, 2016, 32(3): 284-291
- Chin J Biotech, 2016, 32(3): 284-291
- 10.13345/j.cjb.150253
-
文章历史
- Received: June 2, 2015
- Accepted: September 6, 2015
糖尿病 (Diabetes mellitus) 是遗传和环境因素共同作用的复杂疾病,全球已有3.47亿人口患有糖尿病,其发病率仍不断上升[1]。我国2010年全国糖尿病流行病学调查[2]显示,20岁以上的成年人中糖尿病的患病率高达11.6%,前期人群达到50.1%,其中2型糖尿病占90%以上。因此对糖尿病病因与机制研究一直是国内外研究的热点。
最近美国人类基因组研究所和欧洲生物信息研究所公布了DNA元件百科全书(ENCODE),解码了占人类DNA98%的非编码序列,确定了8 800个miRNA、9 640个长链非编码RNA和400万个基因调节开关[3]。占非蛋白编码序列绝大多数的长链非编码RNA曾一度被认为是基因在进化过程中累积的无功能的“垃圾序列”,随着二代测序的广泛应用与累积的研究数据发现,长链非编码RNA在多个层面上参与细胞分化和个体发育等重要生命过程的调控,并与人类的重大疾病密切相关。本文结合目前对长链非编码RNA的研究现状与本课题组对lncRNA的研究思路,对其与糖尿病及其并发症的关系研究作一综述。
1 长链非编码RNA 1.1 lncRNA的分类长链非编码RNA (Long non-coding RNA,lncRNA) 是一类转录本长度超过200个核苷酸的RNA分子,无编码蛋白质功能,通常是多聚腺苷酸化的,受RNA聚合酶Ⅱ催化转录合成。目前lncRNA的分类标准尚未统一[4]。Kung等[5]将其分为5类:1) 独立lncRNA (Stand-along lncRNA):位于序列中单独的转录单位,与编码蛋白的基因没有重叠。包括Xist、H19、HOTAIR等。2) 自然反义转录本 (Natural antisense transcripts,NAT):自然情况下生物体内生成的反义RNA。3) 假基因 (Pseudogenes):由于无义突变、转移突变或其他突变导致无编码能力的基因“遗迹”。4) 长链固有ncRNA (Long intronic ncRNA):在注释基因内含子内被编码的长转录本。5) 其他RNA (增强子RNA等)。根据lncRNA基因在基因组上的位置,又可将其分为3类:1) 位于基因区间的长链非编码RNA,又称lincRNA (Long intergenic RNA)。2) 天然反义长链非编码RNA。3) 内含子区长链非编码RNA[6]。
1.2 lncRNA的特征越来越多的研究显示,lncRNA存在组织特异性、细胞特异性、发育阶段特异性、时空特异性以及疾病特异性。与编码蛋白质的mRNA相比,lncRNA表达丰度一般较低,但却具有更强的组织和细胞特异性[7]。Timothy等[8]在分析若干来源小鼠组织的全长lncRNA文库时也发现,大量lncRNA基因呈现组织特异性的表达。通过检查linc-DC在人类其他免疫细胞中的表达水平,发现linc-DC在DC中特异的高表达,表明linc-DC是DC特异的功能调控分子,具有组织特异性。经反义RNA干扰结果发现,linc-DC被抑制后,成熟DC表面抗原呈现分子及共刺激分子的表达下降,细胞因子IL12的分泌减少,表现出未成熟的特征[9],这表明linc-DC对DC的成熟是必需的,linc-DC在DC的成熟过程中表现出发育阶段特异性。同样研究发现一种反义转录本——cTN1仅在成人心肌中表达[3]。大多数的lncRNA在组织分化发育过程中,都具有明显的时空表达特异性。如有人针对小鼠的 1 300个lncRNA进行研究,发现在脑组织中的不同部位,lncRNA具有不同的表达模式。在疾病的研究过程中,越来越多的研究表明lncRNA与疾病密切相关。缺氧诱导的胃癌细胞与常氧的胃癌细胞比较,lncRNA表达谱发生明显差异[10]。大鼠坐骨神经缺损后背根神经节组织中lncRNA的表达谱发生改变[11]。Helgadottir等[12]发现,ANRIL在动脉粥样硬化患者的血液中表达水平较高,且高水平ANRIL可导致心肌梗死的发生率升高。深入了解lncRNA的特征将有助于更好的了解lncRNA,为更好研究疾病以及探索疾病新的发生发展机制提供新的思路。
1.3 lncRNA的功能lncRNA可从染色质重塑、转录调控及转录后加工等多种层面实现对基因表达的调控,如图 1:A) lncRNA通过招募染色质重塑复合物至特定的基因组位点使其发生催化活性。如HOTAIR21、Xist、RepA和Kcnqot1招募Polycomb complex至HoxD位点,使得X染色体或Kcnq1功能域的组蛋白H3 第27位赖氨酸发生3甲基化 (me3K27),诱导异染色质形成,从而抑制该区域基因表达。B) lncRNA通过多种机制进行转录
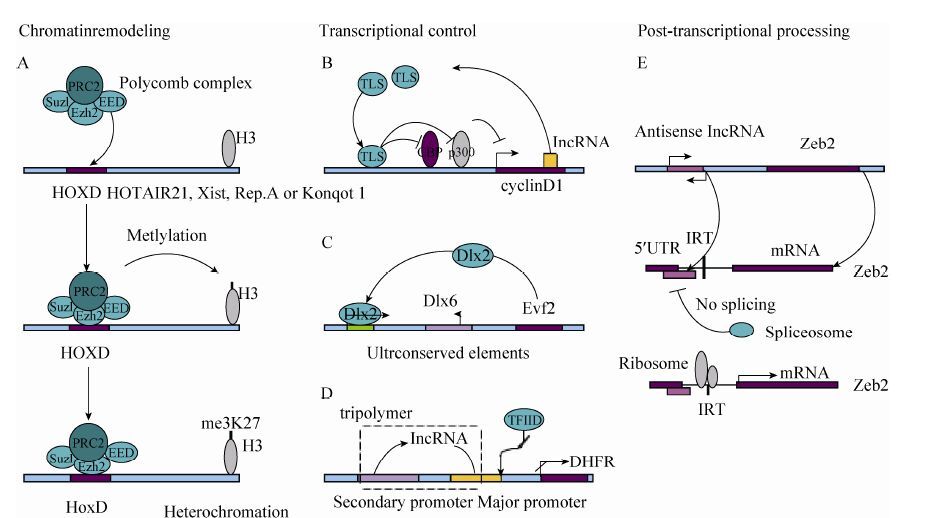
|
| 图1 lncRNA对基因表达的调控 Figure1 Regulation of lncRNA to gene expression. |
| |
水平调控。如lncRNA结合到基因cyclin D1上,招募RNA结合蛋白TLS来调控蛋白CBP和p300的组蛋白乙酰转移酶活性,进而抑制cyclin D1转录。C) 超保守增强子转录出lncRNA-Evf2,该lncRNA能激活转录因子DLX2,进而调控基因Dlx6转录。D) DHFR次要启动子区域转录出的lncRNA与该基因主要启动子区域结合形成三聚体,抑制转录因子TFIID结合,从而使基因DHFR发生沉默。E) 反义lncRNA能够与剪接体 (Spliceosome) 中锌指同源mRNA Zeb2的5'剪切位点结合,使内含子未被剪切掉,而该内含子序列中保留有内部核糖体进入位点 (IRE位点),翻译过程中识别并结合该位点,导致Zeb2基因表达和翻译。
此外,lncRNA在分子水平上的调控还包括以下几个方面[13]:1) 来自上游非编码启动子 (紫色) 的序列可通过抑制RNA聚合酶Ⅱ的招募负向影响下游基因 (蓝色) 的表达。2) 或引起染色质重塑来正相关影响下游基因的表达。3) 反义转录本 (红色) 可以杂交到重叠的正义转录本,阻碍剪切体识别剪切位点,导致另一种拼接转录。4) 或Dicer酶分裂正义转录本与反义转录本杂交体从而产生内生的siRNA。5)非编码转录本 (绿色) 还可通过与特异蛋白结合调节蛋白的活动。6) 也可作为一种结构组件来组成一种更大的RNA蛋白复合体。7) 或者改变蛋白在细胞内的位点。8) lncRNA经过处理可产生小RNA (橙色),比如miRNA、Piwi蛋白相互作用RNA (Piwi-interacting RNA,piRNA) 和其他一些较少特征的小转录本 (图 2)。

|
| 图2 lncRNA在分子水平上的调控 Figure2 Regulation of lncRNA on molecular level. |
| |
糖尿病是一组复杂的代谢疾病,能破坏体内葡萄糖平衡,包括破坏β细胞或者泌胰岛素细胞对代谢需求增加的弥补[14]。胰岛细胞功能性障碍是2型糖尿病的病理学核心。lncRNA的胰岛特性大约是普通蛋白编码基因的5倍多[15]。有研究通过一个已知的胰岛特异转录本认为,一种能编码胰岛转录因子的基因——GLIS3是lncRNA-HI-LNC25的下游靶点,HI-LNC25的损耗能抑制其mRNA对刺激的反应,而GLIS3位点的突变与1型糖尿病[16]、血糖水平快速升高[17]和2型糖尿病有关[18],但其具体的机制目前尚未清楚。IGF-2AS广泛存在各种组织中,表达于父源等位基因,是生长因子IGF-2的反义印记基因。据报道,IGF-2和IGF-2AS可作为糖尿病等重要疾病的候选基因[19, 20]。用高浓度葡萄糖刺激胰岛β细胞可上调IGF-2AS的量,证实了血糖的浓度是影响IGF-2AS基因表达的主要调节因素[20]。 另外,GWAS研究证实在INK4位点 (ANRIL) 的反义非编码RNA显著的与增加2型糖尿病的敏感性相关[21]。
2.2 lncRNA与糖尿病性心肌病糖尿病性心肌病(Diabetic cardiomyopathy,DCM) 是一种独立于高血压、冠状动脉粥样硬化、心脏瓣膜病及其他心脏病变的心肌病。糖尿病人患DCM的风险较高,心肌纤维化是引发DCM的最主要原因之一[22- 23]。高浓度葡萄糖可诱导心肌成纤维细胞表达纤维化相关基因[24- 25]。利用糖尿病心肌纤维化动物模型,研究发现糖尿病心肌中明显的lncRNA差异表达,通过鉴定糖尿病心肌中部分的lncRNA,确证了AK014842和BF607975在DCM的动物模型和细胞模型中呈一致性上调表达[26]。但这些lncRNA在DCM中的作用机制尚不清楚,还有待进一步研究。
2.3 lncRNA与糖尿病视网膜病变糖尿病视网膜病变 (Diabetic retinopathy,DR) 是糖尿病常见的微血管并发症之一,是产生失明的一个主要原因。在早期DR视网膜中发现大约有303种lncRNAs异常表达,其中214种lncRNAs表达下调,89种lncRNAs表达上调。GO分析表明,与这些lncRNAs共表达的mRNAs靶向眼发育过程、膜完整性和结构分子活性。在RF/6A高血糖症细胞模型、房水样品和糖尿病病人维管组织膜中,保守lncRNA MALAT1呈显著上调,其可能成为DR预后、诊断和治疗的一个潜在治疗靶标[27]。在糖尿病条件下MALAT1可以激活p38/MAPK信号通路来调节视网膜内皮细胞功能和病理性微血管的增长。通过体内敲除MALAT1,可导致周皮细胞减少,毛细血管退化,影响微血管渗漏与视网膜炎症,显著改善糖尿病视网膜病变。在体外敲除MALAT1可调节视网膜内皮细胞增生、迁移和小管形成[28]。同样,在体外敲除MALAT1,对从增殖到内皮细胞表型迁移都起着决定性作用[29]。这些发现表明lncRNA与糖尿病视网膜病变有着紧密的关系,探索lncRNA与糖尿病视网膜病变的关系将为进一步了解糖尿病视网膜病变提供良好条件,也为探索新的潜在的治疗靶点提供新的依据。
2.4 lncRNA与糖尿病肾病糖尿病肾病 (Diabetic Nephropathy,DN) 是严重的糖尿病微血管并发症,是导致末期肾病的第二大原因,也是导致患者死亡的原因。随着近年来对lncRNA的研究发现,lncRNA-PVT1基因与DN密切相关。PVT1位于人类8号染色体8q24区域,其表达可促进细胞增殖和抑制细胞凋亡[30],在肾脏多种细胞中均呈高表达状态。Hanson等[31]使用全基因组关联研究技术发现PVT1基因在Pima印第安人DN患者中是糖尿病性末期肾病的候选基因,PVT1基因内含子8附近的多态性位点rs2720709可能是DN发生的易感SNP位点。随后在1型糖尿病患者中也发现在PVT1基因区域有高度相关的SNP位点[32]。研究发现PVT1以独立于TGF-β1的方式调节细胞外基质 (ECM) 蛋白的表达,与TGF-β1相比,敲除PVT1可更高更快地降低FN1、COLA A1和PAI-1。高血糖可调节PVT1的表达,而PVT1可能通过调节ECM的堆积来调节糖尿病肾病 [33]。但有相关研究发现,PVT1基因的表达可能与种族差异有关,在对中国连云港市225例汉族2型糖尿病患者的研究发现,T2DM患者PVT1基因rs2720709的A/G多态性与DN的易感性无关[34]。具体其相关性还有待进一步多种族、更深入更规模的研究。
3 问题与展望lncRNA是一种不编码蛋白的RNA,与编码蛋白质的mRNA相比,lncRNA表达丰度一般较低,这对直接探索lncRNA与疾病的关系提供了难度,而本实验组结合基因芯片技术、高通量测序技术、BiBiServ2、miRBase与NCBI等分析工具,通过生物信息学分析及文献查询,找到与糖尿病肾病相关的lncRNA和miRNA或蛋白编码基因,通过研究lncRNA与这些基因的联系从而进一步探索lncRNA与糖尿病肾病发生发展的关系。
目前对lncRNA的研究还处在起始阶段,随着越来越多lncRNA的发现,使得大量的遗传信息被认知。lncRNA通过调节与之相关的蛋白编码基因,直接或间接地引起疾病的发生,这开阔了对病因学上lncRNA作用机制研究的新领域。但lncRNA与疾病的研究还很少,与糖尿病及其并发症的相关联证据也并不多。通过以上的综述我们可以看到目前虽发现了一些与糖尿病相关的lncRNA,但这些lncRNA的作用机制大多尚未清楚,并且目前尚未报道与糖尿病性皮肤病、糖尿病性足病、糖尿病性神经病相关的lncRNA,而要想lncRNA成为糖尿病及其并发症的一种诊断标志,不仅需要明确其在该疾病中的作用机制,还需要确定其在正常人中的表达水平以及临床诊断意义的变化程度,因此lncRNA与糖尿病及其并发症关系的研究还需要通过各种基因诊断手段来揭开lncRNA的神秘面纱,为糖尿病提供一种新的治疗方法。
| [1] | Pullen TJ, Rutter GA. Roles of lncRNAs in pancreatic beta cell identity and diabetes susceptibility. Front Genet, 2014 : 193 (in Chinese). |
| [2] | Du XY, Ounissi-Benkalha H, Loder MK, et al. Overexpression of ZAC impairs glucose-stimulated insulin translation and secretion in clonal pancreatic beta-cells. Diabetes Metab Res Rev, 2012, 28 (8) : 645–653 (in Chinese). |
| [3] |
Wang N, Luo YH, Deng JC, et al. LncRNAs and cardiovascular diseases.
Prog Physiol Sci, 2014, 45
(3)
: 172–176
(in Chinese).
王楠, 罗雨虹, 邓嘉成, 等. 长非编码RNA(lncRNA) 与心血管疾病. 生理科学进展,2014,45 (3) :172–176. |
| [4] | Schonrock N, Harvey RP, Mattick JS. Long noncoding RNAs in cardiac development and pathophysiology. Circ Res, 2012, 111 (10) : 1349–1362 (in Chinese). |
| [5] | Kung JTY, Colognori D, Lee JT. Long noncoding RNAs: past, present, and future. Genetics, 2013, 193 (3) : 651–669 (in Chinese). |
| [6] | Moran VA, Perera RJ, Khaliln AM. Emerging functional and mechanistic paradigms of mammalian long non-coding RNAs. Nucleic Acids Res, 2012, 40 (14) : 6391–6400 (in Chinese). |
| [7] | Fatica A, Bozzoni I. Long non-coding RNAs: new players in cell differentiation and development. Nat Rev Genet, 2014, 15 (1) : 7–21 (in Chinese). |
| [8] | Ravasi T, Suzuki H, Pang KC, et al. Experimental validation of the regulated expression of large numbers of non-coding RNAs from the mouse genome. Genome Res, 2006, 16 (1) : 11–19 (in Chinese). |
| [9] | 王品. 非编码RNA对人NK细胞与树突状细胞免疫功能的调控作用及相关机制研究[D]. 上海: 第二军医大学, 2013. |
| [10] |
Wang YF, Liu LL, Jin HF, et al. Study on expression profile of long non-coding RNA in gastric cancer cell lines under hypoxia.
Mod Oncol, , 21
(2)
: 225–228
(in Chinese).
王亚芳, 刘理礼, 靳海峰, 等. LncRNA在缺氧诱导的胃癌细胞中表达谱的变化. 现代肿瘤医学,,21 (2) :225–228. |
| [11] |
Qian TM, Gao R, Yu B, et al. Altered lncRNA expression following sciatic nerve resection in rats.
Med J Commun, 2012, 26
(4)
: 306–309
(in Chinese).
钱天梅, 高蓉, 于彬, 等. 大鼠坐骨神经缺损后背根神经节组织lncRNA表达变化. 交通医学,2012,26 (4) :306–309. |
| [12] | Helgadottir A, Thorleifsson G, Manolescu A, et al. A common variant on chromosome 9p21 affects the risk of myocardial infarction. Science, 2007, 316 (5830) : 1491–1493 (in Chinese). |
| [13] | Wilusz JE, Sunwoo H, Spector DL. Long noncoding RNAs: functional surprises from the RNA world. Genes Dev, 2009, 23 (13) : 1494–1504 (in Chinese). |
| [14] | Kameswaran V, Kaestner KH. The missing lnc (RNA) between the pancreatic β-cell and diabetes. Front Genet, 2014 : 200 (in Chinese). |
| [15] | Ku GM, Kim H, Vaughn IW, et al. Research resource: RNA-Seq reveals unique features of the pancreatic β-cell transcriptome. Mol Endocrinol, 2012, (10) : 1783–1792 (in Chinese). |
| [16] | Barrett JC, Clayton DG, Concannon P, et al. Genome-wide association study and meta-analysis find that over 40 loci affect risk of type 1 diabetes. Nat Genet, 2009, 41 (6) : 703–707 (in Chinese). |
| [17] | Dupuis J, Langenberg C, Prokopenko I, et al. New genetic loci implicated in fasting glucose homeostasis and their impact on type 2 diabetes risk. Nat Genet, 2010, 42 (2) : 105–116 (in Chinese). |
| [18] | Cho YS, Chen CH, Hu C, et al. Meta-analysis of genome-wide association studies identifies eight new loci for type 2 diabetes in east Asians. Nat Genet, 2011, 44 (1) : 67–72 (in Chinese). |
| [19] | Okutsu T, Kuroiwa Y, Kagitani F, et al. Expression and imprinting status of human PEG8/IGF2AS, a paternally expressed antisense transcript from the IGF2 locus, in Wilms’ tumors. J Biochem, 2000, 127 (3) : 475–483 (in Chinese). |
| [20] | Mutskov V, Felsenfeld G. The human insulin gene is part of a large open chromatin domain specific for human islets. Proc Natl Acad Sci USA, 2009, 106 (41) : 17419–17424 (in Chinese). |
| [21] | Tsai FJ, Yang CF, Chen CC, et al. A genome-wide association study identifies susceptibility variants for type 2 diabetes in Han Chinese. PLoS Genet, 2010, 6 (2) : e1000847 (in Chinese). |
| [22] | Nunoda S, Genda A, Sugihara N, et al. Quantitative approach to the histopathology of the biopsied right ventricular myocardium in patients with diabetes mellitus. Heart Vessels, 1985, 1 (1) : 43–47 (in Chinese). |
| [23] | Devereux RB, Roman MJ, Paranicas M, et al. Impact of diabetes on cardiac structure and function: the strong heart study. Circulation, 2000, 101 (19) : 2271–2276 (in Chinese). |
| [24] | Tang MX, Zhou FH, Zhang W, et al. The role of thrombospondin-1-mediated TGF-β1 on collagen type Ⅲsynthesis induced by high glucose. Mol Cell Biochem, 2011, 346 (1/2) : 49–56 (in Chinese). |
| [25] | Wang P, Li HW, Wang YP, et al. Effects of recombinant human relaxin upon proliferation of cardiac fibroblast and synthesis of collagen under high glucose condition. J Endocrinol Invest, 2009, 32 (3) : 242–247 (in Chinese). |
| [26] |
Zhang CS, Lin QX, Zhu JN, et al. Expression and identification of up-regulated long non-coding RNA (lncRNA) in a mouse model of diabetic myocardial fibrosis.
J Trop Med, 2014, 14
(1)
: 8–11
(in Chinese).
张传寿, 林秋雄, 朱杰宁, 等. 糖尿病性心肌纤维化中上调表达长链非编码RNA(lncRNA) 的鉴定. 热带医学杂志,2014,14 (1) :8–11. |
| [27] | Yan B, Tao ZF, Li XM, et al. Aberrant expression of long noncoding RNAs in early diabetic retinopathy. Invest Ophthalmol Vis Sci, 2014, 55 (2) : 941–951 (in Chinese). |
| [28] | Liu JY, Yao J, Li XM, et al. Pathogenic role of lncRNA-MALAT1 in endothelial cell dysfunction in diabetes mellitus. Cell Death Dis, 2014 : e1506 (in Chinese). |
| [29] | Michalik KM, You XT, Manavski Y, et al. Long noncoding RNA MALAT1 regulates endothelial cell function and vessel growth. Circ Res, 2014, 114 (9) : 1389–1397 (in Chinese). |
| [30] | Guan YH, Kuo WL, Stilwell JL, et al. Amplification of PVT1 contributes to the pathophysiology of ovarian and breast cancer. Clin Cancer Res, 2007, 13 (19) : 5745–5755 (in Chinese). |
| [31] | Hanson RL, Craig DW, Millis MP, et al. Identification of PVT1 as a candidate gene for end-stage renal disease in type 2 diabetes using a polling-based genome-wide single nucleotide polymorphism association study. Diabetes, 2007, 56 (4) : 975–983 (in Chinese). |
| [32] | Millis MP, Bowen D, Kingsley C, et al. Variants in the plasmacytoma variant translocation gene (PVT1) are associated with end-stage renal disease attributed to type 1 diabetes. Diabetes, 2007, 56 (12) : 3027–3032 (in Chinese). |
| [33] | Alvarez ML, DiStfano JK. Functional characterization of the plasmacytoma variant translocation 1 gene (PVT1) in diabetic nephropathy. PLoS ONE, 2011, 6 (4) : e18671 (in Chinese). |
| [34] |
Zheng P, Tian XP, Xu N, et al. Correlation of rs2720709 polymorphism of plasmacytomas variant translocation 1 gene and type 2 diabetes nephropathy.
Jiangsu Med J, 2014, 40
(6)
: 663–665
(in Chinese).
郑萍, 田小平, 徐宁, 等. PVT1基因rs2720709多态性与2型糖尿病肾病的相关性. 江苏医药,2014,40 (6) :663–665. |
 2016, Vol. 32
2016, Vol. 32




